2. 温州医科大学附属第二医院神经内科, 浙江温州 325027
2. Department of Neurology, the Second Affiliated Hospital Wenzhou Medical University, Wenzhou 325027, China
肿瘤组织中的肿瘤相关巨噬细胞来源于外周循环血中的单核细胞,单核细胞经过招募、分化和增殖等过程,最后成为肿瘤间质中的巨噬细胞。近十年来逐渐认识到在不同的肿瘤微环境中,巨噬细胞可以发生不同性质的活化,成为具有分子特征、功能特征不同甚至相反的亚群。当前研究普遍认为活化的肿瘤相关巨噬细胞可以分为M1型巨噬细胞和M2型巨噬细胞。在肿瘤微环境中,M1型巨噬细胞主要与炎症应答相关,而M2型巨噬细胞往往与肿瘤的进展有关[1]。在乳腺癌恶化过程中,M2型巨噬细胞会促发血管的新生,促使乳腺癌细胞的转移,抑制其抗乳腺癌的免疫应答[2]。此外,M2型巨噬细胞能在原发的位点促进乳腺癌细胞的外溢,扎根于转移位点和促使肿瘤细胞随后的生长与增殖[3, 4]。巨噬细胞的M2型极化常常与肿瘤的发生发展息息相关。针对肿瘤相关巨噬细胞 M2型极化的干预方法正成为有别于以往肿瘤治疗手段的全新策略,在肿瘤研究领域受到高度关注。
IL-13是普遍应用的巨噬细胞M2型极化的诱导因子[5, 6, 7],IL-13可有效诱导M2型特异性标志物CD206及M2型特异性基因Ⅰ型巨噬细胞甘露糖受体 (macrophage mannose receptor 1,Mrc1)、Ⅲ型壳多糖酶样蛋白(chitinase-like protein 3,Chil3也称Ym1)和I型精氨酸酶(arginase 1,Arg1)的表达[5, 8, 9]。拉帕替尼是第一个上市的表皮生长因子受体(human epidermal growth factor receptor,HER)2酪氨酸激酶的口服抑制剂。2007年美国食品药品监督管理局批准拉帕替尼与卡培他滨联合用于治疗蒽环类药物、紫杉醇、赫赛汀等治疗后复发的HER2阳性的晚期乳腺癌以及转移性的乳腺癌[10]。Ⅱ期临床试验数据表明,拉帕替尼单用对HER2阳性患者有一定的治疗效果,但疗效不佳[11]。绿原酸是天然来源的化合物,具有消炎、抗菌、抗病毒作用。近年来,也有文献报道其有抗肿瘤作用[12, 13, 14]。Bernstein等[12]发现绿原酸能使结肠癌小鼠模型结肠癌的发生率从56%降至18%,Kang等[14]发现绿原酸具有抑制结肠癌转移的作用。
本研究利用IL-13建立巨噬细胞M2型极化的体外模型,研究拉帕替尼和绿原酸对巨噬细胞M2型极化的作用;并选择具有小鼠乳腺肿瘤多瘤病毒T原癌基因(mouse mammary tumor virus-driven polyoma virus middle T oncogene,MMTV-PyVT)的小鼠为体外模型[15, 16, 17],探究拉帕替尼和绿原酸合用的抗肿瘤转移作用。
1 材料与方法 1.1 实验动物C57BL/6雌性小鼠6~8周龄,体质量18~22 g,购于浙江省医学科学院实验动物中心。雄性FVB/N-Tg(MMTV-PyVT)634Mul/JNju (以下简称MMTV-PyVT)转基因小鼠3只,4~5周龄,体质量18~20 g,购于南京大学南京生物医药研究院,后在浙江大学实验动物中心SPF级区域与其背景一致的FVB/NJNju 雌性小鼠繁殖,鉴定为MMTV-PyVT 转基因的雌性子代小鼠用于实验。MMTV-PyVT小鼠携带鼠乳腺肿瘤病毒,雌鼠在5~8周会产生明显的乳房肿瘤,转移到肺部的概率为80%~94%。
1.2 材料和试剂绿原酸和牛血清白蛋白(albumin from bovine serum,BSA)购于德国Sigma-Aldrich公司;拉帕替尼购于美国Selleck公司;IL-13购于美国Peprotech公司;用含0.2%BSA的无菌PBS配置成100 μg/mL的储备液;小鼠巨噬细胞集落刺激因子(M-CSF)购自美国Peprotech公司,用含0.2% BSA的无菌PBS配置成50 μg/mL的储备液。所有药液均经分装后于-20 ℃避光保存。DMEM培养基购于美国Gibco公司;FBS购于美国Hyclone公司;胰酶购于吉诺生物医药技术有限公司;PE标记的CD206抗体和FITC标记的 F4/80 抗体均购于美国eBioscience公司;Trizol和DEPC购于生工生物工程(上海)股份有限公司;氯仿、异丙醇和无水乙醇购于国药集团化学试剂有限公司;逆转录试剂盒购于北京全式金生物技术有限公司;SYBR试剂盒购于日本Takara公司;封闭绵羊血清购于北京索莱宝科技有限公司;CD68购自美国BD biosciences公司;CD206购自美国Santa Cruz公司;驴抗羊Alexa Fluor® 594和羊抗鼠Alexa Fluor® 488标记的荧光二抗购于美国Life Technologies公司;4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)购于日本同仁化学研究所;抗荧光淬灭剂fluoromount-G购于美国Southern Biotech公司。
1.3 小鼠骨髓单核细胞的分离和诱导分化颈椎脱臼法处死C57BL/6小鼠,75%酒精消毒,在超净台取出完整股骨,除去股骨表面的肌肉,用眼科剪剪去两端;用5 mL注射器吸取含10%FBS的DMEM培养液冲出骨髓细胞,用移液枪反复吹打制成单细胞悬液。将单细胞悬液直接接种于60 mm培养皿中,加入M-CSF使其终浓度为50 ng/mL,于5%二氧化碳、37 ℃条件下培养。72 h后换液去除未贴壁细胞,贴壁的为小鼠骨髓来源的巨噬细胞。用无菌刮刀刮下细胞,5000/孔接种于6孔板中,24 h后给予IL-13、绿原酸、拉帕替尼(用DMSO配置)作用相应的天数,收集细胞用流式细胞术检测细胞表面标志物,用实时定量PCR检测相应基因的表达。
1.4 流式细胞术检测巨噬细胞表面标志物IL-13是公认的巨噬细胞M2型极化诱导因子,F4/80和CD206分别是常用的巨噬细胞以及M2型巨噬细胞的表面标志物,F4/80hi CD206hi代表极化的M2型巨噬细胞。分别用二甲基亚砜将拉帕替尼和绿原酸配制成10 mmol/L的储备液。使用前,将拉帕替尼稀释成0.02 mmol/L。在铺有BMDM细胞的六孔板中按照实验设置加入IL-13、拉帕替尼、绿原酸,作用72 h。用刮刀刮下并收集1×105个BMDM细胞,并用预冷的PBS洗涤1次。用3%BSA重悬细胞,常温封闭45 min后,用PBS洗涤1次。用100 μL 0.2%BSA重悬细胞,加入PE-CD206和FITC-F4/80,使其终浓度为2 μg/mL,4 ℃避光孵育45 min。PBS洗涤2次后,用500 μL PBS重悬,并用流式细胞仪检测巨噬细胞表面标志物CD206和F4/80的表达情况。每个样本至少采集1×104个细胞。用CellQuest软件分析阳性细胞所占比例。
1.5 实时定量PCR检测巨噬细胞Mrc1、Arg1、Ym1 mRNA表达化合物配置参照1.4。在铺有巨噬细胞的六孔板中按照实验设置加入IL-13、绿原酸、拉帕替尼作用24 h。弃去培养板中的培养液,用PBS洗涤2次,加入Trizol试剂裂解细胞,每孔加1 mLTrizol试剂,用移液器吹打混匀。按照试剂盒说明书提取总RNA。根据总RNA浓度,取2 μg RNA,按照逆转录试剂盒说明书逆转录成cDNA。所得cDNA按SYBR试剂盒说明书进行实时定量PCR,引物退火温度均为55 ℃,引物序列见表1。
| 基因名称 | 序列(5′-3′) | |
| Mrc1 | 上游引物 | AAGGCTATCCTGGTGGAAGAA |
| 下游引物 | AGGGAAGGGTCAGTCTGTGTT | |
| Arg1 | 上游引物 | CCACAGTCTGGCAGTTGGAAG |
| 下游引物 | GGTTGTCAGGGGAGTGTTGATG | |
| Ym1 | 上游引物 | GCCACTGAGGTCTGGGATGC |
| 下游引物 | TCCTTGAGCCACTGAGCCTTC | |
| β-actin | 上游引物 | GGTCATCACTATTGGCAACG |
| 下游引物 | ACGGATGTCAACGTCACACT |
选取周龄一致的雌性MMTV-PyVT转基因小鼠12只,平均分为4组,每组3只。小鼠8周龄时,自发产生乳腺癌,将小鼠分成4组,每日给予不同的灌胃处理:空白对照组给予PBS;绿原酸组给予50 mg/kg绿原酸,用PBS配置;拉帕替尼组给予50 mg/kg拉帕替尼,用PBS配置;合用组采用续灌的给药方式,剂量与给药形式均与拉帕替尼和绿原酸组一致。给药18 d后断颈处死小鼠,取肺,固定后作石蜡组织切片,用于HE染色;并完整剥取小鼠的乳腺肿瘤,做冰冻组织切片免疫荧光染色,观察小鼠肿瘤中M2型巨噬细胞的分布。
1.7 HE染色观察乳腺癌肺组织转移灶用4%的多聚甲醛固定小鼠肺组织后,进行常规石蜡包埋,每隔200 μm切片。所得切片进行HE染色。显微镜下观察并统计各组肺组织转移灶点的个数。
1.8 免疫荧光染色检测乳腺癌组织CD68和CD206表达取每只小鼠肿瘤组织致密的部分进行切片,每只小鼠的肿瘤均取间隔1 mm的两个剖面。用PBS配置的4%多聚甲醛固定30 min,后用PBS洗涤3次;用5%绵羊血清-4%Triton 100-PBS封闭样本1 h;用CD68(1∶200)和CD206(1∶100)抗体4 ℃孵育过夜;PBS洗涤3次,加入相应的荧光二抗(1∶500),室温孵育1 h;PBS洗涤3次后,DAPI(1∶1000)染色5 min;PBS洗涤3次,用抗荧光淬灭剂封片,暗处风干片子,荧光显微镜下观察小鼠乳腺肿瘤中巨噬细胞的分布,每只小鼠取6个代表性的视野,用Image-J统计DAPI、CD68阳性细胞、CD206阳性细胞占视野的比例,并计算CD68阳性细胞/DAPI和CD206阳性细胞/CD68阳性细胞比值,其分别代表巨噬细胞比例和M2型巨噬细胞相对比例。
1.9 统计学方法
采用SPSS 19.0软件进行统计学分析。实验数据先进行正态性检验,偏态分布数据进行非参数秩和检验(Mann-Whitney U检验),结果以中位数和范围[M( Min~Max)] 表示;正态分布数据采用t检验,结果以均数±标准差(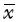 ±s)表示,以P<0.05为差异有统计学意义。
±s)表示,以P<0.05为差异有统计学意义。
流式细胞术检测结果显示,与空白对照组(35.10%±7.58%)比较,加入IL-13后F4/80hi CD206hi细胞比率(61.15%±3.67%)增加,差异有统计学意义(P<0.01)。提示IL-13诱导的M2型巨噬细胞极化体外模型构建成功。而加IL-13和拉帕替尼后 F4/80hi CD206hi细胞比率为53.38%±6.30%,小于只加IL-13组(P<0.05);加IL-13和绿原酸后F4/80hi CD206hi细胞比率为61.13%±3.15%,与只加IL-13组差异无统计学意义(P>0.05);而同时加IL-13、拉帕替尼和绿原酸后F4/80hi CD206hi细胞比率为42.17%±2.59%,均小于只加IL-13组和加IL-13和拉帕替尼组(均P<0.05)。提示拉帕替尼和绿原酸合用能减少由IL-13引起的巨噬细胞M2型极化。
2.2 拉帕替尼和绿原酸合用对M2型巨噬细胞相关基因表达的影响PCR检测结果显示,IL-13能上调Mrc1、Arg1和Ym1转录水平(均P<0.05),拉帕替尼和绿原酸合用能下调由IL-13上调的Ym1基因的转录(P<0.05),见表2。
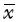 (±s) (±s)
| |||
| 处理因素 | Mrc1 | Arg1 | Ym1 |
| 空白对照 | 1.0±0.0 | 1.0±0.0 | 1.0±0.0 |
| +IL-13 | 2.8±0.7# | 5.5±2.4# | 1.8±0.0# |
| +绿原酸 | 1.3±0.4 | 0.9±0.3 | 0.8±0.1 |
| +拉帕替尼 | 1.8±0.5 | 0.9±0.4 | 1.3±0.0 |
| +绿原酸+拉帕替尼 | 1.5±0.5 | 0.5±0.1 | 0.7±0.2 |
| +IL-13+绿原酸 | 3.2±1.0 | 7.4±4.5 | 1.9±0.1 |
| +IL-13+拉帕替尼 | 1.8±0.5 | 4.1±1.3 | 1.2±0.0 |
| +IL-13+绿原酸+拉帕替尼 | 1.9±1.0 | 4.5±2.5 | 0.9±0.1* |
| 与空白对照比较,#P<0.05;与+IL-13比较,*P<0.05. | |||
由于M2型巨噬细胞的极化过程非常复杂,而Ym1基因作为一个普遍认可的M2型巨噬细胞标志基因,拉帕替尼和绿原酸合用对其由IL-13引起的上调现象有抑制作用,也在一定程度上说明两药合用对M2型巨噬细胞极化的抑制作用。
2.3 拉帕替尼和绿原酸合用对MMTV-PyVT小鼠乳腺癌肺转移的影响HE染色结果显示,对照组、绿原酸组、拉帕替尼组、合用组肺组织转移灶点(见图1)中位数分别为33(17~80)、28(1~39)、19(13~66)和2(2~17)个,合用组的肺组织转移灶点数少于空白对照组(P<0.05),其他两组间差异均无统计学意义。提示拉帕替尼与绿原酸的合用能有效抑制乳腺癌的肺转移。
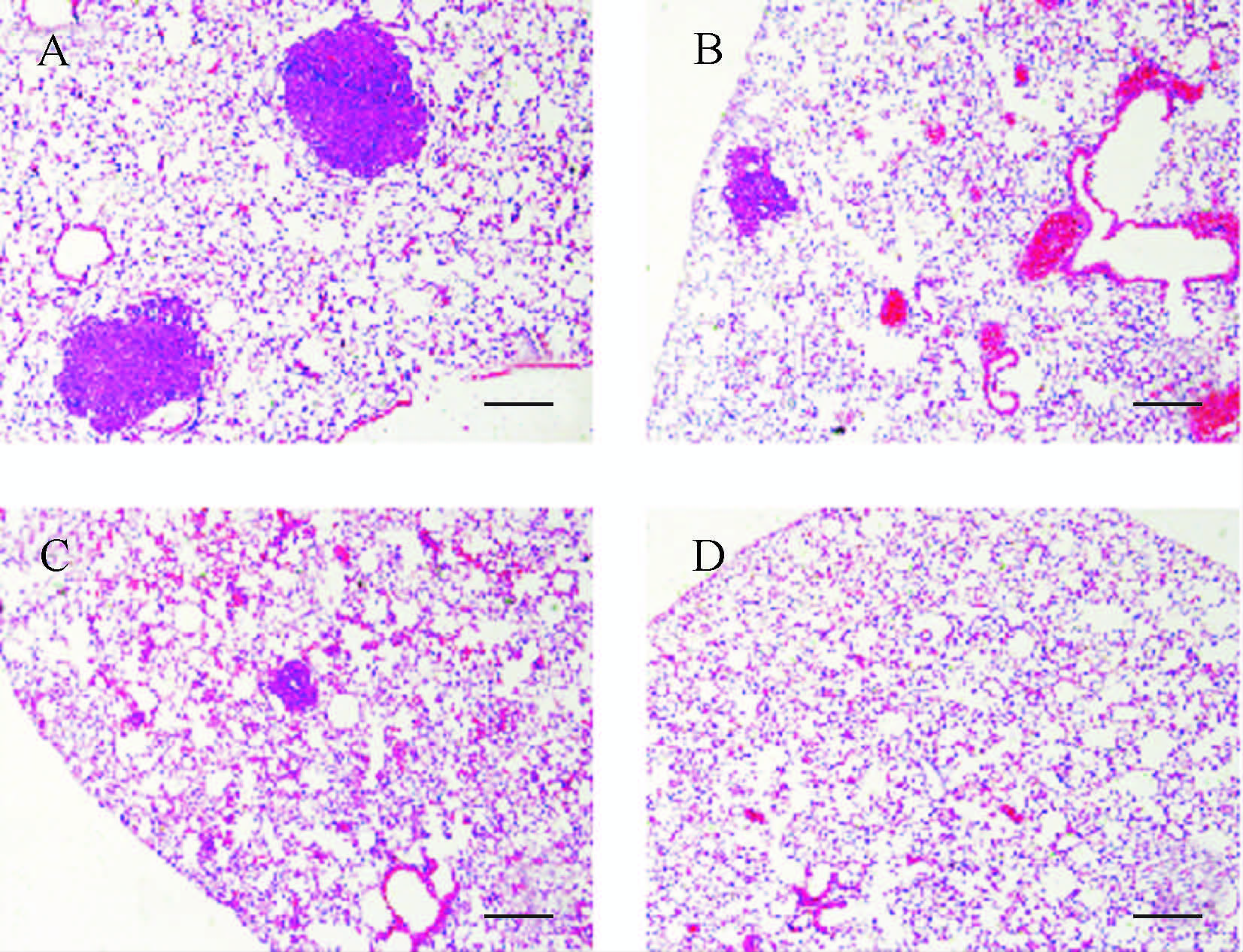
|
| A:空白对照组;B:拉帕替尼组;C:绿原酸组;D:合用组;紫红色区域为乳腺癌肺转移灶点,标尺=200 μm. 图1 各组小鼠肺组织HE染色结果 Fig.1 HE staining of lungs sections |
各组免疫荧光染色结果见图2。空白对照组、绿原酸组、拉帕替尼组、合用组CD68阳性细胞比例(即巨噬细胞比例)分别为4.0%±1.4%、6.0%±0.6%、4.1%±1.6%、3.3%±0.9%,组间CD68阳性细胞比率差异无统计学意义(均P>0.05);提示拉帕替尼和绿原酸的合用不会影响乳腺癌肿瘤组织中巨噬细胞的浸润。上述4组CD206阳性细胞占CD68细胞比率(即M2型巨噬细胞相对比例)分别为29.04%±5.86%、13.41%±3.21%、10.93%±6.05%、6.08%±2.60%,合用组该类型细胞比例低于空白对照组,差异具有统计学意义(P<0.05)。提示绿原酸和拉帕替尼合用能明显降低M2型巨噬细胞的比例。
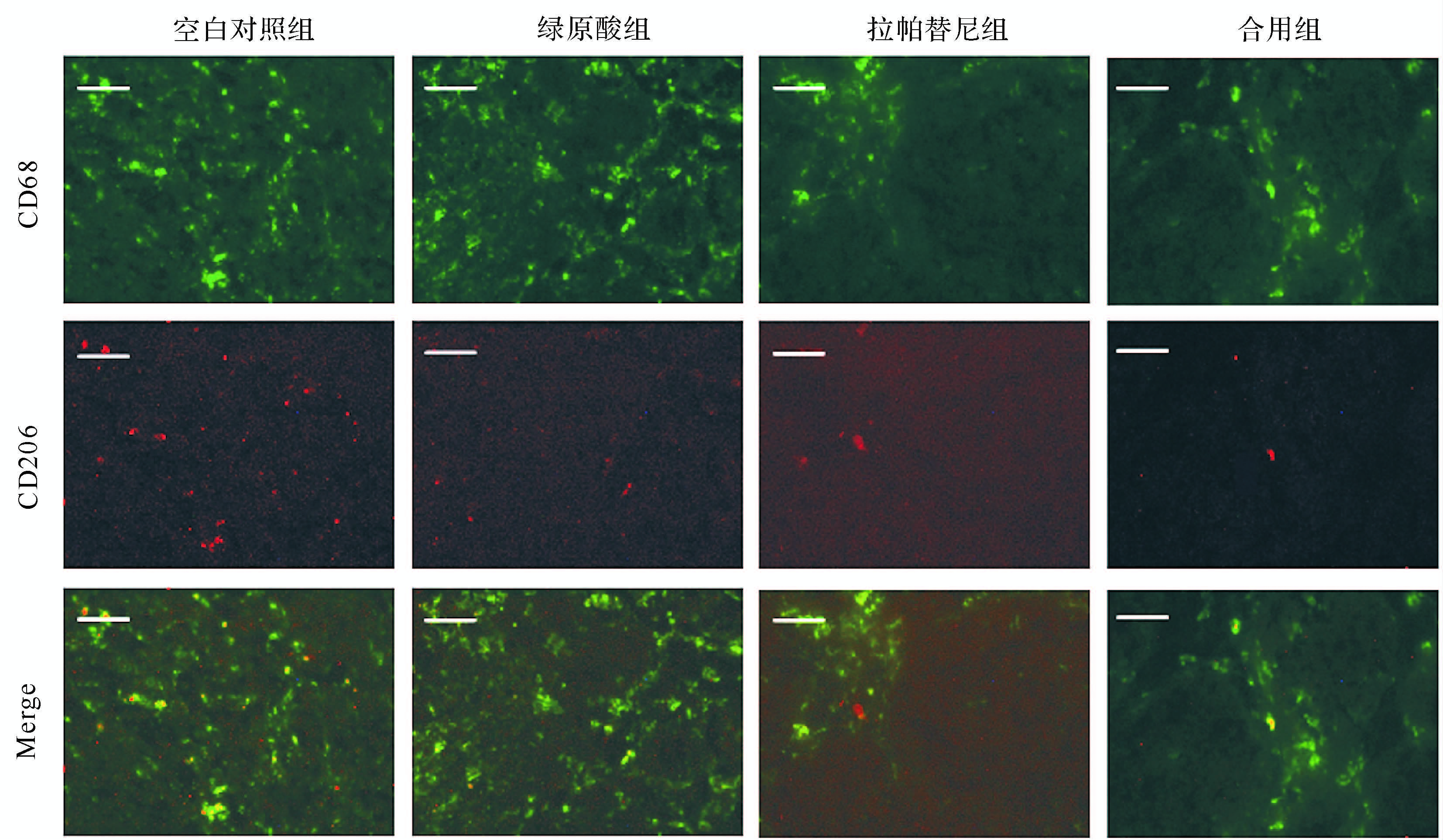
|
| 绿色荧光是CD68,代表巨噬细胞;红色荧光是CD206,代表M2型巨噬细胞.标尺=50 μm. 图2 小鼠乳腺癌组织CD68阳性和CD206阳性巨噬细胞荧光表现 Fig.2 The distribution of macrophages in mice breast cancer |
在体外实验中,我们通过流式细胞术、实时定量PCR两种方法分别从翻译、转录层面探究了拉帕替尼和绿原酸对骨髓来源的巨噬细胞极化的影响。结果表明拉帕替尼和绿原酸的合用能明显抑制IL-13诱导的骨髓来源的巨噬细胞的极化,且这种抑制作用强于拉帕替尼和绿原酸单独作用。
MMTV-PyVT自发乳腺癌小鼠的实验结果表明,拉帕替尼和绿原酸合用能够有效抑制乳腺癌的肺转移,且这种抑制作用强于拉帕替尼和绿原酸单独应用。而小鼠乳腺癌组织巨噬细胞表达情况表明,拉帕替尼和绿原酸合用能有效抑制瘤内巨噬细胞的M2型极化。这提示拉帕替尼和绿原酸的抗肿瘤转移作用与抑制巨噬细胞M2型极化可能存在一定的相关性。在肿瘤中,极化的M2型巨噬细胞能够分泌生长因子,促进肿瘤细胞的增殖; M2型巨噬细胞具有促新生血管生成的功能,还能够分泌基质酶,降低基底膜的通透性,促进肿瘤细胞的转移。而肿瘤转移是肿瘤治疗的重大难题之一,是近90%肿瘤患者死亡的原因。M2型巨噬细胞与肿瘤进阶的相关性表明M2型巨噬细胞可能是潜在的肿瘤治疗靶点[2]。
目前,拉帕替尼的临床应用仅仅局限于HER2阳性的转移性乳腺癌,且其治疗效果有一定的局限性,而临床采用的剂量对患者的毒副作用也无法避免。我们的研究表明拉帕替尼通过影响乳腺癌原发部位微环境中肿瘤相关巨噬细胞的极化而对乳腺癌的转移产生一定的抑制作用,且与绿原酸合用时,这种抑制作用更显著。值得一提的是,临床采用的拉帕替尼剂量平均血药浓度为2.6 μmol/L,而本研究采用的拉帕替尼浓度仅为0.02 μmol/L,近似临床用量的百分之一,可为降低拉帕替尼临床用药的毒性提供思路。
而另一个化合物绿原酸的研究主要集中在其抗炎作用及其机制,近年来也有关于绿原酸抑制结肠癌生长和转移方面的研究[13, 15]。此外,绿原酸是天然来源的化合物,是金银花、咖啡等食品的成分之一。人体可通过日常饮食摄入一定量的绿原酸,以减少摄入药物带来的不便甚至副作用。
本研究结果提示拉帕替尼和绿原酸联合用药能抑制巨噬细胞M2型极化,且可能与抗肿瘤转移作用存在一定的相关性。本研究从抑制巨噬细胞M2型极化抑制肿瘤转移的角度出发,提出了拉帕替尼合用的新方案,不仅丰富了拉帕替尼的用药方案,为拉帕替尼的临床应用提供了参考,也为巨噬细胞M2型极化作为新的抗肿瘤转移治疗提供了理论依据。
| [1] | GAO H, CHAKRABORTY G, LEE-LIM A P, et al. The BMP inhibitor Coco reactivates breast cancer cells at lung metastatic sites[J]. Cell, 2012,150(4):764-779. |
| [2] | QIAN B Z, POLLARD J W. New tricks for metastasis-associated macrophages[J]. Breast Cancer Res, 2012,14(4):316. |
| [3] | QIAN B Z, POLLARD J W. Macrophage diversity enhances tumor progression and metastasis[J]. Cell, 2010,141(1):39-51. |
| [4] | QIAN B Z, LI J, ZHANG H, et al. CCL2 recruits inflammatory monocytes to facilitate breast-tumour metastasis[J]. Nature, 2011,475(7355):222-225. |
| [5] | BISWAS S K, MANTOVANI A. Macrophage plasticity and interaction with lymphocyte subsets:cancer as a paradigm[J]. Nat Immunol, 2010,11(10):889-896. |
| [6] | LEWIS C E, POLLARD J W. Distinct role of macrophages in different tumor microenvironments[J]. Cancer Res, 2006,66(2):605-612. |
| [7] | SCHMIEDER A, MICHEL J, SCHONHAAR K, et al. Differentiation and gene expression profile of tumor-associated macrophages[J]. Semin Cancer Biol, 2012,22(4):289-297. |
| [8] | LAWRENCE T, NATOLI G. Transcriptional regulation of macrophage polarization:enabling diversity with identity[J]. Nat Rev Immunol, 2011,11(11):750-761. |
| [9] | RUFFELL B, AFFARA N I, COUSSENS L M. Differential macrophage programming in the tumor microenvironment[J]. Trends Immunol, 2012,33(3):119-126. |
| [10] | FALCHOOK G S, MOULDER S L, WHELER J J, et al. Dual HER2 inhibition in combination with anti-VEGF treatment is active in heavily pretreated HER2-positive breast cancer[J]. Ann Oncol, 2013,24(12):3004-3011. |
| [11] | TEVAARWERK A J, KOLESAR J M. Lapatinib:a small-molecule inhibitor of epidermal growth factor receptor and human epidermal growth factor receptor-2 tyrosine kinases used in the treatment of breast cancer[J]. Clin Ther, 2009,31 Pt 2:2332-2348. |
| [12] | BERNSTEIN C, HOLUBEC H, BHATTACHARYYA A K, et al. Carcinogenicity of deoxycholate, a secondary bile acid[J]. Arch Toxicol, 2011,85(8):863-871. |
| [13] | KASAI H, FUKADA S, YAMAIZUMI Z, et al. Action of chlorogenic acid in vegetables and fruits as an inhibitor of 8-hydroxydeoxyguanosine formation in vitro and in a rat carcinogenesis model[J]. Food Chem Toxicol, 2000,38(5):467-471. |
| [14] | KANG N J, LEE K W, KIM B H, et al. Coffee phenolic phytochemicals suppress colon cancer metastasis by targeting MEK and TOPK[J]. Carcinogenesis, 2011,32(6):921-928. |
| [15] | GUY C T, CARDIFF R D, MULLER W J. Induction of mammary tumors by expression of polyomavirus middle T oncogene:a transgenic mouse model for metastatic disease[J]. Mol Cell Biol, 1992,12(3):954-961. |
| [16] | LIN E Y, JONES J G, LI P, et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases[J]. Am J Pathol, 2003, 163(5):2113-2126. |
| [17] | ALMHOLT K, JUNCKER-JENSEN A, LAERUM O D, et al. Metastasis is strongly reduced by the matrix metalloproteinase inhibitor Galardin in the MMTV-PymT transgenic breast cancer model[J]. Mol Cancer Ther, 2008, 7(9):2758-2767. |




