全球每年有六十余万人死于肝癌,在癌症相关死亡中肝癌位居第二,仅次于肺癌。我国更是肝癌发病率最高的国家,全球有半数以上的肝癌病例发生在中国。在所有类型的肝癌中,肝细胞癌(hepatocellular carcinoma,HCC)是最主要的组织学亚型,约占肝癌总数的70%~85%[1]。手术治疗(包括外科切除和肝移植)是早期HCC最佳治疗方法,然而,由于HCC早期缺乏特异性症状,大部分患者确诊时已是HCC晚期,因而只有约15%的首诊患者适合手术治疗,不适合手术的HCC晚期患者只能采取化疗药物姑息治疗[2]。但是临床上系统化疗除索拉非尼(sorafenib)外缺乏公认的化疗标准及有效药物,因此晚期HCC患者常常面临无药可用的困境。对于索拉非尼不耐受或者不敏感患者而言,目前临床上多寻求化疗药物的联合应用。
伊立替康是一种Topo-I(Topoisomerase I)抑制剂,而SN-38则是其在人体内的活性代谢产物。Topo-I抑制剂是传统化疗药物,目前在临床上广泛用于多种实体瘤的治疗,大多疗效显著,但对肝癌疗效并不佳[3, 4]。索拉非尼是目前唯一被美国食品药品监督管理局批准用于临床治疗HCC的口服小分子多靶点、多激酶抑制剂,其通过抗肿瘤细胞增殖、抗血管生成和(或)促凋亡作用,破坏肿瘤的微血管,从而抑制肿瘤生长,但其对于肝癌的治疗作用仍十分有限[2]。本研究通过对伊立替康的活性代谢物SN-38与索拉非尼联合应用的体外抗肝癌效果及其机制的考察,旨在探究传统化疗药物与新型小分子靶向药物是否具有协同作用,从而改善两药单用的疗效,为临床肝癌药物治疗提供参考。
1 材料与方法 1.1 材料与试剂HepG-2细胞和BEL-7402细胞购于中国科学院典型培养物保藏委员会细胞库;RPMI-1640、DMEM、FBS均购于澳大利亚Hyclone公司;磺酰罗丹明B (SRB)、4′,6-二脒基-2-苯基吲哚(DAPI)、DMSO、Tris碱(三羟甲基氨基甲烷)、三氯醋酸、PI、核糖核酸酶A均购自美国Sigma-Aldrich公司;剪切的(cleaved-,c-)多聚二磷酸腺苷核糖聚合酶(poly ADP-ribose polymerase,PARP)抗体、剪切的半胱氨酸天冬氨酸水解酶(cysteinyl aspartate specific proteinase,Caspase)-3抗体、c-Caspase-8抗体、p53抗体、p21抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体、β-actin抗体和HRP标记的二抗购自美国Santa Cruz公司;磷酸化的组蛋白H2AX(γ-H2AX)购自美国Cell Signaling Technology公司。
1.2 细胞培养与分组HepG-2细胞和BEL-7402细胞培养于5%二氧化碳、37 ℃细胞培养箱中。其中HepG-2细胞用含10%FBS的DMEM培养液培养,BEL-7402细胞利用含10%FBS的RPMI 1640培养液培养,均以1×105 /mL的密度种于细胞培养瓶中。HepG-2细胞种于6孔板中,分为4组:空白对照组、SN-38组(60 nmol/L)、索拉非尼组(2.5 μmol/L)、合用组(60 nmol/L SN-38+2.5 μmol/L索拉非尼)。BEL-7402细胞种于六孔板中,分为4组:空白对照组、SN-38组(120 nmol/L)、索拉非尼组(2.5 μmol/L)、合用组(120 nmol/L SN-38+2.5 μmol/L索拉非尼)。
1.3 SRB显色法检测细胞存活率药物作用细胞72 h后,弃去培养液,每孔加入预冷的10%三氯醋酸溶液100 μL固定细胞,4 ℃冰箱放置1 h,培养板各孔以去离子水洗涤5遍,以去除三氯醋酸溶液,在空气中干燥后,每孔加入1%乙酸配制4 mg/mL SRB溶液50 μL,室温下放置20 min,弃去各孔内液体后用1%醋酸洗涤5遍,洗净未结合的SRB染料后空气干燥,每孔加入pH值为10.5的10 mmol Tris碱溶液100 μL溶解,在平板振荡器上振荡5 min,酶标仪515 nm波长下测定吸光度值。根据酶标仪测定的吸光度值,按下列公式计算细胞存活率:存活率(%)=给药组吸光度值/对照组吸光度值×100%。
1.4 合用指数评价药物协同作用合用指数是根据Chou-Talalay多药效应方程得出的药物协同作用的量化值,可采用Calcusyn软件计算得出。合用指数小于0.9即表明两药具有协同作用,介于0.9至1.1之间则表明两药有叠加效应,大于1.1则表明两药有拮抗作用。
1.5 流式细胞术检测细胞周期和细胞凋亡率药物作用48 h后,收集不同浓度SN-38组、索拉非尼组及空白对照组的HepG-2细胞,用PBS洗1遍,并用预冷的75%乙醇在-20 ℃固定过夜。固定过的细胞经PBS离心冲洗1次后重悬至500 μL PBS。加入核糖核酸酶 A 5 μL至终浓度为50 mg/mL,并于37 ℃孵育45 min,之后各组细胞加入PI 5 μL至终浓度为200 mg/mL,并在室温下避光进行DNA染色,用滤膜过滤后上流式细胞仪测定(每个样本采集2×104个细胞),用CellQuest软件分析细胞周期分布情况,处于亚 G1期的细胞占总细胞数的百分率表示细胞凋亡率。
1.6 蛋白质印迹法检测蛋白质表达药物作用48 h后,收集不同浓度SN-38组、索拉非尼组及空白对照组HepG-2和BEL-7402细胞,提取细胞总蛋白后利用SDS-PAGE凝胶110 V电泳约90 min,并通过330 mA电转移60 min,转移蛋白至PVDF膜上。5%(w/v)脱脂奶粉封闭1 h后,c-PARP(1∶500)、c-Caspase-8(1∶500)、c-Caspase-3(1∶500)、p53(1∶500)、p21(1∶500)、β-actin(1∶1000)、GAPDH(1∶1000)、γ-H2AX(1∶1000)抗体孵育4 ℃摇床孵育过夜,T-PBS洗膜3次后,室温孵育相应的HRP标记的二抗(1∶1000)1 h后,T-PBS洗膜3次,最后利用ECL试剂盒显色,并曝光、显影、定影,获得所需条带,以此测定细胞中各蛋白的表达情况。
1.7 统计学方法
采用统计软件SPSS 19.0进行数据分析。计量资料以均数±标准差(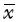 ±s)表示。组间比较采用单因素方差分析,方差齐性者再利用q检验进行两两比较,P<0.05为差异有统计学意义。
±s)表示。组间比较采用单因素方差分析,方差齐性者再利用q检验进行两两比较,P<0.05为差异有统计学意义。
随着药物浓度增加,SN-38组、索拉非尼组对于肝癌细胞的抑制作用逐渐增强,合用组抑制作用更为显著,见图1。此外,两药合用指数在一定范围内均小于0.9,见表1,提示两药具有协同作用。
|
| A:SN-38、索拉非尼单用或合用对HepG-2细胞存活率影响的量效曲线;B:SN-38、索拉非尼单用或合用对BEL-7402细胞存活率影响的量效曲线. 图1 SN-38、索拉非尼单用或合用对HepG-2和BEL-7402细胞生长的影响 Fig.1 The influence of SN-38 and sorafenib on the survival of HepG-2 and BEL-7402 cells |
| HepG-2 | BEL-7402 | ||||
| 索拉非尼浓度(μmol/L) | SN-38浓度(μmol/L) | 合用指数 | 索拉非尼浓度(μmol/L) | SN-38浓度(μmol/L) | 合用指数 |
| 0.3125 | 0.0020 | 1.08 | 0.625 | 0.0039 | 0.54 |
| 0.625 | 0.0039 | 0.61 | 1.25 | 0.0078 | 0.52 |
| 1.25 | 0.0078 | 0.49 | 2.5 | 0.0156 | 0.54 |
| 2.5 | 0.0156 | 0.46 | 5 | 0.0313 | 0.68 |
| 5 | 0.0313 | 0.50 | 10 | 0.0625 | 0.53 |
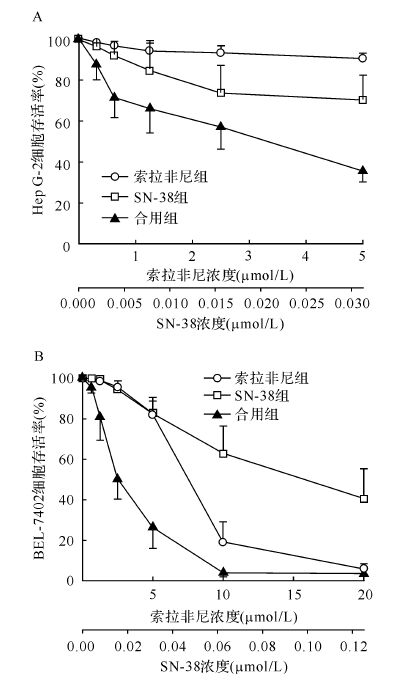
SN-38和索拉非尼单用或合用作用HepG-2 细胞48 h后,光学显微镜下可见合用明显增强了对HepG-2细胞的杀伤作用(图2)。空白对照组、SN-38组、索拉非尼组、合用组HepG-2细胞G2/M期百分率分别为12.2%±0.46%、67.3%±6.84%、8.89%±0.62%、54.0%±19.3%,见图3,SN-38组与合用组之间差异无统计学意义(P>0.05),SN-38组和合用组与空白对照组或索拉非尼组比较差异均有统计学意义 (均P<0.05)。提示SN-38单用或与索拉非尼合用均能导致HepG-2细胞G2/M期明显阻滞。

|
| 光镜下观察空白对照组HepG-2细胞生长正常,SN-38组HepG-2细胞生长受到抑制,索拉非尼组HepG-2细胞生长抑制程度较小,合用组HepG-2细胞生长明显抑制.标尺=100 μm. 图2 光镜下各组HepG-2细胞生长情况观察 Fig.2 Observation of HepG-2 cell survival by optical microscope |

|
| 空白对照组和索拉非尼组未见HepG-2细胞G2/M期阻滞(分别为12.2%±0.46%、8.89%±0.62%),SN-38组和合用组可见HepG-2细胞G2/M期明显阻滞(分别为67.3%±6.84%、54.0%±19.3%). 图3 流式细胞术检测各组细胞周期 Fig.3 Detection of cell cycle with flow cytometry |
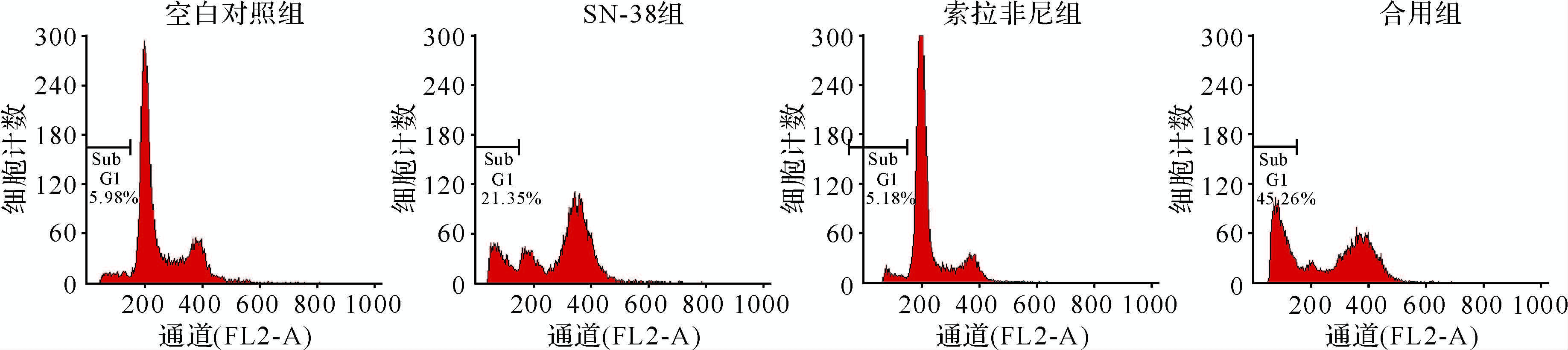
空白对照组、SN-38组、索拉非尼组、合用组HepG-2细胞凋亡率分别为4.25%±2.45%、28.95%±10.75%、3.49%±2.49%、53.19%±11.21%,合用组细胞凋亡率增加(均P<0.05),见图4。此外,DAPI染色可见SN-38组、合用组细胞均有明显的核固缩、高亮的凋亡小体等细胞凋亡的表征,见图5。上述结果提示,SN-38与索拉非尼合用时,HepG-2细胞凋亡率进一步增加。
|
| 空白对照组、SN-38组、索拉非尼组、合用组HepG-2细胞凋亡率分别为 4.25%±2.45%、28.95%±10.75%、3.49%±2.49%、53.19%±11.21%. 图4 流式细胞术检测各组细胞凋亡 Fig.4 Detection of apoptosis with flow cytometry |

|
| SN-38组和合用组均见细胞内核固缩以及高亮的凋亡小体,合用组更为明显. 标尺=100 μm. 图5 DAPI染色观察各组HepG-2细胞凋亡情况 Fig.5 Detection of apoptosis with DAPI staining |
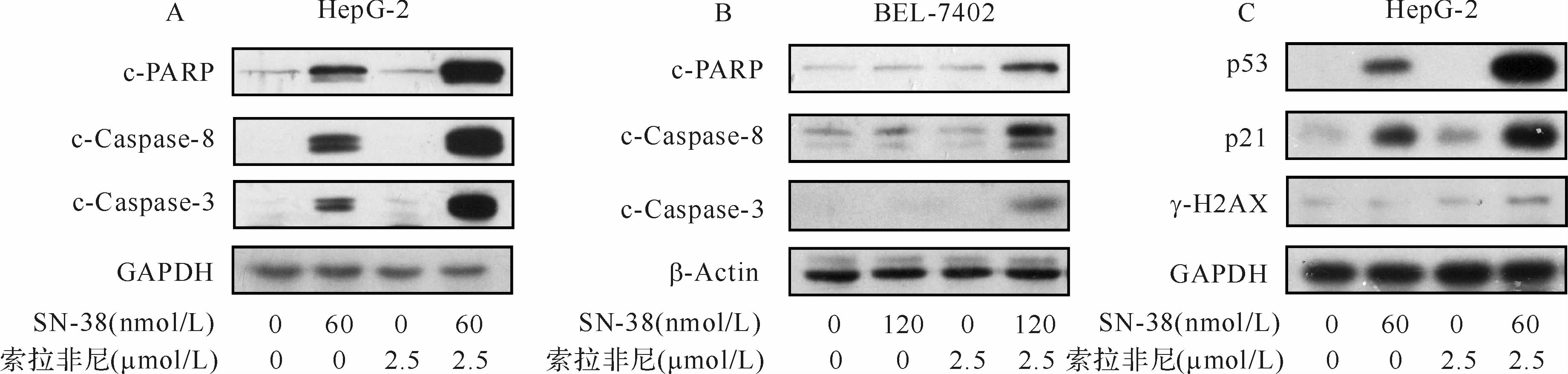
2.5 μmol/L索拉非尼分别与60 nmol/L及120 nmol/L SN-38作用48 h后,明显激活HepG-2和BEL-7402细胞凋亡Caspase信号通路,使得Caspase-8、Caspase-3、PARP蛋白被大量剪切(图6A、B)。此外,与空白对照组、SN-38组、索拉非尼组比较,合用组HepG-2细胞p53蛋白、p21蛋白及DNA损伤标志蛋白γ-H2AX表达均上调(图6C)。提示两药合用增强对肝癌细胞杀伤作用可能与药物引起的DNA损伤和p53蛋白、p21蛋白介导的细胞凋亡相关。
|
| A:HepG-2细胞凋亡相关蛋白的表达;B:BEL-7402细胞凋亡相关蛋白的表达;C:HepG-2细胞DNA损伤标记蛋白的表达 图6 SN-38组、索拉非尼组、合用组细胞凋亡相关蛋白和DNA损伤相关蛋白的表达 Fig.6 The levels of apoptosis-related and DNA damage-related proteins in HepG-2 and BEL-7402 cells after the administration of SN-38 and sorafenib |
晚期肝癌确诊时已不适合采取手术、肝移植等根治性疗法,临床上往往采用化疗药物进行姑息治疗[5]。伊立替康作为Topo-I抑制剂,是一种传统的细胞毒类化疗药物,能够与Topo I-DNA复合物结合并诱导DNA损伤和肿瘤细胞的凋亡。然而临床试验结果显示由于剂量依赖的毒性,伊立替康对HCC患者并没有显著效果[6]。因此期望伊立替康与另一化疗药物联合应用从而减少伊立替康的剂量及其所产生的毒性。
细胞凋亡是真核生物的一种细胞死亡方式,通常在胚胎发育、机体自我平衡的维持、免疫反应以及化学物质诱导的细胞杀伤中起到至关重要的作用[7]。细胞接受特定的信号刺激时(例如抗癌药物对癌细胞的杀伤),会发生一系列生物化学和形态学的改变,可能最终走向凋亡。Caspase家族是细胞凋亡相关的重要蛋白家族,在凋亡早期即会被激活,切割诸如细胞骨架中的结构蛋白和核蛋白等维持细胞生命的重要蛋白,进而引导细胞进入程序性的死亡[8]。
本研究发现,SN-38与索拉非尼联合应用对于HepG-2、BEL-7402肝癌细胞的抑制作用明显高于两药单独应用,0.625 μmol/L以上的索拉非尼与相应浓度的SN-38联合应用时,合用指数均小于0.9,在细胞水平上展现了良好的合用效果。与空白对照组及2.5 μmol/L索拉非尼组比较,60 nmol/L SN-38与索拉非尼和SN-38合用组的G2/M期细胞数增多,展现了明显的G2/M期周期阻滞作用,同时伴随着正常二倍体癌细胞的减少,亚G1期的细胞也显著增加[9],而Caspase家族会激活多种脱氧核糖核酸酶,诱导DNA的断裂与剪切,从而引起DNA的降解、核小体和DNA片段的形成[10]。这些DNA片段增多而正常DNA减少的细胞即为亚G1期的细胞,提示SN-38单用能促使肝癌细胞发生凋亡。当SN-38与索拉非尼合用时,亚G1期的细胞进一步增加,促进肝癌细胞凋亡效果显著。60 nmol/L SN-38与2.5 μmol/L索拉非尼联合应用能够显著增加HepG-2和BEL-7402细胞中Caspase-8、Caspase-3以及PARP的酶切量,这进一步证实了两药合用通过增加肝癌细胞的凋亡来提升抗癌效果。但BEL-7402细胞对SN-38的敏感性并不如HepG-2细胞,需要增加SN-38的浓度才能够观察到明显的合用效果。此外,在HepG-2细胞上,SN-38组的p53、p21表达水平有一定的增加,而合用组则能显著提高p53、p21的表达量。而且,合用组DNA损伤标志蛋白γ-H2AX水平也提高,γ-H2AX的聚集是DNA损伤时的特异性表现,提示两药合用能够增加癌细胞的DNA损伤。
p53是抑癌基因TP53表达的蛋白,当细胞受到严重而不可逆的损伤时,p53就会诱导细胞凋亡的发生[11]。两药合用时引起癌细胞DNA损伤,细胞为进行损伤修复会停滞于各细胞周期检查点,以便给细胞提供DNA修复的时间,p53信号通路在此过程中会被激活,这进一步引起了下游p21的激活[12]。p21是一种细胞周期蛋白的负性调控因子,p21能够抑制细胞从G1期到S期以及G2期到M期的进程[13]。而两药合用时,p53、p21表达上调,进一步维持了细胞周期阻滞。但由于DNA损伤修复受到影响,DNA损伤修复难以完成,进而增加了细胞的凋亡[14]。因此本实验结果表明,两药合用造成的DNA损伤通过p53/p21途径增加了细胞周期阻滞,导致细胞停滞于G2/M期;同时由于对药物所致的DNA损伤的修复失败,最终导致细胞进入凋亡阶段,起到了合用抗肝癌效果。
综上所述,相比于SN-38单独应用,SN-38与索拉非尼合用能够显著增加肝癌细胞凋亡而有效地提升作用效果。同时,两药剂量减少可能会降低伴随的毒性,提高了应用潜能。针对临床肝癌治疗的现状,该合用方案为临床肝癌治疗提供了新的潜在方案。同时,传统化疗药物与小分子靶向药物的联合使用对于临床上拓宽新型小分子靶向药物的适用范围、提升传统化疗药物的治疗作用也有十分重要的意义。
| [1] | TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108. |
| [2] | XIE B, WANG D H, SPECHLER S J. Sorafenib for treatment of hepatocellular carcinoma:a systematic review[J]. Dig Dis Sci, 2012,57(5):1122-1129. |
| [3] | BRANDI G, BIASCO G, MIRARCHI M G, et al. A phase I study of continuous hepatic arterial infusion of irinotecan in patients with locally advanced hepatocellular carcinoma[J]. Dig Liver Dis, 2011,43(12):1015-1021. |
| [4] | FONT A, SANCHEZ J M, ROSELL R, et al. Phase I study of weekly CPT-11(irinotecan)/docetaxel in patients with advanced solid tumors[J]. Lung Cancer, 2002,37(2):213-218. |
| [5] | HOLLEBECQUE A, MALKA D, FERTÉ C, et al. Systemic treatment of advanced hepatocellular carcinoma:from disillusions to new horizons[J]. Eur J Cancer, 2015,51(3):327-339. |
| [6] | BOIGE V, TAÏEB J, HEBBAR M, et al. Irinotecan as first-line chemotherapy in patients with advanced hepatocellular carcinoma:a multicenter phase II study with dose adjustment according to baseline serum bilirubin level[J]. Eur J Cancer, 2006,42(4):456-459. |
| [7] | WYLLIE A H. Apoptosis:an overview[J]. Br Med Bull, 1997,53(3):451-465. |
| [8] | HENGARTNER M O. The biochemistry of apoptosis[J]. Nature, 2000,407(6805):770-776. |
| [9] | RICCARDI C, NICOLETTI I. Analysis of apoptosis by propidium iodide staining and flow cytometry[J]. Nat Protoc, 2006,1(3):1458-1461. |
| [10] | NUNEZ R. DNA measurement and cell cycle analysis by flow cytometry[J]. Curr Issues Mol Biol, 2001,3(3):67-70. |
| [11] | VOGELSTEIN B, LANE D, LEVINE A J. Surfing the p53 network[J]. Nature, 2000,408(6810):307-310. |
| [12] | EVAN G I, VOUSDEN K H. Proliferation, cell cycle and apoptosis in cancer[J]. Nature, 2001,411(6835):342-348. |
| [13] | BUNZ F, DUTRIAUX A, LENGAUER C, et al. Requirement for p53 and p21 to sustain G2 arrest after DNA damage[J]. Science, 1998,282(5393):1497-1501. |
| [14] | OHKI R, NEMOTO J, MURASAWA H, et al. Reprimo, a new candidate mediator of the p53-mediated cell cycle arrest at the G2 phase[J]. J Biol Chem, 2000,275(30):22627-22630. |




