2. 浙江省义乌市中心医院, 浙江义乌 322000
2. Yiwu Central Hospital, Yiwu 322000, China
恶性肿瘤严重威胁人类的健康,目前成为全球第二大死亡原因[1, 2]。肿瘤转移是恶性肿瘤的主要特征之一,也是中晚期肿瘤患者最主要的致死原因。据统计,约有90%的肿瘤患者死于转移相关的并发症[3]。然而目前缺乏针对肿瘤转移的有效治疗药物。因此,在了解肿瘤转移分子生物学机制的基础上研究和开发靶向干预肿瘤转移过程的药物非常迫切。
舒尼替尼是一种口服高选择性多靶点小分子蛋白酪氨酸激酶抑制剂,可阻断多种信号通路和抑制新血管生成,对胃肠肿瘤和晚期肾癌都有治疗作用[4]。除了对新生血管的抑制作用之外,舒尼替尼还可能具有影响和干预肿瘤转移的作用[5],但是其发挥抗肿瘤作用的机制并未明确。近年来研究表明,上皮—间质转化(epithelial-mesenchymal transition,EMT)即上皮细胞通过特定程序转化为具有间质表型细胞的过程是来源于上皮细胞的恶性肿瘤细胞获得迁移和侵袭能力的核心环节[6]。转化生长因子β(transforming growth factor-β,TGF-β)作为EMT发生过程的重要诱导因子,可通过TGF-β-Smad信号轴,上调Snail家族转录因子,抑制上皮标志物的表达,增加间质标志物的水平[7]。目前认为,探寻可靶向阻断EMT从而抑制肿瘤转移的治疗手段,将有望突破抗肿瘤转移药物的研发瓶颈,具有重大的理论意义和临床需求。
EMT是肿瘤细胞获得运动能力的初始步骤,而TGF-β是引发EMT发生的经典刺激因子[8],因此,我们研究了舒尼替尼对TGF-β诱导的SKOV3细胞EMT发生的影响。E-钙黏蛋白(E-cadherin)是钙黏蛋白超家族的经典成员之一,是细胞生长和侵袭的抑制因子。E-cadherin作为上皮标志物,可以维持着细胞间的相互黏附[9];而其表达的下降和缺失则是EMT发生的主要标志之一[10]。目前业内将E-cadherin mRNA水平和蛋白表达下降作为判断EMT发生的重要标志。因此,我们考察了舒尼替尼对E-cadherin mRNA水平、蛋白表达的影响,从而研究其对EMT的干预作用。
TGF-β诱导EMT的发生过程中,转录调节占据了主导地位。在TGF-β作用下,细胞膜表面的TGF-β受体I和受体II形成异源二聚体,募集细胞内的效应蛋白磷酸化Smad2和Smad3,后两者又与Smad4形成三聚体,通过核内外穿梭机制易位至细胞核发挥转录调控作用。在EMT发生过程的不同信号层面上,分别发生转录抑制和转录激活调控,包括Smad复合物对Snail家族成员的转录启动调控,以及Snail等对上皮标志物如E-cadherin转录抑制作用[11]。Snail可通过与E-cadherin启动子区域结合来抑制E-cadherin的转录[12, 13],因此Snail的表达是EMT发生的重要介导分子之一。
本研究在明确舒尼替尼对肿瘤细胞迁移运动能力影响的基础上,通过transwell技术、蛋白质印迹法、荧光定量PCR、免疫荧光等实验方法来探究舒尼替尼对EMT的干预作用,从而阐明舒尼替尼对TGF-β诱导的EMT影响及其抑制肿瘤细胞运动迁移能力的分子生物学机制。
1 材料与方法 1.1 材料与试剂人卵巢癌SKOV3细胞购自中国科学院上海细胞生物研究所细胞库。舒尼替尼和SB431542购自美国Selleck公司;RPMI 1640粉末、FBS购自美国Hyclone公司;胰酶、羊抗鼠Alexa Fluor® 594、羊抗兔Alexa Fluor® 488荧光抗体和LipofectaminTM 2000购自美国Invitrogen公司;TGF-β和Snail抗体购自美国RD公司;E-cadherin抗体购自美国BD Bioscience公司;β-actin抗体、辣根过氧化物酶标记二抗和E-cadherin免疫荧光抗体均购自美国Santa Cruz公司;ECL试剂盒购自澳大利亚Amersham Biosciences公司;PVDF膜(0.45 μm)购自英国Millipore公司;显影粉、定影粉购自杭州凯普乐医疗器械有限公司;X光胶片购自美国柯达公司;RNA提取试剂盒购自加拿大Bio Basic公司;SYBR试剂盒购自日本Takara公司;随机引物、dNTP、RNA酶抑制剂、逆转录酶均购自生工生物工程(上海)股份有限公司;Opti-MEM培养液购自美国Gibco公司;SBE-luciferase购自美国Addgene公司;pRL-IRES Renilla和双荧光素酶报告检测系统购自美国Promega公司;引物序列由生工生物工程(上海)股份有限公司合成。
1.2 细胞培养SKOV3细胞培养于5%二氧化碳、37 ℃细胞培养箱中,用含有10%FBS的RPMI1640培养基培养,细胞传代处理时用胰酶消化,以血清终止消化,离心后以新鲜培养液重悬,接种于细胞培养瓶或者培养板中。
1.3 划痕实验检测细胞迁移情况划痕实验分组设置:空白对照组(10%FBS,不给药物)、不同浓度舒尼替尼组(1、2、4 μmol/L)和阳性对照组(TGF-β受体抑制剂SB431542,10 μmol/L)。将SKOV-3细胞以1×104/孔的密度接种于24孔板,至90%汇合度时用灭菌枪头对贴壁细胞造成划痕,更换新鲜培养液以除去漂浮细胞后,置于显微镜下观察并拍照设为对照。放入培养箱培养一定时间后,置于倒置显微镜下对比每孔细胞迁移情况。
1.4 Transwell技术检测细胞的迁移情况先将细胞用无血清培养液饥饿处理过夜,然后将细胞消化置于无血清培养液中重悬后,接种于上室(200 μL/孔,3×104 /孔),下室放入600 μL/孔培养液。实验分5组:阴性对照组(无血清无给药)、空白对照组(10%FBS,不给药物)和不同浓度舒尼替尼组(1、2、4 μmol/L)。置于培养箱24 h,用PBS清洗上室和下室1次,并用棉签擦去上室的细胞,用75%预冷的酒精固定30 min,固定结束后用0.1%结晶紫进行染色,用PBS清洗多余结晶紫,在显微镜下观察并拍照记录下细胞的迁移情况。
1.5 蛋白质印迹法检测蛋白水平裂解细胞,提取蛋白,定量分装后,加入上样缓冲液,沸水煮5~10 min,-80 ℃冰箱中保存或用于后续的实验;将分装好的蛋白上样,用1×电泳缓冲液恒压电泳,电压为70~130 V。电泳结束后于冰水浴中330 mA恒流转膜1 h。转膜结束后置于5% w/v脱脂奶粉缓慢摇晃封闭1 h,用E-cadherin抗体(250 μg/mL,1∶1000)室温孵育1 h后4 ℃过夜;用1×TBS、0.1% 吐温-20将膜洗3遍;然后加入二抗室温孵育1 h,同上洗3遍。最后用ECL试剂孵育1 min,放于曝光盒中,进入暗室用X光胶片曝光后取出胶片,扫描胶片观察蛋白质条带。
1.6 荧光定量PCR检测E-cadherin mRNA水平用无RNA酶的EP管收集细胞,以Trizol裂解细胞,加入氯仿,剧烈振荡15 s,室温放置5~10 min,4 ℃13 400 ×g离心10 min;吸取上清液,加入等体积异丙醇,轻微晃动,室温放置一段时间,4 ℃13 400 ×g离心10 min;小心吸弃上清液,沉淀用1 mL 75%乙醇洗涤,4 ℃ 13 400 ×g离心3 min,吸弃上清液,挥发至干;用30~50 μL DEPC水溶解沉淀,逆转录得到cDNA。加入PCR反应体系中进行目标片段的扩增,每个样品设两个复孔。PCR引物序列如下:E-cadherin上游引物:5′-CTCGTAACGACGTTGCACC-3′,下游引物:5′-CTGTGGGGTCAGTATCAGCC-3′; GAPDH上游引物: 5′-GACTCATGACCACAGTCCATGC-3′,下游引物: 5′-AGAGGCAGGGATGATGTTCTG-3′。反应体系为20 μL (2×QuantiTect SYBR Green PCR Master Mix 10 μL,10 μmol/L目标基因上游引物和下游引物各0.25 μL,模板cDNA 5 μL,灭菌去离子水4.75 μL)。PCR反应条件为95 ℃预变性15 min后,94 ℃变性30 s,60 ℃退火30 s,68 ℃延伸30 s,40个循环。
1.7 免疫荧光实验检测舒尼替尼对E-cadherin表达和细胞内分布的调控情况以PBS配制的4%多聚甲醛将六孔板中处理过的细胞固定10~15 min,PBS洗2次。3%BSA封闭1 h左右,将E-cadherin抗体(0.3% BSA溶液稀释,按1∶200稀释)加至六孔板,4 ℃过夜。将六孔板用PBS洗3次后,加入荧光二抗,室温孵育1 h。DAPI染色,加入抗体淬灭剂,置于荧光倒置显微镜下观察拍照。
1.8 双荧光素酶报告系统实验检测舒尼替尼对Smad信号通路转录活性的影响将细胞按6 000/孔接种于96孔板后。孵育24 h后,共转染SBE-luciferase和pRL-IRES Renilla质粒。转染24 h后,给予舒尼替尼和TGF-β作用6 h,随后弃去培养液,用PBS清洗1次,以双荧光素酶报告系统检测试剂盒检测。加入PLB(1×)裂解后取20 μL移至96孔板中,待检测荧光素酶活力。每孔加入100 μL Luciferase Assay Buffer II可检测萤火虫荧光素酶活性;加入100 μL Stop & Glo Buffer可检测海肾荧光素酶活性。
1.9 统计学方法
采用SPSS 19.0软件对定量数据进行分析,数值以均数±标准差(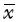 ± s)表示,实验重复至少3次,多组之间均值差异用单因素方差分析检测,两组间均值差异用双侧t检验,P<0.05为差异具有统计学意义。
± s)表示,实验重复至少3次,多组之间均值差异用单因素方差分析检测,两组间均值差异用双侧t检验,P<0.05为差异具有统计学意义。
采用划痕实验和transwell实验考察舒尼替尼对卵巢癌SKOV3细胞迁移能力的影响。如图1A所示,SKOV3细胞划痕后24 h,空白对照组划痕完全修复,不同浓度的舒尼替尼组则可抑制划痕的愈合,阳性对照组也可阻断划痕的修复。由此可见,舒尼替尼对卵巢癌SKOV3细胞的迁移能力有抑制作用,且在一定浓度范围内呈现量效关系。

|
| A:划痕实验观察舒尼替尼处理24 h后SKOV3细胞迁移;划痕24 h后,空白对照组的划痕几乎完全闭合,而舒尼替尼可显著干预划痕的闭合; 标尺=50 μm. B:Transwell实验观察舒尼替尼处理24 h后SKOV3细胞迁移,10% FBS处理造成细胞从上室迁移到下室,舒尼替尼处理组的运动能力显著减少.标尺=50 μm. 图1 舒尼替尼对卵巢癌SKOV3细胞迁移能力的影响 Fig.1 Effect of cell motility of Sunitinib on human ovarian cancer cell line SKOV3 |
为了进一步明确舒尼替尼对细胞迁移能力的影响,以1、2、4 μmol/L 舒尼替尼处理SKOV3细胞24 h,迁移能力较强的细胞通过多孔薄膜转移到下部表面,细胞结晶紫染色后通过倒置显微镜观察结果见图1B。下室无血清的细胞迁移能力较低,而10%FBS刺激则可使大量细胞迁移到下室。0、1、2、4 μmol/L 舒尼替尼与细胞共孵育后细胞迁移抑制率分别为0、6.1%±4.1%、25.3 %±9.3%、61.0%±10.3%,2、4 μmol/L 舒尼替尼组细胞迁移抑制率均大于0、1 μmol/L 舒尼替尼组(均P<0.05)。
划痕实验和transwell实验结果提示舒尼替尼对卵巢癌SKOV3细胞的运动迁移能力有抑制作用。
2.2 舒尼替尼对TGF-β诱导的E-cadherin蛋白下调的干预作用蛋白质印迹法检测结果显示,在未进行任何刺激的SKOV3细胞中,E-cadherin蛋白表达水平较高。当加入5 ng/mL TGF-β干预 48 h后,E-cadherin蛋白表达减少,提示TGF-β可诱导SKOV3细胞发生EMT。以梯度浓度的舒尼替尼处理TGF-β作用的SKOV3细胞,结果舒尼替尼抑制TGF-β导致的E-cadherin蛋白表达减少(图2A)。采用荧光定量PCR检测舒尼替尼作用下E-cadherin mRNA水平。如图2B所示,TGF-β刺激后,SKOV3细胞中E-cadherin mRNA水平下降(E-cadherin/GAPDH从1下降为0.12±0.06),加入SB431254也可干预E-cadherin mRNA下调作用(E-cadherin/GAPDH为0.77±0.14),而加入2 μmol/L 舒尼替尼后E-cadherin mRNA水平的下降被部分阻断(E-cadherin/GAPDH为0.37±0.08),与未加舒尼替尼比较差别有统计学意义(P<0.05)。

|
| A: 蛋白质印迹法检测舒尼替尼对E-cadherin蛋白水平的调控作用;B: 免疫荧光技术观察舒尼替尼对E-cadherin蛋白表达和细胞内分布的影响(绿色代表E-cadherin,蓝色代表DAPI染色的细胞核). 标尺=30 μm.无TGF-β处理的空白对照组细胞中,E-cadherin表达水平较高;TGF-β处理后造成E-cadherin水平显著下降,而舒尼替尼可部分逆转E-cadherin的下降. 图2 舒尼替尼对E-cadherin表达的影响 Fig.2 The effects of Sunitinib on E-cadherin levels |
进一步应用免疫荧光技术检测E-cadherin在细胞内的表达情况,结果显示,TGF-β刺激后SKOV3细胞中E-cadherin基本消失,而在舒尼替尼作用下,SKOV3细胞中E-cadherin蛋白表达有一定程度上调(图2B)。
上述结果提示,舒尼替尼可以阻断TGF-β介导的EMT发生,表现为舒尼替尼可明显抑制TGF-β介导的E-cadherin mRNA和蛋白水平的下降。
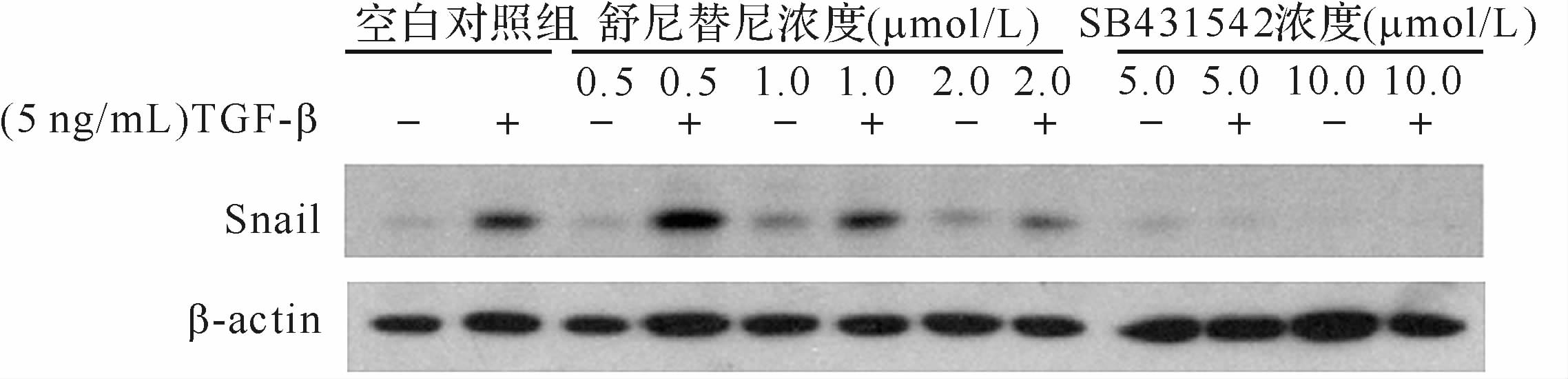
2.3 舒尼替尼可以阻碍TGF-β诱导的Snail蛋白上调和Smad活性增强在TGF-β作用下,Snail蛋白水平上调,而当加入舒尼替尼或SB431254后,Snail的上调被抑制,见图3。提示舒尼替尼可干扰TGF-β对Snail蛋白表达的诱导作用。
|
| 图3 舒尼替尼对Snail蛋白表达的影响 Fig.3 The effects of Sunitinib on Snail protein |
采用报告基因检测系统考察细胞中SBE-luciferase的活性,以此反映Smad复合物启动靶基因转录的活性[14]。对照组细胞在TGF-β作用下,Smad复合物的转录活性增至(14.7±3.3)倍;加入 2、4 μmol/L 舒尼替尼作用后,Smad复合物的活性倍数分别降为(4.9±2.3)倍和(2.5±1.4)倍,差别均有统计学意义(均P<0.05)。
以上结果表明,舒尼替尼可能通过作用于TGF-β-Smad信号通路,干预Smad复合物转录活性,从而阻断Snail蛋白的上调,进而解除其对E-cadherin的转录抑制作用,影响EMT的发生。
3 讨 论舒尼替尼通过抑制新生血管生成,在多种肿瘤模型如肾癌、乳腺癌、结肠癌、黑色素瘤和表皮癌等中均表现出较强的抗肿瘤效果[15]。除了对新生血管的抑制作用之外,舒尼替尼还可能具有潜在的抗肿瘤转移活性[5, 16],但是其抗肿瘤转移机制尚不明确。我们的研究显示,在SKOV3卵巢癌细胞中,舒尼替尼可抑制细胞的运动和迁移,提示该药物可作为干预肿瘤转移的新策略。
EMT作为一种基本的生理病理现象,参与了胚胎早期发育等多种重要的生理过程。EMT的异常发生和肿瘤的发展转移具有密切的关系[17, 18, 19, 20, 21],近年来文献证据显示抑制EMT的发生可有效干预肿瘤细胞的转移[20]。因此,以EMT过程中发挥关键作用的分子为靶点,探寻可干预该过程发生的药物,将可能成为对抗肿瘤转移发生的新策略。TGF-β作为一个经典的肿瘤细胞转移因子,在肿瘤生长和转移过程中起到关键的促进作用,可通过与其受体结合,触发受体磷酸化,继而引起Smad2和Smad3的磷酸化,形成Smad2/3/4复合物,从而激活靶基因的转录,促进EMT的发生[21]。我们的研究采用TGF-β引发卵巢癌SKOV3细胞发生EMT,通过E-cadherin蛋白水平和mRNA水平的减少表征EMT的发生[22]。研究结果显示舒尼替尼可抑制TGF-β引起的E-cadherin下降,说明其可阻断EMT的发生,提示舒尼替尼对肿瘤细胞运动能力的干预可能是其抑制EMT作用的表现。我们考察了E-cadherin mRNA水平,发现舒尼替尼可阻断TGF-β引起的E-cadherin mRNA下降,提示舒尼替尼调控E-cadherin的表达发生在转录层面。接着,我们发现舒尼替尼可以抑制E-cadherin的转录调控分子Snail蛋白水平,并且观察到Snail的上游Smad复合物的转录活性也在舒尼替尼作用下下调。鉴于众多文献已确认Smad-Snail-E-cadherin信号轴在EMT发生过程中的核心作用,我们有理由推测,舒尼替尼可能通过干扰Smad复合物的转录活性,导致Snail表达下降,从而解除Snail对E-cadherin启动子的抑制作用,最终达到抑制EMT发生的作用。
综上所述,我们的研究在明确舒尼替尼影响卵巢癌SKOV3细胞运动和迁移能力的基础上,发现其可能通过干扰TGF-β-Smad信号轴,发挥对EMT乃至肿瘤转移的抑制作用。我们的研究丰富了舒尼替尼的抗肿瘤作用,初步探讨其干预肿瘤转移机制,为拓展舒尼替尼的临床应用提供科学依据。而舒尼替尼负性调控TGF-β-Smad信号通路的具体分子生物学机制有待进一步研究。
| [1] | SIEGEL R, MA J, ZOU Z, et al. Cancer statistics[J]. CA Cancer J Clin, 2014,64(1):9-29. |
| [2] | DESANTIS C E, LIN C C, MARIOTTO A B, et al. Cancer treatment and survivorship statistics[J]. CA Cancer J Clin, 2014,64(4):252-271. |
| [3] | BOGENRIEDER T, HERLYN M. Axis of evil:molecular mechanisms of cancer metastasis[J]. Oncogene, 2003,22(42):6524-6536. |
| [4] | 戴媛媛, 汤致强. 新型多靶点蛋白激酶抑制剂——舒尼替尼[J]. 中国药房, 2008,19(19):1504-1506. DAI Yuan-yuan, TANG Zhi-qiang. A new multi-target kinase inhibitors-sunitinib[J]. China Pharmacy, 2008,19(19):1504-1506.(in Chinese) |
| [5] | KUMAR R M, ARLT M J, KUZMANOV A, et al. Sunitinib malate(SU-11248) reduces tumour burden and lung metastasis in an intratibial human xenograft osteosarcoma mouse model[J]. Am J Cancer Res, 2015,5(7):2156-2168. |
| [6] | 惠起源, 魏晓萍. 上皮间质转化在肿瘤发生发展中的作用[J]. 中国肿瘤, 2013,22(3):219-222. HUI Qi-yuan, WEI Xiao-ping. The effect of the epithelial mesenchymal transition in the occurrence and development of tumor[J], China Cancer, 2013,22(3):219-222.(in Chinese) |
| [7] | XU J, LAMOUILLE S, DERYNCK R. TGF-β-induced epithelial to mesenchymal transition[J]. Cell Res, 2009,19(2):156-172. |
| [8] | DERYNCK R, MUTHUSAMY B P, SAETEURN K Y. Signaling pathway cooperation in TGF-β-induced epithelial-mesenchymal transition[J]. Curr Opin Cell Biol, 2014,12(31):56-66. |
| [9] | VAN ROY F. Beyond E-cadherin:roles of other cadherin superfamily members in cancer[J]. Nat Rev Cancer, 2014,14(2):121-134. |
| [10] | 张可华, 宋建国. EMT与肿瘤[J]. 生命的化学, 2008,28(5):523-526. ZHANG Ke-hua, SONG Jian-guo. EMT and tumor[J]. Chemistry of Life, 2008,28(5),523-526.(in Chinese) |
| [11] | BLANCO M J, MORENO-BUENO G, SARRIO D, et al. Correlation of Snail expression with histological grade and lymph node status in breast carcinomas[J]. Oncogene, 2002,21(20):3241-3246. |
| [12] | NIETO M A. The snail superfamily of zinc-finger transcription factors[J]. Nat Rev Mol Cell Biol, 2002,3(3):155-166. |
| [13] | CANO A, PÉREZ-MORENO M A, RODRIGO I, et al. The transcription factor snail controls epithelial-mesenchymal transitions by repressing E-cadherin expression[J]. Nat Cell Biol, 2000,2(2):76-83. |
| [14] | FENG X H, DERYNCK R. Specificity and versatility in TGF-beta signaling through Smads[J]. Annu Rev Cell Dev Biol, 2005,11(21):659-693. |
| [15] | FAIVRE S, DEMETRI G, SARGENT W, et al. Molecular basis for sunitinib efficacy and future clinical development[J]. Nat Rev Drug Discov, 2007,6(9):734-745. |
| [16] | MOTZER R J, HUTSON T E, TOMCZAK P, et al. Sunitinib versus interferon alpha in metastatic renal-cell carcinoma[J]. N Engl J Med, 2007,356(2):115-124. |
| [17] | HARBOUR J W, LUO R X, DEI SANTI A, et al. Cdk phosphorylation triggers sequential intramolecular interactions that progressively block Rb functions as cells move through G1[J]. Cell, 1999,98(6):859-869. |
| [18] | LIU F. Smad3 phosphorylation by cyclin-dependent kinases[J]. Cytokine Growth Factor Rev, 2006,17(1-2):9-17. |
| [19] | PARDALI K, MOUSTAKAS A. Actions of TGF-β as tumor suppressor and pro-metastatic factor in human cancer[J]. Biochim Biophys Acta, 2007,1775(1):21-62. |
| [20] | YANG J, WEINBERG R A. Epithelial-mesenchymal transition:at the crossroads of development and tumor metastasis[J]. Dev Cell, 2008,14(6):818-829. |
| [21] | WAKEFIELD L M, ROBERTS A B. TGF-β signaling:positive and negative effects on tumorigenesis[J]. Curr Opin Genet Dev, 2002,12(1):22-29. |
| [22] | THIERY J P. Epithelial-mesenchymal transitions in tumor progression[J]. Nat Rev Cancer, 2002,2(6):442-454. |




