胃癌是世界范围内最常见的肿瘤之一,位居肿瘤相关死亡的第二位[1]。进展期胃癌的预后差、死亡率高,而早期胃癌患者5年存活率可高达96%。因此,提高早期胃癌的诊断率对改善胃癌患者预后具有重要意义。由于早期胃癌在传统白光内镜(conventional white light endoscopy,C-WLE)下缺乏明显、特异的表现,诊断较为困难。随着内镜技术的进步,采用窄带成像(narrow-band imaging,NBI)联合放大内镜(magnifying endoscopy,ME)手段,可通过滤光片对蓝绿光进行窄化,并对细微病灶进行放大,以强调胃黏膜血管网及表面结构[2, 3],从而诊断早期胃癌[4, 5, 6]。但目前NBI联合ME(NBI-ME)诊断早期胃癌尚缺乏统一标准,且该方法较传统白光内镜诊断早期胃癌的优势尚不清楚,为此本研究旨在通过系统评价了解NBI-ME对早期胃癌诊断的价值。
1 资料与方法 1.1 文献检索策略截至2014年11月,检索了Embase、PubMed、Web of Science、Cochrane Library四大外文数据库建库以来的文献,检索策略:(“adenoma” or “dysplasia” or “early gastric cancer” or “carcinoma in situ”)and “narrow band imaging” and (“stomach” or “gastric”)或者(“cancer” or “neoplasia” or “carcinoma” or “tumor”) and (“stomach” or “gastric”) and (“intramucosal” or “submucosal”) and “narrow band imaging”。所有语言的文献均纳入检索范围。为尽量减少漏查文献,对已检索文献中提供的参考文献进行二次检索。
1.2 文献筛选分类收集到的文献资料以下列标准对搜索文献进行筛选分类。纳入标准:①研究目的为NBI-ME诊断早期胃癌的准确性,无论是否同时进行传统白光内镜检查;②以Vienna分级(the revised Vienna classification)中4或5类为诊断早期胃癌的病理标准[7];③能直接或间接获得NBI-ME诊断早期胃癌的真阳性、假阳性、真阴性和假阴性值。排除标准:重复发表的文献、个案报告、文摘、综述、讲座及评述类文献。
内镜操作定义:①单用NBI-ME,在前瞻性研究中指检查过程中仅运用NBI-ME对病灶进行观察,未用传统白光内镜对病灶进行观察;在回顾性研究中指只根据NBI-ME图片对病灶进行诊断,未同时观察同一病灶的传统白光内镜图片。②NBI-ME联合传统白光内镜,在前瞻性研究中指检查过程中先运用传统白光内镜对病灶进行观察,后进一步用NBI-ME对病灶进行观察、诊断;在回顾性研究中指对病灶的传统白光内镜及NBI-ME图片同时进行观察、诊断。
1.3 文献数据提取直接提取或间接计算出每篇纳入文献中NBI-ME诊断早期胃癌的真阳性、假阳性、真阴性和假阴性值;同时提取以下变量,包括作者及其国别、发表年份、病灶数量、研究类型、内镜型号、监视器设置、内镜先端帽运用情况、病灶大体类型、标本来源及NBI-ME诊断早期胃癌的分型标准。
1.4 文献质量评价运用诊断准确性研究质量评估工具(quality assessment of diagnostic accuracy studies,QUADAS)对每篇纳入文献的质量进行评价。QUADAS为一问卷式调查表,由14个条目构成,每一条目按“是”、“否”及“不清楚”进行分级[8]。由两名评价者独立进行文献检索、纳入及评价,遇有分歧时讨论解决。
1.5 统计学方法运用Meta-DiSc 1.4及Meta-Analyst 3.0.2软件对数据进行统计分析。计算Spearman相关系数评估各研究间的阈值效应异质性。计算诊断比数比的Cochran's Q及I2评估非阈值效应异质性,I2≤25%表明研究间异质性较小,25%<I2<50%表明异质性中度,I2≥50%表明异质性较大。若存在异质性,运用随机效应模型进行数据分析;若无异质性,则用固定效应模型。根据有无异质性,选择相应效应模型计算合并灵敏度、特异性、阳性似然比、阴性似然比及诊断比数比和相应的95% CI,并绘制综合受试者工作特征(symmetric receiver operator characteristic,SROC) 曲线,计算曲线下面积(area under the curve,AUC);AUC值越接近1,说明诊断的准确性越高。比较单用NBI-ME或NBI-ME联合传统白光内镜与传统白光内镜对早期胃癌的诊断效能,计算加权增量效应(incremental yield,IY)和95%CI。运用meta回归及亚组分析探讨异质性来源。检验水准为α=0.05。
2 结 果 2.1 纳入文献情况文献筛选流程见图 1。根据本研究的检索策略,初步纳入37篇文献进行全文阅读。其中15篇文献与本研究目的不符,5篇文献无法提取真阳性、假阳性、真阴性和假阴性值,5篇文献的病理标准与本研究不符,故予以排除。最终纳入12篇文献[4, 5, 6, 9, 10, 11, 12, 13, 14, 15, 16, 17],具体见表 1。纳入文献均采用Olympus Q240Z或H260Z内镜对病灶进行观察;有5篇文献研究说明白光内镜时监视器的设置为B4或B6,放大内镜时为B8[5, 9, 11, 14, 16],另7篇文献研究则描述不详[4, 6, 10, 12, 13, 15, 17]。有8篇文献研究使用了黑色内镜先端帽进行NBI-ME检查[5, 9, 10, 11, 12, 14, 15, 16],1篇文献研究使用了透明内镜先端帽[4],1篇文献则使用先端帽,但为透明或黑色不详[17],另两篇文献研究是否使用内镜先端帽未作 说明[6, 13]。5篇文献研究单用NBI-ME诊断早期胃癌[9, 10, 12, 15, 17],6篇文献研究则用NBI-ME联合C-WLE诊断早期胃癌[4, 5, 11, 13, 14, 16],1篇文献研究则包括单用NBI-ME及NBI-ME联合C-WLE诊断早期胃癌组[6]。用于病理诊断的标本,7篇文献研究来源于手术切除或内镜下切除[4, 5, 9, 10, 13, 14, 15],3篇文献研究来源于内镜下活检[6, 12, 16],2篇文献研究来源于手术切除或内镜下活检[11, 17]。
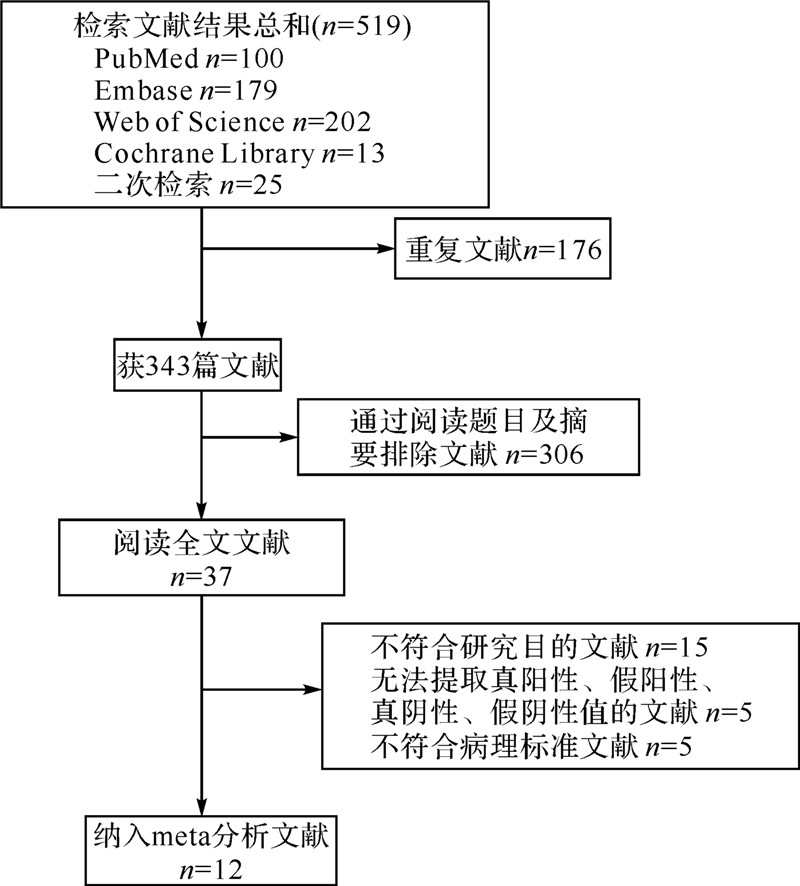
|
| 图 1 文献筛选流程 Fig.1 Study selection flow diagram |
| 作者 | 国别 | 年份 | 例数(男/女) | 年龄均数或中位数(岁) | 研究设计 | 病灶大体类型 | NBI-ME分型 |
| ?:表示无法从原文获取或原文未提供. | |||||||
| Li等[4] | 中国 | 2012 | 146(88/58) | 59.3±9.4 | 单中心前瞻性研究 | 隆起+凹陷性 | 腺管+微血管分型 |
| Miwa等[5] | 日本 | 2012 | 135(77/58) | 70.1(45~93) | 单中心回顾性研究 | 隆起+凹陷性 | 腺管+微血管分型 |
| Ezoe等[6] | 日本 | 2011 | 353(278/75) | 69(37~87) | 多中心前瞻性研究 | 凹陷性 | 微血管分型 |
| Fujiwara等[9] | 日本 | 2014 | 99(69/30) | ? | 单中心回顾性研究 | 隆起+凹陷型 | 腺管+微血管分型 |
| Kanesaka等[10] | 日本 | 2014 | 49(?/?) | ? | 单中心回顾性研究 | 隆起性 | 腺管分型 |
| Yao等[11] | 日本 | 2014 | 310(183/127) | 66(30~90) | 多中心前瞻性研究 | 隆起+凹陷型 | 腺管+微血管分型 |
| Tao等[12] | 中国 | 2013 | 508(316/192) | 63(41~78) | 单中心回顾性研究 | 隆起+凹陷型 | 腺管+微血管分型 |
| Tsuji等[13] | 日本 | 2012 | 137(101/36) | ? | 单中心回顾性研究 | 隆起+凹陷型 | 腺管+微血管分型 |
| Maki等[14] | 日本 | 2013 | 93(73/20) | ? | 单中心回顾性研究 | 隆起性 | 腺管+微血管分型 |
| Wang等[15] | 中国 | 2012 | 76(61/15) | 63.79(39~82) | 单中心回顾性研究 | ? | 腺管+微血管分型 |
| Yao等[16] | 日本 | 2008 | 42(?/?) | ? | 单中心前瞻性研究 | 隆起性 | 腺管+微血管分型 |
| Kaise等[17] | 日本 | 2009 | 100(88/12) | ? | 单中心回顾性研究 | 凹陷性 | 腺管+微血管分型 |
根据QUADAS工具对纳入研究进行质量评价,2篇文献符合该评价工具14个条目中的13个条目[4, 11],4篇文献符合12个条目[9, 15, 16, 17],4篇文献符合11个条目[6, 12, 13, 14],2篇文献符合10个条目[5, 10]。
2.3 NBI-ME诊断早期胃癌准确性的meta分析纳入meta分析的12篇文献,共包含了2 048例患者的2 278个病灶。异质性检验的阈值效应 Spearman相关系数=0.066(P=0.830),提示无阈值效应引起的异质性。诊断比数比的Cochran's Q=50.57(P=0.000),I2=76.3%,提示存在非阈值效应引起的异质性。运用随机效应模型分析NBI-ME联合或不联合传统白光内镜诊断早期胃癌的研究结果显示,合并灵敏度、特异性、阳性似然比、阴性似然比及诊断比数比分别为0.84、0.96、12.95、0.18及81.21,具体见表 2;SROC的AUC值为0.9592,见图 2。
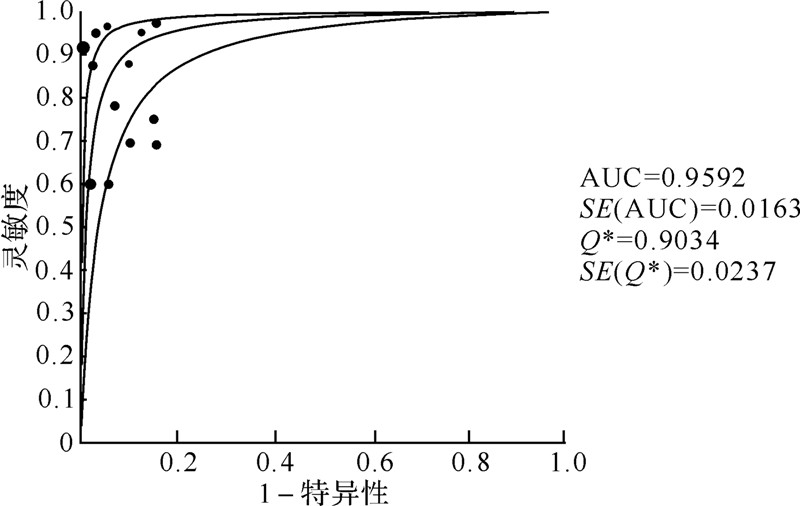
|
| 图 2 纳入研究的SROC曲线 Fig.2 Symmetric receiver operator characteristic curve of all studies |
| 统计指标 | 合并量(95%CI) | 异质性卡方值 | df | P值 | I2值(%) |
| 合并灵敏度 | 0.84(0.80~0.87) | 58.21 | 12 | 0.0000 | 79.4 |
| 合并特异性 | 0.96(0.95~0.97) | 89.73 | 12 | 0.0000 | 86.6 |
| 合并阳性似然比 | 12.95(7.67~21.88) | 58.35 | 12 | 0.0000 | 79.4 |
| 合并阴性似然比 | 0.18(0.12~0.28) | 50.90 | 12 | 0.0000 | 76.4 |
| 合并诊断比数比 | 81.21(36.49~180.71) | 50.57 | 12 | 0.0000 | 76.3 |
有3篇文献比较了单用NBI-ME与传统白光内镜对早期胃癌的诊断效能[6, 12, 17],其研究间无异质性(Cochran's Q=0.466,P=0.800);运用固 定效应模型计算增量效应,IY=0.8% (P=0.498,95% CI:-1.4%~ 2.9%),差异无统计学意义。另有3篇文献比较NBI-ME联合传统白光内镜与单用传统白光内镜对早期胃癌的诊断效能[5, 6, 14],研究间存在中度异质性(Cochran's Q=3.401,P=0.183,I2=41%);运用随机效应模型计算增量效应,IY=9.4% (P=0.011,95% CI: 2.1%~16.6%),差异有统计学意义。
2.4 研究异质性来源分析为探讨研究间异质性来源,对以下变量进行单因素meta回归分析,包括研究者国别(中国与日本)、病灶数、研究类型(前瞻性与回顾性)、病灶大体类型(凹陷型与隆起型与隆起凹陷型)、标本来源(内镜或手术切除与活检)、内镜操作过程(单用NBI-ME与NBI-ME联合传统白光内镜)及文献质量;结果发现病灶数这一变量是异质性的唯一来源,见表 3。然而将这些变量进行多因素meta回归分析,任一变量均未提示是异质性来源。
| 变量 | r值 | 相对诊断比数比(95% CI) | P值 |
| 研究者国别 | 0.983 | 2.67(0.25~28.94) | 0.379 |
| 病灶数 | 0.009 | 1.01(1.00~1.02) | 0.009 |
| 研究设计 | -0.831 | 0.44(0.03~7.58) | 0.521 |
| 病灶大体类型 | 0.084 | 1.09(0.23~5.15) | 0.905 |
| 标本来源 | -0.034 | 0.97(0.20~4.68) | 0.962 |
| 内镜操作 | -1.021 | 0.36(0.04~3.00) | 0.308 |
| 文献质量 | -0.257 | 0.77(0.28~2.17) | 0.592 |
纳入meta分析的12篇文献研究均说明了NBI-ME诊断早期胃癌的分型标准,其中有1篇文献研究根据表面结构分型[10],1篇文献研究根据微血管分型[6],其余10篇文献研究则根据表面结构及微血管分型[4, 5, 9, 11, 12, 13, 14, 15, 16, 17]。有5篇文献研究详细描述了监视器的设置[5, 9, 11, 14, 16] ,另7篇文献研究则描述不详[4, 6, 10, 12, 13, 15, 17]。有10篇文献研究明确使用了透明帽或黑色先端帽进行NBI-ME检查[4, 5, 9, 10, 11, 12, 14, 15, 16, 17],另两篇文献研究是否使用内镜先端帽未作说明[6, 13]。因此,NBI-ME诊断早期胃癌的分型标准、内镜先端帽运用情况及监视器设置情况这三个变量未能进行meta回归分析以探讨研究间异质性来源。将以表面结构联合微血管分型为诊断早期胃癌标准的10篇文献研究进行合并分析,合并灵敏度、特异性、阳性似然比、阴性似然比、诊断比数比及其AUC值分别为0.84 (95% CI: 0.80~0.87)、0.96 (95% CI: 0.95~0.97)、12.58 (95% CI: 6.74~23.49)、0.18 (95% CI: 0.11~0.29)、82.85 (95% CI: 32.35~212.18) 和 0.9570。
2.5 NBI-ME是否联合传统白光内镜亚组诊断早期胃癌的meta分析虽然内镜操作过程这一变量不是异质性来源,但是NBI-ME联合传统白光内镜较传统白光内镜诊断早期胃癌的增量效应高于单用NBI-ME较传统白光内镜的增量效应,故根据是否NBI-ME联合传统白光内镜检查进行亚组分析。有6篇文献研究单用NBI-ME诊断早期胃癌[6, 9, 10, 12, 15, 17],研究间存在异质性( Cochran's Q=25.85,P=0.000;I2=80.7%),运用随机效应模型分析单用NBI-ME诊断早期胃癌研究的合并灵敏度、特异性、阳性似然比、阴性似然比、诊断比数比及其AUC值分别为0.76、0.97、12.99、0.27、51.05及0.8162,具体见表 4及图 3。有7篇文献研究NBI-ME联合传统白光内镜诊断早期胃癌[4, 5, 6, 11, 13, 14, 16],研究间同样存在异质性 (Cochran's Q=20.97,P=0.002;I2=71.4%),运用随机效应模型分析NBI-ME联合传统白光内镜诊断早期胃癌研究的合并灵敏度、特异性、阳性似然比、阴性似然比、诊断比数比及AUC值分别为0.88、0.94、12.99、0.11、125.28及0.9706,具体见表 5及图 4。
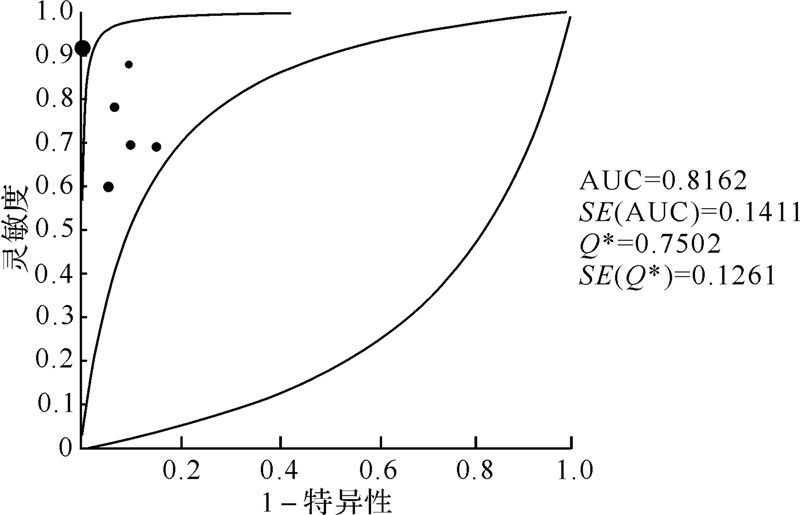
|
| 图 3 单用NBI-ME亚组的SROC曲线 Fig.3 Symmetric receiver operator characteristic curve of NBI-ME alone subgroup |
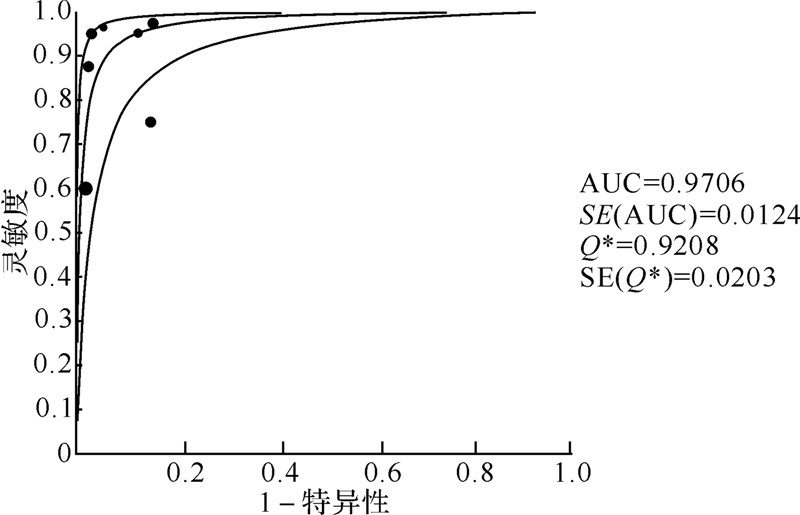
|
| 图 4 NBI-ME联合传统白光内镜亚组的SROC曲线 Fig.4 Symmetric receiver operator characteristic curve of NBI-ME plus conventional white light endoscopy subgroup |
| 统计指标 | 合并量(95%CI) | 异质性卡方值 | df | P值 | I2值(%) |
| 合并灵敏度 | 0.76(0.70~0.82) | 12.06 | 5 | 0.0340 | 58.5 |
| 合并特异性 | 0.97(0.95~0.98) | 46.63 | 5 | 0.0000 | 89.3 |
| 合并阳性似然比 | 12.99(5.04~33.42) | 32.05 | 5 | 0.0000 | 84.4 |
| 合并阴性似然比 | 0.27(0.18~0.41) | 11.20 | 5 | 0.0476 | 55.3 |
| 合并诊断比数比 | 51.05(14.70~177.31) | 25.85 | 5 | 0.0001 | 80.7 |
| 统计指标 | 合并量(95%CI) | 异质性卡方值 | df | P值 | I2值(%) |
| 合并灵敏度 | 0.88(0.84~0.92) | 34.01 | 6 | 0.0000 | 82.4 |
| 合并特异性 | 0.94(0.93~0.96) | 37.57 | 6 | 0.0000 | 84.0 |
| 合并阳性似然比 | 12.99(6.71~25.15) | 26.26 | 6 | 0.0002 | 77.1 |
| 合并阴性似然比 | 0.11(0.05~0.25) | 34.31 | 6 | 0.0000 | 82.5 |
| 合并诊断比数比 | 125.28(43.21~363.20) | 20.97 | 6 | 0.0019 | 71.4 |
早期胃癌在白光胃镜下缺乏特异性表现,诊断较为困难。在临床工作中,当传统白光内镜下 发现可疑病灶,尤其是在计划进行内镜下切除该病灶时,需进行组织病理学检查,确定病灶性质。 然而,在传统白光胃镜监测下进行的活检存在不足,一方面,对可疑病灶进行的多点活检可能是过量的[18];另一方面,病灶的活检标本与最终切除标本的病理学诊断结果间存在差异[19, 20, 21]。
本研究发现,NBI-ME联合传统白光内镜对诊断早期胃癌具有较高的准确性,并且这一方法优于单用NBI-ME或传统白光内镜检查。运用这一方法,有利于发现早期胃癌,可对胃内的可疑病灶进行靶向活检、减少活检次数、拟定病灶的治疗方法及确定病灶的边界。但是,单用NBI-ME检查较传统白光内镜诊断早期胃癌的诊断效能并无差异,这与其他研究存在矛盾[6, 12]。所以,需要进行更多的随机对照试验,明确单用NBI-ME与单用传统白光内镜诊断早期胃癌准确性的差异。
作为meta分析,研究间的异质性往往是无法避免的。本研究对多个变量进行单因素meta回归分析发现,研究的病灶数是异质性的唯一来源,这可能提示运用NBI技术诊断病灶存在较长的学习曲线[22];Pimentel-Nunes等[23]研究也表明,具有更多NBI诊断经验的内镜专家对胃黏膜病灶的NBI下分型及诊断具有更高的一致性。故应加强运用NBI-ME诊断早期胃癌的训练,提高诊断的准确性。
对变量进行多因素meta回归分析发现,任一变量均不是异质性来源,说明除研究的病灶数外,其他因素也可能影响研究间的异质性。本研究显示,NBI-ME联合传统白光内镜较单用NBI-ME诊断早期胃癌具有较高的准确性,提示内镜检查过程中,NBI-ME是否联合传统白光内镜是最有可能影响异质性的因素。同时也说明,在运用NBI-ME诊断早期胃癌时,应常规先进行传统白光内镜检查,而不应将两者孤立。
目前NBI-ME诊断早期胃癌的标准尚未统一。本研究发现,将单独以表面结构分型或微血管分型为诊断早期胃癌标准的研究剔除后[6, 10],剩余10项研究的合并灵敏度、特异性、诊断比数比及AUC值未见明显变化,提示无论单独运用还是联合运用表面结构分型标准与微血管分型标准,可能对诊断早期胃癌的准确性均无显著影响。但是单以表面结构分型标准的研究只针对了隆起性病灶[10],而单以微血管分型标准的研究只针对凹陷性病灶[6],所以单用表面结构分型标准或微血管分型标准能否诊断所有类型早期胃癌尚不明确。故需要进一步研究比较不同分型标准诊断早期胃癌的准确性,最终统一NBI-ME诊断早期胃癌的标准。
内镜先端帽可以帮助内镜医师在进行放大内镜检查时获得稳定的图像,而监视器的设置可以改善内镜图像的对比度。因此,这两个因素可能影响内镜图像的质量,从而影响NBI-ME诊断早期胃癌的准确性。本研究无法将内镜先端帽使用情况及监视器设置情况这两个变量纳入到meta回归分析中,故无法确定这两个因素对诊断准确性的影响。
总之,NBI-ME联合传统白光内镜能提高诊断早期胃癌的准确性,而单用NBI-ME诊断早期胃癌较传统白光内镜并无显著优势。NBI-ME与传统白光内镜的联合运用不仅可提高早期胃癌诊断的准确性,且可靶向病灶活检,从而提高活检的阳性率,以及帮助内镜医师选择胃内可疑病灶进一步处理的方法。
| [1] | PARKIN D M, BRAY F, FERLAY J, et al. Global cancer statistics, 2002 [J]. CA Cancer J Clin, 2005,55(2):74-108. |
| [2] | SGE Technology Committee, SONG L M, ADLER D G, CONWAY J D, et al. Narrow band imaging and multiband imaging [J]. Gastrointest Endosc, 2008,67(4):581-589. |
| [3] | YAO K, ANAGNOSTOPOULOS G K, RAGUNATH K. Magnifying endoscopy for diagnosing and delineating early gastric cancer [J]. Endoscopy, 2009,41(5):462-467. |
| [4] | LI H Y, DAI J, XUE H B, et al. Application of magnifying endoscopy with narrow-band imaging in diagnosing gastric lesions: a prospective study [J]. Gastrointest Endosc, 2012,76(6):1124-1132. |
| [5] | MIWA K, DOYAMA H, ITO R, et al. Can magnifying endoscopy with narrow band imaging be useful for low grade adenomas in preoperative biopsy specimens? [J]. Gastric Cancer, 2012,15(2):170-178. |
| [6] | EZOE Y, MUTO M, UEDO N, et al. Magnifying narrow band imaging is more accurate than conventional white-light imaging in diagnosis of gastric mucosal cancer [J]. Gastroenterol, 2011,141(6):2017-2025. |
| [7] | DIXON M F. Gastrointestinal epithelial neoplasia: vienna revisited [J]. Gut, 2002,51(1):130-131. |
| [8] | WHITING P, RUTJES A W, REITSMA J B, et al. The development of QUADAS: a tool for the quality assessment of studies of diagnostic accuracy included in systematic reviews [J]. BMC Med Res Methodol, 2003,3:25. |
| [9] | FUJIWARA S, YAO K, NAGAHAMA T, et al. Can we accurately diagnose minute gastric cancers (</=5 mm)? Chromoendoscopy (CE) vs magnifying endoscopy with narrow band imaging (M-NBI) [J]. Gastric Cancer, 2015, 18(3): 590-596. |
| [10] | KANESAKA T, SEKIKAWA A, TSUMURA T, et al. Dense-type crypt opening seen on magnifying endoscopy with narrow-band imaging is a feature of gastric adenoma [J]. Dig Endosc, 2014,26(1):57-62. |
| [11] | YAO K, DOYAMA H, GOTODA T, et al. Diagnostic performance and limitations of magnifying narrow-band imaging in screening endoscopy of early gastric cancer: a prospective multicenter feasibility study [J]. Gastric Cancer, 2014,17(4):669-679. |
| [12] | TAO G, LU X H,YANG A M, et al. Enhanced magnifying endoscopy for differential diagnosis of superficial gastric lesions identified with white-light endoscopy [J]. Gastric Cancer, 2014,17(1):122-129. |
| [13] | TSUJI Y, OHATA K, SEKIGUCHI M, et al. Magnifying endoscopy with narrow-band imaging helps determine the management of gastric adenomas [J]. Gastric Cancer, 2012,15(4):414-418. |
| [14] | MAKI S, YAO K, NAGAHAMA T, et al. Magnifying endoscopy with narrow-band imaging is useful in the differential diagnosis between low-grade adenoma and early cancer of superficial elevated gastric lesions [J]. Gastric Cancer, 2013,16(2):140-146. |
| [15] | WANG S F, YANG Y S, YUAN J, et al. Magnifying endoscopy with narrow-band imaging may improve diagnostic accuracy of differentiated gastric intraepithelial neoplasia: a feasibility study [J]. Chin Med J (Engl), 2012,125(5):728-732. |
| [16] | YAO K, IWASHITA A, TANABE H, et al. White opaque substance within superficial elevated gastric neoplasia as visualized by magnification endoscopy with narrow-band imaging: a new optical sign for differentiating between adenoma and carcinoma [J]. Gastrointest Endosc, 2008,68(3):574-580. |
| [17] | KAISE M, KATO M, URASHIMA M, et al. Magnifying endoscopy combined with narrow-band imaging for differential diagnosis of superficial depressed gastric lesions [J]. Endoscopy, 2009,41(4):310-315. |
| [18] | KATO M, KAISE M, YONEZAWA J, et al. Magnifying endoscopy with narrow-band imaging achieves superior accuracy in the differential diagnosis of superficial gastric lesions identified with white-light endoscopy: a prospective study [J]. Gastrointest Endosc, 2010,72(3):523-529. |
| [19] | LEE C K, CHUNG I K, LEE S H, et al. Is endoscopic forceps biopsy enough for a definitive diagnosis of gastric epithelial neoplasia? [J]. J Gastroenterol Hepatol, 2010,25(9):1507-1513. |
| [20] | KIM Y J, PARK J C, KIM J H, et al. Histologic diagnosis based on forceps biopsy is not adequate for determining endoscopic treatment of gastric adenomatous lesions [J]. Endoscopy, 2010,42(8):620-626. |
| [21] | SUNG H Y, CHEUNG D Y, CHO S H, et al. Polyps in the gastrointestinal tract: discrepancy between endoscopic forceps biopsies and resected specimens [J]. Eur J Gastroenterol Hepatol, 2009,21(2):190-195. |
| [22] | DIAS-SILVA D, PIMENTEL-NUNES P, MAGALHAES J, et al. The learning curve for narrow-band imaging in the diagnosis of precancerous gastric lesions by using web-based video [J]. Gastrointest Endosc, 2014,79(6):910-920. |
| [23] | PIMENTEL-NUNES P, DINIS-RIBEIRO M, SOARES J B, et al. A multicenter validation of an endoscopic classification with narrow band imaging for gastric precancerous and cancerous lesions [J]. Endoscopy, 2012,44(3):236-246. |



