2. 浙江大学医学院附属邵逸夫医院妇产科, 浙江 杭州 310020
2. Department of Gynecology and Obstetrics, Sir Run Run Shaw Hospital, Zhejiang University School of Medicine, Hangzhou 310020, China
水通道蛋白(aquaporins,AQP)是一组能选择性跨膜转运水分子的糖蛋白,广泛存在于机体组织细胞中,在液体分泌吸收相关的上皮细胞和内皮细胞中含量尤其丰富。AQP具有促进水分子快速被动运输、调节水盐平衡、促进细胞迁移、调节脂肪代谢和调节神经信号传导等功能[1]。目前已发现的家族成员有13个:AQP 0~12。近期研究发现,AQP参与多种肿瘤的增殖、迁移、血管形成以及对化疗药物的耐药,其中尤以AQP5与肿瘤的相关研究报道为多。AQP5高表达可以促进肿瘤细胞增殖及侵袭能力,影响恶性肿瘤的预后,这已经在前列腺癌、宫颈癌、乳腺癌、结直肠癌等多种恶性肿瘤中证实[2, 3, 4, 5]。在人类女性卵巢排卵月经形成以及疾病发生过程中,也涉及到液体流动以及细胞容积表型的改变;AQP还广泛参与了生殖系统的生理和病理过程。本课题组前期研究发现在位子宫内膜腺上皮细胞及异位子宫内膜腺上皮细胞上均存在AQP5的表达[6]。为了进一步探讨AQP5在异位子宫内膜腺上皮细胞中的功能和对迁移能力的影响,本研究通过原代培养异位子宫内膜腺上皮细胞,探讨AQP5对异位子宫内膜腺上皮细胞增殖、迁移能力的影响,并构建子宫内膜异位症裸鼠模型,以阐明AQP5在子宫内膜异位症侵袭转移中的作用。
1 材料与方法 1.1 试 剂DMEM/F12细胞培养液和0.25%胰酶购自美国Gibco公司,T25细胞培养瓶购自美国Corning公司,AlexaFluor 488标记的抗人细胞角蛋白19(cytokeratin 19,CK19)抗体及PE标记的抗人波形蛋白(vimentin)抗体均购自美国R&D公司,T4连接酶、限制性内切酶Age Ⅰ和EcoR Ⅰ购自美国NEB公司,载体pLKO-GFP购自美国Addgene公司,X-tremeGENE HP DNA Transfection Reagent购自瑞士Roche公司,293T细胞购自中国科学院上海细胞库。丝氨酸/苏氨酸蛋白酶(serine/threonine proteinase AKT)抗体、磷酸化AKT(p-AKT)抗体、AQP5抗体、β-tubulin抗体以及辣根过氧化物酶(HRP)标记的抗小鼠IgG均购自德国CST公司。自行设计AQP5 shRNA 短核苷酸片段(具体序列详见表 1),另在线设计Scramble RNA(http://www.sirnawizard.com/scrambled.php)作为阴性对照,均由生工生物工程(上海)股份有限公司合成。其余试剂购自美国Sigma公司,为分子生物学级别。
| 名 称 | 序 列 |
| shAQP5-1-F | 5′-CCGGACGCGCTCAACAACAACACAACTCGAGTTGTGTTGTTGTTGAGCGCGTTTTTTG-3′ |
| shAQP5-1-R | 5′-AATTCAAAAAACGCGCTCAACAACAACACAACTCGAGTTGTGTTGTTGTTGAGCGCGT-3′ |
| shAQP5-2-F | 5′-CCGGTGCGGTGGTCATGAATCGGTTCTCGAGAACCGATTCATGACCACCGCATTTTTG-3′ |
| shAQP5-2-R | 5′-AATTCAAAAATGCGGTGGTCATGAATCGGTTCTCGAGAACCGATTCATGACCACCGCA-3′ |
| shAQP5-3-F | 5′-CCGGCCATCATCAAAGGCACGTATGCTCGAGCATACGTGCCTTTGATGATGGTTTTTG-3′ |
| shAQP5-3-R | 5′-AATTCAAAAACCATCATCAAAGGCACGTATGCTCGAGCATACGTGCCTTTGATGATGG-3′ |
取3周龄BALB/C-nu/nu雌性裸鼠20只,体质量15~20 g,购自常州卡文斯实验动物有限公司[实验动物许可证号SCXK(苏)2011-0003]。所有裸鼠均在无特殊病原体(specific pathogen free,SPF)条件下饲养。温度25 ℃左右,空气流速为20 cm3/s,空气相对湿度为55%。所用食物和水均灭菌处理。裸鼠适应1周后进行实验。
1.3 原代异位子宫内膜腺上皮细胞来源及培养选择5例于2014年1—3月期间因患有盆腔子宫内膜异位症合并卵巢型子宫内膜异位囊肿在浙江大学医学院附属妇产科医院就诊的患者为研究对象,年龄25~33岁。患者均签署知情同意书。所有患者无内科合并症,术前3个月内未行激素治疗。患者均行腹腔镜探查术,术中取在位子宫内膜活检,经组织病理学检查证实为增生期内膜并确认患者处于卵泡期,术后病理学检查均证实为子宫内膜腺体样结构。采集新鲜的卵巢异位病灶组织或腹膜子宫内膜异位结节处组织用于培养。
新鲜的异位子宫内膜组织用磷酸盐缓冲液(PBS)洗3遍,去除血污和结缔组织。将剪碎的组织块置于用鼠尾胶原包被过夜的T25培养瓶中,再加入少量含10%胎牛血清、100 U/mL氨苄青霉素和100 U/mL链霉素的DMEM/F12培养液,置于37 ℃、5%二氧化碳培养箱中进行“植块法”培养,接种72 h后第1次换液。等细胞覆盖培养瓶底部时,用0.25%胰酶消化细胞,进行传代培养,细胞传至3代,取生长状态良好的异位子宫内膜腺上皮细胞制成单细胞悬液,再用细胞高速离心制片机制成细胞涂片。每张片取 10个不同视野进行间质细胞和上皮细胞的计数,采用免疫组织化学染色和流式细胞术对培养后细胞进行鉴定,分别利用特异性标志物波形蛋白和CK19鉴别间质细胞和上皮细胞的比例。异位子宫内膜腺上皮细胞大量扩增至第3代后冻存。
1.4 AQP5 shRNA慢病毒载体的构建和包装细胞系的建立载体构建: AQP5 shRNA退火后形成双链,Age Ⅰ和EcoR Ⅰ酶切后的片段与线性载体pLKO-GFP按摩尔比7∶1混合并用T4连接酶连接,连接产物转化大肠杆菌感受态细胞DH5α后,37 ℃摇床振荡过夜。提取质粒,并测定其纯度。质粒经Xho Ⅰ酶切鉴定,选取酶切正确的质粒送测序,测序正确的质粒大规模扩增后提取并纯化,去除内毒素后用于转染。
慢病毒包装: 293T细胞在37 ℃、5%二氧化碳的环境中用含10%胎牛血清、100 U/mL氨苄青霉素和100 U/mL链霉素的DMEM培养基培养,0.25%胰酶消化传代。实验前一天将293T细胞培养于60 mm的培养皿中,转染前2 h将培养液换成Opti-MEM培养液。分别取AQP5 shRNA pLKO-GFP质粒2.5 μg,包装质粒Δ8.91 2.5 μg和疱疹性口腔炎病毒糖蛋白G基因(VSV-G) 0.25 μg 混合均匀,加入MEM培养液500 μL,加入X-tremeGENE HP DNA Transfection Reagent 10 μL,室温放置20 min。将混合液加入到293T细胞培养液中,于24 h、48 h和72 h分别收集上清液,并于倒置荧光显微镜下观察293T细胞是否因感染含有绿色荧光蛋白(GFP)的质粒后而呈现出的绿色荧光。阴性对照组慢病毒包装和病毒感染同上述。
慢病毒感染异位子宫内膜腺上皮细胞模型的建立:异位子宫内膜腺上皮细胞培养于37 ℃、5%二氧化碳培养箱中,取包装好的病毒上清液加入到培养液中,24 h后换液,48 h观察荧光加入嘌呤霉素至终浓度为10 μg/mL,筛选至细胞全带有绿色荧光,提示细胞均已被含有GFP标记的病毒感染。后续实验将细胞分成两组: AQP5沉默组(接种稳定转染AQP5-shRNA3的异位子宫内膜腺上皮细胞)和阴性对照组(接种阴性对照序列质粒的异位子宫内膜腺上皮细胞)。
1.5 蛋白质印迹法检测AQP5取经过处理的异位子宫内膜腺上皮细胞,弃去培养液后用冷PBS洗2遍,加入100 μL含蛋白酶抑制剂的RIPA细胞裂解液,于冰上裂解10 min后,采用细胞刷收集细胞至1.5 mL EP管中,1 mL注射器吹打细胞裂解液使DNA断裂,4 ℃13 000×g离心15 min后分装上清液,—80 ℃冰箱冻存备用。取2 μL蛋白裂解液用于BCA蛋白定量。用10%的十二烷基硫酸钠聚丙烯凝胶电泳(SDS-PAGE)电泳分离蛋白,用湿法转膜将凝胶上的蛋白转到PVDF膜上,用含5%脱脂牛奶和含0.1%Tween-20的PBS于室温封闭PVDF膜1 h,剪开后分别加入AQP5抗体(1∶1 000)和内参照蛋白抗人β-tubulin的小鼠单克隆抗体(1∶3 000)4 ℃孵育过夜,采用HRP标记的抗小鼠IgG(1∶3 000)37 ℃孵育2 h后,ECL显影得到条带的吸光度值,使用NIH的Image J 1.40软件进行分析和量化,以AQP5与内参蛋白β-tubulin的比值作为AQP5的相对表达水平。选择异位子宫内膜腺上皮细胞中AQP5 mRNA及蛋白表达水平均最低的稳定沉默细胞用于后续试验。采用同样方法检测异位子宫内膜腺上皮细胞AKT、p-AKT蛋白水平的表达,并与阴性对照组比较。
1.6 MTT法检测异位子宫内膜腺上皮细胞增殖将异位子宫内膜腺上皮细胞传至第3代,消化后锥虫蓝染色计数活细胞。将AQP5 沉默组和阴性对照组异位子宫内膜腺上皮细胞接种于96孔板,细胞密度为1×105个/mL,每组5个复孔在1、3、5和7 d时分别进行MTT测定。具体检测方法为:取出96孔板,加入5 mg/mL的MTT溶液,使得MTT终浓度为0.5 mg/mL,37 ℃孵育4 h后,弃去上清液,加入150 μL二甲基亚砜(DMSO)振荡5 min后,在酶标仪上检测550 nm处吸光度值,以吸光度值为纵坐标,时间为横坐标,绘制细胞生长曲线图。
1.7 Transwell技术检测异位子宫内膜腺上皮细胞迁移能力利用Transwell技术可检测细胞的迁移侵袭能力,其原理为细胞在铺有基底胶的小室中生长,通过侵袭破坏基底胶后可以迁移到小室的另一面,在一定程度上模拟了体内细胞突破基底膜后侵犯进入血管的过程。具体步骤如下:用MEM液将基底胶1∶4稀释,每个小室加50 μL,4 ℃风干过夜。然后每个小室加50 μL培养液,37 ℃水化30 min。消化AQP5沉默组和阴性对照组异位子宫内膜腺上皮细胞,用MEM液重悬,调整细胞密度至4×105个/mL。每个小室加入100 μL细胞悬液。24孔板下室加入含有10%胎牛血清的DMEM/F12培养液。把膜放于37 ℃培养箱中培养6 h,弃去小室上下的培养液,风干。每个孔加入600 μL按1∶4稀释过的结晶紫,染色30 min。用PBS洗2遍,显微镜下观察。放大100倍后,随机计数6个孔中迁移过来的染色细胞数,取3次重复实验结果的平均值用于统计学分析。
1.8 建立裸鼠子宫内膜异位症模型将20只裸鼠随机分成两组: AQP5沉默组和阴性对照组各10只。取对数生长期细胞进行实验,0.25%胰酶消化细胞,制成细胞悬液并计数。锥虫蓝染色测定细胞活性>98%,用培养液调整细胞浓度至1×107个/mL。每只裸鼠腹腔注射接种0.5 mL GFP标记的子宫内膜腺上皮细胞悬液,停针10 s后,旋转出针避免细胞悬液漏出。每日观察裸鼠精神状态、活动、饮食等情况。在15 d后颈椎脱臼法处死各组裸鼠,观察裸鼠腹腔内子宫内膜异位病灶形成数目、瘤体生长及腹膜转移等情况,统计结节数,利用荧光显微镜确认结节是否为GFP标记的细胞。
1.9 统计学方法所有数据采用SPSS 19.0软件包处理,计量资料数据以均数±标准差(x±s)表示,组间比较采用单因素方差分析,计量资料采用两样本秩和检验(Wilcoxon-Mann-Whitney法),以P<0.05为差异有统计学意义。
2 结 果 2.1 原代异位子宫内膜腺上皮细胞鉴定通过“植块法”[7]建立原代异位子宫内膜腺上皮细胞模型,组织块贴壁2~3天后,细胞从组织块边缘游出,镜下可见成团的子宫内膜腺上皮细胞贴壁生长,呈分散的细胞团状或岛状,细胞呈多角形或蝌蚪形,轮廓清晰,细胞核大而圆,细胞质呈颗粒状(图 1)。传代后细胞背景干净,上皮细胞纯度高,可以用于后续研究。每张细胞片取 10 个不同视野进行间质细胞和上皮细胞的计数,对原代细胞进行CK19的免疫细胞化学染色后计算细胞纯度,结果腺上皮细胞纯度约为90%,提示原代异位子宫内膜腺上皮细胞培养成功。

|
| A:子宫内膜腺上皮细胞呈多角形或蝌蚪形,轮廓清晰,细胞核大而圆,细胞质呈颗粒状.B:CK19免疫细胞化学阳性染色的异位子宫内膜腺上皮细胞细胞质和细胞膜呈棕黄色,而间质细胞细胞质和细胞膜均不显色.标尺=50 μm. 图 1 培养的异位子宫内膜腺上皮细胞显微镜下所见和CK19免疫细胞化学染色结果 Fig. 1 Ectopic endometrial glandular epithelial cells culture and keratin 19 immunocytochemistry staining |
利用软件设计shRNA序列,合成后接入pLKO-GFP载体,经过Xho Ⅰ酶切鉴定后显示,原载体所得片段长度为7 872、2 155和190 bp,而AQP5 shRNA经Xho Ⅰ酶切所得片段长度为7 872、190、303和42 bp,见图 2A。可以看出,原载体酶切后有长度为7 872 bp和2 155 bp的片段,而所选的3个AQP5 shRNA以及阴性对照质粒经酶切后没有长度为2 155 bp的片段,初步判断目的片段已经插入到载体中。进一步测序结果显示插入的序列在序列合成以及克隆过程中不存在突变(图 2B,以shRNA3为例)。收集培养液上清液中的慢病毒感染原代异位子宫内膜腺上皮细胞,荧光视野下见大量GFP表达,提示慢病毒成功感染原代异位子宫内膜腺上皮细胞(图 2C、D)。对感染成功的细胞利用嘌呤霉素加以筛选后,除去未感染病毒的异位子宫内膜腺上皮细胞。采用蛋白质印迹法筛选不同shRNA对AQP5沉默的效果(图 2E),对条带灰度值进行量化并与β-actin比较后结果显示,阴性对照组、shRNA1、shRNA2和 shRNA3组细胞的AQP5相对表达水平为:0.28±0.02、0.11±0.01、0.10±0.03和0.03±0.02。其中AQP5 shRNA3感染后,AQP5表达水平最低,故选择AQP5 shRNA 3感染的异位子宫内膜腺上皮细胞用于后续实验。

|
| A:pLKO-GFP载体和AQP5 shRNA重组载体的酶切结果.B:AQP5 shRNA3重组载体测序结果.C:暗场显微镜下观察;D:普通光学显微镜下观察,带有GFP标记的绿色荧光的细胞为慢病毒感染的异位子宫内膜腺上皮细胞.标尺=1mm.E:蛋白质印迹法检测不同AQP5 shRNA 的沉默效果. 图 2 AQP5shRNA慢病毒载体的构建以及沉默效果筛选 Fig. 2 Construction of AQP5 silencing vector and verification |
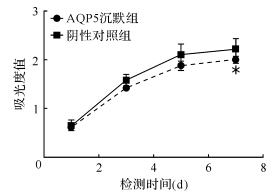
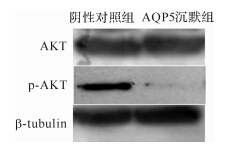
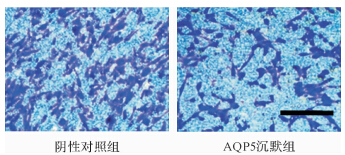
MTT法检测结果显示,AQP5沉默组异位子宫内膜腺上皮细胞的增殖能力在第7天时较阴性对照组减弱,差异有统计学意义(P<0.05,图 3)。蛋白质印迹法检测结果显示,AQP沉默组异位子宫内膜腺上皮细胞p-AKT表达减弱,而AKT水平无改变(图 4),说明AQP5沉默可抑制AKT的磷酸化。Transwell技术结合结晶紫染色观察AQP5沉默组和阴性对照组迁移细胞,未染色时及结晶紫染色后均可见AQP5沉默组发生迁移的细胞数较阴性对照组少,如图 5。计数结果AQP5沉默组和阴性对照组迁移细胞数分别为42±8和112±21(P<0.05),说明AQP5沉默可降低子宫内膜腺上皮细胞的侵袭迁移能力。
|
| 与阴性对照组比较,*P<0.05. n=5. 图 3 AQP5沉默组和阴性对照组异位子宫内膜腺上皮细胞生长曲线 Fig. 3 Cell growth curve of ectopic endometrial glandular epithelial cells in AQP silencing and control group |
|
| 图 4 AQP5沉默组和阴性对照组中p-AKT和AKT的表达 Fig. 4 The expression of p-AKT and AKT of ectopic endometrial glandular epithelial cells in AQP silencing and control group |
|
| 结晶紫染色后可见AQP5沉默组呈紫色的子宫内膜腺上皮细胞比阴性对照组少.标尺=50 μm. 图 5 结晶紫染色观察AQP5沉默组和阴性对照组异位子宫内膜腺上皮细胞数变化 Fig. 5 Crystal violet staining of ectopic endometrial glandular epithelial cells in AQP5 silencing and control group |
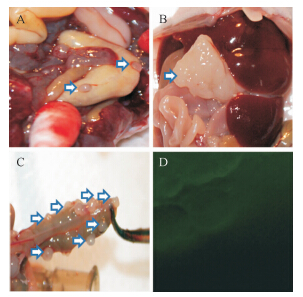
AQP5沉默组和阴性对照组裸鼠腹腔成瘤率均为100%。裸鼠腹腔接种异位子宫内膜腺上皮细胞7 d后一般情况无异常,接种14 d后阴性对照组中有4只裸鼠出现精神萎靡、食欲差、行动迟缓。AQP5沉默组裸鼠一般情况良好。饲养过程中AQP5沉默组有2只裸鼠死亡,阴性对照组4只裸鼠死亡。于第15天处死两组剩余存活裸鼠,每组各6只,观察各组瘤体生长及腹膜转移情况。其中,AQP5沉默组可见大网膜、肠系膜有散在瘤体结节,呈灰白色,大小不一,质地硬(图 6A)。与阴性对照组(图 6B、C)比较,AQP5沉默组瘤体结节数相对较少,体积较小;阴性对照组肝脏均有灰白色瘤体结节,大者达1.5 cm×1.5 cm×2.0 cm(图 6B)。各结节组织均可见GFP标记的绿色荧光(图 6D),其中AQP5沉默组腹膜瘤体结节数(5.3±2.1)少于阴性对照组(25.9±3.6),差异具有统计学意义(P<0.05)。
|
| A:AQP5沉默组腹腔内瘤体结节数量少,体积小.B:阴性对照组大鼠腹腔内成瘤结节.箭头所指为肝脏下结节,结节体积较大.C:阴性对照组裸鼠腹腔内瘤体结节.箭头所指为沿肠壁分布的瘤体结节,结节数量多.D:两组腹腔内瘤体结节组织均显示GFP示踪的绿色荧光. 图 6 AQP5沉默组和阴性对照组子宫内膜腺上皮细胞在裸鼠腹腔内瘤体结节生长情况 Fig. 6 Endometrial cells nodules formation in AQP5 silencing nude mice and control animal |
我们之前在子宫内膜癌中的研究发现,雌激素可促进AQP5在内膜癌细胞的表达,进而提高子宫内膜癌细胞的迁移侵袭和黏附能力 [8]。子宫内膜异位症在组织学上是一个具有侵袭能力的良性疾病,其异位内膜病灶的形成与癌系细胞转移的生物学特性类似,也是一个“迁移黏附血管形成”的过程 [9] 。子宫内膜异位病灶的形成是一个极其复杂的过程,已经发现异位子宫内膜腺上皮细胞存在某些特性,如细胞表达表面分子标记物阶段特异性胚胎抗原1(SSEA-1)及多种转移诱导蛋白 [10, 11]。但目前尚无AQP5对异位子宫内膜腺上皮细胞功能影响的研究。本研究选择卵巢异位子宫内膜组织为研究对象,培养原代异位子宫内膜腺上皮细胞,建立体外细胞模型,利用慢病毒技术稳定沉默AQP5表达,进一步阐明AQP5对异位子宫内膜腺上皮细胞的影响并明确其在细胞增殖和迁移能力中的意义。
子宫内膜异位症是激素依赖性疾病,雌激素可以促进在位子宫内膜腺上皮细胞AQP5的表达,在增生晚期的子宫内膜腺上皮细胞表面AQP5蛋白高表达[6]。子宫内膜异位病灶同样也受到体内雌激素的影响,当子宫内膜处于增生晚期时异位病灶处腺上皮细胞AQP5蛋白相对高表达。关于子宫内膜异位症中上皮细胞的研究一直是国内外研究的难点,由于缺乏子宫内膜上皮细胞株,本研究选择子宫内膜异位症患者直径1~2 cm的多房卵巢子宫内膜异位囊肿或表面富含血管的腹膜子宫内膜异位病灶,剪取病灶组织,尽可能做到病灶内取材,剩余组织送病理学检查证实为子宫内膜腺上皮样结构,最大程度避免因为取材不当导致的其他杂细胞的混入,并在体外通过“植块法”培养出异位子宫内膜原代腺上皮细胞。植块法由于携带了组织块,其细胞的活力一般高于体外的酶消化法,而且减少成纤维细胞因为酶消化而混入培养系统。通过免疫组织化学染色和流式细胞术对培养后细胞进行鉴定,得到高纯度细胞,有助于研究子宫内膜异位细胞的生物学行为特征。再者我们利用慢病毒载体,构建并筛选出可稳定沉默AQP5蛋白的shRNA,在嘌呤霉素压力下获得AQP5稳定沉默的子宫内膜腺上皮细胞。
本研究结果显示,AQP5在子宫内膜异位症患者的异位内膜腺上皮细胞中表达,而AQP5基因沉默以后异位子宫内膜腺上皮细胞的增殖能力和迁移能力下降。细胞的迁移与细胞的形态、体积改变有关,AQP在调节细胞内外渗透压差的过程中起着关键作用,这已经在肾小管上皮细胞、肝细胞、星形胶质细胞等多种不同的细胞中证实[12, 13, 14]。我们关于AQP5在异位子宫内膜腺上皮细胞的研究也为这种理论提供了依据。
异位子宫内膜腺上皮细胞的生长、迁移与机体的微环境密不可分。因此,建立子宫内膜异位症裸鼠腹膜转移瘤模型,并在体内实验中证实AQP5靶向干扰效果显得尤为重要。本实验通过腹腔注射法,接种稳定转染AQP5 shRNA的异位子宫内膜腺上皮细胞,成功构建裸鼠腹腔子宫内膜异位症模型,并观察了两组裸鼠腹腔内瘤体结节生长情况,发现AQP5沉默组裸鼠的瘤体生长及腹膜转移能力较对照组明显减弱。这些结果与以往的AQP5蛋白表达对其他肿瘤(如乳腺癌、胃癌、肺癌)的研究报道类似,即AQP5蛋白表达与细胞增殖、迁移呈正相关[15, 16, 17]。
AQP5介导的细胞增殖、迁移已经在多种组织和细胞中得到证实,但不同的细胞中AQP5介导的细胞迁移的信号通路可能不同,如AQP5通过EGFR/ERK/p38MAPK信号通路活化介导肺癌细胞的增殖与迁移[17];在胰腺癌的研究中发现,AQP5过度表达与Ras信号通路活化相关[18] ;在结肠癌的研究中发现,AQP5基因沉默后抑制了p38 MAPK信号通路活化,提高了结肠癌细胞的耐药性[19]。本研究发现,AQP5蛋白表达下调后,异位子宫内膜腺上皮细胞增殖及迁移能力明显下降,同时出现AKT蛋白磷酸化抑制。该结果提示AQP5蛋白表达可能是AKT磷酸化信号通路调控的一个上游信号,即AQP5可能通过激活AKT磷酸化信号传导通路,促进细胞增殖及迁移。
异位子宫内膜腺上皮细胞能广泛种植在腹腔,并且生长浸润,与周围组织粘连,且极易复发,这些均导致严重的卵巢损伤和盆腔内环境的改变,在临床上表现为盆腔痛和不育,严重影响女性的健康和生活质量。本研究发现,AQP5蛋白在异位子宫内膜腺上皮细胞的迁移及种植中可能起着重要的作用,该作用可能与AKT的活化有关,但具体机制仍有待于进一步深入研究。本研究可能为子宫内膜异位症的药物治疗提供新的思路。
| [1] | VERKMAN A S. Aquaporins in clinical medicine[J]. Annu Rev Med, 2012,63:303-316. |
| [2] | LI J, WANG Z, CHONG T, et al. Over-expression of a poor prognostic marker in prostate cancer: AQP5 promotes cells growth and local invasion[J]. World J Surg Oncol, 2014,12:284. |
| [3] | ZHANG T, ZHAO C, CHEN D, et al. Overexpression of AQP5 in cervical cancer: correlation with clinicopathological features and prognosis[J]. Med Oncol, 2012,29(3):1998-2004. |
| [4] | LEE S J, CHAE Y S, KIM J G, et al. AQP5 expression predicts survival in patients with early breast cancer[J]. Ann Surg Oncol, 2014,21(2):375-383. |
| [5] | SHAN T, CUI X, LI W, et al. AQP5: a novel biomarker that predicts poor clinical outcome in colorectal cancer[J]. Oncol Rep, 2014,32(4):1564-1570. |
| [6] | JIANG X X,WU R J,XU K H,et al. Immunohistochemical detection of aquaporin expression in eutopic and ectopic endometria from women with endometriomas[J]. Fertil Steril, 2010,94(4):1229-1234. |
| [7] | 王 辉,罗 伦,李文胜,等.改良的酶消化后植块法体外培养雪旺细胞[J].中华神经医学杂志, 2011,10(5):461-463. WANG Hui,LUO Lun,LI Wen-sheng, et al. Culturing Schwann cells by explants and modified enzyme digestion technique[J]. Chinese Journal of Neuromedicine,2011,10(5):461-463. (in Chinese) |
| [8] | JIANG X X,XU K H,MA J Y,et al. Reduced migration of Ishikawa cells associated with downregulation of aquaporin-5[J]. Oncol Lett, 2012,4(2):257-261. |
| [9] | SOTNIKOVA N Y,ANTSIFEROVA Y S,POSISEEVA L V,et al. Mechanisms regulating invasiveness and growth of endometriosis lesions in rat experimental model and in humans[J]. Fetil Steril,2010,93(8):2701-2705. |
| [10] | VALENTIJN A J,PALIAL K,AL-LAMEE H,et al. SSEA-1 isolates human endometrial basal glandular epithelial cells: phenotypic and functional characterization and implications in the pathogenesis of endometriosis[J]. Hum Reprod, 2013,28(10):2695-2708. |
| [11] | HAPANGAMA D K,RAJU R S,VALENTJN A J,et al. Aberrant expression of metastasis-inducing proteins in ectopic and matched eutopic endometrium of women with endometriosis: implications for the pathogenesis of endometriosis[J]. Hum Reprod,2012,27(2):394-407. |
| [12] | TRADTRANTIP L, TAJIMA M, LI L, et al. Aquaporin water channels in transepithelial fluid transport[J]. J Med Invest, 2009,56 Suppl:179-184. |
| [13] | HUEBERT R C, VASDEV M M, SHERGILL U, et al. Aquaporin-1 facilitates angiogenic invasion in the pathological neovasculature that accompanies cirrhosis[J]. Hepatology,2010,52(1):238-248. |
| [14] | McCOY E, SONTHEIMER H. Expression and function of water channels (aquaporins) in migrating malignant astrocytes[J]. Glia, 2007,55(10):1034-1043. |
| [15] | JUNG H J, PARK J Y, JEON H S, et al. Aquaporin-5: a marker protein for proliferation and migration of human breast cancer cells[J]. PLoS One,2011,6(12):e28492. |
| [16] | HUANG Y H, ZHOU X Y, WANG H M, et al. Aquaporin 5 promotes the proliferation and migration of human gastric carcinoma cells [J]. Tumour Biol, 2013,34(3):1743-1751. |
| [17] | ZHANG Z,CHEN Z,SONG Y,et al. Expression of aquaporin 5 increases proliferation and metastasis potential of lung cancer[J]. J Pathol, 2010,221(2):210-220. |
| [18] | WOO J, KIM M S, LEE J, et al. The effect of aquaporin 5 overexpression on the Ras signaling pathway[J]. Biochem Biophys Res Commun, 2008,367(2):291-298. |
| [19] | SHI X, WU S, YANG Y, et al. AQP5 silencing suppresses p38 MAPK signaling and improves drug resistance in colon cancer cells [J]. Tumour Biol, 2014,35(7):7035-7045. |



