子宫内膜异位症是指具有活性的子宫内膜组织(腺体和间质)出现在子宫腔被覆盖内膜及宫体肌层以外的其他部位的妇科常见疾病,以疼痛和不孕为主要症状,在育龄妇女中发病率为10%~15%[1]。子宫内膜异位症是一种雌激素依赖性疾病,研究表明,雌激素可结合肥大细胞膜上雌激素受体α启动快速的钙离子流,促进人及小鼠肥大细胞活化脱颗粒释放相应的介质[2],最终可能导致疼痛等症状的发生。而色甘酸钠是肥大细胞膜稳定剂,可能在子宫内膜异位症中影响这个过程。鉴于此,我们设计了本实验,首先建立SD大鼠子宫内膜异位症模型,在此基础上给予色甘酸钠干预,观察模型病灶大小变化及与肥大细胞脱颗粒的关系,探讨色甘酸钠介导的肥大细胞在子宫内膜异位症发病中的作用,为临床子宫内膜异位症的治疗提供新思路。
1 材料与方法 1.1 材料健康雌性未孕SD大鼠由浙江省实验动物中心提供,饲养在浙江大学医学院附属第一医院多器官联合移植重点实验室;4%的水合氯醛购自国药集团化学试剂有限公司;青霉素购自华北制药股份有限公司;0.9%氯化钠溶液(生理盐水)购自杭州民生药业集团有限公司;色甘酸钠购自美国Sigma-Aldrich公司;甲苯胺蓝购自美国Sigma-Aldrich-Fluka公司;肿瘤坏死因子α(TNF-α)酶联免疫吸附试验试剂盒购自美国R&D公司;血清雌激素酶免疫分析试剂盒购自美国Cayman Chemical公司;类胰蛋白酶单克隆抗体和神经生长因子多克隆抗体均购自美国Abcam公司;角蛋白单克隆抗体和波形蛋白单克隆抗体购自武汉博士德生物工程有限公司;二步法抗鼠/兔免疫组织化学染色检测试剂盒购自上海基因公司。
1.2 子宫内膜异位症大鼠建模取健康雌性未孕SD大鼠36只,体质量为200 g左右,鼠龄8~12周,按Vernon 和Wilson[3]方法建立子宫内膜异位症动物模型,在无菌条件下,以4%的水合氯醛7 mL/kg腹腔注射麻醉大鼠,腹部去毛、皮肤消毒后,于尿道口上约1 cm处做一长约1.5 cm切口,在近卵巢处切取一侧子宫角处的一段子宫,长约1 cm,迅速将其置于生理盐水中,将子宫内膜与肌层分离,并剪取两块各约5 mm×5 mm的内膜组织块,将内膜层对着腹壁,缝合固定在腹壁上,缝合线为无损伤性6-0棉纶单丝线。同时取长约0.3 cm同侧正常子宫内膜予10%甲醛固定,常规脱水、包埋、石蜡固定、切片。关腹前予以青霉素20万单位腹腔注射,最后缝合各层组织,使其自然苏醒。2周后进行第二次手术,观察病灶生长情况。测量并记录移植物的大小(最大横径a及与其垂直的纵径b),病灶体积的计算可以参照肿瘤体积的计算公式V=l/2a×b2,体积大于2 mm3认为造模成功。
1.3 模型鉴定取所有子宫内膜异位症病灶组织置于10%甲醛溶液固定后,常规脱水、包埋、石蜡固定切片后,将所有切片行苏木素-伊红(HE)染色,显微镜下进行病理组织学观察。病理组织学检查见内膜腺体和间质生长则为造模成功。并采用常规免疫组织化学染色法分别检测角蛋白和波形蛋白在异位病灶腺上皮和基质细胞中的表达情况。操作方法按试剂盒说明书进行,即石蜡切片脱蜡、水化后,高压热修复10 min滴加过氧化氢阻断内源性过氧化物酶,每张切片滴加1∶100稀释的角蛋白或波形蛋白抗体50 μL,室温下孵育2 h后,滴加生物素化山羊抗小鼠/兔IgG 50 μL,室温下孵育20 min,最后经二氨基联苯胺(DAB)显色后苏木素复染。用大鼠正常子宫内膜做阳性对照,磷酸盐缓冲液代替一抗作为阴性对照。
1.4 模型分组及观察指标模型大鼠随机分成4组,色甘酸钠分别按20 mg/mL及10 mg/mL溶于生理盐水,其中两组每天腹腔注射含不同剂量色甘酸钠(大剂量组20 mg/kg,小剂量组10 mg/kg)的生理盐水,阴性对照组每天注射1 mL/kg生理盐水,空白对照组不做任何处理。两周后处死各组大鼠,收集下腔静脉血和病灶组织标本,观察各组病灶大小、组织形态,比较各组病灶肥大细胞总数、脱颗粒肥大细胞数和病灶组织类胰蛋白酶、神经生长因子的表达以及血清TNF-α、雌二醇水平。
1.5 甲苯胺蓝染色检测肥大细胞及其脱颗粒组织石蜡切片采用甲苯胺蓝染色后,在双盲高倍镜(×400)下连续计数单位面积(个/mm2)每张5个视野中的肥大细胞数,取其平均值。将形态规则、边界清楚的肥大细胞定义为未脱颗粒的肥大细胞,将形态不规则、边界不清、周围可见大量明显散在颗粒的肥大细胞定义为脱颗粒的肥大细胞。
1.6 酶联免疫吸附试验和酶免疫分析法测定TNF-α和雌二醇水平分别取SD大鼠血清用酶联免疫吸附试验试剂盒检测TNF-α水平,用酶免疫分析试剂盒检测雌二醇质量浓度,计算时以标准物的质量浓度为横坐标,吸光度值为纵坐标,绘出标准曲线,根据样品的吸光度值由标准曲线计算出相应的质量浓度。
1.7 免疫组织化学染色检测类胰蛋白酶和神经生长因子的表达标本经石蜡包埋,切片(厚4 μm)后行免疫组织化学染色检测异位病灶类胰蛋白酶和神经生长因子的表达,方法同上,其中类胰蛋白酶用3-氨基-9-己基咔唑(AEC)显色。类胰蛋白酶染色结果判定如下:双盲高倍镜下(×400)下连续计数单位面积(个/mm2)每张5个视野中的类胰蛋白酶阳性细胞数,取其平均值。神经生长因子结果判定采用组织化学评分法:双盲下随机选择5个高倍镜视野(×400),按胞浆的着色深浅评分,其中不着色为0分,淡黄色为1分,黄色为2分,黄棕色甚至咖啡色为3分;计算阳性细胞百分数,以着黄色为阳性细胞,其中阳性细胞占0%为0 分,占1%~25%为1 分,占26%~50%为2分,占50%以上为3分。按公式(∑阳性细胞表达强度×阳性细胞百分数评分)计算出该标本的阳性指数,即为该组织的神经生长因子的表达量。
1.8 统计学方法采用SPSS 20.0软件进行统计学分析。实验数据先进行正态性及方差齐性检验,偏态分布数据采用非参数秩和检验(Mann-Whitney U检验和Kruskal-Wallis检验),结果以中位数和范围[M(Min~Max)]表示;正态分布且方差齐的数据采用单因素方差分析,结果以均数±标准差(x±s)表示,以P<0.05为差异有统计学意义。
2 结 果 2.1 大鼠子宫内膜异位症模型鉴定结果造模后再次剖腹观察病灶生长变化,在移植处可见大小不同的病灶,呈隆起透亮或咖啡色的小囊泡状,内部充满液体,表面血管清晰可见,极少移植病灶与腹部脂肪组织有轻度的粘连,但是较易分离。病灶在显微镜下可见明显的腺体和间质,间质纤维化伴有少许炎症细胞浸润,层次分明,结构整齐,生长良好,表面上皮细胞柱状,腺体丰富,增生现象明显,组织病理学证实为子宫内膜腺体和间质。角蛋白在模型病灶腺上皮中均表达,但在病灶间质细胞中均不表达;相反,波形蛋白在模型病灶间质细胞中均表达,而在上皮细胞中均不表达,与正常子宫内膜表达一致,该结果证实大鼠子宫内膜异位症模型造模成功,见图 1。
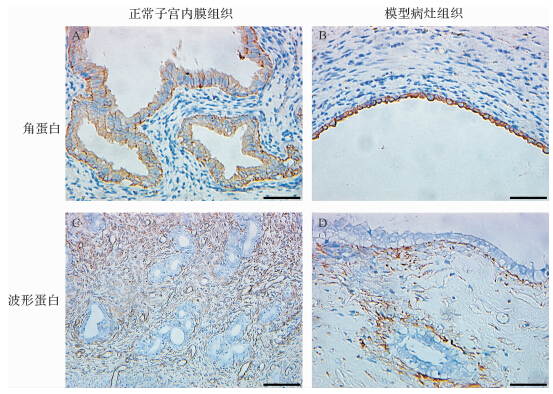
|
| 正常子宫内膜腺上皮细胞中有土黄色角蛋白表达,模型病灶组织也有土黄色角蛋白表达(标尺=50 μm);正常子宫内膜间质中有棕色波形蛋白表达(标尺=100 μm),模型病灶间质中也有棕色波形蛋白表达(标尺=50 μm). 图 1 子宫内膜异位症模型病灶和正常子宫内膜组织角蛋白及波形蛋白的表达 Fig. 1 Keratin and vimentin expressions in endometriotic lesions and normal endometrium of rats |
造模后2周剖腹观察病灶生长情况,大剂量组、小剂量组、阴性对照组和空白对照组病灶大小差异无统计学意义(P>0.05)。连续使用色甘酸钠治疗4周,大剂量组病灶体积较2周前有所缩小,但差异仍无统计学意义(P>0.05)。见表 1。
| [M(Min~Max,mm3)] | |||
| 组别 | n | 2周 | 4周 |
| 大剂量组 | 10 | 34.00(13.50~208.30) | 25.75(11.44~91.50) |
| 小剂量组 | 10 | 29.63(9.75~171.80) | 49.00(7.69~118.00) |
| 阴性对照组 | 8 | 35.72(18.00~105.80) | 25.00(15.75~101.75) |
| 空白对照组 | 8 | 36.03(18.00~117.00) | 46.50(40.5~108.00) |
甲苯胺蓝特异性染色显示,各组间肥大细胞总数差异无统计学意义,大剂量组脱颗粒肥大细胞数少于阴性对照组和空白对照组,相应脱颗粒肥大细胞数/肥大细胞总数比值也小于阴性对照组和空白对照组(均P<0.05),见表 2。
| [M(Min~Max)] | ||||
| 组别 | n | 肥大细胞总数 | 脱颗粒肥大细胞数 | 脱颗粒肥大细胞数/肥大细胞总数 |
| 与阴性对照组比较,*P<0.05;与空白对照组比较,#P<0.05. | ||||
| 大剂量组 | 10 | 1.60(0.20~3.20) | 0.20(0~0.60)*# | 0.19(0~0.25)*# |
| 小剂量组 | 10 | 2.20(1.40~5.20) | 0.80(0.40~2.40) | 0.27(0.44~0.56) |
| 阴性对照组 | 8 | 3.40(2.00~6.20) | 1.20(0.40~1.80) | 0.31(0.20~0.36) |
| 空白对照组 | 8 | 2.00(0.60~3.20) | 0.80(0.20~1.80) | 0.36(0.11~0.56) |
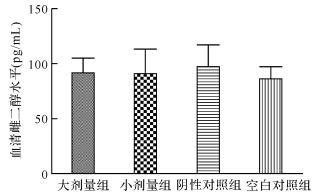
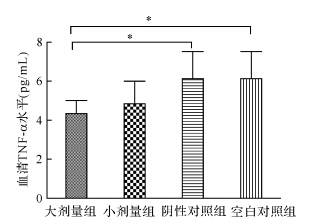
各组间血清雌二醇水平差异无统计学意义(P>0.05),见图 2。大剂量组和小剂量组血清TNF-α水平分别为(4.33±0.68) pg/mL和(4.84±1.17) pg/mL,阴性对照组和空白对照组TNF-α水平分别为(6.14±1.38 )pg/mL和 (5.97±1.29)pg/mL,大剂量组TNF-α水平低于阴性对照组和空白对照组(均P<0.05),其他组间均无差异,见图 3。
|
| 图 2 各组血清雌二醇水平比较 Fig. 2 Serum estradiol levels after treatment with different doses of sodium cromoglycate in endometriosis model |
|
| 组间比较,*P<0.05 图 3 各组血清TNF-α水平比较 Fig. 3 Serum TNF-α levels after treatment with different doses of sodium cromoglycate in endometriosis model |
免疫组织化学染色结果显示,大剂量组类胰蛋白酶阳性的肥大细胞数少于阴性对照组和空白对照组(均P<0.05);两色甘酸钠组比阴性对照组和空白对照组神经生长因子表达稍低,但差异无统计学意义(均P>0.05),见表 3。
| [M(Min~Max)] | |||
| 组别 | n | 类胰蛋白酶表达阳性的肥大细胞数 | 神经生长因子染色评分 |
| 与阴性对照组比较,*P<0.05;与空白对照组比较,#P<0.05. | |||
| 大剂量组 | 10 | 1.90(0.40~3.60)*# | 1.40(0.60~6.00) |
| 小剂量组 | 10 | 2.60(0.80~5.40) | 1.60(0.60~6.40) |
| 阴性对照组 | 8 | 4.60(0.60~11.0) | 2.60(1.20~5.20) |
| 空白对照组 | 8 | 3.60(2.20~10.80) | 2.40(1.40~5.80) |
子宫内膜异位症最主要的临床表现是疼痛(包括痛经、性交痛、排便痛、排尿痛及慢性盆腔痛),但其确切发病机制至今尚不清楚,同时也缺乏有效的治疗手段。目前药物治疗方式主要有非甾体类消炎药、口服避孕药、甲羟孕酮、左炔诺孕酮宫内缓释系统、促性腺激素释放激素激动剂、孕激素、芳香化酶抑制剂、丹那唑等[4],但这些药物有较多的副作用,限制了临床长期应用。腹腔镜是诊断和治疗子宫内膜异位症的金标准,但是术后有相当一部分患者仍然存在疼痛症状,有些患者的疼痛症状甚至比手术前还要严重;据报道,术后6个月~1年,患者疼痛症状累积复发率高达30%~60%[5, 6]。因此,阐明子宫内膜异位症疼痛的发病机制以及寻找相应的治疗方案是治疗子宫内膜异位症的重要任务。
子宫内膜异位症病灶内周期性出血导致无菌性炎症、免疫炎症以及病灶神经异常生长导致中枢与外周神经敏化可能是子宫内膜异位症疼痛的主要发生机制[7, 8]。肥大细胞是一种具有免疫活性的多功能细胞,它广泛分布于人体的结缔组织、黏膜组织及血管周围组织,参与体内多种生理和病理反应。研究发现肥大细胞脱颗粒与疼痛发生有明显的相关性,在炎症形成过程中肥大细胞脱颗粒,释放类胰蛋白酶、TNF-α、神经生长因子等炎症介质,可能激活或致敏初始感觉神经元。而敏化的神经可释放大量神经递质反过来激活肥大细胞促使其脱颗粒释放致痛物质,进一步促进神经敏化,从而导致神经病理性疼痛的持续状态[9]。研究发现子宫内膜异位症病灶存在肥大细胞数量增加及其活性增强。早在1998年就有研究证实腹膜型子宫内膜异位症病灶中肥大细胞数量及其脱颗粒细胞数均高于正常腹膜,近期进一步研究发现这些肥大细胞存在着异质性改变,表现为类胰蛋白酶阳性的肥大细胞数增多及内源性类胰蛋白酶的表达,正常腹膜即使存在肥大细胞但几乎没有肥大细胞脱颗粒现象[10, 11]。Engemise等[12]研究发现,轻至中度子宫内膜异位症患者放置左炔诺孕酮宫内缓释系统(曼月乐)治疗后,其异位内膜和在位内膜中肥大细胞数量减少,因此推测肥大细胞数量的减少与左炔诺孕酮宫内缓释系统缓解子宫内膜异位症患者的疼痛症状有关。色甘酸钠是肥大细胞膜稳定剂,亦是一种抗变态反应药物,其作用是稳定肥大细胞的细胞膜,阻止肥大细胞脱颗粒,从而抑制TNF-α、类胰蛋白酶等介质的释放[13]。本研究结果表明,给予大剂量色甘酸钠后子宫内膜异位症病灶组织脱颗粒肥大细胞及与肥大细胞总数比值减少,而肥大细胞总量并无减少,证明色甘酸钠在子宫内膜异位症组织中是肥大细胞细胞膜稳定剂,可以使后者保持稳定,从而可能减少对神经元的刺激,促进症状缓解。
本研究结果显示,色甘酸钠应用后治疗组与对照组中血清雌激素水平并无明显差异,但给予大剂量色甘酸钠后,大鼠血清TNF-α水平、组织类胰蛋白酶表达减少,说明该药物应用后出现的效果与雌激素水平无关,可能与肥大细胞脱颗粒减少相关。研究表明色甘酸钠药理作用稳定,但作用机制却尚未明确,可能与肥大细胞上一相对分子量为78 000的蛋白磷酸化有关。该蛋白由两段与肥大细胞膜突蛋白同源的染色体组成,在细胞表面与细胞内构架之间通过调节性功能的连接而参与信号传导,一旦膜突蛋白在磷酸化/脱磷酸化作用下结构发生改变,将导致细胞膜和细胞内部相互构相的位置重排,并可能使肥大细胞分泌颗粒[14]。近年来也有研究提示色甘酸钠与G蛋白偶联受体35信号通路上一种抗炎症蛋白——膜联蛋白Ⅰ的作用有关[15, 16]。
本研究为了解色甘酸钠及其不同剂量对肥大细胞脱颗粒的影响,设定了20 mg/kg和10 mg/kg两个剂量色甘酸钠治疗及阴性对照组、空白对照组,结果表明生理盐水不会干扰病灶中肥大细胞的状态,小剂量的色甘酸钠也不足以显著改变肥大细胞脱颗粒状态,只有相对较大剂量色甘酸钠才对子宫内膜异位症组织中的肥大细胞有细胞膜稳定的作用。在过敏性疾病(如哮喘、过敏性鼻炎、过敏性结膜炎和春季角结膜炎等)的研究中,已证实色甘酸钠作为肥大细胞膜稳定剂有控制肥大细胞脱颗粒的作用[17, 18]。Vincent等[19]在镰状细胞性贫血的研究中发现,活化的肥大细胞释放细胞因子及神经肽等相关介质,使镰状细胞性贫血的小鼠痛觉感受器致敏,应用色甘酸钠或者伊马替尼能减轻炎症反应,缓解该疾病小鼠的疼痛。Zuo等[20]在肥大细胞介导的坐骨神经痛研究中发现,10 mg/kg色甘酸钠作用于大鼠并不能很好地稳定肥大细胞,因此并不是最佳剂量。本研究结果也支持上述研究,20 mg/kg的色甘酸钠剂量才具有肥大细胞膜稳定作用。
本研究数据显示应用色甘酸钠后,子宫内膜异位症病灶大小并无显著改变,提示色甘酸钠虽然可通过稳定肥大细胞细胞膜改善症状,但可能不参与子宫内膜异位症病灶的增殖过程。同时,本研究中神经生长因子的表达也无显著改变,说明神经生长因子可能同时受多种因素影响,肥大细胞脱颗粒并非其惟一改变途径。此外,也有研究认为,色甘酸钠除了稳定肥大细胞膜的作用外,亦能降低未脱髓鞘的神经纤维对辣椒素的敏感性,抑制体内免疫细胞的功能[21, 22],从而也能起到缓解症状的作用,这为我们今后的研究提供了思路。
总之,色甘酸钠的应用可通过稳定肥大细胞、抑制其脱颗粒,减少TNF-α、类胰蛋白酶的释放,从而有助于缓解子宫内膜异位症症状。因此,色甘酸钠的临床应用可能为子宫内膜异位症患者的治疗提供新思路。
| [1] | WANG G, TOKUSHIGE N, MARKHAM R, et al. Rich innervation of deep infiltrating endometriosis [J]. Hum Reprod, 2009, 24(4):827-834. |
| [2] | ZAITSU M, NARITA S, LAMBERT K C, et al. Estradiol activates mast cells via a non-genomic estrogen receptor-alpha and calcium influx [J]. Mol Immunol, 2007, 44(8):1977-1985. |
| [3] | VERNON M W, WILSON E A. Studies on the surgical induction of endometriosis in the rat [J]. Fertil Steril, 1985, 44(5):684-694. |
| [4] | GIUDICE L C. Clinical practice. Endometriosis [J]. N Engl J Med, 2010, 362(25):2389-2398. |
| [5] | Practice Committee of American Society for Reproductive Medicine. Treatment of pelvic pain associated with endometriosis [J]. Fertil Steril, 2008, 90(5 Suppl):S260-S269. |
| [6] | JACOBSON T Z, DUFFY J M, BARLOW D, et al. Laparoscopic surgery for pelvic pain associated with endometriosis [J]. Cochrane Database Syst Rev, 2014,8:CD001300. |
| [7] | ZHANG G, DMITRIEVA N, LIU Y, et al. Endometriosis as a neurovascular condition: estrous variations in innervation, vascularization, and growth factor content of ectopic endometrial cysts in the rat [J]. Am J Physiol Regul Integr Comp Physiol, 2008, 294(1):R162-R171. |
| [8] | ASANTE A, TAYLOR R N. Endometriosis: the role of neuroangiogenesis [J]. Annu Rev Physiol, 2011, 73:163-182. |
| [9] | KIRCHHOFF D, KAULFUSS S, FUHRMANN U, et al. Mast cells in endometriosis: guilty or innocent bystanders? [J]. Expert Opin Ther Targets,2012,16(3):237-241. |
| [10] | MATSUZAKI S, CANIS M, DARCHA C, et al. Increased mast cell density in peritoneal endometriosis compared with eutopic endometrium with endometriosis [J]. Am J Reprod Immunol, 1998, 40(4):291-294. |
| [11] | PAULA R J R, OLIANI A H, VAZ-OLIANI D C, et al.The intricate role of mast cell proteases and the annexin A1-FPR1 system in abdominal wall endometriosis [J]. J Mol Histol, 2015,46(1):33-43. |
| [12] | ENGEMISE S L, WILLETS J M, EMEMBOLU J O, et al.The effect of the levonorgestrel-releasing intrauterine system, Mirena® on mast cell numbers in women with endometriosis undergoing symptomatic treatment [J]. Eur J Obstet Gynecol Reprod Biol,2011,159(2):439-442. |
| [13] | 卢韵碧,江 波,周汉良. 沙丁胺醇与色甘酸钠对大鼠腹腔肥大细胞脱颗粒过程中磷脂酶D活性的影响[J].中国药理学与毒理学杂志, 2001, 15(5):366-371 LU Yun-bi, JIANG Bo, ZHOU Han-liang. The effect of salbutamol and sodium cromoglycate on the activity of phospholipase D in the process of intraperitoneal degranulation of mast cells in rats [J]. Chinese Journal of Phamacology and Toxicology, 2001, 15(5):366-371. (in Chinese) |
| [14] | THEOHARIDES T C, WANG L, PANG X, et al. Cloning and cellular localization of the rat mast cell 78-kDa protein phosphorylated in response to the mast cell “stabilizer” cromolyn [J]. J Pharmacol Exp Ther, 2000, 294(3):810-821. |
| [15] | YANG Y, LU J Y, WU X,et al. G-protein-coupled receptor 35 is a target of the asthma drugs cromolyn disodium and nedocromil sodium [J]. Pharmacology, 2010,86(1):1-5. |
| [16] | YAZID S, SINNIAH A, SOLITO E, et al.Anti-allergic cromones inhibit histamine and eicosanoid release from activated human and murine mast cells by releasing Annexin A1 [J]. PLoS One, 2013,8(3):e58963 |
| [17] | SHAPIRO G G, KONIG P. Cromolyn sodium: a review [J]. Pharmacotherapy, 1985, 5(3):156-170. |
| [18] | PATALANO F, RUGGIERI F. Sodium cromoglycate: a review [J]. Eur Respir J Suppl, 1989, 6:556s-560s. |
| [19] | VINCENT L, VANG D, NGUYEN J,et al. Mast cell activation contributes to sickle cell pathobiology and pain in mice [J]. Blood, 2013,122(11):1853-1862. |
| [20] | ZUO Y, PERKINS N M, TRACEY D J, et al. Inflammation and hyperalgesia induced by nerve injury in the rat: a key role of mast cells [J]. Pain, 2003, 105(3):467-479. |
| [21] | DIXON M, JACKSON D M, RICHARDS I M. The action of sodium cromoglycate on 'C' fibre endings in the dog lung [J]. Br J Pharmacol, 1980, 70(1):11-13. |
| [22] | KAY A B, WALSH G M, MOGBEL R, et al. Disodium cromoglycate inhibits activation of human inflammatory cells in vitro [J]. J Allergy Clin Immunol, 1987, 80(1):1-8. |



