2.西安交通大学医学部公共卫生学系流行病与卫生统计学教研室, 陕西 西安 710061
2.Teaching and Research Section of Epidemiology and Health Statistics, Department of Public Health, Xi'an Jiaotong University School of Medicine, Xi'an 710061, China
急性髓系白血病(acute myeloid leukemia,AML)是造血系统的髓系原始细胞克隆性恶性增殖性疾病。随着诊疗技术的进展,AML的诊断方法越来越多,目前的诊断分类技术已更多地基于细胞遗传学及分子遗传学检测[1],如染色体分带技术、荧光免疫杂交技术、多重逆转录聚合酶链反应技术等[2]。近年来,研究者发现基因突变可能是影响AML患者预后的一个重要的独立危险因素[3]。
2001年Mizuno等[4]发现,AML患者中DNA甲基转移酶(DNA methyltransferase,DNMT )家族有较高表达,认为DNMT表达的上调会引发超甲基化最终导致白血病的发生。Ley等[5]认为在正常核型AML中DNMT3A基因存在一定比例的突变,并可能成为一种独立的预后不良因素;但是研究发现DNMT3A基因突变较多伴随CCAAT增强子结合蛋白α(CCAAT enhancer binding protein alpha,CEBPA)基因突变[6],而单纯CEBPA基因突变患者无病生存期和总生存期均长于DNMT3A基因突变伴随CEBPA基因突变者,表现为预后良好[7]。目前DNMT3A基因突变对AML患者预后的报道不一。本研究旨在通过系统评价进一步了解DNMT3A突变对AML患者预后的影响,为AML患者预后分类及分层治疗提供依据。
1 资料与方法 1.1 检索策略计算机检索以“AML or ANLL or acute myeloid leukemia”and “DNMT3 or DNMT3A”为英文检索词,以“急性髓系白血病或急性非淋巴细胞白血病” 和“DNMT3 或 DNMT3A”为中文检索词,检索PubMed、Embase、Ovid、中国知网、中国生物医学文献数据库、万方和维普等中英文数据库及ClinicalTrials临床试验注册网站,检索时限为2008~2014年,全面收集AML患者伴随DNMT3A基因突变的临床对照试验,并手工检索相关领域学术期刊及追查纳入研究的参考文献。
1.2 文献纳入及排除标准纳入文献研究对象符合以下条件:①经过PCR、基因检测等方式提供患者DNMT3A基因突变结果;②经骨髓细胞形态学、染色体核型分析、免疫表型等检测确诊为AML;③无年龄、性别等一般情况的限制;④能够进行标准化疗,无明显化疗禁忌证;⑤采用IA(去甲氧柔红霉素+阿糖胞苷)、DA( 柔红霉素+阿糖胞苷)、MA(米托蒽醌+阿糖胞苷)、 FA(氟达拉滨+阿糖胞苷)、CAG(阿克拉霉素+阿糖胞苷+粒细胞集落刺激因子)或者HAD(高三尖杉酯碱+阿糖胞苷+柔红霉素)等方案治疗。
排除属于以下研究的文献:①研究对象为骨髓增生异常综合征继发白血病;②慢性髓性白血病急变期和药物相关白血病;③AML-M3的研究; ④文献中研究数据不完整;⑤原始文献研究对象不是人类。
1.3 资料收集方法阅读原始文献题目、摘要,剔除与题目无关文献,获取可能纳入的文献全文再次筛选,最后纳入符合标准的文献。根据纳入标准严格筛选后确定纳入文献。提取纳入文献的第一作者、年份、所在地区、DNMT3A基因突变及无突变患者化疗后完全缓解率、无病生存期及总生存期。文献筛选及数据提取由两位研究者独立完成并交叉核对,如遇分歧,由第三位研究者解决。
1.4 研究质量评价纽卡斯尔—渥太华量表[8](the Newcastle-Ottawa Scale,NOS)适用于评价队列研究。具体包括研究人群选择(selection)、可比性(comparability)、暴露(exposure)评价或结果(outcome)评价。NOS对文献质量的评价采用了星级系统的半量化原则,满分9分。研究人群选择:暴露组的代表性如何(1分)、非暴露组的选择方法(1分)、暴露因素的确定方法(1分)、确定研究起始时尚无要观察的结局指标(1分);组间可比性:设计和统计分析时考虑暴露组和未暴露组的可比性(2分);结果测量:研究对于结果的评价是否充分(1分)、结果发生后随访是否足够长(1分)、暴露组和非暴露组的随访是否充分(1分)。
1.5 数据分析采用Stata 11.0软件进行meta分析,合并效应量为OR和HR。根据异质性检验结果选择相应模型计算合并统计量,提示纳入研究间有异质性采用随机效应模型,无异质性则采用固定效应模型,计算95% CI,并对总体是否有统计学意义进行统计推断,检验水准为0.05。异质性检验采用Q检验及I2统计量,Q检验检验水准为0.10,I2<50%提示各研究间无异质性。采用Begg检验和漏斗图法评估纳入研究的发表偏倚,检验水准为0.05,漏斗图近似对称认为不存在发表偏倚,反之则认为可能存在发表偏倚。敏感性分析选用不同的模型分别进行效应量合并,确定结果稳定性。
2 结 果 2.1 文献检索和选择研究情况检索中外文数据库排除重复后共获得41篇相关文献,经标题及摘要初步审查后筛除22篇,获得全文后进一步阅读全文后最终7篇文献[6, 9, 10, 11, 12, 13, 14]纳入研究。合计1493例研究对象,有DNMT3A基因突变患者211例,无DNMT3A基因突变患者1282例。见图1。

|
| 图1 文献筛选流程图 Fig.1 The process of identifying and selecting relevant studies |
见表1。
| 作者 | 年份 | 地区 | 类型 | 包含研究对象 | 完成随访 | 结局指标 |
| 纪濛濛等[9] | 2013 | 中国,安徽 | 有DNMT3A突变 | 6 | 3(完全缓解2例) | 完全缓解率 |
| 无DNMT3A突变 | 48 | 32(完全缓解17例) | ||||
| 乔纯等[6] | 2011 | 中国,南京 | 有DNMT3A突变 | 7 | 4(完全缓解3例) | 完全缓解率 |
| 无DNMT3A突变 | 52 | 27(完全缓解19例) | ||||
| 陈亚玫等 [10] | 2012 | 中国,厦门 | 有DNMT3A突变 | 13* | 9(完全缓解6例) | 完全缓解率,总生存期 |
| 无DNMT3A突变 | 87 | 41(完全缓解21) | ||||
| EL Ghannam等[11] | 2014 | 埃及,曼苏拉 | 有DNMT3A突变 | 17 | 17(完全缓解12例) | 完全缓解率,总生存期,无病生存期 |
| 无DNMT3A突变 | 46 | 31(完全缓解31) | ||||
| Hou等[12] | 2011 | 中国,台湾 | 有DNMT3A突变 | 70 | 43(完全缓解32例) | 完全缓解率,总生存期,无病生存期 |
| 无DNMT3A突变 | 430 | 320(完全缓解252例) | ||||
| Yan等[13] | 2011 | 中国,上海 | 有DNMT3A突变 | 23 | 23 | 总生存期 |
| 无DNMT3A突变 | 89 | 68 | ||||
| Shen等[14] | 2011 | 中国,上海 | 有DNMT3A突变 | 75 | 72 | 总生存期,无病生存期 |
| 无DNMT3A突变 | 530 | 513 | ||||
| *删去3例AML-M3患者 | ||||||
7个研究均对研究对象的患者类型、年龄、性别、基因突变情况等描述具体。7篇均对暴露组及非暴露组有明确的诊断标准,暴露组及非暴露组的组间可比性较好,研究结果评价充分,实验结果数据明确,随访较充分。2篇样本量较少,5篇结局指标不完整,7篇文献均存在部分失访。质量评价结果见表2。
共5个研究纳入,有DNMT3A基因突变患者113例(76例完成随访),无DNMT3A基因突变患者663例(451例完成随访)。异质性检验结果:I2=0,P=0.844,说明5个研究间无异质性,故使用固定效应模型。有DNMT3A基因突变对完全缓解率影响的分析结果提示,DNMT3A基因突变与无DNMT3A基因突变患者化疗后完全缓解率差异无统计学意义(OR=1.034,95% CI: 0.596~1.796,P=0.905)。见图2。

|
| 图2 DNMT3A基因突变对AML患者完全缓解率影响的meta分析森林图 Fig.2 Forest plots of the odds ratio and 95% confidence intervals for complete remission |
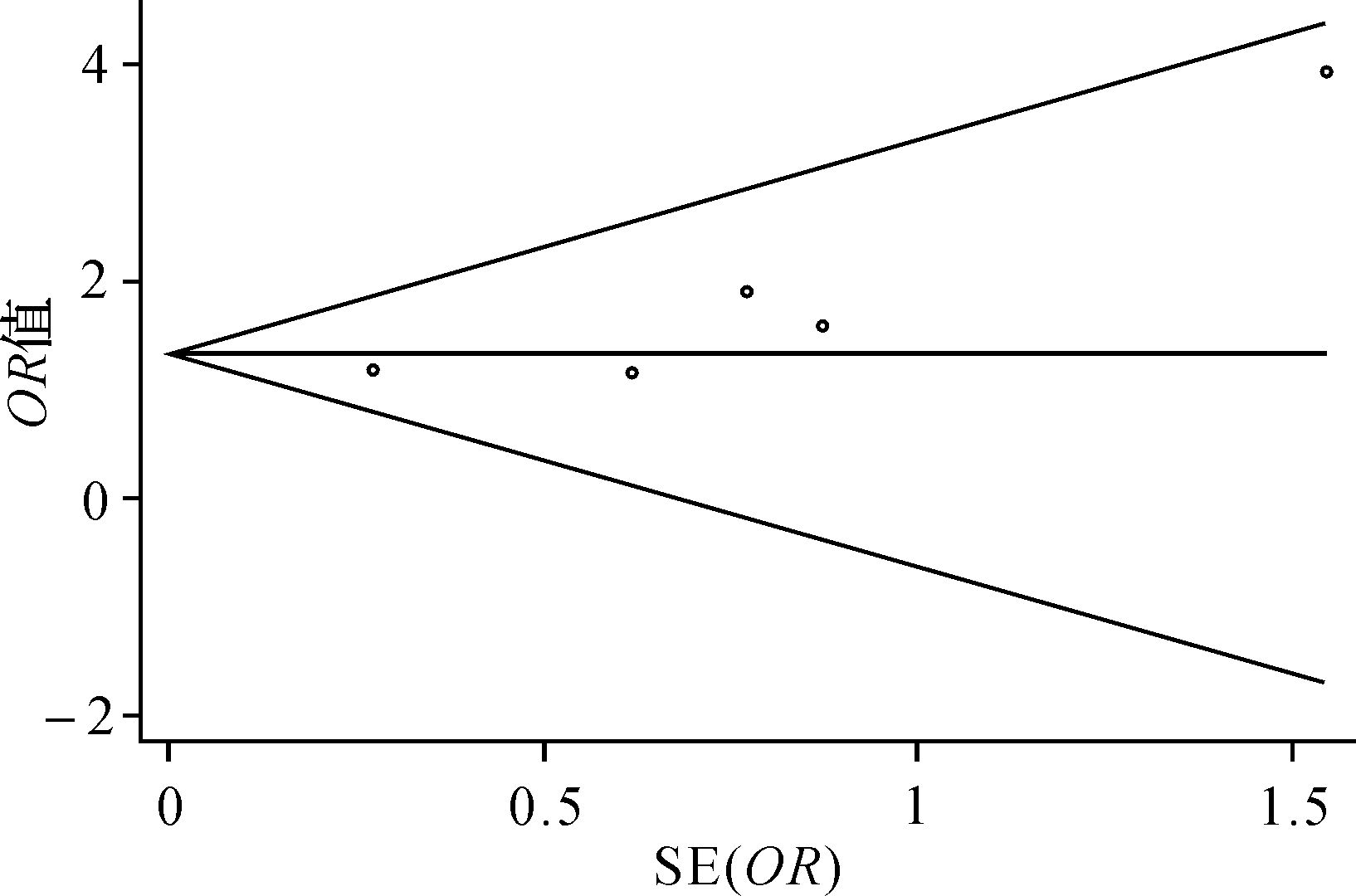
发表偏倚检测结果显示: Begg法检测结果中Pr>|z|指标为0.221(P > 0.05),提示纳入研究中不存在明显的发表偏倚。见图3。
|
| 图3 DNMT3A基因突变对AML患者化疗后完全缓解率影响的meta分析发表偏倚漏斗图 Fig.3 Funnel plot of CR publication bias |
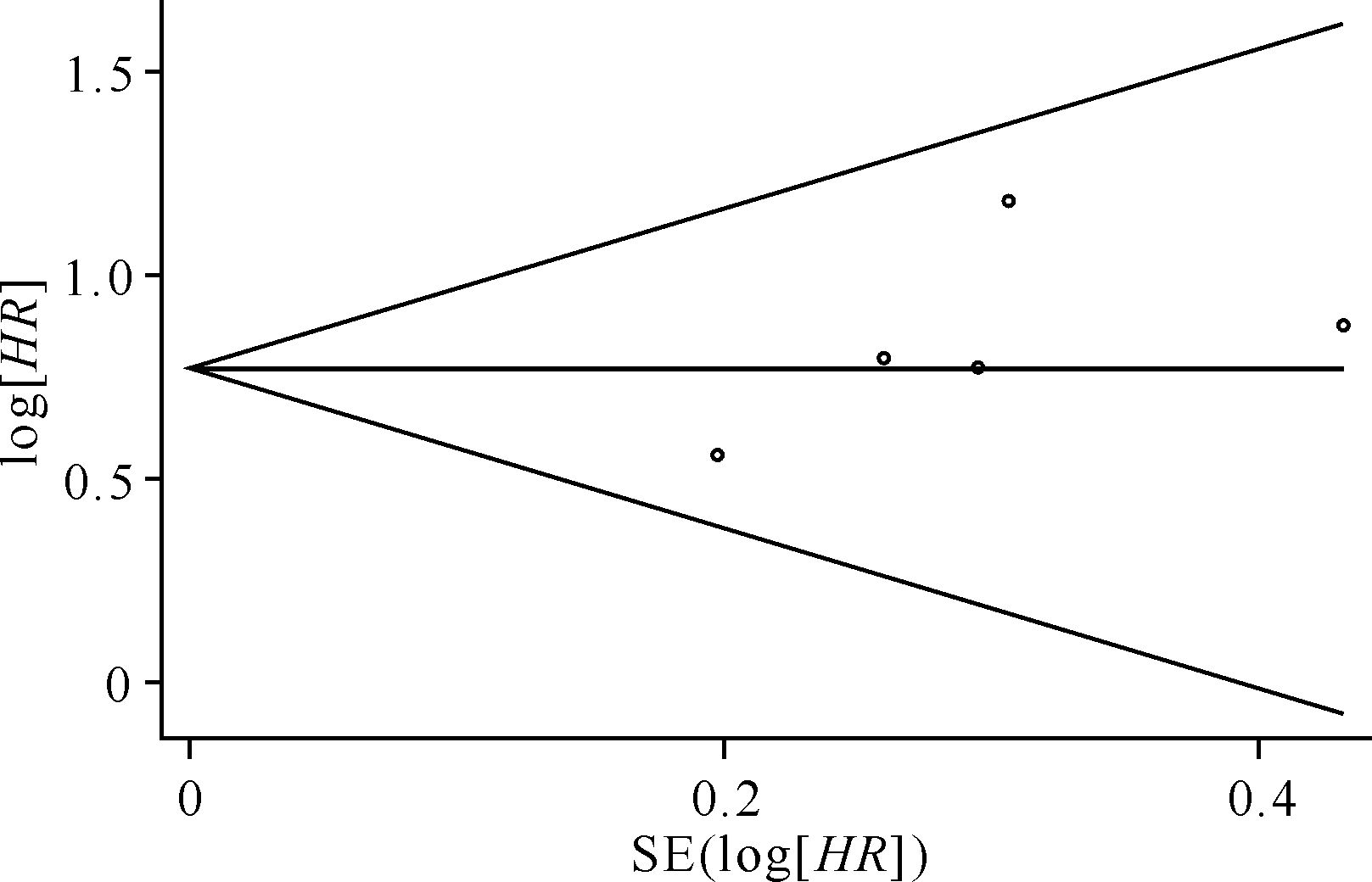
共有5个研究纳入,DNMT3A基因突变患者198例(164例完成随访),无DNMT3A基因突变患者1182例(973例完成随访)。异质性检验结果:I2=0,P=0.842,说明5个研究间无异质性,故使用固定效应模型。DNMT3A基因突变对总生存期影响的分析结果提示,有DNMT3A基因突变与无DNMT3A基因突变患者化疗后总生存期差异有统计学意义(HR=1.99,95% CI: 1.463~2.510,P=0.000)。见图4。发表偏倚的检测结果显示: Begg法检测结果中Pr>|z|指标为1.00(P > 0.05),提示纳入研究中不存在明显的发表偏倚。见图5。

|
| 图4 DNMT3A基因突变对AML患者化疗后总生存期影响的meta分析森林图 Fig.4 Forest plots of the hazard ratio and 95% confidence intervals for overall survival |
|
| 图5 DNMT3A基因突变对AML患者化疗后总生存期影响的meta分析发表偏倚漏斗图 Fig.5 Funnel plot of OS publication bias |
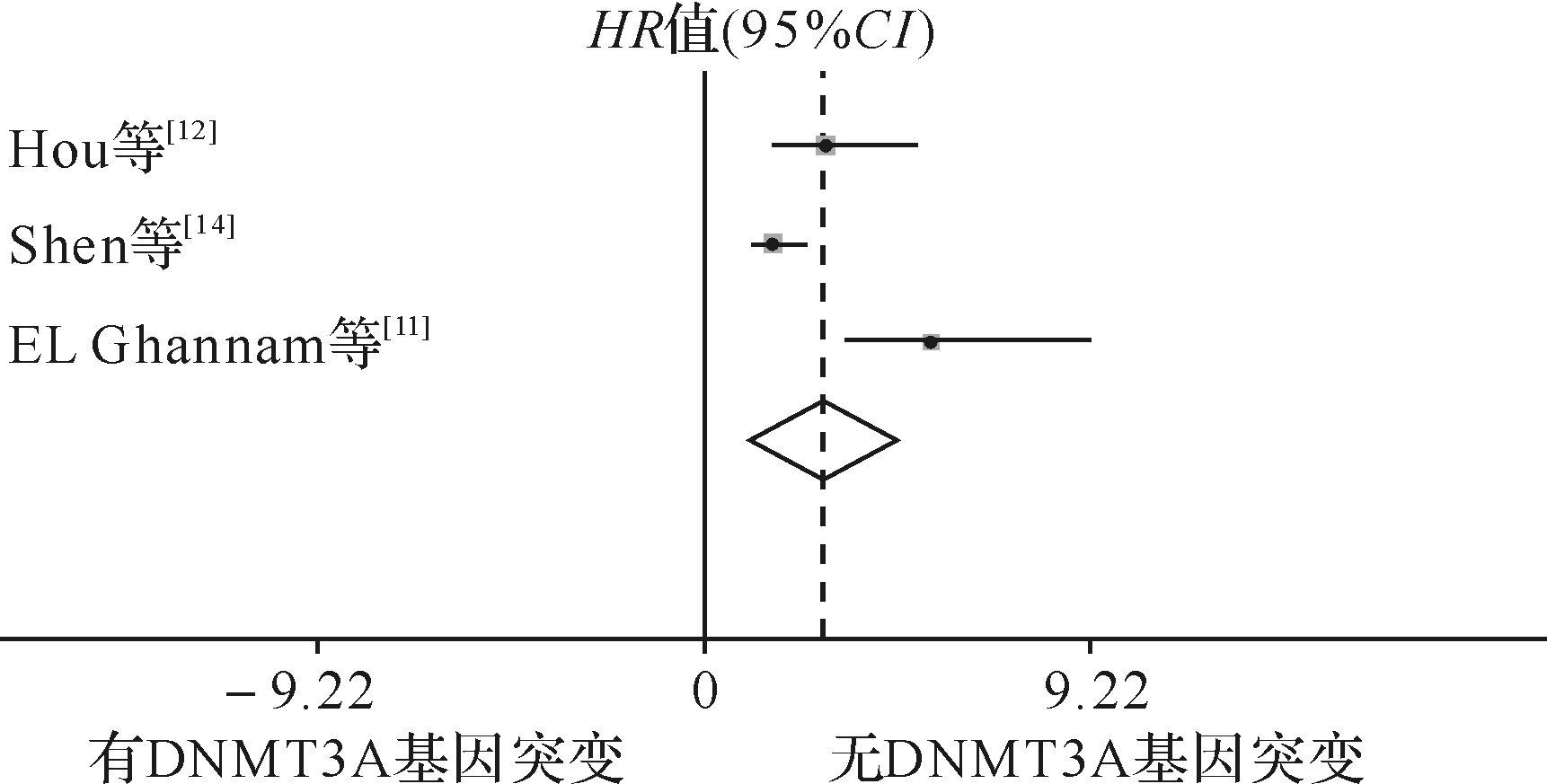
共3个研究纳入,有DNMT3A基因突变患者162例(132例完成随访),无DNMT3A基因突变患者1006例(864例完成随访)。异质性检验结果:I2=72.8%,P=0.025,说明3个研究间有异质性,故使用随机效应模型。DNMT3A基因突变对无病生存期影响的分析结果提示,有DNMT3A基因突变与无DNMT3A基因突变患者化疗后无病生存期差异有统计学意义(HR=2.84,95% CI: 1.063~4.613,P=0.002)。见图6。
|
| 图6 DNMT3A基因突变对AML患者化疗后无病生存期影响的meta分析森林图 Fig.6 Forest plots of the hazard ratio and 95% confidence intervals for disease-free survival |
发表偏倚的检测结果显示: Begg法检测结果中Pr>|z|指标为0.086(P > 0.05),提示纳入研究中不存在明显的发表偏倚。见图7。

|
| 图7 DNMT3A基因突变对AML患者化疗后无病生存期影响的meta分析发表偏倚漏斗图 Fig.7 Funnel plot of DFS publication bias |
7篇文献均未对患者化疗后的不良反应进行描述。
2.6 敏感性分析对所有的临床效应指标均分别进行了固定效应模型与随机效应模型的meta分析,结果显示两个模型分析的OR值或者HR值及其可信区间均比较接近,提示meta分析结果比较稳定。见表3。
| 结局指标 | 效应模型 | OR值或HR值 | P值 | 95%CI |
| 完全缓解率 | 随机效应 | 1.020 | 0.844 | 0.59~1.77 |
| 固定效应 | 1.034 | 0.905 | 0.60~1.80 | |
| 总生存期 | 随机效应 | 1.990 | 0.000 | 1.46~2.51 |
| 固定效应 | 1.990 | 0.000 | 1.46~2.51 | |
| 无病生存期 | 随机效应 | 2.840 | 0.002 | 1.06~4.61 |
| 固定效应 | 1.930 | 0.000 | 1.35~2.51 |
AML是一组起源于造血干细胞的恶性克隆性疾病,在临床上和遗传学上都具有高度的异质性[15]。目前诊疗技术不断进步,研究认为由基因突变所致细胞的增殖、分化及凋亡途径的改变是AML的发病基础[16]。目前,大约有55%的AML患者可检测出染色体的异常[16],这些特异的染色体改变与临床特点及预后有很大的关系。然而45%的AML患者用标准的核型分析方法不能检测出异常,其预后存在很大的差异,常被归为预后中等组[17] 。近年来,随着对白血病分子遗传学与分子生物学的研究进展,发现AML患者存在多种不同的基因突变及基因表达的改变,如核仁磷酸蛋白1(nucleophosmin,NPM1)基因、CEBPA基因、Fms 样酪氨酸激酶3内部串联重复(Fms like tyrosine kinase 3 internal tandom duplication,FLT3-ITD)基因、MLL-ITD基因等,这些基因突变与AML的预后有着密切的相关性[18]。其中NPM1基因、FLT3-ITD基因出现突变的频率较高,因此国外临床实践指南中已将这2个基因作为治疗决策的重要参考指标[19]。由此可见,遗传学的改变对AML患者诊断及治疗的有重要指导意义。
Walter等[20]发现在8%的骨髓增生异常综合征患者中检测到DNMT3A-882位点突变,Abdel-Wahab等[21]在原发性骨髓纤维化患者中也检测到7%的突变率,两项研究均表明DNMT3A基因突变已先于AML阶段存在。因此,DNMT3A基因突变应引起足够的重视。近年来进一步研究发现AML患者中DNMT3A基因突变影响患者预后[5],与患者预后呈负相关[11],但是DNMT3A与CEBPA基因伴随突变,而CEBPA是预后良好的一个指标,因此其对AML的预后影响报道不一。
本研究共纳入7个临床对照试验进行meta分析,结果显示:有DNMT3A基因突变与无DNMT3A基因突变患者化疗后完全缓解率无明显差异;有DNMT3A基因突变患者化疗后总生存时间较无DNMT3A基因突变患者明显缩短;有DNMT3A基因突变患者化疗后无病生存时间较无DNMT3A基因突变患者明显缩短。由此提示DNMT3A基因突变是AML患者预后不良的一个独立因素。
经检索可纳入的原始研究数量较少,可提取到的数据较少无法进行亚组分析以及其中研究对象有失访等偏倚,这些因素可能影响结果的真实性,故本研究有一定的局限性,评价结果有待于开展独立临床试验和在临床使用中进一步验证。进一步开展大样本、高质量的队列研究试验将为明确DNMT3A基因突变对AML患者预后的影响提供更可靠的依据。
| [1] | DOHNER H, ESTEY E H, AMADORI S, et al. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European Leukemia Net[J]. Blood, 2010, 115(3):453-474. |
| [2] | 陈亮, 严智昌, 张彦芳. 急性髓系白血病诊断的研究进展[J]. 中国冶金工业医学杂志,2012, 29(04):396-398. CHEN Liang, YAN Zhi-chang, ZHANG Yan-fang.The research progress of acute myeloid leukemia diagnosis[J].Chinese Medical Journal of Metallurgical Industry,2012, 29(04):396-398. (in Chinese) |
| [3] | KELLY L M, GILLILAND D G. Genetics of myeloid leukemias[J]. Annu Rev Genomics Hum Genet, 2002, 3: 179-198. |
| [4] | MIZUNO S, CHIJIWA T, OKAMURA T, et al. Expression of DNA methyltransferases DNMT1, 3A, and 3B in normal hematopoiesis and in acute and chronic myelogenous leukemia[J]. Blood, 2001, 97(5):1172-1179. |
| [5] | LEY T J, DING L, WALTER M J, et al. DNMT3A mutations in acute myeloid leukemia[J]. N Engl J Med, 2010, 363(25):2424-2433. |
| [6] | 乔纯, 孙超, 张苏江, 等. 急性髓系白血病中DNMT3A基因突变的研究[J]. 中国实验血液学杂志,2011, 19(02):303-307. QIAO Chun, SUN Chao, ZHANG Su-jiang, et al. Analysis of DNMT3A gene mutations in acute myelogenous leukemia[J]. Journal of Experimental Hematology,2011, 19(02):303-307. (in Chinese) |
| [7] | KATO N, KITAURA J, DOKI N, et al. Two types of C/EBPalpha mutations play distinct but collaborative roles in leukemogenesis: lessons from clinical data and BMT models[J]. Blood, 2011, 117(1):221-233. |
| [8] | WELL G,SHEA B,OCONNELL D,et al. Newcastle-ottawa quality assessment scale—cohort studies[EB/OL].[2012-06-15].http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp. |
| [9] | 纪濛濛, 孙自敏, 刘会兰, 等. 成人急性髓细胞白血病DNMT3A基因突变的检测和临床意义[J]. 安徽医药,2013, 17(04):575-577. JI Meng-meng, SUN Zi-min, LIU Hui-lan, et al. The incidence of DNA methyltransferase 3 alpha(DNMT3A) gene mutation in patients with acute myeloid leukemia( AML) and its clinical significance[J]. Anhui Medical and Pharmaceutical Journal,2013, 17(04):575-577. (in Chinese) |
| [10] | 陈亚玫, 鹿全意. 急性髓系白血病中的DNMT3A基因突变研究[J]. 中国实验血液学杂志,2011, 19(06):1556-1560. CHEN Ya-mei,LU Quan-yi.DNMT3A gene mutations in acute myeloid leukemia—review[J]. Journal of Experimental Hematology,2011, 19(06):1556-1560. (in Chinese) |
| [11] | El GHANNAM D, TAALAB M M, GHAZY H F, et al. DNMT3A R882 mutations in patients with cytogenetically normal acute myeloid leukemia and myelodysplastic syndrome[J]. Blood Cells Mol Dis, 2014, 53(1-2):61-66. |
| [12] | HOU H A, KUO Y Y, LIU C Y, et al. DNMT3A mutations in acute myeloid leukemia: stability during disease evolution and clinical implications[J].Blood, 2012, 119(2):559-568. |
| [13] | YAN X J, XU J, GU Z H, et al. Exome sequencing identifies somatic mutations of DNA methyltransferase gene DNMT3A in acute monocytic leukemia[J]. Nat Genet, 2011, 43(4):309-315. |
| [14] | SHEN Y, ZHU Y M, FAN X, et al. Gene mutation patterns and their prognostic impact in a cohort of 1185 patients with acute myeloid leukemia[J]. Blood, 2011, 118(20):5593-5603. |
| [15] | LOWENBERG B. Acute myeloid leukemia: the challenge of capturing disease variety[J]. Hematology Am Soc Hematol Educ Program,2008,2008(1):1-11. |
| [16] | 吴皓, 陈洁平. NPM1和FLT3基因同时突变影响急性髓细胞白血病患者完全缓解率的Meta分析[J]. 国际检验医学杂志,2013, 34(09):1071-1073. WU Hao,CHEN Jie-ping.A Meta-analysis of effects of simultaneous mutation in NPM1 and FLT3 gene on complete remission rate patients with acute myeloid leukemia[J]. International Journal of Laboratory Medicine, 2013, 34(09):1071-1073. (in Chinese) |
| [17] | BYRD J C, MROZEK K, DODGE R K, et al. Pretreatment cytogenetic abnormalities are predictive of induction success, cumulative incidence of relapse, and overall survival in adult patients with de novo acute myeloid leukemia: results from Cancer and Leukemia Group B (CALGB 8461) [J]. Blood, 2002, 100(13):4325-4336. |
| [18] | SCHLENK R F, DOHNER K, KRAUTER J, et al. Mutations and treatment outcome in cytogenetically normal acute myeloid leukemia[J].N Engl J Med, 2008, 358(18):1909-1918. |
| [19] | LEY T J, MARDIS E R, DING L, et al. DNA sequencing of a cytogenetically normal acute myeloid leukaemia genome[J]. Nature, 2008, 456(7218):66-72. |
| [20] | WALTER M J, DING L, SHEN D, et al. Recurrent DNMT3A mutations in patients with myelodysplastic syndromes[J]. Leukemia, 2011, 25(7):1153-1158. |
| [21] | ABDEL-WAHAB O, PARDANANI A, RAMPAL R, et al. DNMT3A mutational analysis in primary myelofibrosis, chronic myelomonocytic leukemia and advanced phases of myeloproliferative neoplasms[J]. Leukemia, 2011, 25(7):1219-1220. |



