缝隙连接(gap junction)是相邻细胞间直接进行物质交流的细胞膜通道, 由开口于相邻细胞胞浆的两个半通道对接而成。相对分子质量<1500、直径<1.0nm的物质, 如无机离子、小分子物质(氨基酸、葡萄糖等)和第二信使(环磷酸腺苷、环磷酸鸟苷、钙离子)等可以通过缝隙连接在细胞间进行自由传递, 即发挥缝隙连接通讯 (gap junction intercellular communication) 功能[1, 2]。研究表明, 缝隙连接通讯在同步细胞活动、维持细胞内环境稳定、调控细胞生长发育等生命过程中发挥十分重要的作用[3, 4]。缝隙连接功能的异常是多种疾病的病理基础。作为脑组织中数量最多的细胞, 星形胶质细胞 (astrocyte) 中存在大量缝隙连接蛋白 [5, 6]。研究证实, 在脑缺血性损伤中, 星形胶质细胞比神经元更能耐受脑缺血缺氧, 适度增生的星形胶质细胞对神经元的存活和功能恢复具有重要意义[7, 8]。因此, 脑缺血性损伤后星形胶质细胞自身存活与否直接影响神经元的活性及其突触再生, 进而影响到患者的临床治疗效果及康复情况。通过调节星形胶质细胞功能来促进神经生长和修复是一个重要的研究方向。
本实验利用原代培养的新生SD大鼠大脑皮层星形胶质细胞缺氧/复氧损伤模型, 模拟在体缺血/再灌注损伤, 观察细胞缝隙连接抑制剂18-α-甘草次酸(18-α-glycyrrhetinic acid, 18-α-GA) 及油酸酰胺对星形胶质细胞缺氧/复氧损伤的影响。
1 材料与方法 1.1 实验动物、主要试剂及仪器新生24 h内的SD大鼠, 雌雄不限, 由蚌埠医学院实验动物中心提供。胎牛血清、DMEM/F12培养基、荧光染料calcein-AM及 CM-Dil 购自美国Gibco公司; 18-α-GA及胰酶购自美国Sigma公司; 兔抗鼠神经胶质纤维酸性蛋白(GFAP)多克隆抗体、异硫氰酸荧光素(FITC)标记山羊抗兔IgG二抗购自北京中杉金桥生物技术有限公司。仪器包括二氧化碳培养箱(Thermo 3111)、缺氧培养箱(Thermo 3131)、倒置显微镜(XPS-1B)、超净工作台(SW-CJ-IF)、数显振荡培养箱(BS-1E)等。
1.2 大鼠大脑皮质星形胶质细胞的原代培养和纯化参照课题组前期报道的实验方法[9], 取新生24 h内的SD大鼠, 无菌条件下取脑, 分离大脑皮质, 用D-Hanks液洗两次, 剪成糜状后, 用0.125%胰酶37 ℃消化15 min, 用含有10%胎牛血清的 DMEM/F12 培养基终止消化, 轻轻吹打, 以894.4×g离心力离心5 min, 弃上清液, 加入含10%胎牛血清的DMEM /F12培养基混悬细胞沉淀, 接种于培养瓶, 置于二氧化碳培养箱差速贴壁法培养 30 min后, 取上清液接种于细胞培养瓶中, 置于37℃、5%二氧化碳饱和湿度条件下继续培养。第2天更换培养液, 以后每3 d更换培养液。培养7~ 10 d待细胞分层生长后, 置于37 ℃恒温摇床中250 r/min振荡18 h, 弃上清液, D-Hanks液洗涤后, 进行传代培养。取纯化后传代2~3次的细胞, 接种至多聚赖氨酸包被的盖玻片上, 继续培养。待细胞生长稳定后, 进行星形胶质细胞特异性蛋白GFAP免疫荧光染色。GFAP标记呈绿色荧光者为星形胶质细胞, DAPI标记呈蓝色者为细胞核。多个标本从上、下、左、右4个方向分别选取4个视野计数绿色荧光和蓝色荧光细胞, 将绿色荧光细胞数量占蓝色荧光细胞数量的比值作为星形胶质细胞的GFAP阳性率, 并进行细胞纯度鉴定, 取纯度在95%以上的细胞进行研究。
1.3 实验分组及处理实验分为正常对照组、空白对照组、18-α-GA组和油酸酰胺组。各组细胞先用含10%胎牛血清的DMEM/F12培养液, 37 ℃、5%二氧化碳恒温、恒湿培养。空白对照组缺氧时, 则把培养液更换为无血清、无糖的DMEM-F12(1∶1)培养液, 移至缺氧培养箱(94%氮气、5%二氧化碳、1%氧气)内培养8 h, 复氧时, 即把培养液换为含10%胎牛血清的DMEM/F12培养液, 37 ℃、5%二氧化碳恒温、恒湿继续培养24 h。18-α-GA组和油酸酰胺组细胞与空白对照组的差异仅为在复氧培养开始时分别向培养液内加入终浓度为10 μmol/L的18-α-GA和25 μmol/L的油酸酰胺, 两药的给药浓度参考本课题组前期研究结果[10]并结合预实验结果确定。正常对照组细胞则用含10%胎牛血清的DMEM/F12培养液, 37 ℃、5%二氧化碳恒温、恒湿持续培养相应时间。
1.4 细胞接种荧光示踪法(Parachute assay)测定星形胶质细胞间的缝隙连接通讯功能[10]取无血清培养基, 向每毫升该培养基中加入10 μL 25 μmol/L calcein-AM 和50 μmol/L CM-Dil并混匀, 制备成荧光负载液体。向接种于6孔培养板中的各组细胞加入上述荧光负载液体, 置于5%二氧化碳、37℃培养箱中培养30 min。吸去负载液, 磷酸盐缓冲液(PBS)冲洗3次。胰酶消化后收集该孔细胞, 将细胞浓度稀释至500/mL, 制成 “供体细胞”液。其余各孔细胞作为“接受细胞”, 移去培养液, PBS冲洗1次。分别加入“供体细胞”液, 1 mL/孔。置于5%二氧化碳、37 ℃培养箱中培养4 h。在倒置荧光显微镜下, 计数一个“供体细胞”周围含Calcein-AM的“接受细胞”的数量, 作为判断缝隙连接通讯功能的指标[9, 10, 11]。实验重复5次(n=5)。各组按正常对照组的细胞荧光传递的结果进行标准化处理(即设定正常对照组“供体细胞”周围的“接受细胞”的数量为1)[11]。
1.5 MTT法检测细胞存活率取对数生长期细胞, 用0.25%胰酶消化后, 悬浮于DMEM/F12培养基中, 玻璃吸管轻轻吹打至单细胞悬液, 调整细胞终浓度为5×104/mL, 接种于96孔板, 每孔接种细胞200 μL, 同时设立空白对照。细胞接种后, 将96孔板置于37 ℃、5%二氧化碳的饱和湿度培养箱中培养, 至细胞密度达到60%~70% 后, 各组细胞分别按上述分组处理方法进行相应处理。每组设5个复孔, 实验重复5次(n=5)。经相应处理后的细胞, 每孔加入5 mg/mL MTT 15 μL, 继续孵育4 h。4 h后缓慢地吸去孔内培养液, 每孔加入150 μL 二甲基亚砜, 于微量震荡器上轻轻震荡10 min, 在酶联免疫检测仪上测定各孔的吸光度值, 波长设为490 nm, 以空白对照比色调零, 并计算细胞的存活率。
1.6 流式细胞术检测细胞凋亡取对数生长期的细胞, 胰酶消化后, 吹打至单细胞悬液, 调整细胞终浓度为10×104/mL, 接种于12孔板, 每孔接种细胞1 mL, 同时设立阴性对照。按上述分组处理方法进行相应处理后, 用预冷的PBS(0.01 mol/L, pH 7.2)洗细胞1次, 胰酶消化, 以3577.6×g离心力离心5 min, PBS洗2次。收集约(1~5)×104个细胞。吹打细胞悬浮于300 μL 结合缓冲液悬浮液中, 加入3 μL AnnexinV-FITC混匀5 min后, 加入3 μL 碘化丙啶(PI), 混匀, 在室温下, 避光反应5~15 min。用流式细胞仪检测各组细胞凋亡。
1.7 Hoechst 33258 荧光染色法检测细胞凋亡以2×105/mL的密度将细胞接种于6孔板, 6孔板每孔内预先放置消毒后的盖玻片, 置于37 ℃、5%二氧化碳培养箱孵育后按实验分组进行相应处理。待细胞长满盖玻片后, 弃去原培养基, 0.01 mol/L PBS 洗3 min 1 次, 4%多聚甲醛摇床上固定10 min, 0.01 mol/L PBS 洗 5 min×2 次。每孔加入0.5 mL Hochest 33258, 染色30 min, 0.01 mol/L PBS 洗 5 min×2 次。荧光显微镜下紫外光激发观察细胞核的改变。正常细胞的细胞核呈现均匀蓝色荧光, 凋亡细胞则呈现细胞核碎裂、浓缩等表现。随机视野下在100个细胞中计数凋亡细胞数, 计算细胞凋亡率。
1.8 统计学分析
实验结果使用SPSS 11.5软件进行分析, 统计图表采用Sigma Plot 10.0软件绘制。计量资料数据用均数±标准差(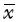 ±s)表示。呈正态分布的数据两组间比较用t检验; 多组间比较用单因素方差分析, 组间比较采用LSD-t法。以P<0.05为差异有统计学意义。
±s)表示。呈正态分布的数据两组间比较用t检验; 多组间比较用单因素方差分析, 组间比较采用LSD-t法。以P<0.05为差异有统计学意义。
星形胶质细胞的免疫荧光染色结果见图1, 其阳性率为97.5%±1.7%。
|
| A: 绿色荧光为星形胶质细胞 (GFAP染色); B: 蓝色荧光为细胞核(DAPI染色). 图1 星形胶质细胞免疫荧光染色结果 Fig.1 Immunofluorescence staining of astrocytes |
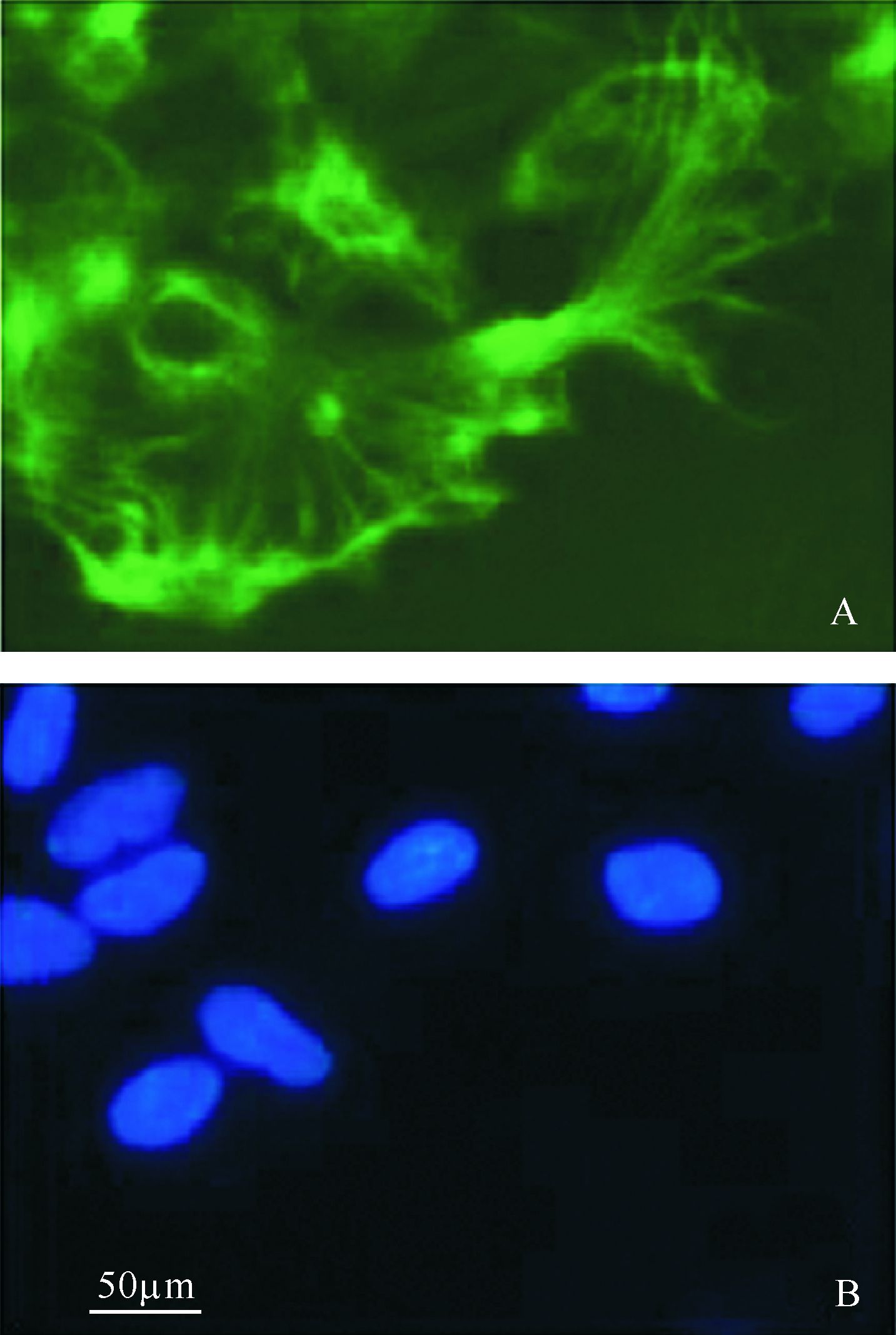
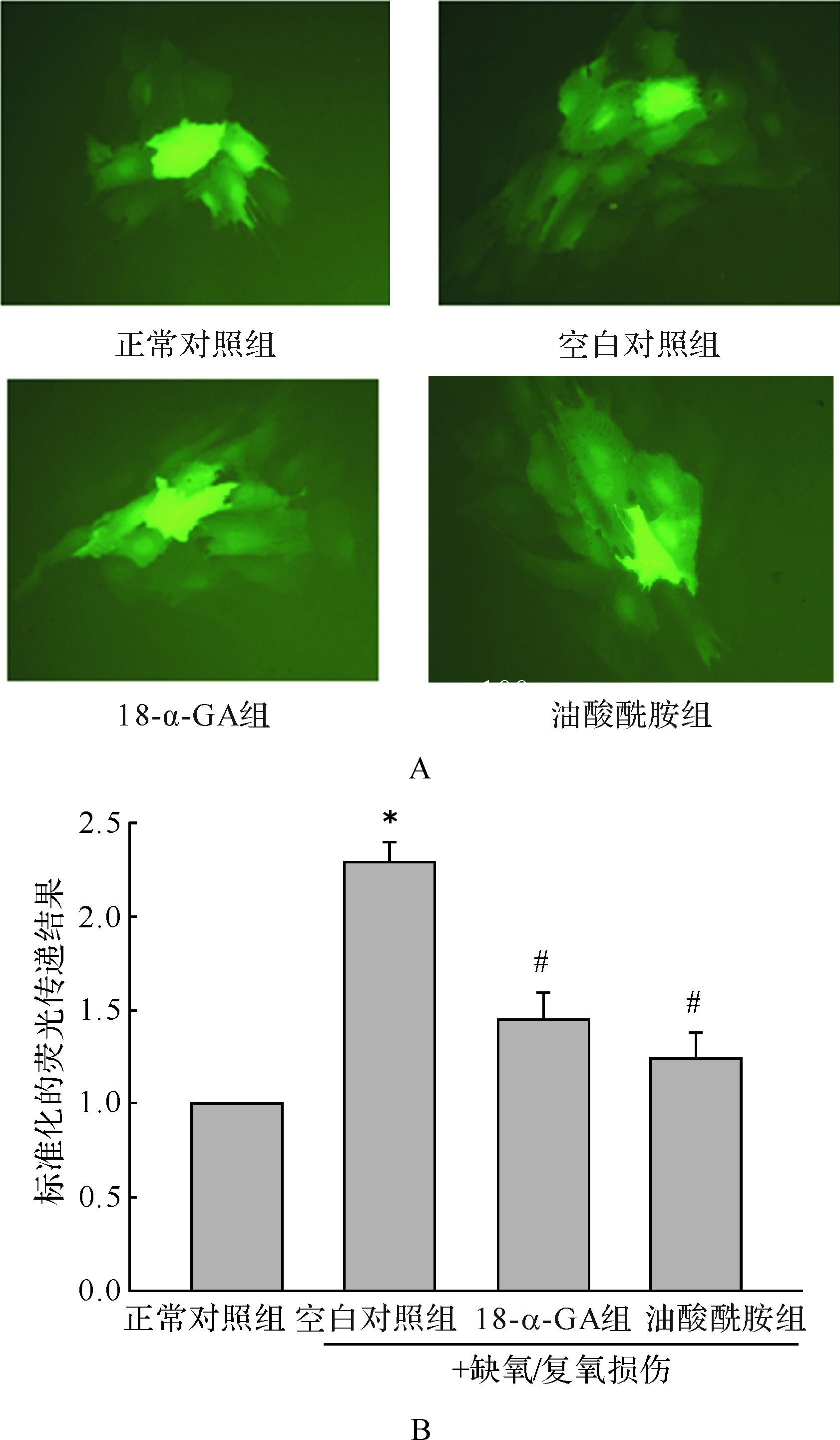
如图2所示, 细胞荧光传递结果空白对照组为2.29±0.04, 18-α-GA组和油酸酰胺组分别为1.39±0.13和1.31±0.12。与正常对照组比较, 缺氧/复氧损伤可使星形胶质细胞的缝隙连接通讯功能增强(P<0.01); 与空白对照组比较, 18-α-GA和油酸酰胺则减弱缺氧/复氧损伤引起的缝隙连接功能增强作用(均P<0.01)。
|
| A: 各组细胞图片中间含高亮度荧光的细胞为“供体细胞”, 其周围细胞接受荧光传递的“接受细胞”. B: 以正常对照组细胞荧光传递的结果为1, 对各组细胞荧光传递的结果进行标准化的结果. 与正常对照组比较, *P< 0.01; 与空白对照组比较, #P < 0.01. n=5. 图2 缝隙连接抑制剂对缺氧/复氧损伤星形胶质细胞荧光传递的影响 Fig.2 Effect of gap junctional inhibitors on dye spread of astrocytes induced with hypoxia/reoxygen determined by Parachute assay |
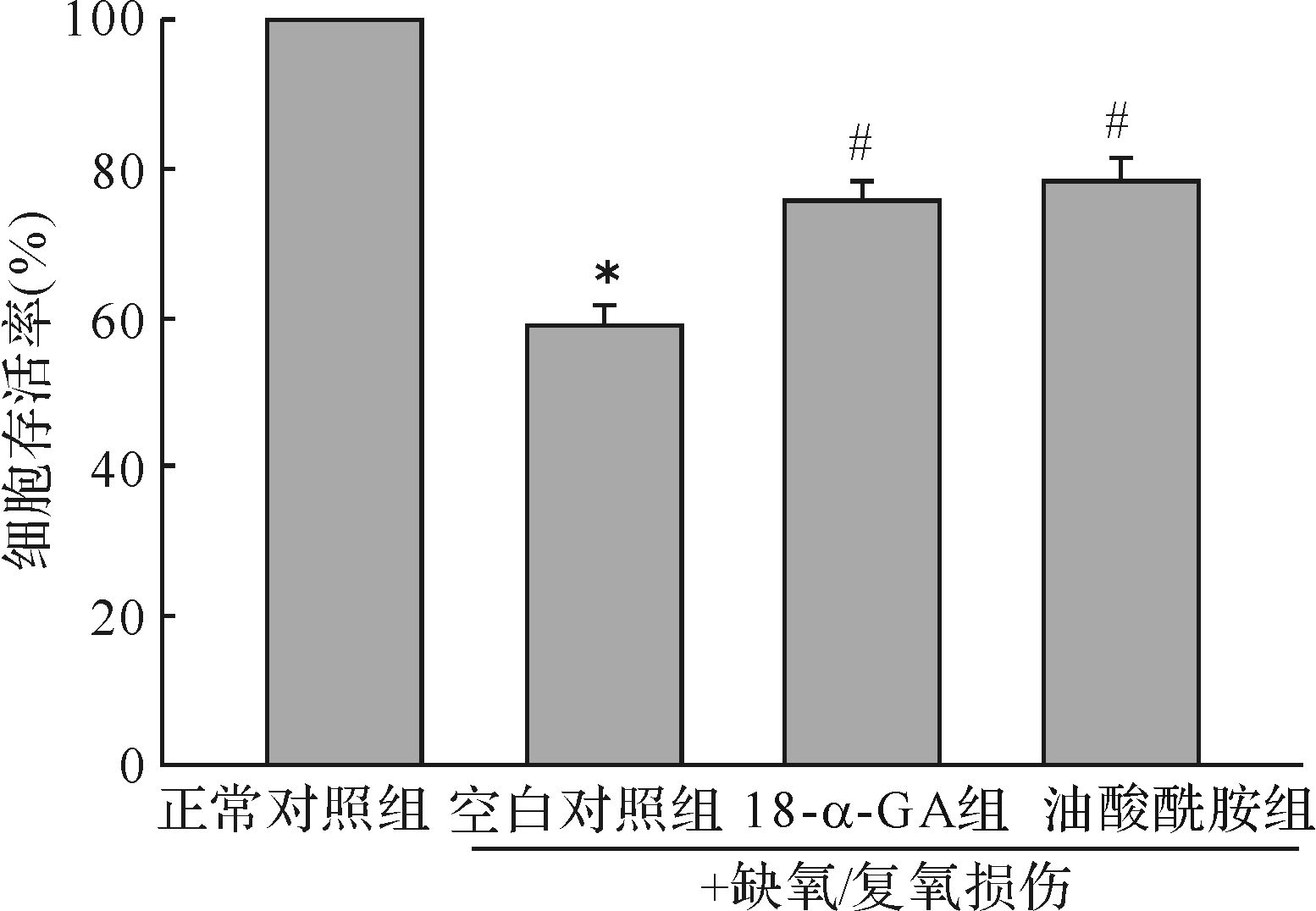
MTT法检测结果显示(图3), 与正常对照组比较, 缺氧/复氧损伤可使星形胶质细胞存活率明显降低(P<0.01); 与空白对照组比较, 18-α-GA组及油酸酰胺组星形胶质细胞的存活率明显提高(均P<0.01)。
|
| 与正常对照组比较, *P< 0.01;与空白对照组比较, ##P<0.01. n=5. 图3 缝隙连接抑制剂对缺氧/复氧损伤星形胶质细胞存活率的影响 Fig.3 Effects of gap junctional inhibitors on the survival of cells induced with hypoxia/reoxygen determined by MTT assay |
Annexin V/PI 双染流式细胞术结果显示, 原代培养的新生SD大鼠星形胶质细胞经缺氧8 h/复氧24 h后, 细胞凋亡率较正常对照组细胞凋亡率明显增加(31.8 %± 3.4%与6.5 %± 0.8%, P<0.01), 而18-α-GA组和油酸酰胺组的细胞凋亡率分别为13.9 %± 2.1%和10.6 %± 1.3%, 显著低于空白对照组(均P<0.01)。
Hoechst 33258荧光染色法的结果见图4, 统计结果表明, 原代培养的新生SD大鼠星形胶质细胞经缺氧8 h/复氧24 h处理后的细胞凋亡率较正常对照组增加(23.6%±3.1 %与3.7%±0.6 %, P<0.01); 而18-α-GA组及油酸酰胺组细胞凋亡率则分别为14.7%±1.6%和12.8%±1.3%, 低于空白对照组(均P<0.01)。
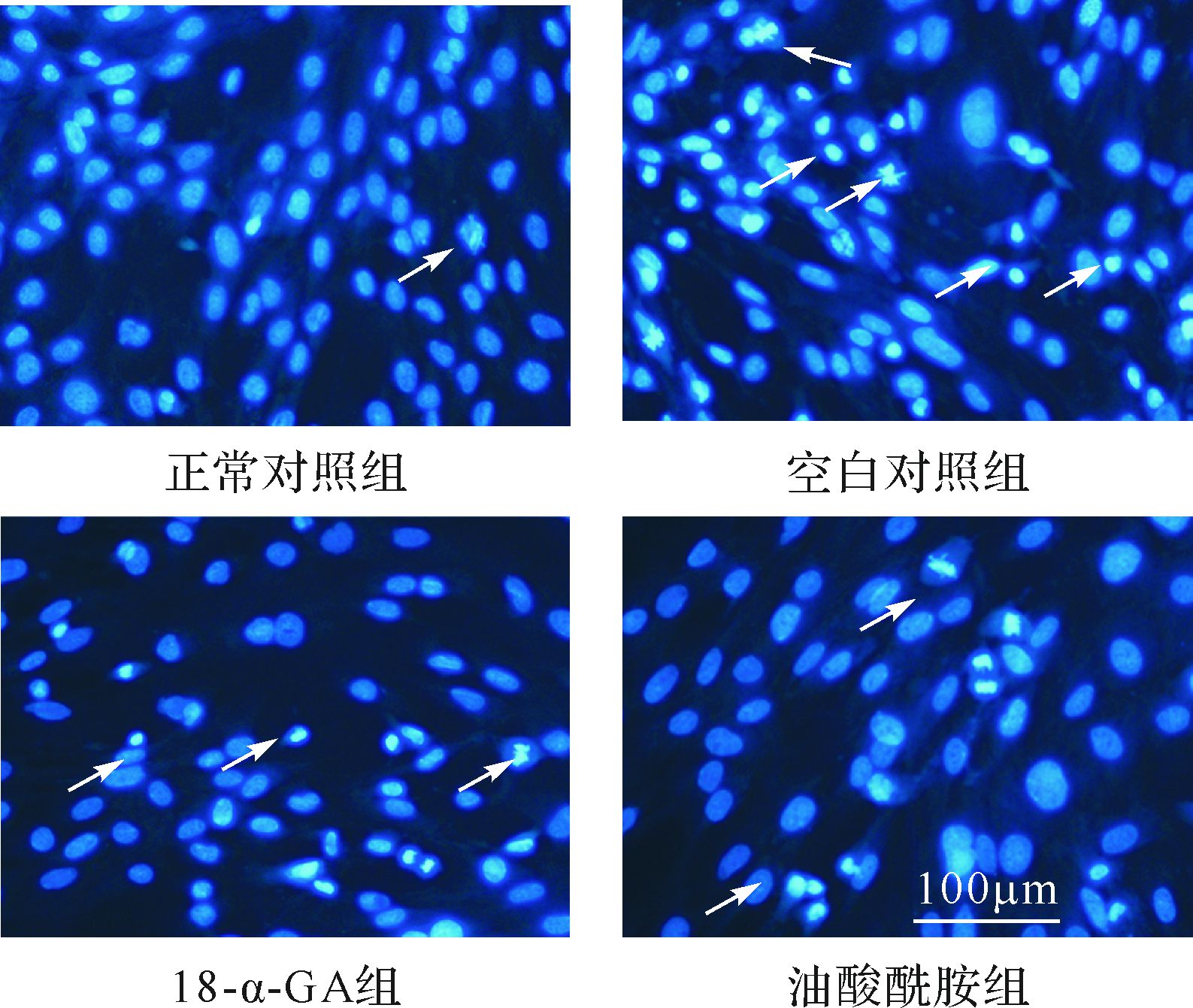
|
| 正常细胞的细胞核呈现均匀蓝色荧光; 凋亡细胞呈现细胞核碎裂、浓缩等表现(箭头所示). 图4 缝隙连接抑制剂对缺氧/复氧损伤星形胶质细胞凋亡率的影响(Hoechst 33258染色) Fig.4 Effect of gap junctional inhibitors on the apoptosis induced with hypoxia/reoxygenation determined by Hoechst 33258 staining |
以上两种凋亡检测结果表明, 缺氧/复氧损伤可明显诱导细胞凋亡, 而18-α-GA及油酸酰胺可明显减少缺氧/复氧损伤诱导的细胞凋亡。
3 讨 论缺氧/复氧损伤是指遭受一定时间缺氧的组织细胞恢复氧供应后, 组织损伤程度增剧的情况, 是组织器官缺血/再灌注损伤的研究常用的体外模型, 这类损伤的发生与钙离子超载、氧自由基形成、线粒体损伤等有关[12]。大量研究证明, 缝隙连接通讯功能异常与包括脑缺血在内的多种中枢神经系统疾病的发生、发展有密切的联系[13, 14, 15]。星形胶质细胞是脑组织中数量最多的细胞, 表达丰富的缝隙连接蛋白, 其中以Cx43为主。星形胶质细胞间通过缝隙连接通讯进行细胞间信息通讯交流, 在脑代谢调节方面发挥重要的作用。
正常情况下, 星形胶质细胞网络从血液循环中摄取能源物质并通过缝隙连接通讯传递、分发给神经元, 维持神经细胞内外环境的稳定及某些功能。与神经元相比, 星形胶质细胞对缺氧的耐受性更强, 在缺血的早期, 缝隙连接的开放有利于星形胶质细胞向周围缺氧的神经元传递能量, 对神经元起到保护作用, 而持续较长时间的缺血, 缺 氧中心区域细胞内的腺苷三磷酸 迅速消耗, 附近仍存活的星形胶质细胞将腺苷三磷酸、葡萄糖等营养物质继续通过缝隙连接通讯运送给受损的细胞, 导致更多的细胞因能量短缺而受损[16, 17]。此外, 缺血性疾病发生时, 一些损伤性的因素通过缝隙连接通讯作用在细胞之间进行传递, 导致缺血毗邻区的细胞损伤加重, 损伤范围扩大[18, 19]。脑缺血后兴奋性氨基酸产生增多、自由基和细胞色素C释放、线粒体损伤, 这些有害信号通过缝隙连接通讯传播到半暗带激活细胞凋亡基因, 启动细胞凋亡程序[20]。
本实验中, 我们建立了原代培养的星形胶质细胞缺氧/复氧损伤模型, 模拟体外脑缺血/再灌注损伤, 进一步观察缝隙连接抑制剂18-α-GA和油酸酰胺对缺氧/复氧损伤星形胶质细胞缝隙连接通讯功能和细胞生长及凋亡的影响并探讨了可能机制。结果表明, 缺氧8 h /复氧24 h可致星形胶质细胞间缝隙连接通讯功能增强, 星形胶质细胞活性降低, 而缝隙连接抑制剂18-α-GA和油酸酰胺可明显抑制星形胶质细胞的缝隙连接通讯功能, 从而显著提高受损星形胶质细胞的存活率; 此外, 18-α-GA和油酸酰胺可显著减少缺氧/复氧损伤星形胶质细胞凋亡。
缺氧/复氧损伤时星形胶质细胞的缝隙连接通讯功能增强, 使星形胶质细胞间借助缝隙连接的相互影响, 使垂死细胞的损伤因子、有害代谢产物和凋亡信号等在神经元间传递, 而使凋亡细胞增加, 细胞存活率降低, 而缝隙连接抑制剂18-α-GA和油酸酰胺的使用可阻断这种凋亡信号及一些未知的神经毒性物质的传导[17], 减少凋亡细胞对正常细胞的影响, 从而减轻缺氧/复氧损伤引起细胞活性的降低, 起到神经保护作用[21,22] 。
综上所述, 抑制缝隙连接通讯功能对缺氧/复氧损伤引起的星形胶质细胞损伤具有良好的保护作用, 其机制可能与抑制星形胶质细胞间的缝隙连接通讯功能, 减轻缺氧/复氧损伤诱发的星形胶质细胞凋亡有关。
| [1] | MALONE P, MIAO H, PARKER A, et al. Pressure induces loss of gap junction communication and redistribution of connexin 43 in astrocytes[J]. Glia, 2007, 55(10):1085-1098. |
| [2] | LANGER J, STEPHAN J, THEIS M, et al. Gap junctions mediate intercellular spread of sodium between hippocampal astrocytes in situ[J]. Glia, 2012, 60(2):239-252. |
| [3] | TABERNERO A, MEDINA J M, GIAUME C. Glucose metabolism and proliferation in glia: role of astrocytic gap junctions[J]. J Neurochem, 2006, 99(4):1049-1061. |
| [4] | WIENCKEN-BARGER A E, DJUKIC B, CASPER K B, et al. A role for connexin43 during neurodevelopment[J]. Glia, 2007, 55(7):675-686. |
| [5] | 牛 非, 胡金凤, 苑玉和, 等. 星形胶质细胞在脑缺血中的变化和作用[J]. 中国药理学通报, 2011, 27(10):1342-1345. NIU Fei, HU Jin-feng, YUAN Yu-he, et al. Change and role of astrocyte in cerebral ischemia [J]. Chinese Pharmacological Bulletin, 2011, 27(10), 1342-1345. (in Chinese) |
| [6] | CHEW S S, JOHNSON C S, GREEN C R, et al. Role of connexin43 in central nervous system injury[J]. Exp Neurol, 2010, 225(2):250-261. |
| [7] | ESCARTIN C, BONVENTO G. Targeted activation of astrocytes: a potential neuroprotective strategy[J]. Mol Neurobiol, 2008, 38(3):231-241. |
| [8] | SALMINA A B. Neuron-glia interactions as therapeutic targets in neurodegeneration[J]. J Alzheimers Dis, 2009, 16(3):485-502. |
| [9] | 董淑英, 童旭辉, 蒋国君, 等. 星形胶质细胞中缝隙连接蛋白connexin 43的表达及其功能调控[J]. 南方医科大学学报, 2012, 32(10):1423-1426. DONG Shu-ying, TONG Xu-hui, JIANG Guo-jun, et al. Expression of connexin43 and functional modulation of gap junction in neonatal rat astrocytes in vitro [J]. Journal of Southern Medical University, 2012, 32(10):1423-1426. (in Chinese) |
| [10] | 童旭辉, 董淑英, 蒋国君, 等. 缝隙连接蛋白Cx26/Cx32对依托泊苷抗肿瘤作用的影响[J]. 南方医科大学学报, 2012, 32(3):329-332. TONG Xu-hui, DONG Shu-ying, JIANG Guo-jun, et al. Influence of Cx26/Cx32 gap junction channel on antineoplastic effect of etoposide in Hela cells [J]. Journal of Southern Medical University, 2012, 32(3):329-332. (in Chinese) |
| [12] | BAGAI A, DANGAS G D, STONE G W, et al.Reperfusion strategies in acute coronary syndromes[J]. Circ Res, 2014, 114(12):1918-1928. |
| [13] | QUINTANILLA R A, ORELLANA J A, VON BERNHARDI R.Understanding risk factors for Alzheimers disease: interplay of neuroinflammation, connexin-based communication and oxidative stress[J]. Arch Med Res, 2012, 43(8):632-644. |
| [14] | 姚丽芬, 王真奎, 王真刚, 等. 缝隙连接蛋白Cx32、Cx43在难治性颞叶癫痫患者脑中表达的研究[J]. 中华医学杂志, 2009, 89(43):3058-3060. YAO Li-fen, WANG Zhen-kui, WANG Zhen-gang, et al. Expression and function of Cx32 and Cx43 junctions in medically intractable temporal lobe epilepsy in human[J]. National Medical Journal of China, 2009, 89(43):3058-3060. (in Chinese) |
| [15] | 唐 容, 蒋丽萍, 洪 涛. 缝隙连接蛋白与神经胶质瘤[J]. 中国药理学通报, 2012, 28(12):1648-1651. TANG Rong, JIANG Li-ping, HONG Tao. Connexin43 and glioma [J]. Chinese Pharmacological Bulletin, 2012, 28(12):1648-1651. (in Chinese) |
| [16] | BELOUSOV A B, FONTES J D. Neuronal gap junctions: making and breaking connections during development and injury [J]. Trends Neurosci, 2013, 36(4):227-236. |
| [17] | CONTRERAS J E, SNCHEZ H A, EUGENIN E A, et al. Metabolic inhibition induces opening of unapposed connexin43 gap junction hemichannels and reduces gap junctional communication in cortical astrocytes in culture[J]. Proc Natl Acad Sci USA, 2002, 99(1):495-500. |
| [18] | MINAMINO T. Gap junctions mediate the spread of ischemia-reperfusion injury[J]. Circ J, 2009, 73(9):1591-1592. |
| [19] | SHINTANI-ISHIDA K, UNUMA K, YOSHIDA K. Ischemia enhances translocation of connexin43 and gap junction intercellular communication, thereby propagating contraction band necrosis after reperfusion[J]. Circ J, 2009, 73: 1661-1668. |
| [20] | 吴其艳, 张金英, 邓子辉, 等. 瘦素对小鼠局灶性脑缺血再灌注损伤的保护作用及表达Cx43的影响[J]. 四川大学学报 (医学版), 2012, 43(3):314-318. WU Qi-yan, ZHANG Jin-yin, DENG Zi-hui, et al. The effect of leptin on cx43 expression in protecting rat cerebral ischemia/reperfusion injury [J]. Journal of Sichuan University (Medical Sciences Edit), 2012, 43(3):314-318. (in Chinese) |
| [21] | RAMI A, VOLKMANN T, WINCKLER J.Effective reduction of neuronal death by inhibiting gap junctional intercellular communication in a rodent model of global transient cerebral ischemia[J]. Exp Neurol, 2001, 170(2):297-304. |
| [22] | 张光运, 段 丽, 饶志仁, 等. 甘珀酸对大鼠脑皮质缺血后神经元损伤的影响[J]. 第四军医大学学报, 2004, 25 (12):1092-1094. ZHANG Guang-yun, DUAN Li, RAO Zhi-ren, et al. Effects of carbenoxolone on neuron injury induced by focal cerebral infact [J]. Journal of Fourth Military Medical University, 2004, 25 (12):1092-1094. (in Chinese) |



