2. 浙江万晟药业有限公司, 浙江 杭州 310013
3. 浙江大学城市学院药物研究所, 浙江 杭州 310015
2. Zhejiang Wansheng Pharmaceutical Co. Ltd., Hangzhou 310013, China;
3. Institute of Materia Medica, Zhejiang University City College, Hangzhou 310015, China
中药穿山龙为薯蓣科植物穿龙薯蓣(Dioscorea nipponica Makino) 的干燥块茎, 性甘、苦、温, 归肝、肾、肺经, 具有祛风除湿、舒筋活络、活血止痛和止咳平喘等作用, 用于治疗风湿痹病、关节肿胀、疼痛麻木、跌扑损伤、闪腰岔气、咳嗽气喘等症[1]。现代药理学研究表明, 穿山龙具有改善冠状动脉循环、增加冠状动脉流量、抗动脉粥样硬化、调节免疫、镇咳、祛痰、平喘、抗炎镇痛等作用[2, 3]。近年来, 对穿山龙提取方法、药理作用等的研究报道也比较多[4, 5, 6, 7, 8]。
穿山龙已经在中医临床实践中用于治疗高尿酸血症[9]以及由此引起的痛风性关节炎[10], 但这方面的动物实验研究报道尚不多见。本文分别用次黄嘌呤灌胃同时皮下注射氧嗪酸钾及仅皮下注射尿酸的方法建立小鼠高尿酸血症模型, 考察穿山龙的降血尿酸作用。
1 材料与方法 1.1 实验动物实验用动物为清洁级18~22 g雄性ICR小鼠80只, 购自浙江省医学科学院〔动物生产许可证号: SCXK(浙)2008-0033〕。
1.2 仪器与试剂PL2001-L电子天平、AL204电子天平, 梅特勒-托利多仪器有限公司; 安捷伦 HPLC 1200高效液相色谱仪; BUCHI R-210旋转蒸发仪; BECKMAN 64R高速离心机。穿山龙饮片(批号090804), 杭州医药股份有限公司; 薯蓣皂苷对照品(批号111707-200501), 中国药品生物制品检定所; 尿酸(纯度99%, 批号STBB7849V)和氧嗪酸钾(纯度97.5%, 批号9B0F01), Sigma-Aldrich公司; 次黄嘌呤(纯度>99%, 美国SigmaH-9377), 杭州昊天生物技术有限公司; 色谱甲醇(批号1105066), 美国TEDIA 天地试剂公司; 乙酸(分析纯, 批号20060309), 杭州化学试剂有限公司; 别嘌醇片(批号090102), 重庆青阳药业有限公司; 苯溴马隆片(批号100861), 德国舒曼大药厂; 其他试剂均为分析纯。
1.3 穿山龙醇提取物的制备薯蓣皂苷是穿山龙降血尿酸的有效成分, 也是中国药典规定的指标成分[1]。由于薯蓣皂苷在醇提取物中的含量明显高于水提取物中的含量, 因此选择乙醇溶液作为提取溶媒。称取一定量穿山龙饮片, 用10倍量(V/W)的80%乙醇(V/V)回流提取2次, 每次2 h。合并提取液, 旋转蒸发浓缩至近干, 用纯净水将浓缩后的穿山龙醇提取物稀释至0.54 g/mL, 备用。
1.4 小鼠高尿酸血症模型的建立模型A: 以1%羧甲基纤维素钠水溶液分别配制50 mg/mL次黄嘌呤混悬液和40 mg/mL氧嗪酸钾混悬液。参考文献[11], 采用次黄嘌呤混悬液10 mL/kg灌胃同时皮下注射氧嗪酸钾混悬液10 mL/kg的方法建立次黄嘌呤和氧嗪酸钾诱导的小鼠高尿酸血症模型。
模型B: 以1%羧甲基纤维素钠水溶液配制40 mg/mL尿酸混悬液。参考文献[12], 采用皮下注射尿酸混悬液10 mL/kg的方法建立尿酸诱导的小鼠高尿酸血症模型。
1.5 分组与给药根据引起小鼠高尿酸血症的不同机制选择合适的阳性对照药。次黄嘌呤是体内经黄嘌呤氧化酶等作用合成尿酸的重要原料, 可以增加小鼠体内尿酸合成, 而尿酸酶抑制剂氧嗪酸钾可以抑制尿酸在小鼠体内经尿酸酶降解, 两者合用能有效提高小鼠体内血尿酸水平, 黄嘌呤氧化酶抑制剂别嘌醇比较适合作为模型A的阳性对照药。苯溴马隆是促尿酸排泄药, 适合作为直接注射尿酸引起高尿酸血症的模型B的阳性对照药。
模型A: 将小鼠随机分为4组, 即空白对照组、模型A组、穿山龙醇提取物组、别嘌醇对照组, 每组10只。在造模后1 h按10 mL/kg剂量灌胃给药, 空白对照组和模型组给予相同体积的纯净水。参照《中国药典》(2010版)的穿山龙推荐剂量[1], 穿山龙醇提取物组给予5.4 g/kg(按生药量计)的穿山龙醇提取物, 别嘌醇对照组给予以1%羧甲基纤维素钠水溶液配制的10 mg/mL别嘌醇混悬液。小鼠阳性对照药剂量参照成人剂量按体表面积换算得到。
模型B: 将小鼠随机分为4组, 即空白对照组、模型B组、穿山龙醇提取物组、苯溴马隆对照组, 每组10只。除了阳性对照药改为以1%羧甲基纤维素钠水溶液配制的5 mg/mL苯溴马隆混悬液外, 其余给药方法同模型A。
1.6 外标法测定血尿酸含量[13]给药2 h(次黄嘌呤和氧嗪酸钾造模)或1.5 h(尿酸造模)后采血0.5 mL, 置肝素管中上下翻转摇匀, 3500 r/min离心5 min。取上清液100 μL于离心管中, 加入900 μL甲醇, 混匀后室温下超声20 min, 12 000 r/min离心10 min, 取上清液200 μL, 加入200 μL的0.2%乙酸溶液, 混匀后进样分析, 用外标法测定尿酸含量。
色谱条件: Phenomenex C18 POLAR-RP 80A 色谱柱(250 mm×4.60 mm, 4.6 μm); 流动相为0.2%乙酸溶液-甲醇(94∶6); 柱温为30 ℃; 流速为1.0 mL/min; 紫外检测波长为288 nm; 进样量为10 μL。经专属性、精密度、稳定性、线性关系、加样回收率等方法学验证, 该色谱条件符合定量测定的要求。
1.7 数据统计方法
采用SPSS 17.0统计软件进行单因素方差分析。数据呈正态分布, 以均数±标准差(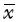 ±s)表示。两两间比较采用LSD-t检验。以P<0.05为差异有统计学意义。
±s)表示。两两间比较采用LSD-t检验。以P<0.05为差异有统计学意义。
空白对照组、模型A组、穿山龙醇提取物组和别嘌醇对照组的血尿酸水平如表1所示。
| (x±s) | |||||||||||||
| 组别 | n | 给药剂量 (g/kg) | 血清尿酸 水平 (μg/mL) | ||||||||||
| 空白对照组 | 10 | 0 | 4.08±1.47 | ||||||||||
| 模型A组 | 10 | 0 | 40.03±27.24* | ||||||||||
| 穿山龙醇提取物组 | 10 | 5.4 | 18.10±8.87# | ||||||||||
| 别嘌醇对照组 | 10 | 0.10 | 1.56±1.28 ## | ||||||||||
| 与空白对照组比较, *P<0.01; 与模型A组比较, #P<0.05, ##P<0.01. | |||||||||||||
上述实验结果显示, 穿山龙醇提取物组的血尿酸水平显著低于模型A组(P<0.05), 表明穿山龙醇提取物可以降低次黄嘌呤和氧嗪酸钾诱导的高尿酸血症小鼠的血尿酸水平。
2.2 穿山龙醇提取物对模型B小鼠血尿酸水平的影响空白对照组、模型B组、穿山龙醇提取物组和苯溴马隆对照组的血尿酸水平如表2所示。
| (x±s) | |||
| 组别 | n | 给药剂量 (g/kg) | 血清尿酸 水平(μg/mL) |
| 空白对照组 | 10 | 0 | 4.29±2.36 |
| 模型B组 | 10 | 0 | 18.57±3.83* |
| 穿山龙醇提取物组 | 10 | 5.4 | 15.36±2.71# |
| 苯溴马隆对照组 | 10 | 0.05 | 6.38±2.19 ## |
| 与空白对照组比较, *P<0.01; 与模型B组比较, #P<0.05, ## P<0.01. | |||
上述实验结果显示, 穿山龙醇提取物组的血尿酸水平显著低于模型B组(P<0.05), 表明穿山龙醇提取物可以降低尿酸诱导的高尿酸血症小鼠的血尿酸水平。
3 讨 论痛风是一种由于嘌呤代谢紊乱所致的疾病, 其临床特点为高尿酸血症及由此而引起的急性痛风性关节炎反复发作, 还可引起慢性间质性肾炎和尿酸肾结石形成。近年来, 随着人们生活水平的提高, 饮食结构发生变化, 糖、脂肪、蛋白质的摄入量明显增加, 高尿酸血症和痛风的发病率迅速增加, 严重危害人们的健康。 目前我国临床常用的抗痛风类药物是秋水仙碱、别嘌呤、丙磺舒和苯溴马隆等西药。这些药物都有较大的毒副作用。在中药宝库中寻找和筛选疗效确切、毒副作用小的降血尿酸药物很有意义。
吕婧等[6]研究了穿山龙水提取物对尿酸钠诱导的Wistar 大鼠急性痛风性关节炎的治疗作用, 结果表明穿山龙可以减轻急性痛风性关节炎的关节肿胀程度, 降低血浆中白细胞数量和血清中白细胞介素1β含量。周琦等[14]研究了穿山龙总皂苷对尿酸酶抑制剂奥替拉西钾诱导的高尿酸血症昆明小鼠的降血尿酸作用, 结果表明穿山龙总皂苷可显著降低高尿酸血症小鼠血清尿酸水平, 同时降低血清黄嘌呤氧化酶和腺苷脱氨酶活性并回调肾组织阴离子转运体1的表达量。由于黄嘌呤氧化酶和腺苷脱氨酶是参与尿酸形成的关键酶, 而肾组织阴离子转运体1是尿酸分泌的重要转运体, 因此, 穿山龙总皂苷可能通过抑制黄嘌呤氧化酶和腺苷脱氨酶活性而降低尿酸生成, 以及通过提高肾组织阴离子转运体1的表达而促进尿酸的排泄。
中药由于其成分复杂, 通常体现出多成分、多靶点的药理作用特点。本文的研究结果显示: 穿山龙醇提取物对直接注射尿酸诱导的小鼠高尿酸血症有显著的降血尿酸效果, 提示其可能具有促进尿酸排泄的作用; 穿山龙醇提取物对次黄嘌呤和氧嗪酸钾诱导的小鼠高尿酸血症同样有显著的降血尿酸效果, 提示穿山龙醇提取物可能也具有抑制黄嘌呤氧化酶活性的作用。穿山龙醇提取物含有薯蓣皂苷等成分, 与周琦等[14]提出的穿山龙总皂苷降血尿酸作用机制一致。吕婧等[6]和周琦等[14]的研究结果还显示, 穿山龙水提取物和穿山龙总皂苷的药效具有一定的剂量依赖性。穿山龙醇提取物对降血尿酸作用的影响是否也有类似的剂量依赖性有待进一步研究。
| [1] | 国家药典委员会. 中华人民共和国药典(一部)[M].北京: 中国医药科技出版社, 2010, 250-251. Membership of the Pharmacopoeia Commission of the Peoples Republic of China. Pharmacopoeia of the Peoples Republic of China (Part Ⅰ) [M].Beijing: Chinese Medical Science and Technology Press, 2010: 250-251. (in Chinese) |
| [2] | 楼芳嫣. 中药穿地龙的研究进展[J]. 中国药师, 2010, 13(7):1041-1043. LOU Fang-fan. Advance of the study on Rhizoma Dioscorea Nipponica Makino [J]. China Pharmacist, 2010, 13(7):1041-1043. (in Chinese) |
| [3] | 张伟锋, 刘宝山. 薯蓣皂苷的药理作用研究进展[J]. 世界中西医结合杂志, 2010, 5(6):543-545. ZHANG Wei-feng, LIU Bao-shan. Advance in the study on pharmacological activities of dioscin [J]. World Journal of Integrated Traditional and Western Medicine, 2010, 5(6):543-545. (in Chinese) |
| [4] | 王 俊, 杨克迪, 陈 钧. 超临界CO2萃取穿山龙中薯蓣皂苷元的研究[J]. 中国药学杂志, 2003, 38(8):580-583. WANG Jun, YANG Ke-di, CHEN Jun. Study on supercritical-CO2 extraction of diosgenin from Dioscorea nipponica [J]. Chinese Pharmaceutical Journal, 2003, 38(8):580-583. (in Chinese) |
| [5] | 徐雄良, 柯尊洪, 张志荣. 正交试验法优选穿山龙总皂苷的提取工艺[J]. 华西药学杂志, 2003, 18(2):95-98. XU Xiong-liang, KE Zun-hong, ZHANG Zhi-rong. Orthogonal test for optimization of extracting procedure to total saponins from Rhizoma Dioscoreae Nipponicae [J]. West China Journal of Pharmaceutical Sciences, 2003, 18(2): 95-98. (in Chinese) |
| [6] | 吕 婧, 苗志敏, 阎胜利, 等. 穿山龙治疗急性痛风性关节炎的效果[J]. 青岛大学医学院学报, 2009, 45(4):389-391. LU Jing, MIAO Zhi-min, YAN Sheng-li, et al. The effect of Dioscorea Nipponica Makino on rats with acute gouty arthritis [J]. Acta Aacademiae Medicinae Qingdao Universitatis, 2009, 45(4):389-391. (in Chinese) |
| [7] | 赵 璐, 王铁杰, 程 磊, 等. 穿山龙指纹图谱及其抑制人肝癌HepG2细胞增殖活性相关性研究[J]. 沈阳药科大学学报, 2013, 30(5):366-373. ZHAO Lu, WANG Tie-jie, CHENG Lei, et al. HPLC fingerprint analysis of Dioscorea nipponica Mak.and the correlation with its anticancer activity on human HepG2 cell [J]. Journal of Shenyang Pharmaceutical University, 2013, 30(5): 366-373. (in Chinese) |
| [8] | 陈新焰, 许 凤, 赵世华, 等. 穿山龙对胰岛素抵抗糖尿病大鼠血糖改善作用及其机制[J]. 辽宁中医药大学学报, 2009, 11(9):156-159. CHEN Xin-yan, XU Feng, ZHAO Shi-hua, et al. Observation of Dioscorea Nipponica Makino in the treatment of diabetic rat [J]. Journal of Liaoning University of Traditional Chinese Medicine, 2009, 11(9):156-159. (in Chinese) |
| [9] | 赵明成, 谷慧敏, 陈 伟, 等. 浊瘀清汤治疗高尿酸血症64例[J]. 中医研究, 2012, 25(4):21-23. ZHAO Ming-cheng, GU Hui-min, CHEN Wei, et al. Treatment for 64 cases of hyperuricemia by using Zhuo Yu Qing Tang[J]. Traditional Chinese Medicinal Research, 2012, 25(4):21-23. (in Chinese) |
| [10] | 高 菁, 李 靖, 于秀辰, 等. 商宪敏教授论治痛风经验[J]. 北京中医药大学学报 (中医临床版), 2005, 12(3):30-31. GAO Jing, LI Jing, YU Xiu-chen. The experience of Professor Shang Xian-min on treating gout [J]. Journal of Beijing University of Traditional Chinese Medicine (Clinical Medicine), 2005, 12(3):30-31. (in Chinese) |
| [11] | 徐 立, 时 乐. 小鼠代谢性高尿酸血症模型的复制方法初探[J]. 中国比较医学杂志, 2006, 16(1):1- 4. XU Li, SHI Le. A preliminary study on the establishment of a mouse model of hyperuricemia [J]. Chinese Journal of Comparative Medicine, 2006, 16(1):1- 4. (in Chinese) |
| [12] | 陈光亮, 孙秀霞, 王钦茂, 等. 小鼠高尿酸血症模型的研究[J]. 中国药理学通报, 2001, 17( 3):350-352. CHEN Guang-liang, SUN Xiu-xia, WANG Qin-mao, et al. Studies on mouse hyperuricemia model [J]. Chinese Pharmacological Bulletin, 2001, 17( 3) : 350-352. (in Chinese) |
| [13] | 王建平, 傅旭春, 白海波. 泽泻降血尿酸乙醇提取物的提取工艺研究[J]. 中国中药杂志, 2010, 35(14):1809-1811. WANG Jian-ping, FU Xu-chun, BAI Hai-bo. Study on extracting process of ethanol extract with hypouricemic effect from Rhizoma Alismatis[J]. China Journal of Chinese Materia Medica, 2010, 35(14):1809-1811. (in Chinese) |
| [14] | 周 琦, 张 翀, 于栋华, 等. 穿山龙总皂苷对高尿酸血症的降尿酸及细胞抗炎作用研究[J]. 中华中医药杂志, 2013, 28(5):1444-1448. ZHOU Qi, ZHANG Chong, YU Dong-hua, et al. Study on uric acid reducing effect of total saponins from Rhizoma Dioscoreae Nipponicae in treating hyperuricemia and in vitro study of its anti-infl ammatory effect [J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2013, 28(5):1444-1448. (in Chinese) |



