2. 潍坊医学院临床医学系, 山东 潍坊 261053;
3. 浙江大学医学院附属第一医院麻醉科, 浙江 杭州 310003
2. Department of Clinical Medicine, Weifang Medical College, Weifang 261053, China;
3. Department of Anesthesiology, First Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310003, China
帕金森病 (Parkinson disease)是一种中老年人中枢神经系统退行性疾病,主要病理特征是中脑黑质多巴胺能神经元的选择性变性死亡,纹状体多巴胺含量显著减少以及黑质残存神经元胞浆中路易小体(Lewy body)的形成等[1, 2, 3]。目前帕金森病确切的发病机制尚不完全清楚,也没有行之有效的治疗措施,深入探讨帕金森病的发病机制,寻找有效的治疗药物成为当前急需解决的问题[4, 5, 6]。丹皮酚(paeonol)是从毛莨科植物牡丹根皮与萝摩科植物徐长卿干燥根或全草中提取的活性成分,是天然的抗氧化剂,具有镇静、解热、镇痛、抗炎、抗过敏、抗氧化、抗动脉粥样硬化以及抗肿瘤等作用,丹皮酚在中枢神经系统的药理作用也十分广泛[7]。1-甲基-4-苯基吡啶(MPP+)是一种具有神经毒性的物质,能够选择性触发多巴胺能神经元损伤,广泛地用于帕金森病细胞模型的构建。目前尚未见丹皮酚对MPP+诱导的神经细胞凋亡的研究报道。因此,本研究采用公认的MPP+损伤PC12细胞株构建帕金森病模型细胞,探讨丹皮酚对帕金森病模型细胞的保护作用及其机制。
1 材料与方法 1.1 试剂与仪器PC12细胞株购自中国科学院上海生命科学研究院细胞资源中心;胎牛血清购自杭州四季青生物有限公司;DMEM培养基购自美国Gibco公司;四甲基偶氮唑蓝比色法(MTT)、MPP+、胰酶、碘化丙啶(PI)、赫斯特荧光染剂(Hoechst 33258)、二氯二氢荧光素-乙酰乙酸酯(DCFH-DA)购自美国Sigma公司;丹皮酚注射液(主要成分为丹皮酚,每支2 mL含10 mg丹皮酚)由上海第一生化药业有限公司提供,实验时用高糖DMEM培养液无菌过滤配置;抗甘油醛-3-磷酸脱氢酶(GAPDH)鼠单克隆抗体购自上海康成生物工程有限公司;抗Bcl-2、Bcl-2相关X蛋白(Bax)鼠单克隆抗体购自美国Cell signal公司;抗半胱氨酸天冬氨酸蛋白酶-3(caspase-3)兔多克隆抗体购自美国Santa Cruz公司;抗鼠及抗兔荧光二抗购自美国Rockland公司;Annexin V-异硫氰酸荧光素(FITC)凋亡检测试剂盒购自美国BD Pharmingen公司。仪器包括FACSalibur 流式细胞仪(美国Becton Dickinson公司)、BX51型倒置显微镜(日本Olympus公司)、免疫印迹膜荧光成像系统(美国Odyssey公司)。
1.2 细胞分组及处理PC12细胞置于含10%胎牛血清的DMEM培养基中,在37℃、5%二氧化碳培养箱中培养,细胞汇集到80%时进行传代,选取对数生长期的细胞进行实验。培养24 h后的细胞分为正常对照组、空白对照组、1 μmol/L丹皮酚组、3 μmol/L丹皮酚组和9 μmol/L丹皮酚组,除正常对照组外,分别加入终浓度为4 mmol/L(半数致死量)MPP+。造模前30 min先分别给予0、1、3、9 μmol/L丹皮酚预处理。正常对照组仅加入DMEM培养基,维持至实验结束。
1.3 MTT法检测细胞存活率PC12细胞以每孔1×105/ml接种于96孔板中,各组按“1.2细胞分组及处理”中方法处理细胞,到达预定时间后每孔加入100 μL MTT液(5 g /L),37 ℃ 反应4 h 后,小心弃上清液,加入200 μL二甲基亚砜充分溶解甲瓒颗粒,用酶标仪测定波长570 nm 处的吸光度值,用于计算细胞存活率。
1.4 乳酸脱氢酶漏出率检测细胞损伤鉴于细胞损伤或死亡后胞浆中的乳酸脱氢酶会漏到培养液中,实验采用乳酸脱氢酶漏出率评价细胞损伤。PC12细胞接种于 96 孔板,各组按“1.2细胞分组及处理”中方法处理后收集细胞培养液,按照试剂盒所示步骤依次加入相应试剂,在酶标仪测定波长450 nm 处吸光度值,计算乳酸脱氢酶漏出百分率。
1.5 荧光光度计检测细胞内活性氧浓度将所需检测的PC12细胞继续培养 24 h,胰酶消化后计数收集细胞,离心后用完全培养液重悬细胞并加入终浓度为10 μmol/L的DCFH-DA,37 ℃避光孵育60 min。然后1000 r/min (最大相对离心力2515× g)离心5 min,弃上清液,加入 1 mL 0.01 mol/L 磷酸盐缓冲液重悬细胞后,使用荧光光度计(激发波长488 nm,发射波长530 nm)测定各组细胞的荧光度值,以处理组/对照组的荧光度值比值计算活性氧浓度。
1.6 Hoechst 33258 染色检测细胞凋亡将PC12细胞接种于24孔板内的盖玻片上,贴壁后各组按“1.2细胞分组及处理”中方法处理,到预定时间后加入5 mg/L Hoechst 33258染色10 min,0.01 mol/L 磷酸盐缓冲液清洗后加入冰甲醇固定细胞5 min,用抗淬灭封片剂封片后在荧光显微镜下观察细胞核形态变化。正常细胞核出现均匀的低强度荧光,凋亡细胞核则呈现浓染致密的固缩形态或者颗粒状荧光。
1.7 流式细胞术检测细胞凋亡将PC12细胞接种于培养瓶中,待其贴壁后各组按“1.2细胞分组及处理”中方法处理,到预定时间后胰酶消化并及时加入完全培养基终止反应,1000 r/min(最大相对离心力2515 × g)离心5 min收集细胞,弃上清液,加入培养基后充分吹打为单细胞悬液,然后按照Annexin V-FITC凋亡试剂盒说明书进行操作,并加入PI存储液,立即上机检测。
1.8 蛋白质印迹法检测细胞caspase-3、Bax以及Bcl-2蛋白表达收集细胞,加入蛋白裂解液提取细胞总蛋白,以考马斯亮蓝法进行蛋白定量,取40 μg 蛋白样品进行12%十二烷基硫酸钠—聚丙烯酰胺凝胶(SDS-PAGE)电泳后,以 300 mA恒流转膜90 min,室温下再用 5 %的脱脂奶粉封闭 2 h,一抗4℃孵育过夜(抗 GAPDH抗体1∶3000;抗caspase-3、Bax、Bcl-2抗体1∶1000),次日,以800CW标记(绿色)的抗鼠荧光二抗(1∶3000)以及700DX标记(红色)的抗兔荧光二抗(1∶2000)中,室温平缓摇动2 h,而后采用蛋白质印迹膜荧光成像系统(ODYSSEY)荧光扫描,图片保存于工作站电脑中。Quantity one v4.62 软件分析条带灰度,分别计算caspase-3与内参GAPDH以及Bax/Bcl-2比值并进行统计分析。
1.9 统计学分析用SPSS 13.0统计软件进行分析。实验数据用均数±标准差($\bar x$±s)表示。组间均数比较采用单因素方差分析,两两间比较用SNK-q 检验。以P <0.05为差异有统计学意义。
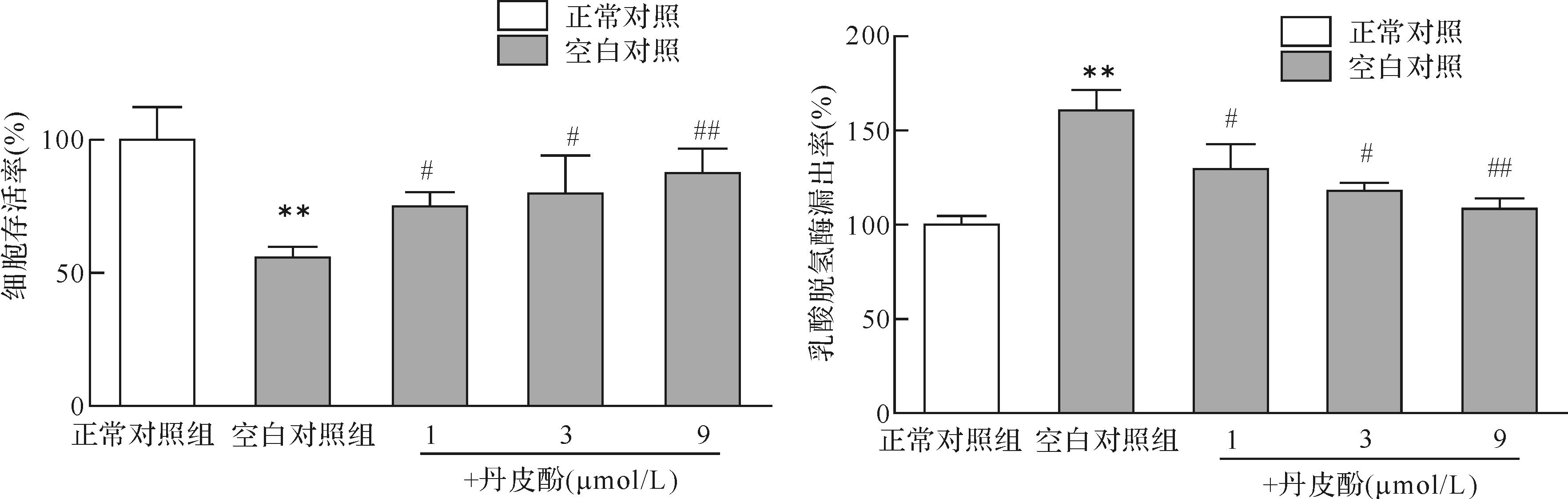
2 结 果 2.1 丹皮酚对PC12细胞活力及乳酸脱氢酶漏出率的影响与正常对照组比较,空白对照组细胞存活率下降,乳酸脱氢酶漏出率升高(P <0.01);与空白对照组比较,不同剂量丹皮酚预处理后,细胞存活率升高,乳酸脱氢酶漏出率降低,差异具有统计学意义(P <0.05或P <0.01)。提示丹皮酚可减轻帕金森病模型细胞损伤,并且在1~9 μmol/L浓度范围内,随着丹皮酚剂量增大,减轻细胞损伤的效应增强,以丹皮酚9 μmol/L组效果最明显。见图1。
|
| 与正常对照组比较,** P < 0.01;与空白对照组比较,# P < 0.05,## P< 0.01. 图1 各组细胞存活率和乳酸脱氢酶漏出率比较 Fig.1 Effect of paeonol on MPP+ -induced cell viability and lactate dehydrogenase increase |
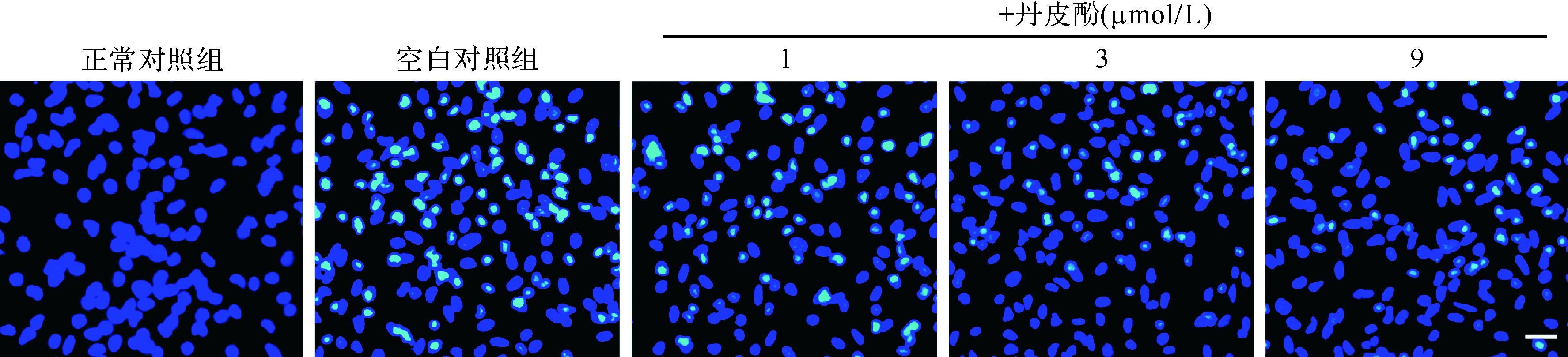
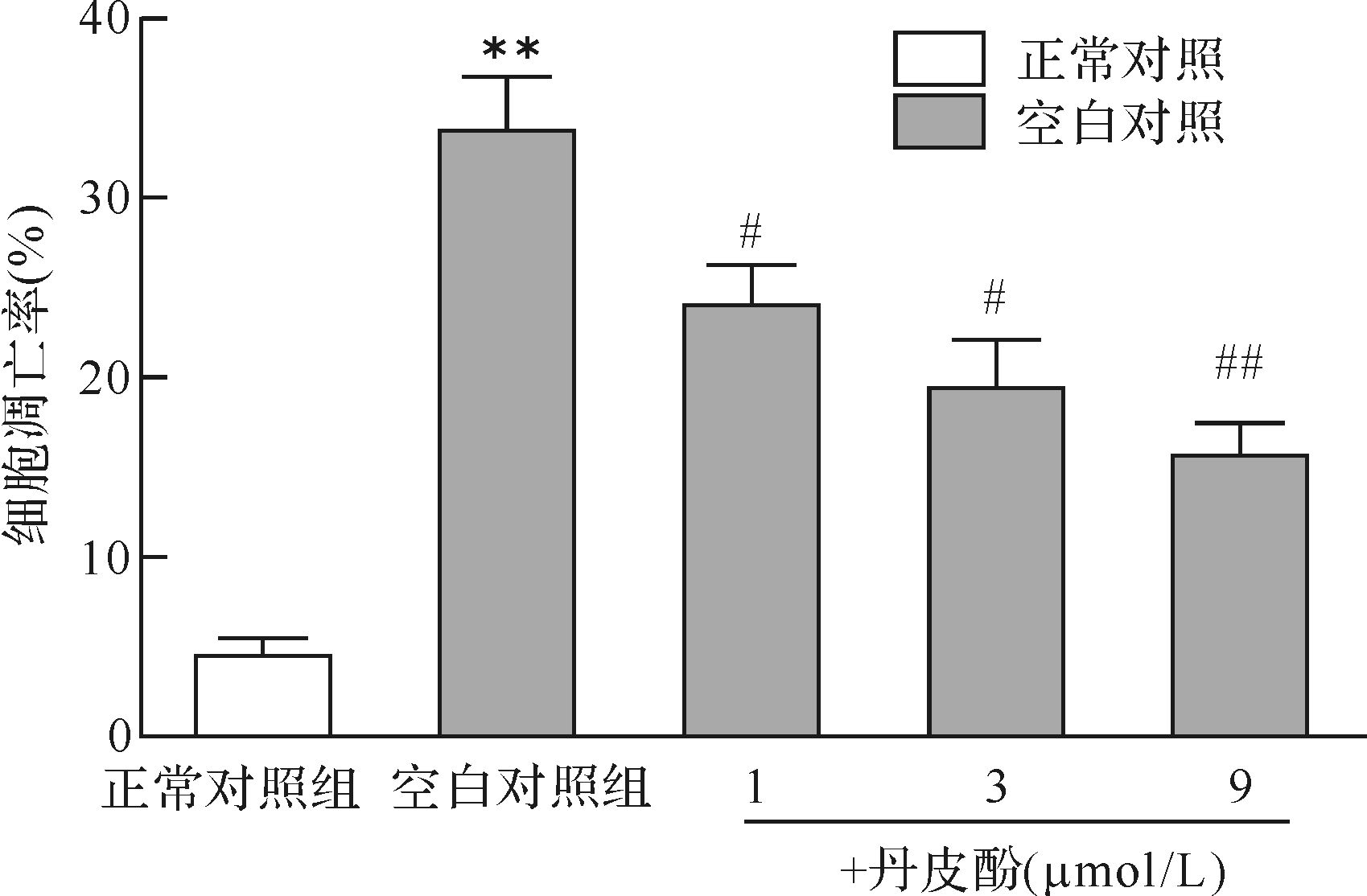
Hoechst 33258染色结果表明,正常对照组细胞呈现均匀的低强度荧光,细胞核圆或椭圆形,边缘清晰;空白对照组凋亡细胞明显增多,产生强的亮蓝色荧光,核呈现浓染致密的固缩形态,并出现核小体碎裂、颗粒荧光等特征性表现;丹皮酚预处理后凋亡细胞减少,见图2。应用流式细胞术进一步检测丹皮酚预处理后细胞凋亡百分率。结果表明,丹皮酚预处理可减少细胞凋亡百分率,以丹皮酚9 μmol/L组最明显(P <0.05或P <0.01),见图3。提示丹皮酚可抑制帕金森病模型细胞凋亡,并且在1~9 μmol/L浓度范围内,随着丹皮酚剂量增大,抑制细胞凋亡效应增强。
|
| 图2 各组细胞凋亡免疫荧光检测结果(标尺=100 μm) Fig.2 Effect of paeonol on MPP+ induced apoptosis ratio by Hoechst 33258 staining (scale bar=100 μm) |
|
| 与正常对照组比较,** P < 0.01;与空白对照组比较,# P < 0.05,## P< 0.01. 图3 流式细胞术检测各组细胞凋亡结果比较 Fig.3 Effect of paeonol on MPP+ induced apoptosis ratio by flow cytometry |
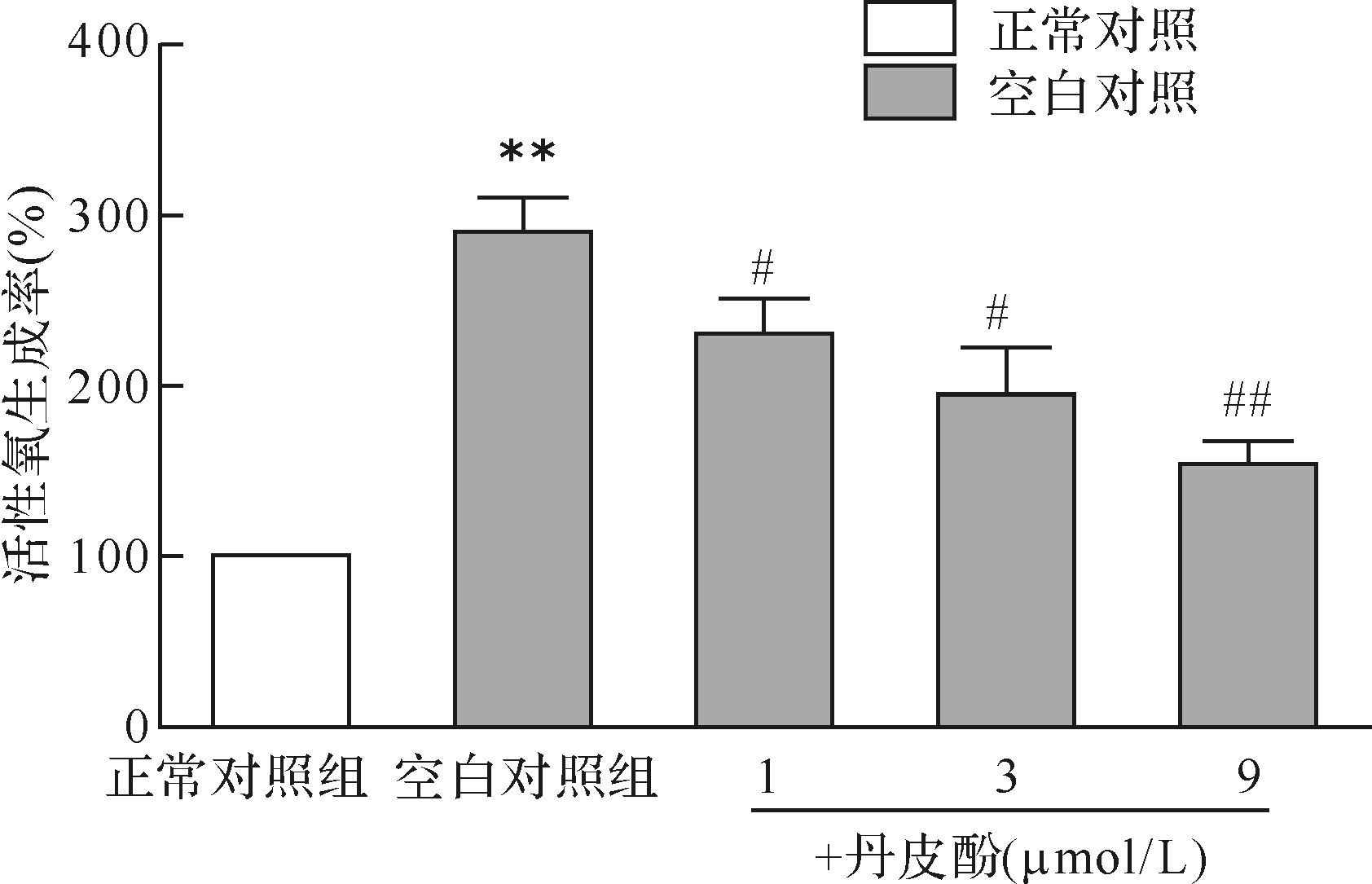
与正常对照组比较,空白对照组模型细胞内活性氧水平明显升高 (P < 0.01);而丹皮酚预处理各组细胞内活性氧水平均比空白对照组降低 (P < 0.05或P < 0.01),其中,以丹皮酚9 μmol/L组细胞内活性氧水平最低,见图4。提示丹皮酚可抑制帕金森病模型细胞中氧化应激水平升高,并且在1~9 μmol/L浓度范围内,随着丹皮酚剂量增大,抑制活性氧产生的效应增强,以丹皮酚9 μmol/L组效果最明显。
|
| 与正常对照组比较,** P < 0.01;与空白对照组比较,# P < 0.05,## P< 0.01. 图4 各组细胞活性氧生成率比较 Fig.4 Effect of paeonol on MPP+ -induced reactive oxygen species production |
与正常对照组比较,空白对照组细胞凋亡相关分子Bax表达上调,Bcl-2表达下降,Bax/Bcl-2比值升高,caspase-3活性上调,差异均有统计学 意义(均P <0.01);而与空白对照组比较,不同 浓度丹皮酚预处理后Bax表达下降,Bcl-2表达上调,Bax/Bcl-2比值降低,caspase-3活性下调,差异均有统计学意义(P <0.05或P <0.01),且以丹皮酚9 μmol/L组最明显,见图5、6。提示丹皮酚可抑制帕金森病模型细胞中Bax/Bcl-2比值升高,caspase-3活性上调,并且在1~9 μmol/L浓度范围内,随着丹皮酚剂量增大,抑制上述凋亡相关分子的效应增强,以丹皮酚9 μmol/L组效果最明显。
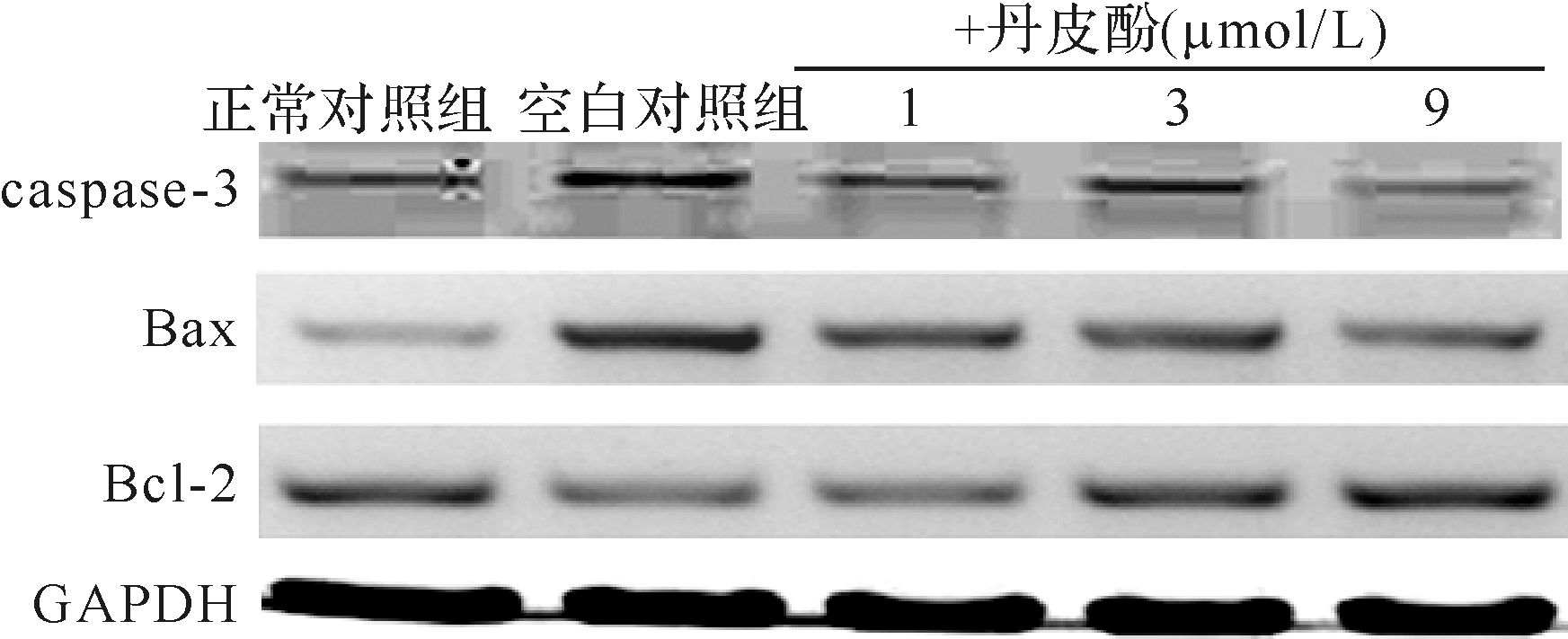
|
| 图5 各组细胞凋亡相关蛋白电泳结果 Fig.5 SDS-PAGE results of apoptosis-related proteins |
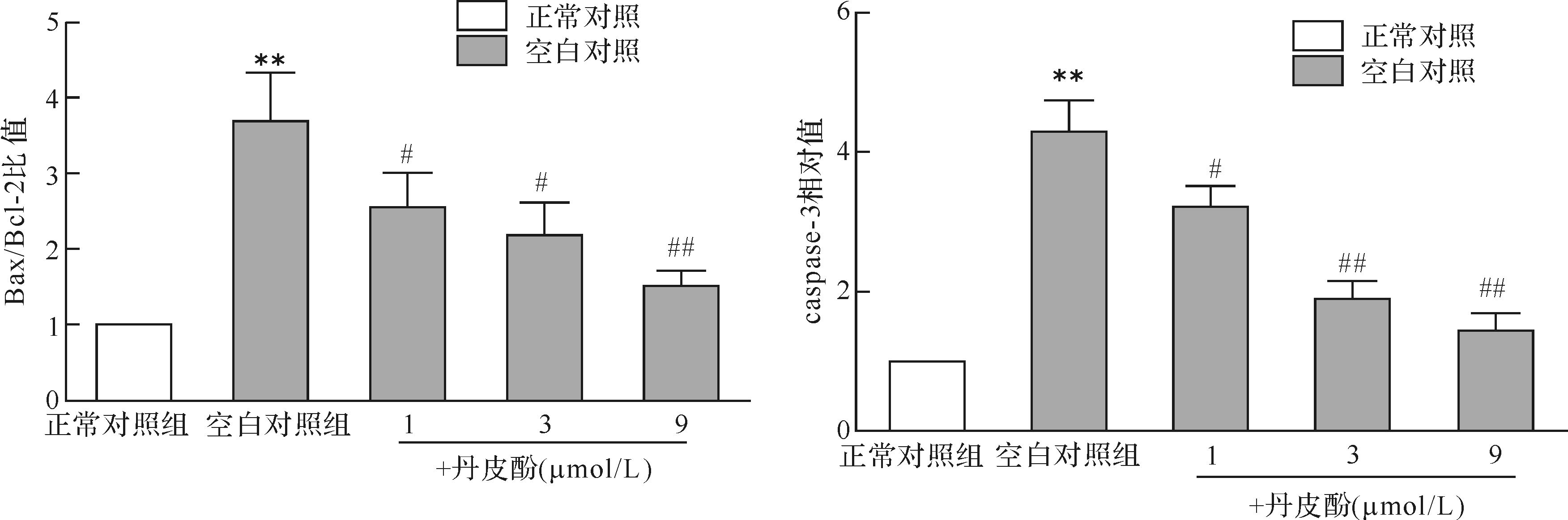
|
| 与正常对照组比较,**P < 0.01;与空白对照组比较,# P < 0.05,## P< 0.01. 图6 各组细胞Caspase-3、Bax以及Bcl-2表达比较 Fig.6 Effects of paeonol on MPP+ induced expression of caspase-3,Bax and Bcl-2 in PC12 cells |
随着健康水平提高以及人口老龄化,帕金森病发病率及患病率呈上升趋势[2]。目前帕金森病的病因和发病机制并不完全明确,一般认为与年龄、遗传、环境等因素及氧化应激、兴奋性毒素、自身免疫、线粒体功能障碍、细胞凋亡等机制密切相关[2, 3]。众多研究表明氧化应激在帕金森病发生发展中起重要作用,是启动细胞凋亡信号通路的重要环节;而多巴胺能神经元过度凋亡则是帕 金森病发生的中心环节,各种病因最终可经细胞凋亡这一共同通路而导致帕金森病发病,并且在此过程中,活性氧、Bax、Bcl-2、caspase-3均发挥了重要作用,可能是由于环境毒素、自由基等抑制了线粒体呼吸链复合酶,从而减少谷胱甘肽、腺苷三磷酸等生成,进一步促进活性氧生成,并通过激活Bax/Bcl-2、caspase-3等来调控神经元凋亡,最终造成帕金森病[2, 3]。
近年来,中药及其活性成分在帕金森病治疗方面显示出一定的效果,对其作用及机制的研究成为热点。丹皮酚是从毛茛科植物牡丹皮、萝藦科植物徐长卿等提取出来的一种中药单体,体内外实验均表明丹皮酚具有一定的神经保护作用:丹皮酚可减轻大鼠急性脑缺血再灌注损伤,改善血脑屏障通透性,抑制活性氧生成,改善微循环并发挥抗炎作用[8, 9];丹皮酚可调节阿尔茨海默病后脑源性神经营养因子、Bcl-2 的表达,对β淀粉样蛋白诱导海马神经元损伤发挥保护作用[10];有效改善糖尿病脑病、血管性痴呆以及阿尔茨海默病模型小鼠的认知功能障碍[11, 12, 13, 14],并抑制小胶质细胞介导的炎症[15]。
在本研究中,丹皮酚1、3、9μmol/L能够显著抑制帕金森病模型细胞存活率下降以及乳酸脱氢酶漏出率升高,并且抑制PC12细胞凋亡。此外我们还检测了活性氧的生成以及凋亡相关蛋白caspase-3、Bcl-2和Bax表达的变化。结果发现,与正常对照组比较,帕金森病模型细胞活性氧生成增加,caspase-3表达上调以及Bax /Bcl-2比值升高,而与空白对照组比较,丹皮酚可明显抑制帕金森病模型细胞活性氧生成增加、caspase-3表达增强以及Bax /Bcl-2比值升高。
丹皮酚的上述作用与剂量有一定的关系。我们的预实验显示丹皮酚抑制帕金森病模型细胞存活率下降以及乳酸脱氢酶漏出率升高的效应在9 μmol/L左右时最为明显,剂量进一步增大到18 μmol/L时该抑制效应虽然仍很显著,但已经出现平台效应。而当剂量进一步增加到30 μmol/L时出现细胞存活率下降以及乳酸脱氢酶漏出率升高,即细胞毒性反应。提示在一定剂量范围内,丹皮酚的治疗效应随着剂量增大而增强,但是超过该限度,随着剂量增大丹皮酚保护效应并不能增强,因此,本研究丹皮酚干预的剂量梯度选择为1、3、9 μmol/L。
综上所述,本研究证明丹皮酚对MPP+诱导的帕金森病模型细胞损伤具有保护作用,能够抑制细胞凋亡;并进一步阐明其发挥保护作用的机制可能与改善帕金森病模型细胞氧化应激,降低Bax/ Bcl-2比值,抑制caspase-3活化有关。本研究提示了丹皮酚在帕金森病治疗方面具有潜在的应用价值,并可进一步探讨其对神经系统作用的意义。
| [1] | SCHAPIRA A H, JENNER P. Etiology and pathogenesis of Parkinson's disease [J]. Mov Disord, 2011, 26(6):1049-1055. |
| [2] | PERIER C, BOVE J, VILA M. Mitochondria and programmed cell death in Parkinson's disease: apoptosis and beyond [J]. Antioxid Redox Signal, 2012, 116(9):883-895. |
| [3] | BISAGLIA M, FILOGRANA R, BELTRAMINI M, et al. Are dopamine derivatives implicated in the pathogenesis of Parkinson's disease? [J]. Ageing Res Rev, 2014, 13: 107-114. |
| [4] | ESPOSITO E, CUZZOCREA S. New therapeutic strategy for Parkinson's and Alzheimer's disease [J]. Curr Med Chem, 2010, 17(25):2764-2774. |
| [5] | 王 浩, 石巧娟, 史文珍, 等. 半胱氨酰白三烯受体CysLT_1R和CysLT_2R以及GPR17在帕金森病模型小鼠脑内的表达分布[J]. 浙江大学学报(医学版) , 2013, 42(1):52-60. WANG Hao, SHI Qiao-juan, SHI Wen-zhen, et al. Expression and distribution of cysteinyl leukotriene receptors CysLT1R and CysLT2R, and GPR17 in brain of Parkinson disease model mice [J]. Journal of Zhejiang University(Medical Science), 2013, 42(1):52-60. (in Chinese) |
| [6] | 张晓燕, 张丽慧, 李成檀, 等. 5-脂氧酶参与鱼藤酮诱导的PC12细胞损伤[J]. 浙江大学学报(医学版) , 2011, 40(2):150-155. ZHANG Xiao-yan, ZHANG Li-hui, LI Cheng-tan, et al. 5-lipoxygenase is involved in rotenone-induced injury in PC12 cells [J]. Journal of Zhejiang University(Medical Science), 2011, 40(2):150-155. (in Chinese) |
| [7] | 郭 齐, 李贻奎, 王志国, 等. 丹皮酚药理研究进展[J]. 中医药信息, 2009, 29(1):20-22. GUO Qi, LI Yi-kui, WANG Zhi-guo, et al. Research progress on paeonol pharmacological [J]. Information on Traditional Chinese Medicine, 2009, 29(1): 20-22. (in Chinese) |
| [8] | ZHAO Y, FU B, ZHANG X, et al. Paeonol pretreatment attenuates cerebral ischemic injury via upregulating expression of pAkt, Nrf2, HO-1 andameliorating BBB permeability in mice [J]. Brain Res Bull, 2014, 109: 61-67. |
| [9] | WU J B, SONG N N, WEI X B, et al. Protective effects of paeonol on cultured rat hippocampal neurons against oxygen-glucose deprivation-induced injury [J]. J Neurol Sci, 2008, 264 (1-2):50-55. |
| [10] | ZHOU J, ZHOU L, HOU D, et al. Paeonol increases levels of cortical cytochrome oxidase and vascular actin and improves behavior in a rat model of Alzheimer's disease [J]. Brain Res, 2011, 1388: 141-147. |
| [11] | ZHONG S Z, GE Q H, QU R, et al. Paeonol attenuates neurotoxicity and ameliorates cognitive impairment induced by d-galactose in ICR mice [J]. J Neurol Sci, 2009, 277(1-2):58-64. |
| [12] | LIU J, FENG L, MA D, et al. Neuroprotective effect of paeonol on cognition deficits of diabetic encephalopathy in streptozotocin-induced diabetic rat [J]. Neurosci Lett, 2013, 549: 63-68. |
| [13] | SU S Y, CHENG C Y, TSAI T H, et al. Paeonol protects memory after ischemic stroke via inhibiting β-secretase and apoptosis [J]. Evid Based Complement Alternat Med, 2012, 2012: 932823. |
| [14] | 王 浩, 耿赵铭, 呙登俊, 等. 丹皮酚对血管性认知障碍小鼠认知功能的保护作用[J]. 温州医科大学学报, 2014, 44(10):708-711. WANG Hao, GENG Zhao-ming, GUO Deng-jun, et al. Protective effects of paeonol on cognitive dysfunctions in mice with vascular cognitive impairment [J]. Journal of Wenzhou Medical University, 2014, 44(10):708-711. (in Chinese) |
| [15] | TSENG Y T, HSU Y Y, SHIH Y T, et al. Paeonol attenuates microglia-mediated inflammation and oxidative stress-induced neurotoxicity in rat primary microglia and cortical neurons [J]. Shock, 2012, 7(3):312-318. |



