2.浙江大学医学院药理学系, 浙江 杭州 310058
2. Department of Pharmacology, Zhejiang University School of Medicine, Hangzhou 310058, China
视网膜组织的缺氧性疾病如糖尿病视网膜病变、青光眼、视网膜中央动脉阻塞等在临床较为常见,视网膜神经节细胞(retina ganglion cell,RGCs)位于视网膜内层,在视觉信息的整合和传递中起重要作用。缺氧所致的视网膜损伤容易累及RGCs[1],因此寻求有效的药物治疗是临床亟待解决的问题之一。RGC-5是永生化的大鼠视网膜神经节细胞株[2],属于未分化幼稚细胞,与原代培养RGCs相比,除不具有电生理学特性外其他性状基本相似,近年来已广泛用于RGCs相关研究。原花青素是一大类多酚类化合物的总称,由儿茶素、表儿茶素及表儿茶素没食子酸酯组成,主要存在于葡萄、山楂、银杏等多种植物中,其中以葡萄籽原花青素(grape seed proanthocyanidin extracts,GSPE)的含量最为丰富[3, 4]。研究表明GSPE在体内的抗氧化能力是维生素C的20倍、维生素E的50倍[5]。在动物实验研究中已证实GSPE在脑缺血和视网膜缺血后可有效防止再灌注损伤,并可有效抑制神经细胞的凋亡,其机制与GSPE抗氧化作用有关[6, 7],但在离体分子水平上,GSPE能否保护缺氧条件下RGCs尚需进一步证实。氯化钴是一种可以体外诱导细胞损伤的化学试剂,能够很好地模拟神经细胞缺氧损伤[8]。本实验采用氯化钴诱导RGC-5细胞化学缺氧损伤,观察GSPE对缺氧条件下RGC-5细胞存活率的影响,并探讨相关机制,为其在RGCs损伤中的治疗奠定基础。
1 材料与方法 1.1 材 料GSPE(纯度≥95%)购自天津市尖峰天然产物研究开发有限公司;RGC-5细胞购自美国ATCC公司;DMEM高糖培养基、胎牛血清、胰酶购自美国Gibco公司;氯化钴、MTT购自美国Sigma公司;活性氧荧光测定试剂盒、Hoechst 33342购自上海碧云天生物技术有限公司;Trizol试剂购自美国Invitrogen公司;SYBR Premix Ex Taq试剂盒购自宝生物工程(大连)有限公司;MMLV逆转录酶、随机引物、靶基因引物及其余试剂购自上海生工生物工程技术服务有限公司。
1.2 RGC-5细胞化学缺氧模型的建立和分组RGC-5细胞用含10%胎牛血清的DMEM高糖培养基培养,以1×105/孔的密度接种于96孔板,待细胞贴壁生长24 h后,弃去原培养基,加入磷酸盐缓冲液洗2次,每组加入不同浓度的氯化钴(0、100、200、400、800 μmol/L) 处理24 h。选取细胞存活率约50%的氯化钴浓度作为细胞化学缺氧模型的处理浓度。GSPE在氯化钴处理前6 h进行预给药,浓度为40μg/mL。未作任何处理的为正常对照组;40 μg/mL GSPE预处理者为正常GSPE组;400 μmol/L氯化钴处理者为缺氧对照组;40 μg/mL GSPE和400 μmol/L氯化钴处理者为缺氧GSPE组。
1.3 MTT法检测细胞存活率RGC-5细胞以1×105/孔的密度接种于96孔板,待细胞贴壁生长24 h后用于实验。氯化钴缺氧损伤24 h后或GSPE预处理后,向96孔板内每孔加入MTT液(0.5 mg/mL),在5%二氧化碳孵箱37 ℃培养4 h后,吸取培养液,加入100 μL二甲基亚砜,以酶标仪(ELX800,美国Bio-Tek公司)检测波长为570 nm处的吸光度值。
1.4 Hoechst 33342荧光染色法检测细胞凋亡率细胞接种于玻片上,分别按上述各组给予不同的处理后,用Hoechst 33342(10 μg/mL)37 ℃避光染色10 min,用荧光显微镜(OlympusBX51,日本奥林巴斯公司)观察。每一玻片观察6个视野,计算凋亡细胞数占总细胞数的百分率。
1.5 荧光法检测细胞内活性氧浓度细胞内活性氧测定是基于H2DCFDA氧化产生荧光物质,荧光强度与活性氧的浓度呈线性关系。细胞接种于96孔板,分别按上述各组给予不同的处理,D-Hanks液清洗后,用50 μmol/mL H2DCFDA孵育30 min。清洗后,以荧光检测仪(Fluostar,德国BMG LABTECH公司)在激发波长360 nm、吸收波长450 nm下检测荧光强度。
1.6 实时定量PCR检测RGC-5细胞内凋亡相关因子mRNA表达水平用Trizol法提取RGC-5细胞内总RNA,核酸检测仪(Smart+specTM3000,美国)测定RNA浓度;每个样本中取1 μg的RNA,再分别加入4 μL M-MLV缓冲液、1 μL M-MLV 、0.5μL RNasin、2 μL dNTP,DEPC水加至20 μL,逆转录反应合成cDNA。PCR反应依照SYBR Premix Ex Taq试剂盒说明书进行。凋亡相关因子包括Bcl-2、半胱酰胺天冬氨酸蛋白酶(caspase) 9和caspase 3,引物序列如下:Bcl-2上游引物为5’-TGGGATACTGGAGATGAAGACT-3’,下游引物为5’-CCACCGAACTCAAAGAAGG-3’; Caspase 9上游引物为5’-GCCTCATCATCAACAACGTG-3’,下游引物为5’-CCTGGTATGGGACAGCATCT-3’; Caspase 3 上游引物为5’-GACGACAGGGTGCTACGAT-3’,下游引物为5’-ACAGACCAGTGCTCACAAGG-3’;β-actin 上游引物为5’-GCAGATGTGGATCAGCAAGC-3’,下游引物为5’-GTCAAAGAAAGGGTGTAAAACG-3’[9]。结果用标准曲线法进行分析,并以β-actin作为内参进行标准化。
1.7 统计学分析用SPSS 15.0 for windows软件进行统计学处理。数据以均数±标准差( ± s)表示。组间比较采用单因素方差分析,两两比较采用Student-Newman-Keuls q检验,以P <0.05为差异有统计学意义。
2 结 果 2.1 氯化钴造模浓度的选择随着氯化钴浓度的增加,RGC-5细胞的存活率逐渐降低,50、100、200、400、800 μmol/L氯化钴处理后RGC-5细胞存活率分别为(94.60±7.94)%、(89.37±6.96)%、(78.14±7.59)%、(51.40±1.20)%、(26.35±1.53)%。氯化钴终浓度为400 μmol/L时RGC-5细胞的抑制率接近50%,即接近半数致死浓度,故选此作为最佳造模浓度。
2.2 GSPE对氯化钴诱导RGC-5细胞缺氧损伤的影响40 μg/mL GSPE干预后RGC-5细胞存活率较缺氧对照组提高了30.33%(P<0.001),正常GSPE组与正常对照组比较RGC-5细胞存活率无明显变化(P>0.05),见图1。表明GSPE可减轻氯化钴对RGC-5细胞的缺氧损伤。
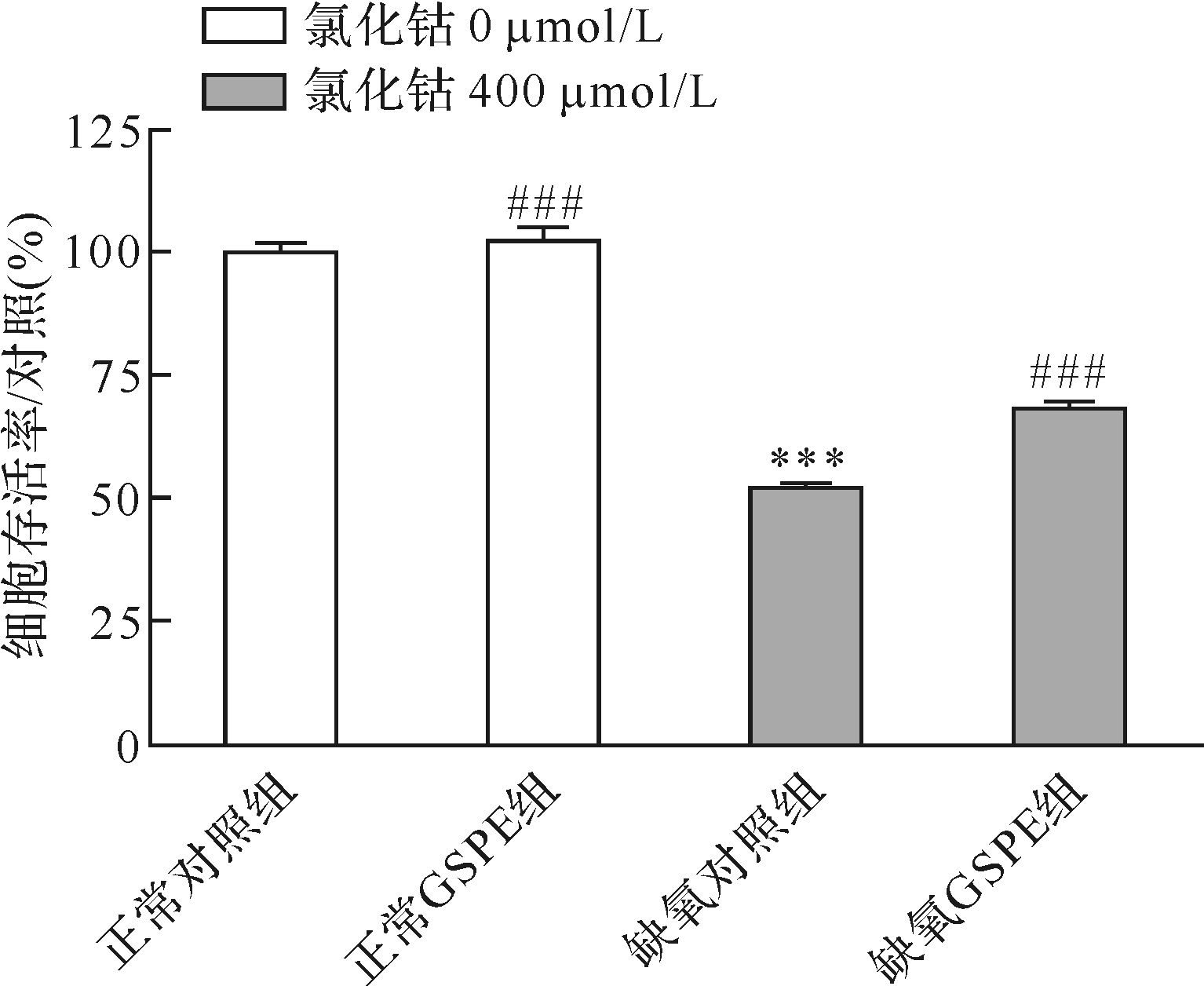
|
| 与正常对照组比较,*** P<0.001;与缺氧对照组比较,# # # P<0.001.n=6. 图1 各组RGC-5细胞存活率比较 Fig.1 Effectof GSPE on cell viability in CoCl2-induced hypoxia in RGC-5 cells |
在缺氧对照组中可见RGC-5细胞发生了典型的形态学改变和核萎缩(图2A),细胞凋亡率达到(22.2±2.50)%,而缺氧GSPE组细胞凋亡率降至(5.3±1.32)% ,两组差异具有统计学意义(P<0.001),正常GSPE组与正常对照组细胞凋亡率差异则无统计学意义(P>0.05),见图2B。表明GSPE可以减少氯化钴诱导的RGC-5细胞凋亡。
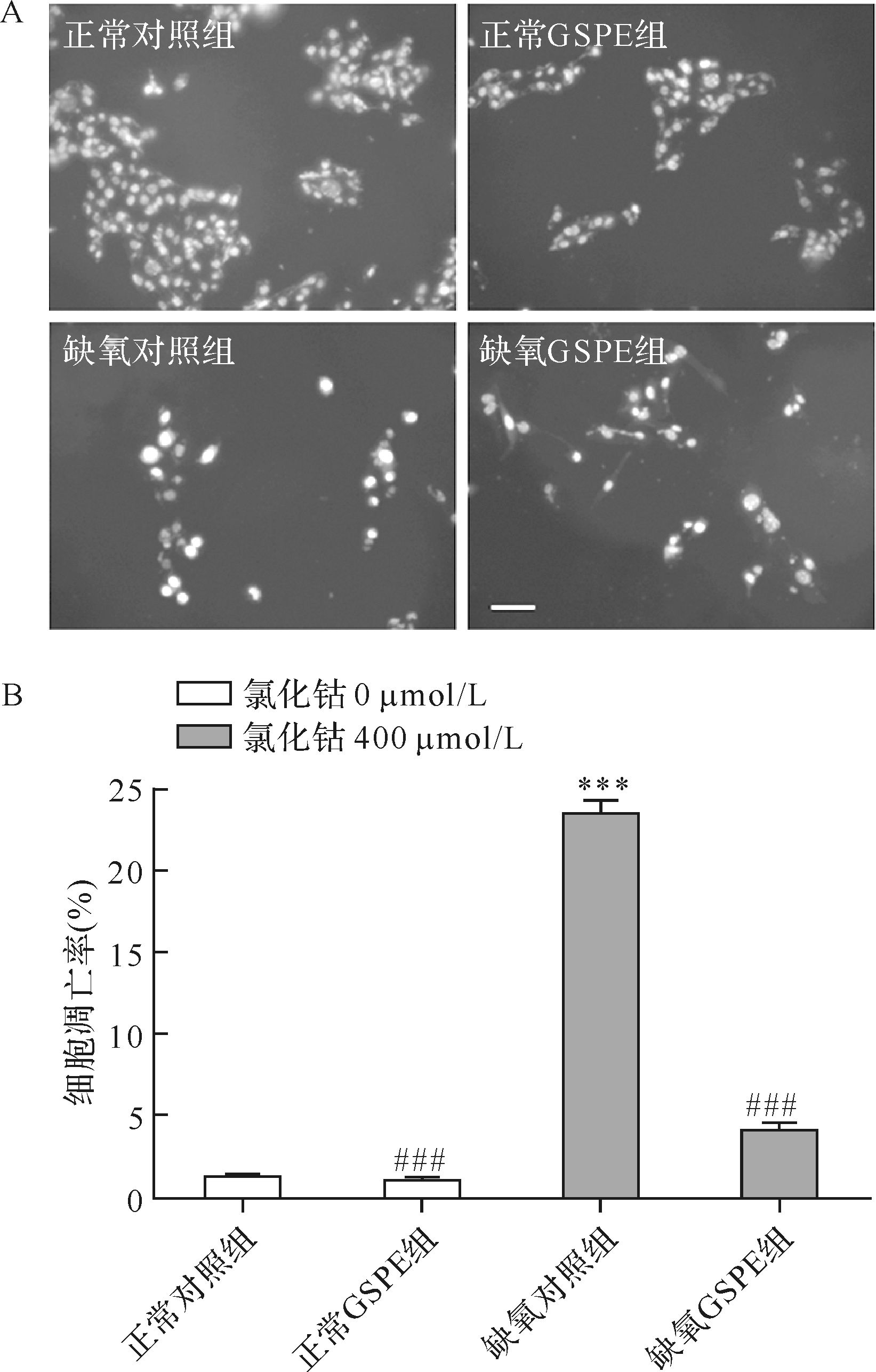
|
| A: 各组Hoechst染色结果. 正常对照组细胞形态未发生改变;正常GSPE组细胞形态未发生改变;缺氧对照组细胞发生了典型的形态学改变和核萎缩;缺氧GSPE组较缺氧对照组形态学改变和核萎缩的细胞明显减少. 标尺=50 μm. B: 各组细胞凋亡率比较. 与正常对照组比较,***P<0.001;与缺氧对照组比较,###P<0.001. n=9. 图2 各组RGC-5细胞凋亡结果比较 Fig.2 Effect of GSPE on CoCl2-induced RGC-5 cell apoptosis |
缺氧对照组细胞内活性氧水平较正常对照组上升 (P<0.001);GSPE预处理后活性氧水平较缺氧对照组下降( P<0.001),正常GSPE组与正常对照组活性氧差异无统计学意义(P>0.05),见图3A。表明GSPE可以降低氯化钴诱导的RGC-5活性氧释放水平。
2.5 GSPE对RGC-5细胞内Bcl-2、caspase 9和caspase 3 mRNA表达的影响缺氧对照组Bcl-2基因mRNA水平较正常对照组降低(P<0.001),而caspase 9 mRNA(P<0.001)和caspase 3 mRNA(P<0.001)水平较正常对照组升高,GSPE可逆转这种现象,见图3B、C、D。
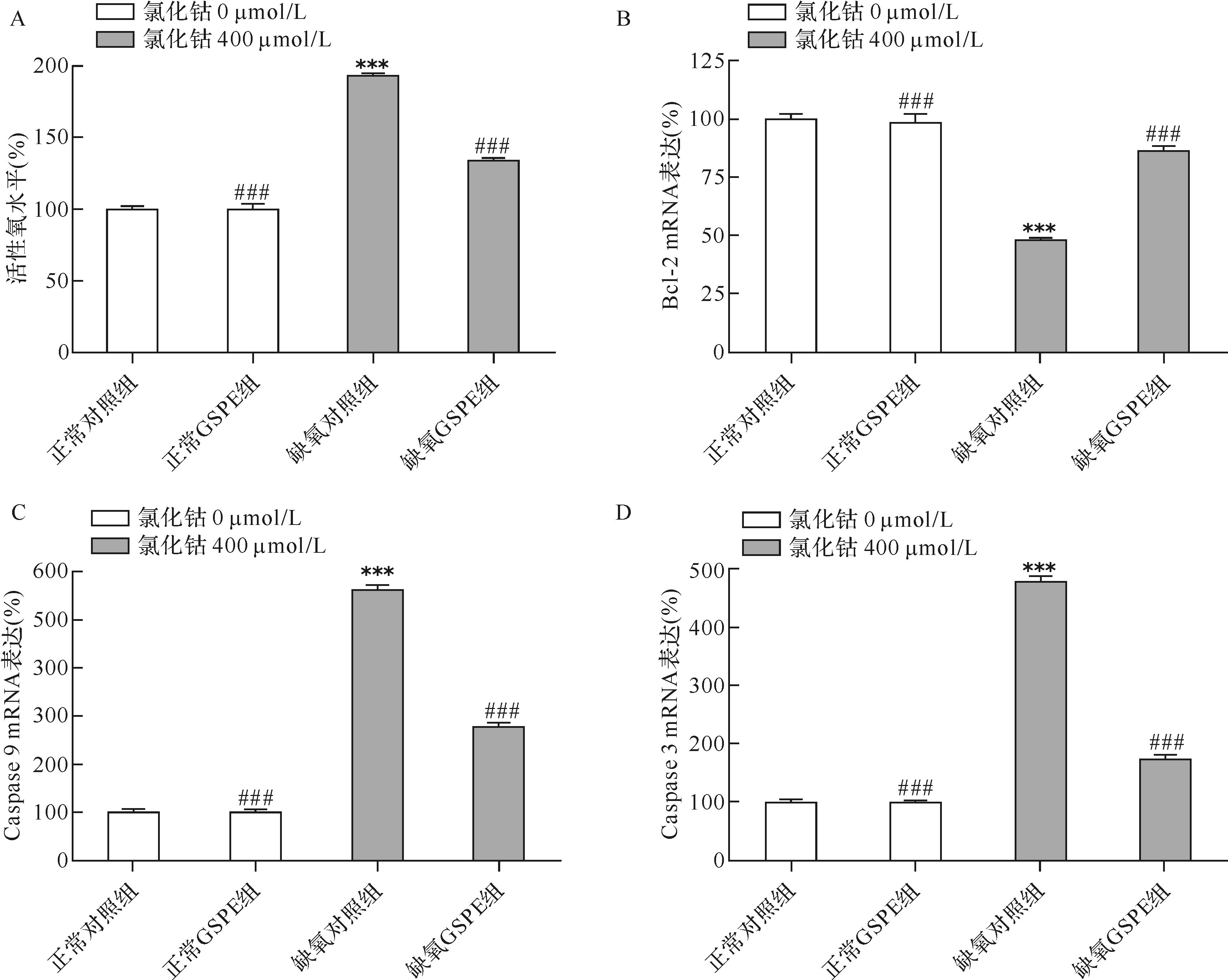
|
| 与正常对照组比较,*** P<0.001;与缺氧对照组比较,# # # P<0.001. n=4. 图3 各组RGC-5细胞内活性氧及Bcl-2、caspase 9和caspase 3 mRNA比较 Fig.3 Effect of GSPE on ROS and the mRNA expression of Bcl-2,caspase 9 and caspase 3 in RGC-5 cells induced by CoCl2 |
视网膜中的RGCs是对氧气需求很高的组织,对缺氧十分敏感,而缺氧是视网膜病变的主要机制之一[10]。视网膜缺氧可以对组织功能和细胞活性产生负面影响,是一个潜在的危险因素[11]。在本实验中,采用氯化钴构建RGC-5细胞化学缺氧模型,在氯化钴的终浓度为400 μmol/L时RGC-5细胞的抑制率接近半数致死浓度,因此选取400 μmol/L作为造模浓度模拟RGCs的缺氧损伤。
本研究探索GSPE干预对上述RGC-5细胞缺氧模型的作用,结果显示:GSPE预处理后可以显著改善细胞存活率,对RGC-5细胞的缺氧损伤具有保护作用。研究还发现GSPE对氯化钴诱导的RGC-5细胞的凋亡具有一定的拮抗作用,与原慧萍等[12]研究发现原花青素对微波引起的RGCs的凋亡具有拮抗作用的结果一致。
线粒体对细胞氧化还原状态的变化较敏感,在细胞凋亡中发挥重要作用。多项研究表明,在氧化应激状态下,线粒体功能的关闭会导致细胞凋亡[13]。Bcl-2基因家族主要通过线粒体途径调节细胞凋亡,Bcl-2基因具有潜在的抗凋亡作用,其抗凋亡机制可能与活性氧有关[14, 15]。Caspase是一种天冬氨酸蛋白水解酶,并特异性地断开天冬氨酸残基后的肽键,细胞色素C激活caspase 9后再激活效应器caspase 3,并抑制Bcl-2基因表达,从而导致细胞凋亡[16, 17, 18]。GSPE具有极强的抗氧化活性,是一种良好的氧游离基清除剂和脂质过氧化抑制剂,具有很强的抗氧化活性和自由基清除功能。GSPE 能够调节p53、Bcl-2基因、Bcl-2基因相关X蛋白的表达,通过caspase 3途径,调节细胞周期和减少正常细胞凋亡[19]。在RGC-5细胞中,人参皂苷可以通过降低caspase 3和caspase 9的表达来抑制氯化钴缺氧损伤导致的细胞凋亡,表明在RGC-5细胞缺氧损伤中抑制细胞凋亡机制可能与线粒体途径有关[20]。我们进一步研究了GSPE对氯化钴诱导的RGC-5缺氧损伤保护作用的机制,结果发现GSPE预处理后,逆转了缺氧对照组的变化,Bcl-2基因 mRNA水平的表达显著升高,同时细胞内活性氧的释放量减少,而caspase 9和caspase 3 mRNA表达水平降低,表明GSPE可能通过线粒体凋亡途径保护细胞的缺氧损伤。
综上所述,GSPE对氯化钴诱导的RGC-5缺氧损伤有保护作用,其作用机制可能与线粒体凋亡途径有关。该结果可为GSPE在缺氧性视网膜病变中的治疗奠定基础。
| [1] | SERNAGOR E, EGLEN S J, WONG R O. Development of retinal ganglion cell structure and function [J]. Prog Retin Eye Res, 2001, 20(2): 139-174. |
| [2] | KRISHNAMOORTHY R R, AGARWAL P, PRASANNA G, et al. Characterization of a transformed rat retinal ganglion cell line [J]. Brain Res Mol Brain Res, 2001, 86(1-2):1-12. |
| [3] | BAGCHI D, BAGCHI M, STOHS S J, et al. Free radicals and grape seed proanthocyanidin extract: importance in human health and disease prevention [J]. Toxicology, 2000, 148(2-3): 187-197. |
| [4] | COS P, DE BRUYNE T, HERMANS N, et al. Proanthocyanidins in health care: current and new trends [J]. Curr Med Chem, 2004, 11(10): 1345-1359. |
| [5] | BAGCHI DGARG A, KROHN R L, et al. Oxygen free radical scavenging abilities of vitamins C and E, and a grape seed proanthocyanidin extract in vitro [J]. Res Commun Mol Pathol Pharmacol, 1997, 95(2): 179-189. |
| [6] | 黄晓瑾, 毛峻琴. 葡萄籽油原花青素抗大鼠缺血再灌注损伤的研究[J]. 中国药师, 2005, 8(7):541-542. HUANG Xiao-jin, MAO Jun-qin. Protective effect of procyanidins on cerebral ischemia-reperfusion injury in rats [J]. China Pharmacist, 2005, 8(7): 541-542.(in Chinese) |
| [7] | 贺 玲. 原花青素对大鼠视网膜缺血再灌注损伤后视神经的保护作用[J]. 新乡医学院学报, 2012, 29(1):26-28. HE Ling. Protective effect of proanthocyanidin on optic nerversafter experimental retinal ischemia-reperfusion injury in rats [J]. Journal of Xinxiang Medical College, 2012, 29(1): 26-28. (in Chinese) |
| [8] | 权晶晶. 二氯化钴在体外细胞缺氧研究中的应用[J]. 国际口腔医学杂志, 2009, 6(4):455-458. QUAN Jing-jing. Application of cobalt chloride in cell hypoxia in vitro research [J]. International Journal of Stomatology, 2009, 6(4):455-458.(in Chinese) |
| [9] | WU F J, XUE Y, TANG Q J, et al. Protective effects of cerebrosides from sea cucumber and starfish on the oxidative damage in PC12 cells [J]. J Oleo Sci, 2013, 62(9): 717-727. |
| [10] | AMES A 3RD. Energy requirements of CNS cells as related to their function and to their vulnerability to ischemia: a commentary based on studies on retina [J]. Can J Physiol Pharmacol, 1992, 70 Suppl: S158-S164. |
| [11] | MOZAFFARIEH M, GRIESHABER M C, ORGUL S, et al. The potential value of natural antioxidative treatment in glaucoma [J]. Surv Ophthalmol, 2008, 53(5):479-505. |
| [12] | 原慧萍, 马春阳, 周欣荣, 等. 原花青素对微波诱导视网膜神经节细胞凋亡的拮抗作用[J]. 中国病理生理杂志, 2008, 24(4):812-814. YUAN Hui-ping, MA Chun-yang, ZHOU Xin-rong, et al. Antagonism effect of procyanidins on microwave induced cell apoptosis in retinal ganglion cells[J]. Chinese journal of pathophysiology, 2008, 24(4):812-814.(in Chinese) |
| [13] | KANNAN K, JAIN S K. Oxidative stress and apoptosis [J]. Pathophysiology, 2000, 7(3): 153-163. |
| [14] | YANG E, KORSMEYER S J. Molecular thanatopsis: a discourse on the BCL2 family and cell death [J]. Blood, 1996, 88(2):386-401. |
| [15] | DU L, LI Z J, XU J, et al. The anti-tumor activities of cerebrosides derived from sea cucumber Acaudina molpadioides and starfish Asterias amurensis in vitro and in vivo [J]. J Oleo Sci, 2012, 61(6):321-330. |
| [16] | XIE Z, MOIR R D, ROMANO D M, et al. Hypocapnia induces caspase-3 activation and increases Abeta production [J]. Neurodegener Dis, 2004, 1(1):29-37. |
| [17] | MARTINOU J C, YOULE R J. Mitochondria in apoptosis: Bcl-2 family members and mitochondrial dynamics [J]. Dev Cell, 2011, 21(1):92-101. |
| [18] | GROSS A, MCDONNELL J M, KORSMEYER S J. BCL-2 family members and the mitochondria in apoptosis [J]. Genes Dev, 1999, 13(15):1899-1911. |
| [19] | ROY A M, BALIGA M S, ELMETS C A, et al. Grape seed proanthocyanidins induce apoptosis through p53, Bax, and caspase 3 pathways [J]. Neoplasia, 2005, 7(1):24-36. |
| [20] | LIU Z, CHEN J, HUANG W, et al. Ginsenoside Rb1 protects rat retinal ganglion cells against hypoxia and oxidative stress [J]. Mol Med Rep, 2013, 8(5):1397-1403. |



