2.广东医学院附属医院佛山市三水区人民医院眼科, 广东 佛山 528100
2. Department of Ophthalmology, Sanshui Peoples Hospital of Foshan, Affiliated Hospital of Guangdong Medical College, Foshan 528100, China
眼部碱烧伤是常见且严重的眼外伤之一,对眼前段组织有极强破坏力:急性期出现角膜上皮缺损、基质水肿伴炎症反应,修复期形成角膜瘢痕,并伴有角膜新生血管(corneal neovascularization,CNV) 生成,严重影响视力。重症碱烧伤还可造成角膜穿孔、睑球粘连、继发性青光眼、并发白内障甚至眼球萎缩等。目前临床上尚无令人满意的治疗方法。 绿茶多酚是绿茶的主要成分,研究显示其具有抗炎[1]、抗氧化[2],抑制细胞增殖、细胞周期[3]、CNV生成[4, 5],以及抑制肿瘤生长[6]、侵袭、转移[7]等作用,而表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是绿茶多酚产生这些生物学效应的最主要的有效成分。近年来有饮用绿茶可抑制CNV形成的报道[8],也有局部应用EGCG来抑制CNV的猜想[9]。目前关于EGCG在心血管、肿瘤、退行性神经疾病、炎症性疾病和眼底血管性疾病方面已有研究,但关于EGCG对角膜碱烧伤治疗作用的研究较少。本研究通过建立小鼠角膜碱烧伤模型,探讨EGCG对角膜碱烧伤的治疗作用,以期为临床治疗角膜碱烧伤提供参考。
1 材料与方法 1.1 实验动物及试剂实验动物选取4~6周龄的C57BL/6J健康小鼠200只,体质量20~25 g,雌雄不限,裂隙灯显微镜下排除双眼前节及附属器异常,由浙江大学实验动物中心提供。Trizol (美国Invitrogen 公司);Superscript逆转录试剂盒(美国Life Technologies公司);SYBR Green PCR Master Mix(TAKARA公司);引物由Invitrogen公司合成。抗VEGF多克隆抗体(美国santa cruz生物技术公司);SABC免疫组织化学染色试剂盒和浓缩型二氨基联苯胺(DAB)试剂盒均购自北京中山生物技术有限公司。EGCG(纯度90%以上)由浙江大学茶叶研究所提供。髓过氧化物酶(myeloperoxidase,MPO)试剂盒购自南京建成生物有限公司。磷酸盐缓冲液(PBS)自配。
1.2 模型制作及处理小鼠用4%水合氯醛(10 mL/kg)腹腔内注射诱导全身麻醉,一侧眼球以0.4%盐酸奥布卡因滴眼液表面麻醉后,棉签吸除结膜囊液体。直径2 mm圆形滤纸片浸泡于l mol/L 氢氧化钠溶液中1 min,达饱和状态后置于干燥滤纸上1 s,蘸去多余的碱液,将滤纸片置于角膜中央1 min,取下滤纸,用0.9%生理盐水20 mL冲洗角膜及结膜囊1 min。碱烧伤后每日滴抗生素眼药水预防感染,连用3 d。另一侧眼球作为对照。将小鼠随机均分为EGCG组和PBS组:EGCG组于建模后当天起连续腹腔注射EGCG (50 mg/kg)14 d,PBS组以同样方法注射等量的0.01 mol/L PBS。每组各10只小鼠用于角膜上皮修复、CNV和炎症程度的观察,每组各15只用于组织病理学检查和免疫组织化学染色、各30只用于实时定量PCR检测、各45只用于MPO检测。
1.3 角膜上皮修复观察及CNV评分小鼠模型建立后,每12 h观察 1次,连续2 d,第3天开始观察1次/d。每次均采用1%荧光素钠角膜染色,裂隙灯钴蓝光下拍照观察上皮愈合情况,用图像分析软件Imag pro-plus 6.0测量角膜上皮着色面积,然后通过以下公式计算角膜上皮恢复率:角膜上皮修复率(%)=[(0天着色面积-观察天着色面积)/0天着色面积] ×100%。 每天在裂隙灯下观察小鼠模型CNV的生长情况,评分标准参照有关小鼠真菌性角膜炎模型CNV的评分系统[10],具体见表1。
| 评分 | CNV象限数 | 每个象限的CNV数量 | 最长CNV占角膜半径比例 |
| 1 | 1 | 1~5 | 0.05~0.25 |
| 2 | 2 | 6~10 | 0.26~0.50 |
| 3 | 3 | 11~15 | 0.51~0.75 |
| 4 | 4 | >15 | >0.75 |
小鼠模型角膜碱烧伤炎症反应程度的评分参照Oztürk等[11]提出的方法,并加以修改,炎症指数为以下两个项目的总分。①中央角膜混浊程度分级:0分为角膜无混浊;1分为角膜轻度混浊,虹膜纹理清晰可见;2分为角膜混浊较重,看不清虹膜细节;3分为角膜混浊进一步加重,不能窥见瞳孔。②周边角膜混浊程度分级:0分为角膜无混浊;1分为角膜轻度混浊,虹膜纹理清晰可见;2分为角膜混浊较重,看不清虹膜细节;3分为角膜混浊进一步加重,不能窥见瞳孔。
1.5 组织病理学检查角膜组织CNV和炎症细胞EGCG组和PBS组在建模后第3、7、14天每组分别随机处死5只小鼠,迅速摘除模型眼,10%甲醛溶液固定,常规石蜡包埋和切片,厚度约为4 μm,常规苏木素-伊红(HE)染色,在光镜下观察CNV和炎症细胞浸润情况。CNV计数:每只模型眼随机选取3张组织病理切片,每张切片任选5个高倍视野(×400),记录每个视野下CNV横断面的数量,计数时以管腔完整为准,管径粗细不计。炎症细胞计数:每只模型眼随机选取3张组织病理切片,每张切片任选5个高倍视野(×400),分别计数5个视野内的中性粒细胞数,以均数±标准差($\bar x$±s)表示。
1.6 免疫组织化学染色检测角膜组织血管内皮生长因子(VEGF)免疫组织化学染色采用二步法,按照试剂盒说明进行,以PBS代替一抗为阴性对照。以组织内出现棕黄色颗粒为阳性判断标准,细胞膜和细胞质不染色为阴性。根据染色强度阳性分为:+(黄色)、++(棕黄色)、+++(棕黑色)。染色后采用病理图像分析仪(德国莱卡 DMR+Q550)分析VEGF含量,每张切片随机取5个视野,10×40倍镜下作图像分析,计算5个视野的平均光密度值。
1.7 实时定量PCR检测角膜组织VEGF mRNAEGCG组和PBS组在建模后第1、3、7天每组分别随机处死10只小鼠,摘取模型眼,每个时点取等量的正常小鼠眼球作为对照(正常对照组)。沿角巩膜缘剪下全角膜,每2个角膜合为一个RNA提取样本,采用Trizol一步法提取总RNA,紫外分光光度计测定RNA浓度,逆转录成cDNA。 实时定量PCR采用ABI 7500 实时 PCR 系统,SYBR Green方法。每个样本均做3个平行孔,GAPDH作为内参。VEGF基因上游引物:5’-GAACTTTCTGCTCTCTTGG-3’,下游引物: 5’-CTTCTGCTCTCCTTCTGTC-3’,扩增片段长度103 bp。GAPDH基因上游引物:5’-CGTGTTCCTACCCCCAATGT-3’,下游引物:5’-TGTCATCATACTTGGCAGGTTTCT-3’,扩增片段长度为173 bp。反应结束仪器自动生成Ct (threshold cycles)值和熔解曲线。ΔCt表示各待测基因与GAPDH的Ct值的差值,ΔΔCt表示EGCG组、PBS组与对照组待测基因ΔCt值的差值。通过2ΔΔCt的公式计算,对照组ΔΔCt=0,2ΔΔCt=1,EGCG组和PBS组所得数据为相对于对照组的待测基因的变化倍率。
1.8 角膜组织MPO检测EGCG组和PBS组在建模后第3、7、14天分别随机处死15只小鼠,迅速摘除模型眼,3只眼球合为1个标本,采用商品化MPO测试盒定量检测MPO活性,实验步骤严格按试剂盒中产品说明书进行。
1.9 统计学分析采用SPSS 15.0统计软件。计量资料以均数±标准差($\bar x$±s)表示,两组数据均符合正态分布,组间比较采用配对t检验。以P<0.05为差异有统计学意义。
2 结 果 2.1 EGCG对碱烧伤角膜上皮的修复作用整个实验过程中,所有小鼠的角膜均未发生感染。PBS组:碱烧伤后0.5 h荧光素钠染色,裂隙灯显微镜观察可见角膜中央边界清楚的近圆形上皮缺损(图1A)。第1天,角膜中央荧光素钠染色范围缩小(图1B);第 3天,上皮缺损范围进一步缩小(图1C);第7天时,可见小块状上皮缺损(n=7)或基本修复(n=3,图1D);第14天时,角膜上皮均基本愈合(n=10)。EGCG组:碱烧伤0.5 h后的表现与PBS组相同(图1E)。随后第1天,荧光素钠染色可见分散块状的角膜上皮缺损(图1F);从第3天起角膜上皮基本修复(图1G)。EGCG组在建模后第1、3、7天的角膜上皮恢复率均比PBS组高,差异均有统计学意义(均P≤0.01),见表2。
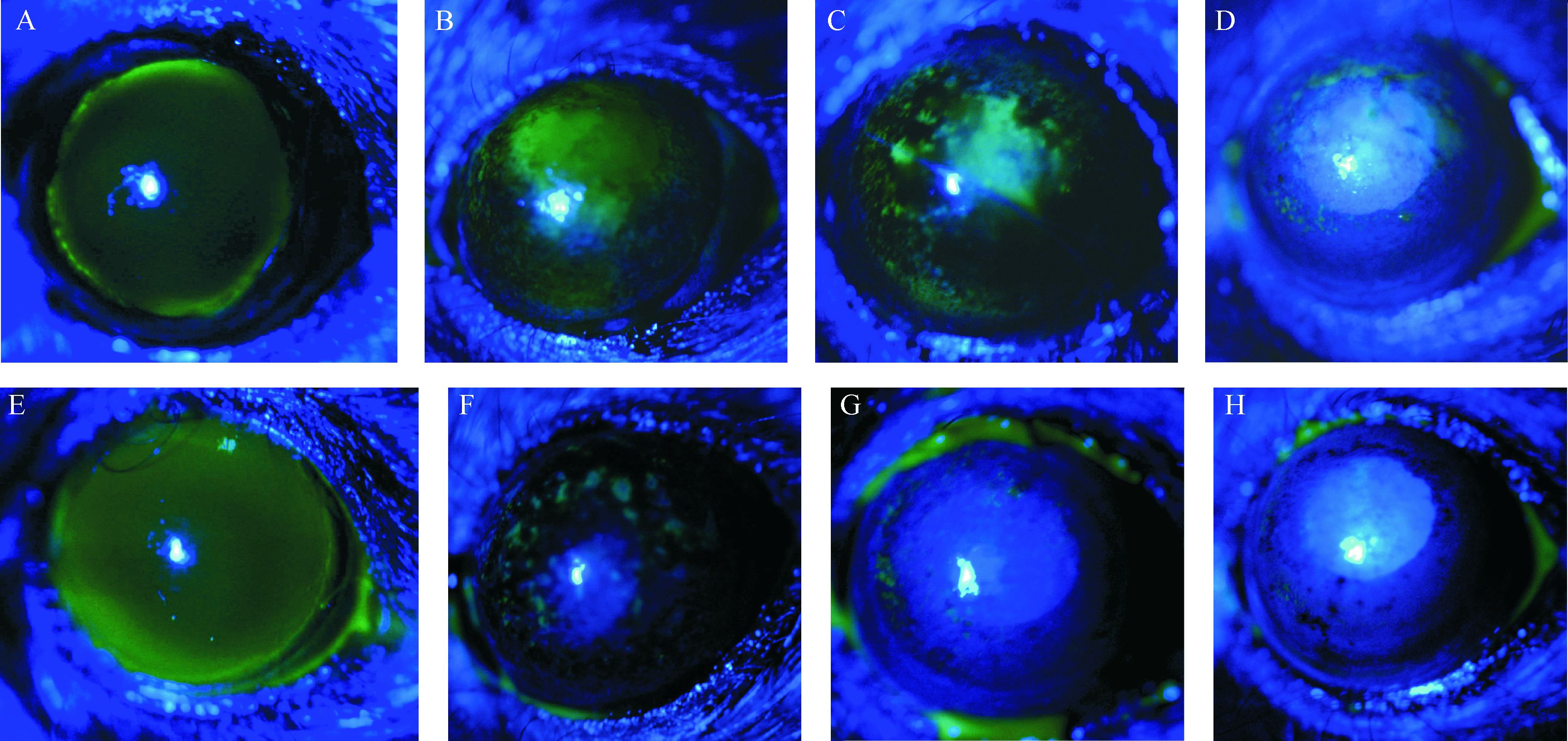
|
| A-D: PBS组碱烧伤后0.5 h和第1、3、7天角膜上皮;E-H: EGCG组碱烧伤后0.5 h和第1、3、7天角膜上皮. 均为荧光素钠染色,裂隙灯显微镜钴蓝光下拍摄. 图1 EGCG组和PBS组碱烧伤后角膜上皮修复情况 Fig.1 Healing of the corneal epithelium of murine corneal alkali burn models in EGCG and PBS groups |
| ($\bar x$±s,%) | ||||
| 组别 | n | 第1天 | 第3天 | 第7天 |
| PBS组 | 10 | 23.8±7.6 | 61.2±6.8 | 74.0±9.1 |
| EGCG组 | 10 | 41.0±13.0 | 76.6±7.5 | 87.8±8.5 |
| t值 | -3.61 | -4.81 | -3.51 | |
| P值 | <0.01 | <0.01 | 0.01 | |
建模后第1、2天裂隙灯显微镜观察可见PBS组角膜缘出现新生血管芽,第3天起可观察到短、 细、密的CNV(图2A),CNV快速向角膜中央生长,管径增粗并形成血管网(图2B),在建模后第14天到达角膜中央区域(图2C)。EGCG组CNV生长程度较PBS组轻(图2D),在碱烧伤后第7天于角膜周边处可以观察到CNV,管径相对较细,长度较短(图2E),之后便逐渐消退(图2F)。PBS组小鼠建模后第3、7、14天的CNV评分分别为6.6±1.0、8.1±1.0、9.2±1.1,EGCG组小鼠建模后第3、7、14天的CNV评分分别为1.1±0.5、1.3±0.3、0.9±0.2。EGCG组在各个时间点的评分均较PBS组低(均P<0.05)。

|
| A-C: PBS组碱烧伤后第3、7、14天角膜CNV;D-F : EGCG组碱烧伤后第3、7、14天角膜CNV. 均为裂隙灯显微镜下拍摄. 图2 EGCG组和PBS组碱烧伤后角膜CNV生长情况 Fig.2 Growth of CNVs of murine corneal alkali burn models in EGCG and PBS groups. |
PBS组建模后0.5 h开始出现界限明确的角膜混浊区域,裂隙灯观察可见基质轻度水肿,瞳孔缘可见,虹膜纹理欠清;建模后第1~7天,角膜水肿混浊逐渐加重并到达高峰,此后水肿有所减退。EGCG组在建模后0.5 h的表现与PBS组相同,角膜水肿混浊在第3天起便呈逐渐减轻趋势。PBS组小鼠建模后第3、7、14天的炎症指数分别为3.7±0.5、4.0±0.0、3.2±0.4,EGCG组小鼠建模后第3、7、14天的炎症指数分别为3.2±0.4、2.3±0.5、0.4±0.8。EGCG组在各个时间点的炎症指数均较PBS组低,在第7、14天的差异均有统计学意义(均P<0.05)。
2.4 EGCG对碱烧伤角膜组织病理学改善作用正常小鼠角膜上皮4~5层,基质纤维排列整齐,无血管结构。PBS组:碱烧伤后第3天可见中央角膜仅覆盖单层上皮细胞,基质水肿,胶原排列疏松,以中性粒细胞为主的炎症细胞浸润明显(图3A);第7天可见3层角膜上皮细胞,但排列欠规整,基质层可见大量粗大的血管管腔,管内可见大量红细胞(图3B);第14天时基质内炎症细胞和血管均有减少。与PBS组相比,EGCG组在碱烧伤3天后角膜上皮层已经修复(图3C、图3D),基质内可见少量炎性细胞浸润,排列稀疏的血管管腔,管径较小(图3D)。碱烧伤后第3、7、14天,EGCG组CNV数量和中性粒细胞计数均少于PBS组(均P<0.01),见表3。
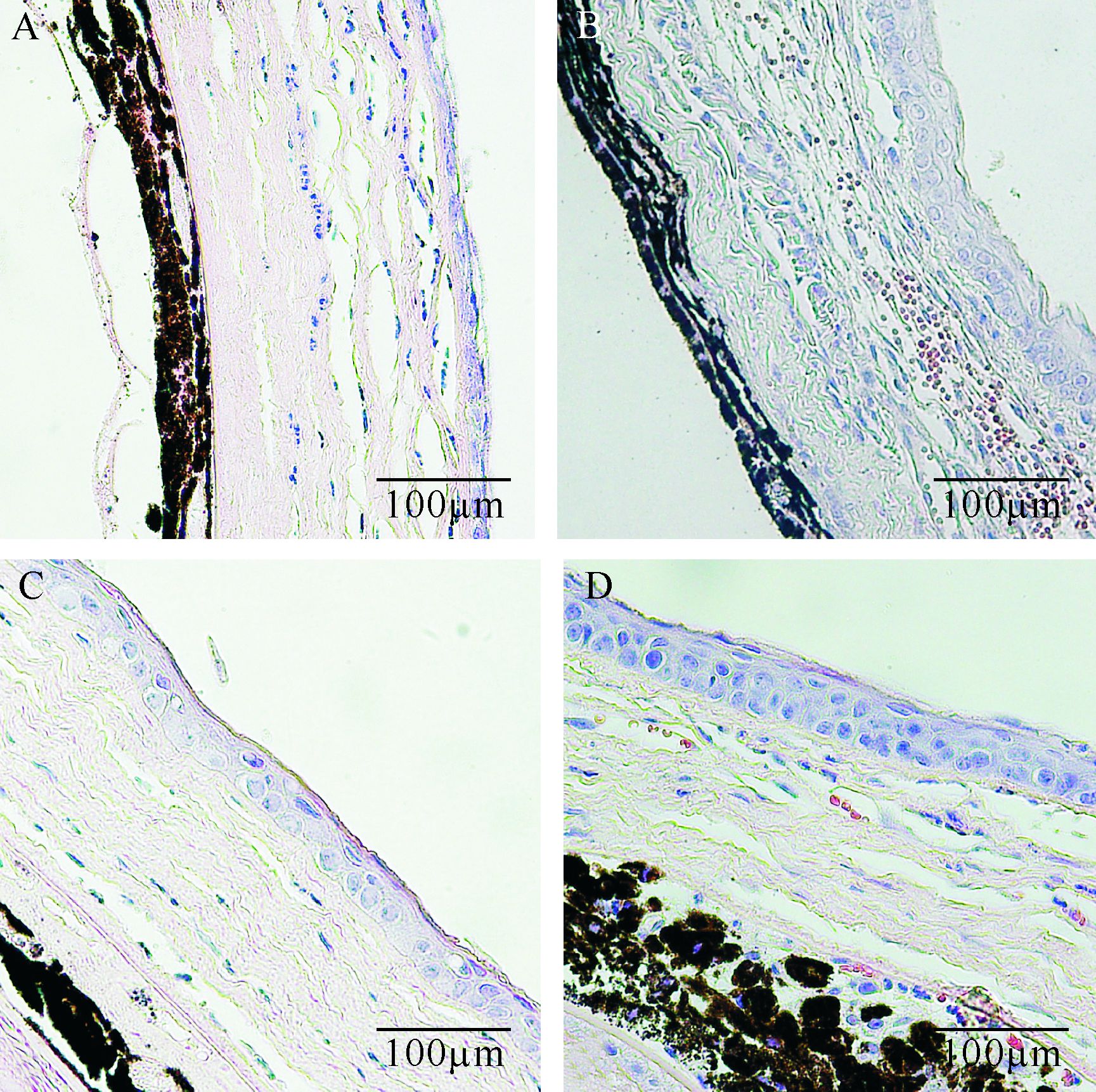
|
| A、B: PBS组碱烧伤后第3、7天;C、D : EGCG组碱烧伤后第3、7天. 图3 EGCG组和PBS组碱烧伤后的组织病理学表现(HE染色) Fig.3 Histopathologic manifestations of murine corneal alkali burn models in EGCG and PBS groups (HE染色) |
| ($\bar x$±s,%) | |||||||
| 组别 | n | CNV数量 | 中性粒细胞计数 | ||||
| 第3天 | 第7天 | 第14天 | 第3天 | 第7天 | 第14天 | ||
| PBS组 | 10 | 2.92±0.95 | 7.92±1.28 | 5.88±0.76 | 90.0±28.8 | 54.9±25.9 | 39.0±17.9 |
| EGCG组 | 10 | 1.68±0.61 | 4.80±1.36 | 3.64±0.71 | 34.5±15.7 | 17.1±11.4 | 12.8±4.6 |
| t值 | 9.51 | 14.47 | 18.65 | 14.65 | 11.57 | 12.28 | |
| P值 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 | 0.01 | |
VEGF在正常角膜上皮中有微弱表达,VEGF阳性反应为棕黄色或棕色颗粒;碱烧伤后第3天,两组均可见VEGF在上皮细胞和炎症细胞内表达,PBS组呈+或++(图4A),EGCG组呈+(图4C); 碱烧伤后第7天,两组VEGF表达均达高峰,角膜上皮细胞层和基质层内炎症细胞和CNV区域VEGF表达明显增强,PBS组呈+++(图4B),EGCG组呈++(图4D);碱烧伤后第14天两组VEGF表达有所下降,PBS组呈+,EGCG组呈+。碱烧伤后第3天和第7天,EGCG组VEGF的光密度值均低于PBS组(均P<0.01); 碱烧伤 后第14天,两组VEGF的光密度值差异无统计学意义(P>0.05),见表4。
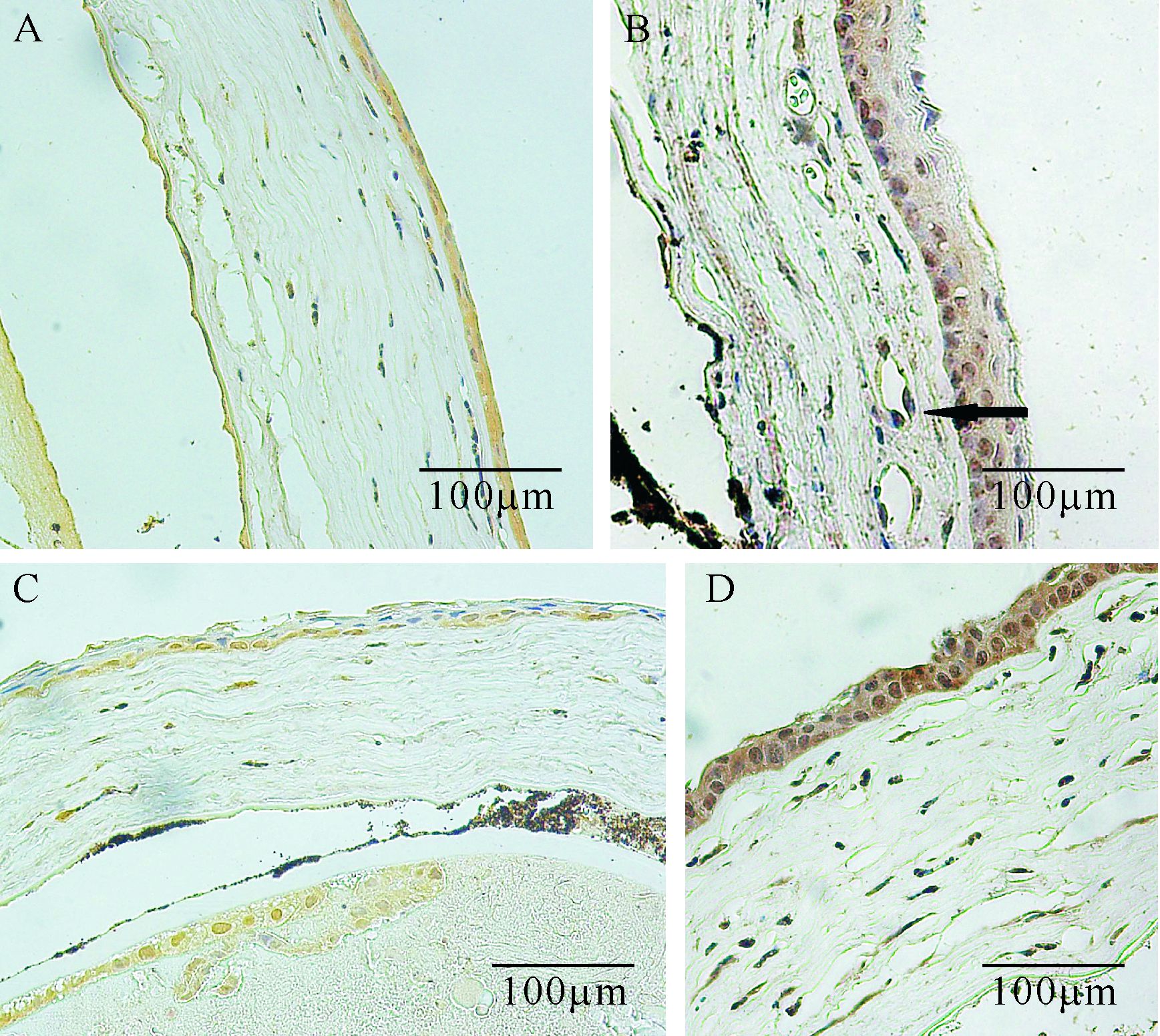
|
| A、B: PBS组碱烧伤后第3、7天,黑色箭头示着染的血管内皮细胞;C、D: EGCG组碱烧伤后第3、7天. 图4 EGCG组和PBS组碱烧伤后VEGF免疫组织化学染色 Fig.4 Anti-VEGF immunohistochemical staining of murine corneal alkali burn models in EGCG and PBS groups |
| ($\bar x$±s,%) | ||||
| 组别 | n | 第3天 | 第7天 | 第14天 |
| PBS组 | 5 | 0.45±0.08 | 0.84±0.09 | 0.34±0.07 |
| EGCG组 | 5 | 0.19±0.05 | 0.42±0.07 | 0.32±0.04 |
| t值 | 23.87 | 31.90 | 1.92 | |
| P值 | <0.01 | <0.01 | 0.06 | |
建模后第1、3和7天,PBS组和EGCG组角膜VEGF的mRNA表达均明显升高,并于碱 烧伤后第3天达高峰,分别达到正常对照组的(109.1±11.2)倍和(59.6±4.7)倍;碱烧伤后第1、3、7天,PBS组VEGF的mRNA表达明显高于EGCG组(图5),差异均有统计学意义(均P<0.05)。

|
| 图5 PBS组和EGCG组角膜中VEGFmRNA的表达比较 Fig.5 Comparison of corneal VEGF mRNA expression of murine alkali burn models in PBS and EGCG groups |
建模后第3、7和14天,PBS组的MPO检测值分别为3.53±0.23,3.09±0.24,1.34±0.29,EGCG组的MPO检测值分别为2.73±0.34,1.76±0.20,0.68±0.25。两组小鼠的MPO检测值均呈下降趋势,EGCG组MPO检测值在各个时 点均低于PBS组(均P <0.05)。
3 讨 论角膜碱烧伤是临床上复杂且难以治愈的眼病之一,部分患者因烧伤后角膜持续不愈,甚至溶解穿孔而失明,更多的患者因为角膜瘢痕和严重的CNV形成而致盲。为了恢复碱烧伤后角膜的透明性,角膜移植术是必不可少的治疗措施。但由于碱烧伤角膜的炎症和CNV形成,移植排斥率极高,角膜存活率不足10%[12]。因此,角膜碱烧伤的治疗仍是眼科医师面临的巨大挑战,其治疗主要有3个难点:①抑制炎症及其导致的二次角膜组织损伤;②促进角膜修复;③抑制CNV的生成。目前临床上主要使用糖皮质激素抑制角膜碱烧伤炎症,但其在角膜创伤修复方面的影响一直存在争议,且有引发青光眼、白内障、眼表感染等一系列眼部并发症的问题。另外,有研究报道抗VEGF药物虽可抑制CNV形成,但在抑制炎症和促进角膜上皮修复方面并无作用[13]。理想的角膜碱烧伤治疗药物必须能同时解决上述难点,才能最终给角膜碱烧伤的治疗带来突破性的进展,给广大患者和临床眼科医师带来新的希望。
本研究发现,小鼠角膜碱烧伤后主要表现为以中性粒细胞浸润为主的急性炎症反应;与PBS组相比,EGCG能够有效地减轻角膜碱烧伤后炎症细胞浸润、角膜混浊程度,以及显著抑制角膜CNV的生长。EGCG在其他疾病方面的作用也有类似报道,Chan等[14]研究发现绿茶能够抑制烟草诱发的呼吸道中性粒细胞浸润,并抑制弹性蛋白酶、基质金属蛋白酶活性,从而减轻吸烟引起的肺损伤。Dona等[4]证明微摩尔每升剂量的EGCG即能抑制中性粒细胞中氧自由基的活性。Katiyar等[15]发现EGCG能阻断由紫外线β诱发的皮肤白细胞浸润,减少氧自由基的生成,从而减轻皮肤炎症反应。但EGCG对眼表炎症作用的研究甚少[16],其对碱烧伤角膜炎症的作用机制尚不清楚。碱烧伤后多形核白细胞激活、炎性浸润和释放大量破坏性酶类以及氧自由基是导致角膜组织损伤的主要途径,且炎症也与CNV的生成密不可分,因此我们推测EGCG可能通过抑制中性粒细胞的趋化,清除自由基,抑制相关蛋白酶的活性,从而抑制角膜碱烧伤的炎症反应,减少组织损伤,以利修复。与此同时,抑制炎症反应也能在一定程度上抑制CNV的生成。Dona等[4]同样发现,EGCG除能抑制中性粒细胞的氧自由基活性、抑制趋化因子诱导的中性粒细胞趋化作用外,还能在体内炎性血管生成模型实验中抑制中性粒细胞介导的血管生成。
眼表CNV的形成是多种因素共同作用的结果,除炎症外,角膜内血管生成因子的刺激作用已被许多研究证实。VEGF是其中一种重要的血管生成因子,它特异作用于血管内皮细胞的有丝分裂原,促进血管内皮细胞增殖和血管渗漏。近年来,绿茶多酚对VEGF表达的抑制作用也备受关注。Oak等[17]发现,绿茶多酚能够强烈地抑制血管平滑肌细胞中VEGF的表达;Sartippour等[18]报道绿茶多酚能减少乳腺肿瘤细胞和头部肿瘤中VEGF的产生。Cao等[8]发现给小鼠喝绿茶能有效阻止CNV的生成。绿茶多酚抑制VEGF的机制尚不十分清楚,目前的研究证明绿茶多酚中的EGCG能从以下四方面起作用:①干扰诱导VEGF表达的信号转导途径;②影响VEGF基因的转录和翻译过程,减少VEGF表达;③抑制VEGF/VEGF受体复合物的形成,影响VEGF的功能;④在上游直接减少诱导VEGF产生的因子。本研究发现,在碱烧伤早期,角膜VEGFmRNA的表达即开始上升并于第3天达高峰,VEGF蛋白的表达量于第7天达高峰,与此同时,CNV生长速度最快,此后VEGF表达逐渐减弱,CNV生长速度变慢,VEGF表达与CNV增殖平行;EGCG治疗能显著抑制VEGF基因和蛋白的表达以及CNV的生长。因此,我们推测EGCG可能通过抑制VEGF表达来抑制CNV形成。另外,也有研究报道EGCG能够抑制基质金属蛋白酶2的表达和活化[19, 20],以及抑制内皮细胞和血管平滑肌的迁移和增殖,从而抑制CNV[21, 22],这也是我们将进一步深入研究的方向之一。
此外,本研究还发现一个非常有意义的现象:EGCG组角膜上皮修复速度明显加快。这是EGCG具有促进上皮修复的直接作用,还是抗炎作用的间接表现?尚不得而知。为此,我们还进行了部分体外细胞培养实验,研究发现低浓度EGCG(≤40 μmol/L)具有促进角膜上皮细胞增殖和迁移的作用,显著上调与细胞迁移相关的pAkt、pFAK、F-actin和vinculin的表达量(该研究结果尚未发表),可能与EGCG促进角膜上皮细胞修复的现象有关。
综上所述,本研究认为EGCG能同时促进小鼠碱烧伤角膜上皮修复、减轻炎症反应和抑制CNV的生成,很可能是一个极为理想的角膜碱烧伤治疗药物,但尚需要进一步深入的作用机制探讨、局部使用治疗效果和毒副作用的观察等后续研究支持。
志谢 相关研究在浙江大学医学院附属第一医院完成.
| [1] | DONÀ M, DELL'AICA I, CALABREASE F, et al. Neutrophil restraint by green tea: inhibition of inflammation, associated angiogenesis, and pulmonary fibrosis[J]. J Immunol, 2003, 170(8):4335- 4341. |
| [2] | AHMAD N, CHENG P, MUKHTAR H. Cell cycle dysregulation by green tea polyphenol epigallocatechin-3-gallate[J]. Biochem Biophys Res Commun, 2000, 275(2):328-334. |
| [3] | ALBINI A. Tumor and endothelial cell invasion of basement membranes. The matrigel chemoinvasion assay as a tool for dissecting molecular mechanisms [J]. Pathol Oncol Res,1998, 4(3):230-241. |
| [4] | PIYAVIRIYAKUL S, SHIMIZU K, ASAKAWA T, et al. Anti-angiogenic activity and intracellular distribution of epigallocatechin-3-gallate analogs[J]. Biol Pharm Bull, 2011, 34(3):396- 400. |
| [5] | TOSETTI F, FERRARI N, DE FLORA S, et al. Angioprevention: angiogenesis is a common and key target for cancer chemopreventive agents[J]. FASEB J, 2002, 16(1):2-14. |
| [6] | ALBINI A, IWAMOTO Y, KLEINMAN H K, et al. A rapid in vitro assay for quantitating the invasion potential of tumor cells[J]. Cancer Res, 1987, 47(12):3239-3245. |
| [7] | BALASUBRAMANIAN S, EFIMOVA T, ECKERT R L. Green tea polyphenol stimulates a Ras, MEKK1, MEK3, and p38 cascade to increase activator protein 1 factor-dependent involucrin gene expression in normal human keratinocytes[J]. J Biol Chem, 2002, 277(3):1828-1836. |
| [8] | CAO Y, CAO R. Angiogenesis inhibited by drinking tea[J]. Nature, 1999, 398(6726):381. |
| [9] | SÁNCHEZ-HUERTA V, GUTIRREZ-SÁNCHEZ L, FLORES-ESTRADE J. (-)-Epigallocatechin 3-gallate (EGCG) at the ocular surface inhibits corneal neovascularization[J]. Med Hypotheses, 2011, 76(3):311-313. |
| [10] | YUAN X, WILHELMUS K R. Corneal neovascularization during experimental fungal keratitis[J]. Mol Vis, 2009, 15: 1988-1996. |
| [11] | OZTVRK F, KURT E, CERÜI M, et al. The effect of propolis extract in experimental chemical corneal injury[J]. Ophthalmic Res, 2000, 32(1):13-18. |
| [12] | YAMADA J, DANA MR, SOTOZONO C, et al. Local suppression of IL-6 by receptor antagonist in the rat model of corneal alkali injury[J]. Exp Eye Res, 2003, 76(2):161-167. |
| [13] | MEKKO G R, PIZZOLATTI M L, WASILEWSKI D, et al. The effect of subconjunctival bevacizumab on corneal neovascularization, inflammation and reepithelization in a rabbit model[J]. Clinics (Sao Paulo), 2011, 66(8):1443-1450. |
| [14] | CHAN K H, CHAN S C, YEUNG S C, et al. Inhibitory effect of Chinese green tea on cigarette smoke-induced up-regulation of airway neutrophil elastase and matrix metalloproteinase-12 via antioxidant activity[J]. Free Radic Res, 2012, 46(9):1123-1129. |
| [15] | KATIYAR S K, MATSUI M S, ELMETS C A, et al. Polyphenolic antioxidant (-)-epigallocatechin-3-gallate from green tea reduces UVB-induced inflammatory responses and infiltration of leukocytes in human skin[J]. Photochem Photobiol, 1999, 69(2):148-153. |
| [16] | LEE H S, CHANHAN S K, OKANOBO A, et al. Therapeutic efficacy of topical epigallocatechin gallate in murine dry eye[J]. Cornea, 2011, 30(12):1465-1472. |
| [17] | OAK M H, CHATAIGNEAU M, KERAVIS T, et al. Red wine polyphenolic compounds inhibit vascular endothelial growth factor expression in vascular smooth muscle cells by preventing the activation of the p38 mitogen-activated protein kinase pathway[J]. Arterioscler Thromb Vasc Biol, 2003, 23(6):1001-1007. |
| [18] | SARTIPPOUR M R, SHAO Z M, HEBER D, et al. Green tea inhibits vascular endothelial growth factor(VEGF) induction in human breast cancer cells[J]. J Nutr, 2002, 132(8):2307-2311. |
| [19] | OAK M H, EL BEDOUI J, ANGLARD P, et al. Red wine polyphenolic compounds strongly inhibit pro-matrix metalloproteinase-2 expression and its activation in response to thrombin via direct inhibition of membrane type1-matrix metalloproteinase in vascular smooth muscle cells[J]. Circulation, 2004, 110(13):1861-1867. |
| [20] | ANNABI B, LACHAMBRE M P, BOUSQUET-GAGNON N, et al. Green tea polyphenol (-)-epigallocatechin 3-gallate inhibits MMP-2 secretion and MT1-MMP-driven migration in glioblastoma cells[J]. Biochim Biophys Acta, 2002, 1542(1-3):209-220. |
| [21] | KOJIMA-YUASA A, HUA J J, KENNEDY D O, et al. Green tea extract inhibits angiogenesis of human umbilical vein endothelial cells through reduction of expression of VEGF receptors[J]. Life Sci, 2003, 73(10):1299-1313. |
| [22] | IIJIMA K, YOSHIZUMI M, HASHIMOTO M, et al. Red wine polyphenols inhibit vascular smooth muscle cell migration through two distinct signaling pathways[J]. Circulation, 2002, 105(20):2404-2410. |



