至今人们对埃博拉病毒病的发病机制仍然不甚了解,其中一个重要原因是埃博拉病毒的自然宿主仍不明确,对埃博拉病毒病患者进行密切的观察非常困难也是原因之一。埃博拉病毒可以攻击人体内除了骨骼肌和骨头之外的所有内脏和组织。病毒在体内迅速扩散、大量繁殖,袭击多个器官,使之发生变性、坏死,并慢慢被分解,产生弥散性血管内凝血,最后因多器官功能衰竭、脑部受损等原因而死亡。对于埃博拉病毒病的预防和治疗,目前为止还没有特效疗法,也没有特效的预防性疫苗。深入研究和了解埃博拉病毒病的发病机制对有效预防和治疗该疾病有十分重要的意义。
1 埃博拉病毒感染细胞的分子生物学机制埃博拉病毒属于单分子负链RNA病毒目,丝状病毒科。其基因组由18.9 kb RNA组成,编码核蛋白(NP)、病毒颗粒蛋白(VP)35、VP40、VP30、VP24、糖蛋白(GP)和RNA依赖的RNA聚合酶蛋白(L蛋白)等[1]。病毒感染包括吸附、穿入、脱壳、合成、装配、成熟和释放等步骤[1],尽管目前埃博拉病毒侵染细胞的机制尚未明确,但近年来随着相关研究的增加和深入,其感染过程中一些步骤的细节已逐渐清晰起来。埃博拉病毒的感染过程与病毒基因编码的I型跨膜蛋白GP有着密切的关系。GP由两个亚单位GP1和GP2组成,它们之间由二硫键相连接。GP是病毒侵入靶细胞的关键蛋白之一,同时也是病毒逃避免疫反应、参与宿主细胞调控等的主要蛋白。
埃博拉病毒包括4种亚型:扎伊尔型埃博拉病毒、苏丹型埃博拉病毒、科特迪瓦型埃博拉病毒和雷斯顿型埃博拉病毒。发生在扎伊尔[刚果(金)]、苏丹和科特迪瓦的三亚型埃博拉病毒能使人类致病。不同亚型毒力不同,扎伊尔型埃博拉病毒毒力最强,致死率高达88%;苏丹型埃博拉病毒次之,致死率约为50%;科特迪瓦型埃博拉病毒对黑猩猩有致死性,对人的毒力较弱,致病但不致死;雷斯顿型埃博拉病毒对非人类灵长类动物有致死性,人感染不发病[2]。
1.1 侵入细胞机制病毒进入细胞是病毒感染的第一步,也是病毒致病的一个先决条件。而宿主细胞摄取毒粒可能是通过多种不同的细胞依赖的内吞方式进行的。真核生物的内吞作用分为通过网格蛋白介导的内吞作用、巨胞饮作用以及吞噬作用等。研究表明,埃博拉病毒可能会根据宿主细胞大小以及毒粒大小的不同通过多种方式穿入细胞,而且在宿主的多种组织和细胞内都能进行复制。
1.1.1 通过有被小凹和网格蛋白内吞内吞作用是生物体摄取生物大分子的主要形式,其中网格蛋白介导的内吞作用由接头蛋白和网格蛋白的招募开始。网格蛋白是由3条重链和3条轻链构成的三聚物,激活后在细胞膜内表面聚集,然后被网格蛋白包裹的有被小凹发生内陷、缢缩、包被液泡芽殖和包被液泡脱壳。最后脱壳后的网格蛋白会被胞膜上的接头蛋白迅速回收,以便于下一次使用[1]。Empig等[3]通过研究发现一些有被小凹形成抑制剂,如胆固醇螯合药物、佛波醇酯等能够抑制丝状假病毒进入人体细胞,以此推断丝状病毒可能是通过细胞表面有被小凹介导的内吞作用进入宿主细胞。Bhattacharyya等[4]研究了一些抑制剂对含有埃博拉病毒包膜糖蛋白的人类免疫缺陷病毒假病毒感染细胞的影响,其中一种抑制剂为氯丙嗪,它可以使网格蛋白在内体膜附近集聚,从而阻止网格蛋白回收。此外,用小分子干扰RNA敲除网格蛋白重链基因,对该假病毒侵染细胞也有抑制作用。以上研究结果说明埃博拉病毒可能是通过网格蛋白介导的内吞作用来感染细胞。
1.1.2 巨胞饮作用胞饮作用是细胞内吞作用从外界获取物质及液体的一种方式,是细胞外的微粒通过细胞膜的内陷包裹形成小囊泡(胞饮囊泡),最终与溶酶体相结合并将囊泡内部的物质水解或者分解的过程。这个过程能非选择性地吞入可溶性分子、营养物质和抗原等。巨胞饮作用依赖于肌动蛋白,其过程开始于膜表面褶皱产生的巨噬泡。
传统的网格蛋白和小凹蛋白1介导的内吞作用的内吞泡直径通常分别小于200nm和100nm。因此推论埃博拉病毒这样较大的毒粒可能通过巨胞饮作用进入细胞[5]。Aleksandrowicz等[6]发现埃博拉病毒样颗粒主要通过巨胞饮作用进入细胞。他们认为埃博拉病毒样颗粒可能刺激细胞发生褶皱,从而引发了巨胞饮作用将病毒样颗粒吞入细胞。几种巨胞饮作用的抑制剂如拉春库林A、钠/氢离子交换体阻滞剂和渥曼青霉素均可以抑制埃博拉病毒样颗粒进入细胞内部。Nanbo等[7]也发现埃博拉病毒的GP首先与细胞膜上受体结合,通过激活细胞膜表面肌动蛋白调节分子,引发细胞表面褶皱进而开始巨胞饮作用。此外,Saeed等[8]使用了具有复制和感染能力的扎伊尔型埃博拉病毒来感染人胚胎肾细胞和绿猴肾细胞,结果显示该病毒的穿入与网格蛋白、小凹蛋白、马达蛋白均无关,但表现出巨胞饮作用的特征:病毒与细胞膜上受体的结合直接刺激了细胞对液相的吸收以及局部肌动蛋白的聚合。
1.2 胞内融合机制包膜病毒需要将病毒包膜和宿主细胞膜或内体膜融合,然后将基因组释放到胞质中进行复制。融合通过病毒表面的一种或几种跨膜GP介导,不同的病毒融合蛋白有不同结构和不同激活模式,因而也就有不一样的融合机制。尽管如此,不同的融合机制均遵循以下大致的步骤:在激活剂的作用下,病毒融合蛋白与内体膜相接合,触发病毒融合蛋白构象改变,暴露出中心融合肽以介导病毒包膜和内体膜融合,然后释放遗传物质入胞内[9]。
1.2.1 组织蛋白酶埃博拉病毒的糖蛋白为I型病毒融合蛋白,它由两个亚基组成:连接亚基GP1和融合亚基GP2,两亚基之间以二硫键相连。Bale等[10]最新研究表明,埃博拉病毒GP1和GP2在酸碱度值较低时并不能单独完成构象变化和介导融合,可能还需要另外的激活信号如与其他的细胞内蛋白进行结合来触发构象改变,完成融合准备。Schornberg等[11]通过化学抑制剂和小分子干扰RNA的作用,确证了组织蛋白酶B和组织蛋白酶L在埃博拉病毒GP介导的感染中所起的作用。研究结果显示组织蛋白酶B和组织蛋白酶 L将GP1切割为相对分子量为19大小的片段来为融合做好准备,但该大小的片段是如何触发膜的结合和诱导融合的机制尚不明确。Brecher等[12]将不同形态的GP与脂质体结合,证明了相对分子量为19的片段与脂质体结合所需的激活温度最低,这说明它是最适宜融合的形态。但是在另一项研究中,Martinez等[13]却认为组织蛋白酶L对埃博拉病毒感染人树突细胞几乎没什么作用,提示组织蛋白酶B和组织蛋白酶 L在埃博拉病毒感染细胞中的作用机制尚待进一步明确。许多研究表明,埃博拉病毒除了表达膜融合蛋白GP外,还表达两种分泌型GP和一种Δ-肽段,其中分泌型GP包括可溶糖蛋白(sGP)和小分子可溶糖蛋白(ssGP),这些ssGP与GP相比具有相同的N端,其中包含受体结合区域,但C末端不同。Radoshitzky等[14]将合成的sGP、ssGP 以及Δ-肽段分别加入Vero E6和Hela等细胞系中孵育,发现这些肽段能抑制逆转录假病毒通过GP介导的方式穿入细胞。推测可能的机制是这些ssGP与GP竞争结合内体上丝状病毒的受体,或者是干扰了组织蛋白酶对GP的切割。然而这些假设还有待实验进一步明确。
1.2.2 Niemann-Pick C1相关研究认为埃博拉病毒进入细胞也与Niemann-Pick C1(NPC1)有关,NPC1编码一种膜蛋白,参与细胞的胆固醇转运。Carette等[15]对NPC1突变细胞进行感染实验,发现携带埃博拉病毒包膜蛋白且有复制能力的水泡性口炎病毒(rVSV-GP-EBOV)几乎不感染该细胞;而当细胞再次表达NPC1后它又恢复了对病毒的易感性。与此一致的是,Côté等[16]研究了一些NPC1的小分子抑制剂如苄基哌嗪金刚烷二酰胺衍生物,发现其对埃博拉病毒感染绿猴肾细胞有干扰作用。由此,他们提出了相近的埃博拉病毒侵染细胞的可能机制:首先埃博拉病毒内吞进入细胞,然后在内体内被组织蛋白酶B剪切,剪切后的埃博拉病毒的GP与NPC1结合,最后膜融合,GP将遗传物质释放入胞质中。另外,Shimojima等[17]研究也发现埃博拉病毒穿入细胞的受体可能是酪氨酸激酶家族的几种成员。
2 埃博拉病毒病的免疫学及病理学机制埃博拉病毒进入机体之后,会靶标一些负责免疫系统一线防御的免疫细胞,比如树突细胞。正常情况下树突细胞会将感染信息呈递给T细胞,然后T细胞在病毒进一步复制之前摧毁受到感染的细胞。如果树突细胞无法送出正确的信号,T细胞就不会应答感染,相应的抗体也就不能活化。因此埃博拉病毒能在机体中快速复制。有学者研究显示,免疫学机制在埃博拉病毒病发病中起重要作用:在死亡患者血清中,一些细胞因子水平明显升高。如γ干扰素的水平可超过100pg/mL,其他如白细胞介素(IL)-2、IL-I0、肿瘤坏死因子-α(TNF-α)及α干扰素水平均明显升高[18]。一些学者以豚鼠和绿猴为动物模型研究埃博拉病毒病发病机制,结果其感染埃博拉病毒的机制与非人类灵长类动物及人类感染的机制相似。研究者应用免疫组织化学、原位杂交及电镜观察等研究方法发现,单核吞噬细胞系统,特别是巨噬细胞是病毒首先攻击的靶细胞,随后不同组织的间质成纤维细胞、内皮细胞均被感染,血管通透性增加,并有纤维蛋白沉着。病毒几乎侵犯每个器官,但以肝、脾损害最为严重,感染后两日病毒首先在肺中检出,4天后在肝、脾等组织中检出,6天后全身组织均可检出[19]。
2.1 先天免疫损伤许多研究表明先天免疫系统在埃博拉病毒感染中起核心作用。人类和非人类灵长类动物感染埃博拉病毒后,可检测到伴随大量细胞因子产生的炎症反应。在人类体内,埃博拉病毒选择性抑制α干扰素和γ干扰素对双链RNA的反应。Basler等[20]鉴别出了可以抑制干扰素反应的两种埃博拉病毒蛋白。与许多其他病毒一样,埃博拉病毒也能抑制干扰素,干扰素是细胞阻止病毒增殖的一大武器。研究人员发现埃博拉病毒的VP24能结合并阻断免疫细胞表面的转运蛋白,而该蛋白在干扰素通路中具有重要的作用[21]。VP24可能阻碍干扰素信号转导,VP35阻碍干扰素调节因子3的磷酸化,其中,干扰素调节因子3在干扰素产生中起转录因子的作用。近来,Halfmann等[22]指出p38磷酸化作用受阻导致干扰素信号传导受阻,p38的磷酸化作用是丝裂素活化蛋白激酶(MAPK) p38/干扰素信号通路的中心。目前我们对干扰素在体内的抗病毒作用了解还不深。一项非人类灵长类动物研究表明,干扰素信号传导的阻断在活体埃博拉病毒感染发病机制中扮演着重要角色。但是,这项研究只研究了一类干扰素,这类干扰素可能不足以引发抗滤过性病原体的反应[18]。
单核细胞、巨噬细胞和树突细胞在埃博拉病毒感染中是最重要的早期靶细胞;但机体感染埃博拉病毒后,单核细胞和巨噬细胞的作用有多大还不清楚。相反,在先天免疫和获得性免疫中都有重要作用的树突细胞,在体外感染埃博拉病毒实验研究中发现其并不行使功能:感染埃博拉病毒后树突细胞并不能产生前炎性细胞活素或表达协同刺激分子,如CD80或CD86,它们支持T细胞增殖的能力减弱,产生反常成熟过程。不过,研究结果显示,非感染性埃博拉病毒样颗粒可以引起这些反应,这表明感染性埃博拉病毒可能干扰或抑制了树突细胞的活性[23]。
自然杀伤细胞也是受埃博拉病毒感染影响的先天免疫细胞。这些细胞以独立抗原的方式应答滤过性毒菌的感染,并且通过释放穿孔素和颗粒酶诱导凋亡来杀死被感染的细胞。自然杀伤细胞可能不受埃博拉病毒的侵害,但在非人类灵长类动物感染埃博拉病毒的过程中,自然杀伤细胞的数量锐减,4天后几乎完全消失;自然杀伤细胞中半胱氨酸天冬氨酸特异性蛋白酶(caspase)活性增强,淋巴细胞中出现DNA碎片。电子显微镜观察结果表明凋亡导致自然杀伤细胞数量减少。人类感染埃博拉病毒后,伴随外周血单核细胞CD3、CD8分子mRNA和T淋巴细胞受体γβ mRNA消失,血管内广泛出现细胞凋亡迹象。但这些数据并不能证实这些衰竭的细胞是CD8+自然杀伤细胞、CD8+细胞毒性细胞或T淋巴细胞[24]。不过,另有研究表明,人类感染埃博拉病毒后体内自然杀伤细胞的数量只是略有减少。
2.2 获得性免疫损伤在埃博拉病毒感染中,获得性免疫的角色要比先天性免疫更难评价,因为很难从现有的动物模型中得到相关数据。早期报道说非人类灵长类动物感染埃博拉病毒6~9天后死亡。但病毒在人体中较长的潜伏期和致病过程增强了获得性免疫功能。从人类感染埃博拉病毒获得的有限资料得知,获得性免疫在致死和非致死病例中显著不同,这暗示了获得性免疫在埃博拉病毒感染中的重要作用。对幸存者的研究显示,患者在机体被攻击后两天就产生特异性IgM抗体,在5~8天后产生特异性IgG抗体[18]。
相反,只有30%致死病例检测到低水平的特异性IgM,未检测到特异性IgG。同样,致死性和非致死性病例中似乎也存在着T细胞活化作用模式的不同。虽然各种研究结果数据并不相同,但有一点是相同的,就是发现致死性病例中T细胞数量锐减。同样,在非人类灵长类动物中可以发现CIM+、CD8+淋巴细胞和浆细胞严重缺失。有趣的是,与自然杀伤细胞相似,淋巴细胞并没有被埃博拉病毒感染,而是充当了“凋亡旁观者”。在症状发生后的初期出现的获得性免疫应答对患者预后有重要影响。幸存者往往在感染埃博拉病毒后出现早期炎症反应也证实这个假设[18]。因此,非常必要进一步研究分析埃博拉病毒对先天免疫和获得性免疫的影响,尤其是对其相互作用的影响。
2.3 血管系统损伤目前为止不多的内皮损伤分子机制的研究表明,内皮细胞在埃博拉病毒发病机制中发挥重要作用。据推测,埃博拉病毒的GP是血管内皮细胞损伤的主要决定因素。埃博拉病毒感染会诱导内皮细胞结构损伤,这可能是导致出血的重要因素。人类和非人类灵长类动物的内皮细胞都容易被埃博拉病毒感染,埃博拉病毒感染的内皮细胞存在一些细胞病变效应。一般情况下,在非人类灵长类动物的内皮细胞中,埃博拉病毒复制并未引起明显的细胞病理学损伤。事实上,一项使用人类原代内皮细胞的研究发现,扎伊尔型埃博拉病毒感染可以诱导保护性的抗凋亡基因上调。
埃博拉病毒体内感染人类内皮细胞的研究数据还很少。1995在扎伊尔基奎特市爆发的埃博拉病毒病疫情中,从死亡病例的不同组织内皮细胞中均检出了扎伊尔型埃博拉病毒抗原。然而,对一例感染埃博拉病毒的死亡病例的免疫组织化学分析结果显示,检测组织中内皮细胞感染较少见。可能血液组织屏障的保护是一个重要的因素,病毒因此难以直接感染和破坏组织的内皮细胞。然而,从早期埃博拉病毒感染死亡病例的尸体检查中,组织学观察结果并没有提示血管病灶,随后的研究也没有血管损伤的报道。与人类感染的研究结果一致,也没有发现感染埃博拉病毒的非灵长类动物重要的血管病变。
在一项非人类灵长类动物研究中发现,扎伊尔型埃博拉病毒感染内皮细胞十分罕见,感染也主要局限于疾病的晚期。在这些动物中,虽然观察到血管通透性增加,但内皮细胞形态保持相对完整。这与在患者中观察到的血管内和血管外组织间隙之间的体液不平衡流动相一致。在体外,内皮通透性增加与扎伊尔型埃博拉病毒感染的人单核细胞/巨噬细胞释放TNF-α相关。随后的研究表明,埃博拉病毒诱导机体细胞因子释放导致内皮细胞活化,从而引起内皮细胞屏障功能障碍。这些证据进一步表明,初始靶细胞感染引起的炎症反应可以通过介质间接影响内皮细胞功能,而不是病毒感染直接诱导细胞病理学改变。在比较不同的研究结果时,应当注意非人类灵长类动物模型与人类感染存在巨大的差异,这种差异可能是由内皮细胞受体的不同引起的,例如树突细胞特异的细胞间黏附分子-3捕获非整合素(DC-Specific Intercellular Adhesion Molecule-3-Grabbing Nonintegrin Related,DC-SIGNR)[25]。然而,如前所述,大多数研究表明,血管内皮细胞完整性的损害主要是由病毒感染引起的局部或全身的炎症因子及其他宿主细胞因子水平升高导致的。
埃博拉病毒感染引起宿主免疫反应及细胞损伤机制见图1[26]。
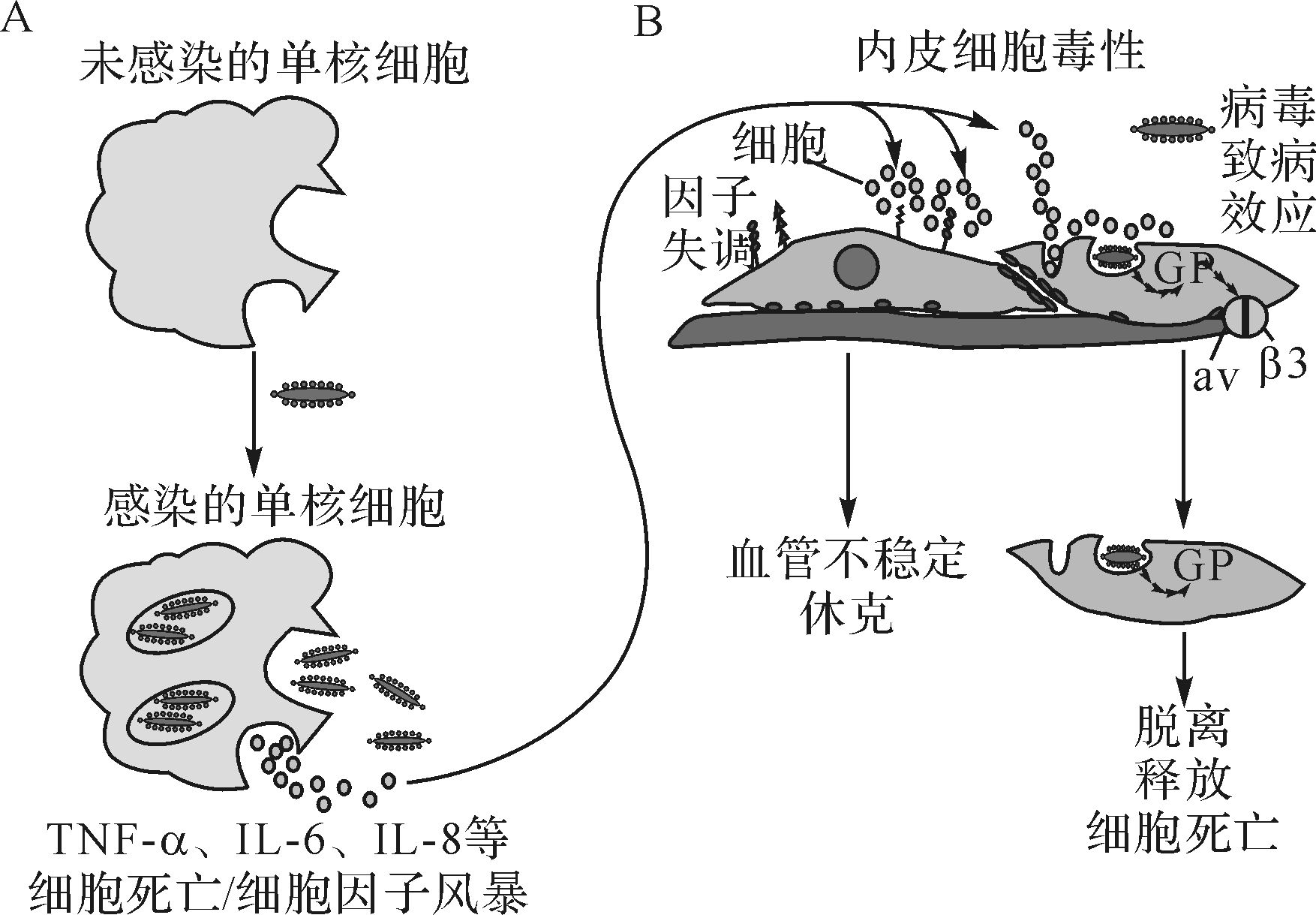
|
| A:埃博拉病毒感染单核细胞和巨噬细胞引起细胞损伤,并释放炎症相关的细胞因子. B:内皮细胞感染引起细胞病变并损伤内皮细胞屏障,与细胞因子一起破坏血管壁完整性. 图1 埃博拉病毒感染引起宿主免疫反应及细胞损伤机制示意图 Fig.1 Mechanism of host immune response and cell injury caused by Ebora virus |
埃博拉病毒感染会导致凝血和纤溶系统的缺陷,临床表现为皮肤瘀点、瘀斑,黏膜出血、充血,静脉穿刺部位难以控制的出血。目前为止罕见大量出血病例,或者仅限于胃肠道出血。事实上,这些情况下的出血不足以导致死亡。埃博拉病毒感染导致的凝血功能障碍的其他指标和特点包括血小板减少、凝血因子消耗和纤维蛋白降解产物水平的增加。尽管弥散性血管内凝血通常是灵长类动物中丝状病毒感染的一个突出表现,在人类感染病例中弥散性血管内凝血的证据却很少,这在很大程度上可能是由于疫情主要发生在偏远地区,当地缺乏足够的卫生和安全防护设施,在疫情暴发时难以开展深入的调查和系统性的研究所致。临床观察和实验室研究数据表明,弥散性血管内凝血是人类埃博拉病毒病的重要特征,但凝血障碍的外在表现不如非人类灵长类动物明显[26]。
大量研究表明,各种非人类灵长类物种感染埃博拉病毒后存在弥散性血管内凝血的组织学和生物化学证据[26]。有研究发现,在实验感染的猴脾脏里存在纤维蛋白沉积的一些证据。尽管人类与非人类灵长类动物的弥散性血管内凝血存在一些差异,凝血系统的损伤仍然是埃博拉病毒病的重要发病机制。目前对于触发凝血障碍的机制尚未完全清楚。新的研究结果对我们了解凝血系统功能障碍的发病机制有所启示,凝血功能异常的发生时间可能比人们以前认为的要早。例如,在一项研究中,扎伊尔型埃博拉病毒实验感染食蟹猴后进行D-二聚体水平和病毒血症的检测,发现病毒感染1天后就能检测到D-二聚体水平显著升高,比病毒血症的出现要早2天[27]。虽然埃博拉病毒感染导致凝血功能障碍可能是由多种因素造成的,尤其是在疾病的后期阶段,但是最近的数据表明,埃博拉病毒感染后单核细胞/巨噬细胞组织因子的表达和释放增多是引起凝血异常的一个关键因素。其他因素也可能促进博拉病毒感染相关的凝血障碍的形成。最近的研究表明,扎伊尔型埃博拉病毒感染食蟹猴的过程中,随着血浆蛋白C的迅速下降出现了纤溶系统损害。
3 用于发病机制研究的动物模型人们对于埃博拉病毒病发病机制缺乏充分了解的另一个重要原因是疫情主要发生在偏远地区,当地缺乏足够的卫生和安全防护设施,在疫情暴发时难以开展深入的调查和研究。因此,构建良好的动物模型对于病毒致病机制的了解和深入研究,以及治疗药物和疫苗的研发具有至关重要的作用。
3.1 小鼠模型免疫系统完整的成熟小鼠不能感染埃博拉病毒,推测可能是由于其强大的先天免疫系统,尤其是I型干扰素反应所导致的免疫作用。腹腔或脑内接种病毒可使乳鼠致死,推测是由于I型干扰素免疫反应系统发育不全缘故[28]。成熟的免疫系统缺陷小鼠,如缺失功能性B细胞及T细胞的SCID小鼠也可被埃博拉病毒感染并致死。然而,不同于人类及其他动物模型,SCID小鼠被扎伊尔型埃博拉病毒感染后可继续健康存活数周,然后再逐渐出现体质量下降及活动减少等症状,20~25天后死亡。缺失I型干扰素免疫系统的小鼠,如α干扰素受体或STAT基因敲除小鼠,无一例外会于皮下感染埃博拉病毒一周内死亡[29]。
另一研究途径是通过将扎伊尔型埃博拉病毒在免疫系统完整的小鼠体内连续传代来获得小鼠适应株。感染这种小鼠适应型埃博拉病毒的小鼠于接种病毒后3 天发病,5~7 天后死亡,死亡小鼠的肝脏、脾脏内均可检测到滴度高达109pfu/g的病毒;同时,这些肝脏和脾脏发生的病理改变以及血清中的氨基转移酶(如天冬氨酸氨基转移酶、丙氨酸氨基转移酶)水平与被扎伊尔型埃博拉病毒感染的灵长类动物模型的病理表征极为类似。然而,与灵长类动物相反的是,小鼠组织中仅有少量的纤维蛋白沉淀,并且仅腹腔感染埃博拉病毒可致死小鼠;当采用其他感染途径时,即使加大感染剂量,小鼠仍能存活[30]。
3.2 豚鼠模型用扎伊尔型埃博拉病毒感染豚鼠仅能引发短时的、非致死的发热症状。同样,使用扎伊尔型埃博拉病毒在近交及远交系豚鼠体内连续传代可获得使豚鼠致死的适应株。该适应株感染约5 天后,豚鼠开始出现厌食、发热、脱水等临床症状,8~11天后无一例外死亡,并不伴随出血的现象。豚鼠感染埃博拉病毒后2天在肝脏和脾脏中可检测到病毒,3天时病毒扩散至肾脏、肾上腺、肺及胰脏,随后组织中病毒平均滴度逐步上升并于9天时达到峰值,病毒血症在7天时即达到近105 pfu/mL的峰值。感染豚鼠同时还逐渐出现凝血时间延长等现象[28, 29]。
3.3 非人类灵长类动物模型很多非人类灵长类动物均被用于埃博拉病毒动物模型的研究,包括非洲绿猴(Chlorocebus aethiops)、狒狒(Papio hamadryas)、恒河猴(Rhesus macaques)、食蟹猴(Cynomolgus macaques)等。其中恒河猴和食蟹猴均对埃博拉病毒高度敏感,可引起与人类极为类似的临床症状,因此目前使用最为广泛。食蟹猴对扎伊尔型埃博拉病毒最敏感,临床症状出现最快,一般3~4天,濒死前发热持续时间短,约2~3天。而恒河猴临床症状出现时间要稍迟一些,但更接近于人类。非人类灵长类动物感染埃博拉病毒后2天可检测到病毒血症,并于2~3天后达到峰值[28]。除此以外,狒狒对所有埃博拉病毒亚型均存在一定程度耐受,非洲绿猴对雷斯顿型埃博拉病毒耐受。值得一提的是,除了使用不同类型动物模型,埃博拉病毒的毒株、剂量及接种方式均对模型最终所产生的临床症状、病情持续时间及严重程度产生不可忽视的影响。
非人类灵长类动物模型被扎伊尔型埃博拉病毒感染后于濒死前体温会骤然下降,体质量减少程度大于10%,推测是由于脱水而非脂肪的分解,部分动物还会出现腹泻及间歇性黑粪症的现象。感染后4天时,非人类灵长类动物皮肤上通常会出现斑丘疹并持续至死亡。发病早期会出现外周淋巴结肿大,中期及晚期可见肝脏肿大并出现圆形囊状边缘。感染埃博拉病毒2天后可以检测出病毒血症,并于2~3天后达到峰值。同时,所有被感染的非人类灵长类动物均出现明显血小板减少症状,从感染后6天开始出现凝血时间延长,至10~12天时血液失去凝集能力。此外,血浆中的钠、钾、钙离子水平均呈下降趋势,而尿素和肌酐水平上升。从第5天开始,氨基转移酶水平持续升高,直至动物死亡[29]。
苏丹型埃博拉病毒感染非人类灵长类动物进行动物模型研究的报道较少,恒河猴和食蟹猴被苏丹型埃博拉病毒感染后临床症状较扎伊尔型埃博拉病毒感染后临床症状出现稍晚几天,而动物存活率要稍高一些。
3.4 动物模型的评价尽管啮齿类动物模型与人类疾病存在一定程度的相似性,但它们感染埃博拉病毒后与人类及非人类灵长类动物在临床表征、组织病理改变等方面的显著性差异限制了其使用,一些非常重要的临床感染现象如体温升高、斑丘疹的出现、弥散性血管内凝血等在啮齿类动物模型身上均无法体现。与小鼠相比,豚鼠感染后可表现出相对而言更严重的凝血障碍,包括血小板数量减少、凝血时间延长等,但纤维蛋白的沉积及凝结程度仍远轻于非人类灵长类动物模型。此外,小鼠及非人类灵长类动物感染埃博拉病毒后出现的一项重要特征——淋巴细胞凋亡现象——在豚鼠模型中也并不明显。尽管如此,在对新疫苗进行体内评估或制定新的治疗方案时,啮齿类动物模型仍然担当着不可替代的重要角色。尤其是小鼠,我们可以方便获得大量的近交系品种,或者各种不同品系的免疫缺陷型,以及各种基因改造小鼠。值得注意的是,当对基于啮齿类动物模型的研究进行评估时,绝不可随意推测其用于人类临床治疗的效果。已有大量报道指出很多抗埃博拉病毒的治疗药物及疫苗在啮齿类动物模型上表现出极好的保护性作用,而一旦进入非人类灵长类动物模型实验阶段却显示无效。研究者们推测这归因于啮齿类与人类及非人类灵长类动物免疫系统的巨大差异,尤其是啮齿类动物所特有的极强的先天免疫系统的差异所导致的。
非人类灵长类动物作为研究埃博拉病毒感染的优良动物模型,它们在临床表征、组织病理等方面都与人类极为类似。在选择一种合适的非人类灵长类动物模型时,动物的品种、性别、年龄,以及病毒感染的途径、剂量,都必须列入重点挑选及考虑范围之内,因为这些都是影响实验结果的关键因素。食蟹猴和恒河猴公认为是研究埃博拉病毒感染的“金标准”模型,其中恒河猴的优势更加明显,因其广泛地用于制药行业,并且其全基因组序列已经知晓。然而,由于近年来新发传染性疾病迅速增多,导致对非人类灵长类动物模型需求激增,以至于非人类灵长类动物供不应求及持续短缺。基于此,一些非人类灵长类动物模型新品种的开发对于满足目前的研究需求及准备应对未来各种突发疾病的研究需求均具有至关重要的意义。
| [1] | STAHELIN R V. Membrane binding and bending in Ebola VP40 assembly and egress[J]. Front Microbiol, 2014, 5: 300. |
| [2] | GALAS A. The determinants of spread of Ebola virus disease-an evidence from the past outbreak experiences[J]. Folia Med Cracov, 2014, 54(3):17-25. |
| [3] | EMPIG C J, GOLDSMITH M A. Association of the caveola vesicular system with cellular entry by filoviruses[J]. J Virol, 2002, 76(10):5266-5270. |
| [4] | BHATTACHARYYA S, WARFIELD K L, RUTHEL G, et al. Ebola virus uses clathrin-mediated endocytosis as an entry pathway[J]. Virology, 2010, 401(1):18-28. |
| [5] | WEINGARTL H M, NFON C, KOBINGER G. Review of Ebola virus infections in domestic animals[J]. Dev Biol (Basel), 2013, 135: 211-218. |
| [6] | ALEKSANDROWICZ P, MARZI A, BIEDENKOPF N, et al. Ebola virus enters host cells by macropinocytosis and clathrin-mediated endocytosis[J]. J Infect Dis, 2011, 204 Suppl 3: S957-S967. |
| [7] | NANBO A, IMAI M, WATANABE S, et al. Ebolavirus is internalized into host cells via macropinocytosis in a viral glycoprotein-dependent manner[J]. PLoS Pathog, 2010, 6(9):e1001121. |
| [8] | SAEED M F, KOLOKOLTSOV A A, ALBRECHT T, et al. Cellular entry of ebola virus involves uptake by a macropinocytosis-like mechanism and subsequent trafficking through early and late endosomes[J]. PLoS Pathog, 2010, 6(9):e1001110. |
| [9] | PAESSLER S, WALKER D H. Pathogenesis of the viral hemorrhagic fevers[J]. Annu Rev Pathol, 2013, 8: 411- 440. |
| [10] | BALE S, JULIEN J P, BORNHOLDT Z A, et al. Ebolavirus VP35 coats the backbone of double-stranded RNA for interferon antagonism[J]. J Virol, 2013, 87(18):10385-10388. |
| [11] | SCHORNBERG K L, SHOEMAKER C J, DUBE D, et al. Alpha5beta1-integrin controls ebolavirus entry by regulating endosomal cathepsins[J]. Proc Natl Acad Sci U S A, 2009, 106(19):8003-8008. |
| [12] | BRECHER M, SCHORNBERG K L, DELOS S E, et al. Cathepsin cleavage potentiates the Ebola virus glycoprotein to undergo a subsequent fusion-relevant conformational change[J]. J Virol, 2012, 86(1):364-372. |
| [13] | MARTINEZ O, JOHNSON J, MANICASSAMY B, et al. Zaire Ebola virus entry into human dendritic cells is insensitive to cathepsin L inhibition[J]. Cell Microbiol, 2010, 12(2):148-157. |
| [14] | RADOSHITZKY S R, WARFIELD K L, CHI X, et al. Ebolavirus delta-peptide immunoadhesins inhibit marburgvirus and ebolavirus cell entry[J]. J Virol, 2011, 85(17):8502-8513. |
| [15] | CARETTE J E, RAABEN M, WONG A C, et al. Ebola virus entry requires the cholesterol transporter Niemann-Pick C1[J]. Nature, 2011, 477(7364):340-343. |
| [16] | CÔTÉ M, MISASI J, REN T, et al. Small molecule inhibitors reveal Niemann-Pick C1 is essential for Ebola virus infection[J]. Nature, 2011, 477(7364):344-348. |
| [17] | SHIMOJIMA M, TAKADA A, EBIHARA H, et al. Tyro3 family-mediated cell entry of Ebola and Marburg viruses[J]. J Virol, 2006, 80(20):10109-10116. |
| [18] | RAMANAN P, SHABMAN R S, BROWN C S, et al. Filoviral immune evasion mechanisms[J]. Viruses, 2011, 3(9): 1634-1649. |
| [19] | FELDMANN H, GEISBERT T W. Ebola haemorrhagic fever[J]. Lancet, 2011, 377(9768): 849-862. |
| [20] | CÁRDENAS W B, LOO Y M, GALE M JR, et al. Ebola virus VP35 protein binds double-stranded RNA and inhibits alpha/beta interferon production induced by RIG-I signaling[J]. J Virol, 2006, 80(11):5168-5178. |
| [21] | LUTHRA P, RAMANAN P, MIRE C E, et al. Mutual antagonism between the Ebola virus VP35 protein and the RIG-I activator PACT determines infection outcome[J]. Cell Host Microbe, 2013, 14(1):74-84. |
| [22] | HALFMANN P, NEUMANN G, KAWAOKA Y. The Ebolavirus VP24 protein blocks phosphorylation of p38 mitogen-activated protein kinase[J]. J Infect Dis, 2011, 204 Suppl 3: S953-S956. |
| [23] | BOSIO C M, MOORE B D, WARFIELD K L, et al. Ebola and Marburg virus-like particles activate human myeloid dendritic cells[J]. Virology, 2004, 326(2):280-287. |
| [24] | HOENEN T, GROSETH A, FALZARANO D, et al. Ebola virus: unravelling pathogenesis to combat a deadly disease[J]. Trends Mol Med, 2006, 12(5): 206-215. |
| [25] | GRAMBERG T, SOILLEUX E, FISCH T, et al. Interactions of LSECtin and DC-SIGN/DC-SIGNR with viral ligands: Differential pH dependence, internalization and virion binding[J]. Virology, 2008, 373(1):189-201. |
| [26] | SULLIVAN N, YANG Z Y, NABEL G J. Ebola virus pathogenesis: implications for vaccines and therapies[J]. J Virol, 2003, 77(18): 9733-9737. |
| [27] | ROLLIN P E, BAUSCH D G, SANCHEZ A. Blood chemistry measurements and D-Dimer levels associated with fatal and nonfatal outcomes in humans infected with Sudan Ebola virus[J]. J Infect Dis, 2007, 196 Suppl 2: S364-S371. |
| [28] | BENTE D, GREN J, STRONG J E, et al. Disease modeling for Ebola and Marburg viruses[J]. Dis Model Mech, 2009, 2(1-2): 12-17. |
| [29] | NAKAYAMA E, SAIJO M. Animal models for Ebola and Marburg virus infections[J]. Front Microbiol, 2013, 4: 267. |
| [30] | BRADFUTE S B, WARFIELD K L, BRAY M. Mouse models for filovirus infections[J]. Viruses, 2012, 4(9): 1477-1508. |


