| 禽CD133胞外结构域原核表达及多克隆抗体的制备 |
2. 浦东新区动物疫病预防控制中心,上海 201200
2. Pudong Center of Animal Disease Prevention and Control, Shanghai 201200, China
内皮祖细胞(endothelial progenitor cells, EPCs)是一类起源于骨髓的血管内皮细胞的前体细胞,在血管修复和新生血管形成中发挥重要作用[1],是目前心血管系统疾病领域[2]和组织再生领域[3]的研究热点。由于EPCs可向受损血管定向迁移,因此,基于EPCs的细胞治疗引起了学术界的极大兴趣[4]。
CD133/prominin 1是一种跨膜糖蛋白,哺乳动物的CD133分子由1个N端胞外域、5个跨膜区、2个大的胞外环、2个小的富含半胱氨酸的胞内环及1个胞内C端结构域构成[5]。CD133被认为是造血干细胞和祖细胞表面标志分子[6],与KDR(VEGRF-2)或CD31一道被广泛用于鉴定EPCs[7-8]。
肉鸡肺动脉高压(pulmonary arterial hypertension, PAH)是发生于商品肉鸡的一种主要的心血管疾病,以肺血管病理性重构为特征,致死率极高,对世界肉鸡业造成极大危害[9]。此外,PAH肉鸡还被认为是人PAH的良好动物模型,得到了学术界的普遍关注[10-11]。因而,探讨肉鸡PAH的发生发展机制一直是兽医学领域的研究热点。我们最近的研究提示,EPCs功能障碍在PAH肉鸡肺血管病变发生机制中发挥着重要作用[12],这从新的角度揭示了肉鸡PAH的发生发展机制。然而,由于缺乏家禽特异性的商品化CD133抗体,对家禽EPCs的表型鉴定存在一定困难[13-14]。
本研究在生物信息学分析的基础上,利用禽CD133蛋白N端胞外域重组蛋白免疫小鼠,制备了抗禽CD133多克隆抗体,为开发禽CD133抗体提供了技术方法。
1 材料与方法 1.1 试剂及试验动物质粒提取试剂盒、胶回收试剂盒、二喹啉甲酸(bicinchoninic acid, BCA)试剂盒、异丙基β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside, IPTG)和弗氏佐剂购自生工生物工程(上海)股份有限公司; 限制性内切酶和镍离子柱-重力流(His60 Ni gravity columns)购自宝生物工程(大连)有限公司; 商品化鼠抗CD133购自武汉博士德生物技术有限公司; 羊抗小鼠IgG-HRP购自杭州华安生物技术有限公司; 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)相关试剂购自上海碧云天生物技术有限公司; 电致化学发光(electrochemiluminescence, ECL)显影液购自美国伯乐(Bio-Rad)公司; 聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜购自德国默克密理博(Merck Millipore)公司; 9周龄成年雌性BALB/c小鼠购自浙江大学动物实验中心。
1.2 菌种和质粒pMD-19T和PET-28a(+)载体由浙江大学动物病理学实验室保存; 大肠埃希菌DH5α和BL21(DE3)感受态细胞购自北京全式金生物技术有限公司。
1.3 CD133胞外区原核表达 1.3.1 胞外区预测及引物设计通过TMHMM-2.0服务器(http://www.cbs.dtu.dk/services/TMHMM/)对禽CD133(登录号:NP_001278578.1)跨膜区进行分析,结合ExPASy工具中ProtScale亲水性预测(Hphob./Hopp & Woods)结果,选择N端去信号肽后的89个氨基酸残基构成的胞外域作为候选抗原,设计引物来扩增其全长编码序列。带有BamHⅠ酶切位点的上游引物序列为5′- CGGGATCCGAAGTACAGCCTATATACAAGCCG C-3′,带有XhoⅠ酶切位点的下游引物序列为5′- CCGCTCGAGCTCATAGTAGATGGCCTGGAGTG T-3′。CD133引物设计模板来源于NCBI (https://www.ncbi.nlm.nih.gov/)上发表的禽CD133序列(登录号:NM_001291649)。
1.3.2 CD133胞外区基因扩增及原核表达载体的构建聚合酶链式反应(polymerase chain reaction, PCR)扩增所用模板为肉鸡肺组织cDNA(肺组织中含有丰富的EPCs)。割胶回收目的条带,连接pMD-19T载体并转化大肠埃希菌感受态DH5α,涂布于含有100 μg/mL氨苄霉素的LB培养基上,培养12 h后,挑取阳性单克隆送杭州擎科梓熙生物技术有限公司测序。将测序正确的阳性克隆扩大培养,抽提质粒并用限制性内切酶BamHⅠ和XhoⅠ进行双酶切,连接表达载体pET-28a(+),转化大肠埃希菌DH5α,涂布于含有50 μg/mL卡那霉素的LB培养基上,培养12 h后,挑取阳性单克隆扩大培养,提取质粒进行双酶切鉴定,并送样测序。
1.3.3 重组蛋白诱导表达及纯化将测序正确的pET-28a-CD133质粒转化大肠埃希菌BL21(DE3),涂布于固体培养基上,挑取阳性克隆于含有50 μg/mL卡那霉素的LB/Km培养基中培养,至菌液吸光度值达0.8~1.0时,加入1 mmol/L的IPTG在37 ℃条件下诱导表达4 h。收集菌体,用磷酸盐缓冲溶液(phosphate buffer solution, PBS)重悬,于冰上超声破碎,直至菌液清澈透明,4 ℃、1×104 r/min离心30 min,分别收集上清液和沉淀,沉淀用与上清液相同体积的PBS重悬。取相同体积上清液和沉淀悬液与上样缓冲液混合,95℃变性10 min,8 000 r/min离心10 min,取各自上清液在12%凝胶上进行SDS- PAGE电泳和考马斯亮蓝染色。
大量培养细菌并诱导蛋白表达,收集菌体,并用含有8 mol/L脲的PBS重悬菌体,于冰上超声破碎,4 ℃、1×104 r/min离心30 min。取上清液,过镍离子柱进行蛋白纯化。调整洗涤液和洗脱液中咪唑的浓度,收集蛋白,进行SDS-PAGE电泳检测并对比,选择洗脱后杂带较少且目的蛋白较多的相应咪唑浓度的洗涤液和洗脱液,在该条件下大量纯化目的蛋白。
1.4 动物免疫将纯化的CD133重组蛋白与弗氏完全佐剂按1:1剂量混合并充分乳化,采用背部皮下多点注射的方法免疫BALB/c小鼠(100 μg/只),于第3周和第4周各加强免疫1次(100 μg/只,不完全弗氏佐剂),共免疫3次。最后一次免疫后的第3天,摘眼球采血,分离血清,于-70 ℃冰箱中保存。
1.5 蛋白质印迹法检测取10 μg CD133重组蛋白在12%凝胶上进行SDS-PAGE电泳,电转印至PVDF膜上。用5%脱脂奶粉封闭1 h,与稀释比例1:200~1:1×104的小鼠血清在4 ℃条件下孵育过夜。用TBST(Tris buffered saline Tween)洗膜3次,每次10 min,之后与辣根过氧化物酶(horseradish peroxidase, HRP)标记的羊抗小鼠IgG(1:1 000)于室温条件下孵育1 h; 再用TBST洗膜3次,每次10 min,ECL法显影。以未经CD133重组蛋白免疫的小鼠血清(1:1 000)为阴性对照。
1.6 免疫组化染色采取肉鸡肺组织,用4%多聚甲醛固定24 h,石蜡包埋,连续切片。捞取相邻2张切片,脱蜡和进水后,用3% H2O2室温避光处理10 min以去除内源性过氧化物酶。然后,置于三羟甲基氨基甲烷-乙二胺四乙酸(Tris-EDTA)缓冲液(Tris 1.21 g/L,EDTA 0.37 g/L,Tween-20 0.5 mL,pH 9.0)中进行高压热修复[12]。于5%牛血清白蛋白(BSA)中室温封闭20 min,滴加自制的CD133抗血清(1:50)于4 ℃条件下孵育过夜,用PBS清洗3次,每次10 min; 滴加生物素标记的羊抗鼠二抗,室温孵育1 h后,用PBS溶液清洗3次,每次10 min,DAB显色,苏木精轻度复染。以未经CD133重组蛋白免疫的小鼠血清为阴性对照。
2 结果与分析 2.1 CD133跨膜区及亲水性分析结果利用TMHMM Server 2.0软件进行跨膜螺旋分析发现,禽CD133具有5个跨膜区、3个胞外区和3个胞内区,其中胞外区分别位于肽链的第1~107位、182~438位和509~795位氨基酸处。选择N端第19~107位氨基酸构成的肽段进行亲水性分析,发现这一肽段的亲水性评分较高。
2.2 CD133胞外域基因合成以肉鸡肺组织提取的cDNA为模板,扩增出长度约为300 bp的片段,与预期扩增的目的片段长度(279 bp)相符(图 1)。
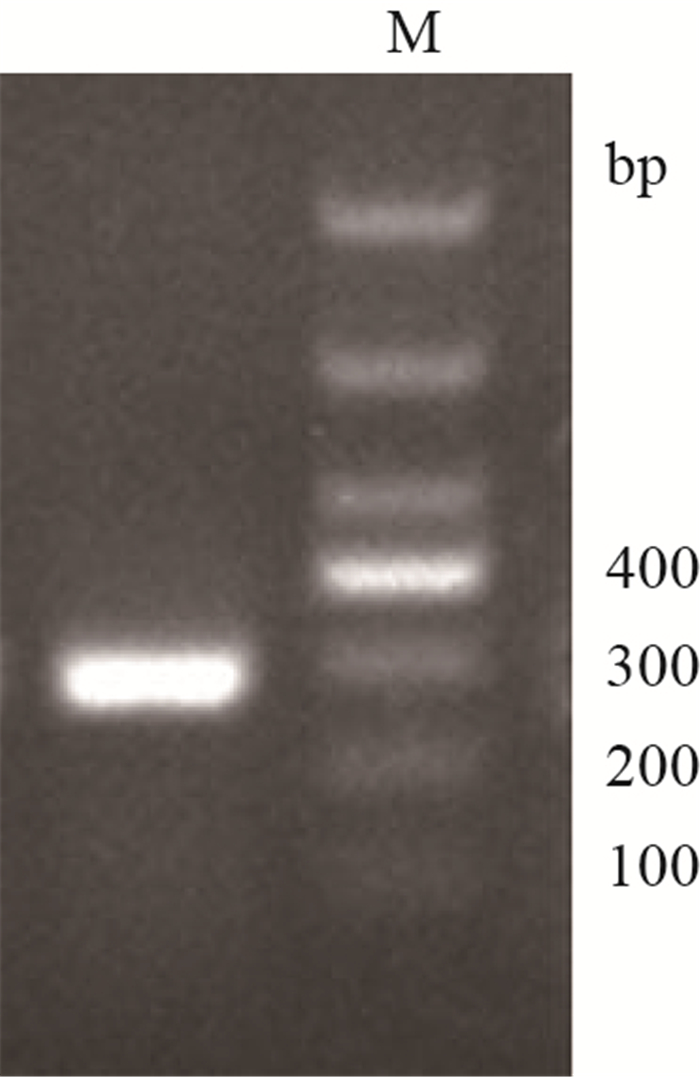 |
| M:DNA分子标志物。 M: DNA marker. 图1 目的基因CD133扩增产物的1.5%琼脂糖凝胶电泳 Fig. 1 Amplified products of the targeted gene CD133 on 1.5% agarose gel electrophoresis |
用限制性内切酶BamHⅠ和XhoⅠ对pET-28a-CD133重组质粒进行双酶切,获得一条长度约为300 bp的条带(图 2),与目的片段长度相符。将质粒测序结果与目的片段基因序列进行Blast比对,表明插入序列完全正确。上述结果表明,pET-28aCD133重组表达质粒构建成功。
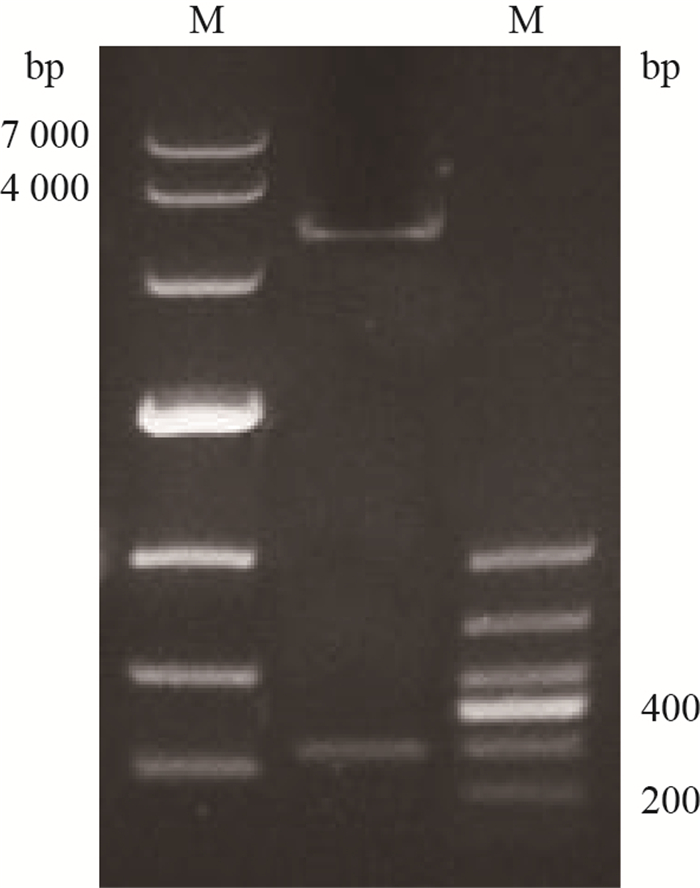 |
| M:DNA分子标志物。 M: DNA marker. 图2 重组质粒pET-28a-CD133双酶切产物的1%琼脂糖凝胶电泳 Fig. 2 Products of the recombinant plasmid pET-28a-CD133 digested by enzymes BamHⅠ and XhoⅠ on 1% agarose gel electrophoresis |
将上述克隆正确的pET-28a-CD133质粒转化大肠埃希菌BL21感受态细胞并小量扩增,用1 mmol/L IPTG诱导蛋白表达,在包涵体中检测到一条分子质量在10~15 kDa之间的特异条带(图 3A),与目的蛋白大小(14.4 kDa)相符。进一步大量培养重组子,用8 mol/L脲溶解包涵体,镍柱亲和层析后得到较高纯度的重组蛋白(图 3B)。
 |
| A:1.转化pET-28a-CD133的BL21经超声破碎后的沉淀; 2.转化pET-28a-CD133的BL21经超声破碎后的上清液; 3.转化pET-28a空载体的BL21经超声破碎后的沉淀; 4.转化pET- 28a空载体的BL21经超声破碎后的上清液。B:纯化后的重组蛋白。M:DNA分子标志物。箭头所指处为重组蛋白。 A: 1. Residue of BL21 transformed with pET-28a-CD133 after sonication; 2. Supernatant of BL21 transformed with pET-28a CD133 after sonication; 3. Residue of BL21 transformed with pET- 28a after sonication; 4. Supernatant of BL21 transformed with pET- 28a after sonication. B: Purified recombinant protein. M: DNA marker. The arrow indicates the recombinant protein. 图3 重组蛋白的SDS-PAGE检测 Fig. 3 Detection of recombinant protein by SDS-PAGE |
CD133重组蛋白可被鼠抗禽CD133血清特异性结合,用蛋白质印迹法检测时出现单一条带。抗CD133血清经1×104倍稀释后仍可与CD133重组蛋白结合,而未免疫CD133蛋白的小鼠血清则不能识别CD133重组蛋白(图 4)。
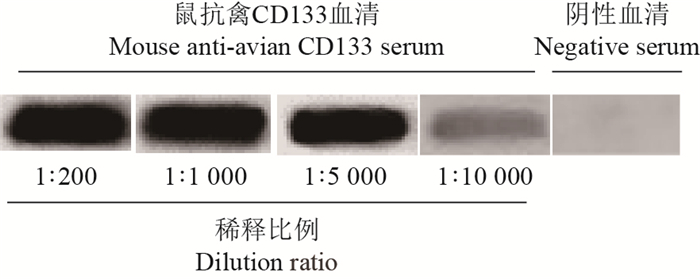 |
| 图4 不同稀释比例的鼠抗禽CD133血清对CD133重组蛋白识别的蛋白质印迹法检测 Fig. 4 Recognition of different dilution ratios of mouse anti avian CD133 serum with recombinant CD133 by Western-blotting |
以鼠抗禽CD133抗血清为一抗,羊抗小鼠IgG为二抗,按常规免疫组化法进行染色后,可见肺血管内膜中有CD133阳性细胞分布(图 5A); 而使用未经CD133蛋白免疫的小鼠血清作为一抗进行免疫组化染色后,同一血管的内膜无明显的颜色反应(图 5B)。
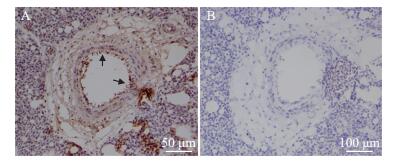 |
| A:CD133抗血清; B:阴性血清。箭头所指处为阳性细胞。 A: Mouse anti-avian CD133 serum; B: Negative serum. The arrow indicates the positive cell. 图5 肉鸡肺血管中CD133阳性细胞的免疫组化法检测 Fig. 5 Detection of CD133 positive cells in pulmonary vascular of chicken by immunohistochemistry |
已有研究表明,哺乳动物CD133蛋白具有3个胞外结构域,其中第1个胞外结构域具有良好的抗原性[15]。本研究采用生物信息学方法对禽CD133的跨膜螺旋进行分析,发现禽CD133蛋白亦具有3个胞外结构域,其N端胞外结构域由107个氨基酸残基构成,去除信号肽后剩余89个氨基酸残基。亲水性预测结果表明,该胞外结构域具有较好的亲水性。基于上述生物信息学预测结果,我们选择该肽段为候选抗原来制备抗禽CD133抗体。
本研究首先以肉鸡肺组织cDNA为模板,扩增出禽CD133蛋白N端胞外区编码序列,进而采用原核表达的方式成功制备出CD133重组蛋白。用纯化后的重组蛋白免疫小鼠,收集血清,检测抗血清对CD133的结合能力。蛋白质印迹法检测结果显示:经CD133重组蛋白免疫的小鼠血清可特异性识别CD133重组蛋白,经1:1×104的比例稀释后仍保持对CD133重组蛋白的结合能力,提示抗血清制备成功。由于血管内皮中含有表达CD133标志的EPCs[16],本研究随后采用免疫组化法验证了CD133抗血清是否可识别血管内皮中的EPCs。结果发现,用抗CD133血清作为一抗染色后,肉鸡肺血管内皮中出现大量棕黄色细胞,而用未经CD133免疫的小鼠血清作为一抗染色后,血管内皮中无颜色反应。上述结果表明,本研究制备的抗CD133多克隆抗体可用于检测组织中的CD133阳性细胞。
4 结论综上所述,本研究利用禽CD133蛋白N端胞外结构域重组蛋白为抗原,成功制备出了抗禽CD133多克隆抗体,为开展相关研究奠定了良好的基础。
| [1] |
ZHANG M, REHMAN J, MALIK A B. Endothelial progenitor cells and vascular repair. Current Opinion in Hematology, 2014, 21(3): 224-228. DOI:10.1097/MOH.0000000000000041 |
| [2] |
SHIMONI S, BAR I, MELEDIN V, et al. Circulating endothelial progenitor cells and clinical outcome in patients with aortic stenosis. PLoS One, 2016, 11(2): e0148766. DOI:10.1371/journal.pone.0148766 |
| [3] |
GEORGE A L, BANGALORE-PRAKASH P, RAJORIA S, et al. Endothelial progenitor cell biology in disease and tissue regeneration. Journal of Hematology & Oncology, 2011, 4(1): 24. |
| [4] |
SUKMAWATI D, TANAKA R. Introduction to next generation of endothelial progenitor cell therapy: A promise in vascular medicine. American Journal of Translational Research, 2015, 7(3): 411-421. |
| [5] |
MIRAGLIA S, GODFREY W, YIN A H, et al. A novel fivetransmembrane hematopoietic stem cell antigen: Isolation, characterization, and molecular cloning. Blood, 1997, 90(12): 5013-5021. |
| [6] |
AKITA M, TANAKA K, MATSUMOTO S, et al. Detection of the hematopoietic stem and progenitor cell marker CD133 during angiogenesis in three-dimensional collagen gel culture. Stem Cells International, 2013(2013): 927403. |
| [7] |
CHENG C C, CHANG S J, CHUEH Y N, et al. Distinct angiogenesis roles and surface markers of early and late endothelial progenitor cells revealed by functional group analyses. BMC Genomics, 2013, 14(1): 182. DOI:10.1186/1471-2164-14-182 |
| [8] |
YODER M C. Human endothelial progenitor cells. Cold Spring Harbor Perspectives in Medicine, 2012, 2(7): a006692. |
| [9] |
WIDEMAN R F, RHOADS D D, ERF G F, et al. Pulmonary arterial hypertension (ascites syndrome) in broilers: A review. Poultry Science, 2013, 92(1): 64-83. DOI:10.3382/ps.2012-02745 |
| [10] |
COLVIN K L, YEAGER M E. Animal models of pulmonary hypertension: Matching disease mechanisms to etiology of the human disease. Journal of Pulmonary & Respiratory Medicine, 2014, 4(4): 198. |
| [11] |
WIDEMAN Jr R J, HAMAL K R. Idiopathic pulmonary arterial hypertension: An avian model for plexogenic arteriopathy and serotonergic vasoconstriction. Journal of Pharmacological and Toxicological Methods, 2011, 63(3): 283-295. DOI:10.1016/j.vascn.2011.01.002 |
| [12] |
TAN X, JUAN F G, SHAH A Q. Involvement of endothelial progenitor cells in the formation of plexiform lesions in broiler chickens: Possible role of local immune/inflammatory response. Journal of Zhejiang University: Science B, 2017, 18(1): 59-69. DOI:10.1631/jzus.B1600500 |
| [13] |
BI S C, TAN X, ALI S Q, et al. Isolation and characterization of peripheral blood-derived endothelial progenitor cells from broiler chickens. The Veterinary Journal, 2014, 202(2): 396-399. DOI:10.1016/j.tvjl.2014.08.017 |
| [14] |
SHAH Q A, TAN X, BI S, et al. Differential characteristics and in vitro angiogenesis of bone marrow- and peripheral bloodderived endothelial progenitor cells: Evidence from avian species. Cell Proliferation, 2014, 47(4): 290-298. DOI:10.1111/cpr.2014.47.issue-4 |
| [15] |
TAÏEB N, MARESCA M, GUO X J, et al. The first extracellular domain of the tumour stem cell marker CD133 contains an antigenic ganglioside-binding motif. Cancer Letters, 2009, 278(2): 164-173. DOI:10.1016/j.canlet.2009.01.013 |
| [16] |
TOSHNER M, VOSWINCKEL R, SOUTHWOOD M, et al. Evidence of dysfunction of endothelial progenitors in pulmonary arterial hypertension. American Journal of Respiratory and Critical Care Medicine, 2009, 180(8): 780-787. DOI:10.1164/rccm.200810-1662OC |
 2018, Vol. 44
2018, Vol. 44


