| c-Jun蛋白对A型流感病毒H1N1感染小鼠体内CD4+和CD8+ T细胞增殖的调节作用 |
2. 中国农业大学动物医学院,北京 100192;
3. 河南科技学院资源与环境学院,河南 新乡453003
2. College of Veterinary Medicine, China Agricultural University, Beijing 100192, China;
3. College of Resources and Environment, Henan Institute of Science and Technology, Xinxiang 453003, Henan, China
A型流感病毒是引发流感的重要病原,可以感染多种动物,引起发热、咳嗽、呼吸困难等呼吸系统疾病以致全身严重败血症等多种症状。经A型流感病毒感染后的复杂致病机制一直是科学家们研究的热点。杀伤性T细胞(CD8+ T细胞)在病毒的清除中发挥重要作用,其作用方式为直接裂解被感染细胞或释放γ-干扰素(interferon-γ, IFN-γ)和肿瘤坏死因子-α(tumor necrosis factor, TNF-α)等促炎性细胞因子,有效控制流感病毒感染。CD8+ T缺乏的小鼠感染流感病毒后呈现出更高的易感性和病毒复制量[1]。辅助性T细胞(CD4+ T细胞)通过分泌IFN-γ、白介素-2(interleukin-2, IL-2)和TNF-α等来促进B细胞产生抗体和维持CD8+ T细胞功能,而缺乏CD4+ T细胞的小鼠呈现出流感病毒清除延迟的现象[2]。因此,CD4+ T和CD8+ T细胞在抗流感感染免疫中发挥着重要的作用。
c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)信号通路对CD4+和CD8+ T细胞的增殖、分化等过程具有重要的调控作用[3]。c-Jun是一种原癌蛋白,也是JNK通路发挥作用的一种下游转录因子。在流感病毒感染的早期,可以检测到c-Jun活化蛋白,而其在流感病毒感染过程中是否对CD4+和CD8+ T细胞发挥作用还不清楚。核酶Dz13是一种可以特异性切割并降解c-Jun蛋白的DNA分子,即一种脱氧核酶,目前已经很成熟地应用在抗肿瘤、细胞迁移等方面的研究中。有研究显示,使用Dz13阻断c-Jun蛋白可以在体外抑制单核-内皮细胞聚集,在大鼠炎症模型中阻止白细胞黏附、渗出[4]。但是关于Dz13应用于病毒感染所引起的细胞增殖或分化等的报道则很少。在本研究中,通过建立H1N1流感病毒感染模型,使用Dz13抑制c-Jun蛋白的表达,从而探讨c-Jun蛋白对病毒感染后小鼠体内CD4+和CD8+ T细胞的增殖及细胞因子的调节作用。
1 材料与方法 1.1 材料动物:6~8周龄无特定病原体(specific pathogen free, SPF)级雌性BALB/c小鼠,体质量(20±1.5)g,购自北京维通利华实验动物技术有限公司,饲养于独立通风笼盒(individually ventilated cages, IVC)系统内。
病毒:H1N1(A/PR/8/34)流感病毒毒株,由中国农业大学动物医学院国家动物寄生原虫实验室保存,于9日龄SPF级鸡胚尿囊腔传代后,测定对小鼠的半数致死量(median lethal dose, LD50),分装后于-80 ℃冰箱中储存,备用。
核酶Dz13和对照序列Dz13scr:核酶Dz13的序列(5′-CGGGAGGAAGGCTAGCTACAACGAGA GGCGTTG-Ti-3′)和Dz13scr的序列(5′-GCGACG TGAGGCTAGCTACAACGAGTGGAGGAG-Ti-3′)由华大基因合成。用无菌磷酸盐缓冲液(phosphate buffer solution, PBS)溶解至质量浓度为2 mg/mL,于-20 ℃冰箱中储存,备用。
试剂:FITC Rat Anti-mouse CD4和PE Antimouse CD8抗体购自美国eBioscience公司;红细胞裂解液购自中科迈晨科技有限公司;TRIzol为美国Invitrogen公司产品;p-c-Jun和c-Jun蛋白抗体为美国Cell Signal Technology(CST)公司产品;FuGENE® 6为美国Promega公司产品。其余常规试剂为实验室内储存的药品。
1.2 方法小鼠攻毒:将小鼠随机分为Dz13+ H1N1、DZ13scr+ H1N1、PBS+ H1N1、PBS 4组,每组9只。肌内注射Zoletil®(16.5 mg/kg)以麻醉小鼠,随后将3 LD50/只H1N1流感病毒溶于50 μL PBS中,以滴鼻方式给予小鼠。
小鼠给药:以感染病毒时计为0 d,在感染的0和3 d,将Dz13和Dz13scr(2.5 mg/kg)溶于50 μL PBS(含2.5 μL FuGENE6和1 mmol/L MgCl2)中,以滴鼻方式给予小鼠。
外周血内CD4+、CD8+ T细胞的检测:于感染后3和6 d时,每组小鼠各取3只,摘取眼球采血并处死。收集经抗凝剂处理的外周血200 μL,1 000 r/min离心3 min,弃上清液;加入1 mL红细胞裂解液,轻轻吹打均匀,室温静置10 min,1 000 r/min离心5 min,弃掉上层红色液体;收集沉淀部分,加入1 mL PBS洗涤,1 000 r/min离心5 min,弃上清液;加入0.5 mL PBS重悬,加入FITC Anti-mouse CD4抗体和PE Anti-mouse CD8抗体,混匀,避光静置约20 min;用BD Accuri®C6 Plus流式细胞仪检测。
用蛋白质印迹法(Western-blotting, WB)检测肺内c-Jun蛋白的表达:在取下来的肺组织(大约全肺的1/3)中加入1 mL RIPA蛋白裂解液[含10 mmol/L苯甲基磺酰氟(phenylmethanesulfonyl fluoride, PMSF)],在低温条件下用玻璃研磨器将组织匀浆。在冰上作用30 min后,以1.2×104 r/min离心10 min,取上清液。按比例加入上样缓冲液,煮沸10 min。用二喹啉甲酸(BCA)法测定蛋白质量浓度后,将各组蛋白样品质量浓度调整为2 μg/μL,取18 μL样品进行聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis, PAGE),用湿转法将蛋白胶样品于60 V电压下2 h内转膜至聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF)上。用5%脱脂奶粉室温封闭l h。一抗用p-c-Jun(1:1 000)抗体、c-Jun(1:1 000)抗体和β-tubulin(1:1 000)抗体孵育过夜(4 ℃),用0.5% PBST溶液洗膜后,用HRP标记的羊抗兔二抗(1:2 000)室温孵育1 h。经0.5% PBST溶液洗膜后,用ECL化学发光试剂盒显色并进行结果分析。
用实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction, qRT-PCR)检测肺内细胞因子的表达:取100 μL外周血,用红细胞裂解液裂解后,1 000 r/min离心10 min,收集沉淀细胞。按照TRIzol说明书提取各组细胞总RNA。取2 μg总RNA,按照全式金反转录试剂盒操作说明将RNA反转录为cDNA,以20 μL反应体系进行PCR扩增。每个样本设3个重复。反应程序:95 ℃预变性90 s;95 ℃退火5 s,58 ℃延伸30 s,共30个循环。获得各样本待测基因的扩增循环阈值(CT)值,采用2-△△CT法进行数据处理。引物序列见表 1。
| 表1 细胞因子的引物序列 Table 1 Primer sequences of the target cytokines |
 |
| 点击放大 |
采用Graphpad Prism 6.0软件作图。采用SPSS 17.0软件中的单因素方差分析及Tukey事后检验对试验所得数据进行统计学分析。
2 结果与分析 2.1 Dz13对c-Jun蛋白表达的抑制作用用蛋白质印迹法检测肺组织内c-Jun蛋白的表达量,结果(图 1)表明:小鼠攻毒后,与未感染组(PBS)相比,肺内c-Jun(p-c-Jun)蛋白的活化水平明显上调,随着感染后时间的递增,在6 d时肺内cJun蛋白的活化程度明显低于3 d时的水平。Dz13用药组(Dz13+H1N1)c-Jun蛋白(t-c-Jun)的表达受到抑制,在3 d时的抑制水平高于6 d,随着t-cJun蛋白表达受到抑制,活化的c-Jun蛋白表达量也随之降低。说明病毒感染后可以引起c-Jun蛋白的活化,核酶Dz13可以特异性地抑制c-Jun蛋白表达及其活化。
 |
| 1:DZ13 + H1N1;2:DZ13scr + H1N1;3:PBS + H1N1;4:PBS。 图1 Dz13对病毒感染小鼠肺内c-Jun蛋白表达的影响 Fig. 1 Effect of Dz13 on c-Jun protein expression in lungs of infected mice |
病毒感染机体后,可以迅速激起机体的免疫反应。使用流式细胞术检测感染后3和6 d小鼠外周血内CD4+和CD8+ T细胞的增殖,结果(图 2)表明:小鼠感染病毒后,外周血内CD4+和CD8+ T细胞的数量与对照组相比明显增多;而核酶Dz13用药组与Dz13scr相比,CD4+和CD8+ T细胞的增殖受到抑制(P<0.05)。说明c-Jun蛋白参与调节流感病毒感染后小鼠体内CD4+和CD8+ T细胞的增殖。
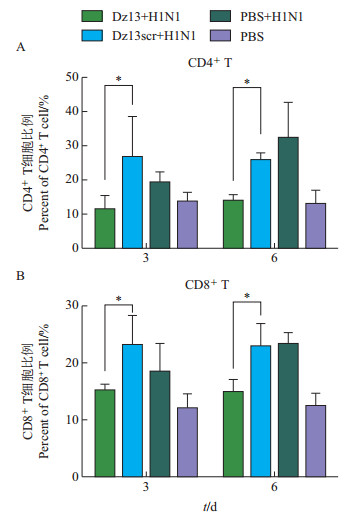 |
| *表示在P<0.05水平差异有统计学意义;n=3。 Single asterisk (*) indicates statistically significant difference at the 0.05 probability level; n=3. 图2 Dz13对病毒感染小鼠外周血内CD4+(A)和CD8+(B)T细胞增殖的影响 Fig. 2 Effect of Dz13 on proliferation of CD4+ (A) and CD8+ (B) T cells in peripheral blood of infected mice |
流感病毒感染后一个特征性变化就是细胞因子表达量的上调。在本研究中,为测定c-Jun蛋白对病毒感染后细胞因子表达量的调节作用,我们使用qRT-PCR测定感染后3和6 d小鼠外周血内细胞因子的表达情况。从图 3中可见:病毒感染后,细胞因子IFN-γ、IL-6和IL-10明显地上调表达;Dz13用药后,Dz13+H1N1组细胞因子IFN-γ、IL-6和IL- 10表达量明显低于Dz13scr+ H1N1组和PBS+ H1N1组(P<0.05)。说明c-Jun蛋白参与调节流感病毒感染后细胞因子的表达。
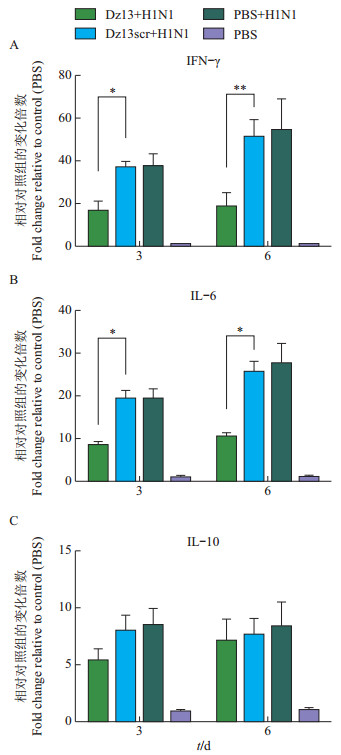 |
| *和**分别表示在P<0.05和 0.01水平差异有统计学意义;n=3。 Single asterisk (*) and double asterisks (**) indicate statistically significant differences at the 0.05 and 0.01 probability levels, respectively; n=3. 图3 Dz13对病毒感染小鼠外周血内细胞因子表达量的影响 Fig. 3 Effect of Dz13 on cytokine expression in peripheral blood of infected mice |
原癌蛋白c-Jun和c-fos以异二聚体的形式组成转录因子AP-1(activator protein-1),AP-1可以调控多种基因的转录,是JNK通路中发挥生物学效应的主要分子,参与细胞增殖、分化、凋亡等的调节过程。大量研究证实:在流感病毒感染的早期可以检测到cJun活化蛋白(p-c-Jun),并启动下游IFN-β等一些抗病毒细胞因子的转录;抑制c-Jun蛋白表达后能够导致IFN-β转录水平降低,病毒繁殖率升高[5-6]。同时,有研究发现,JNK-/-小鼠可抑制感染后引起的CD8+T细胞的增殖[7]。而c-Jun蛋白作为JNK通路的效应因子是否参与流感病毒感染后CD4+和CD8+ T细胞的增殖还不清楚。在本研究中,阻断小鼠体内c-Jun蛋白的表达后,流感病毒感染后c-Jun蛋白的活化明显降低,外周血内CD4+和CD8+ T细胞的增殖均受到抑制。进一步证实了c-Jun蛋白作为JNK通路的效应分子,在流感病毒感染后所引起c-Jun蛋白的活化,参与了T细胞增殖和炎性反应等的调节。
脱氧核酶DRz是人工合成的具有酶活性的DNA分子,能在一定条件下识别并结合靶底物mRNA于配体结合部位形成螺旋,催化切割后与之分离,再结合其他底物,从而持续地抑制底物基因的表达。因其廉价、低毒、高稳定性、高特异性等优点,目前已成为分子生物医药等多个领域的研究热点。c-Jun蛋白在肺癌、肝癌等多种肿瘤中异常表达,在肿瘤的发生发展中发挥着重要作用,因此,cJun蛋白在肿瘤及抗感染治疗中可以作为一个有效靶点而存在。Dz13作为脱氧核酶的一种,通过与c-Jun核酸序列的特异识别,发挥基因表达抑制效应和高效的剪切活性。目前已经广泛应用在抗皮肤癌、血管形成、细胞增殖迁移等方面的研究中[8-9]。将Dzl3体外转染至人类微血管内皮细胞中,发现cJun蛋白表达减少,裸鼠皮肤鳞状细胞癌、黑色素瘤等皮肤癌细胞的迁移、侵袭受到抑制[10]。在本研究中,Dz13作用于流感病毒感染小鼠后,可以明显抑制流感病毒感染引起的c-Jun蛋白的活化和表达及CD4+和CD8+ T细胞的增殖和炎性因子的上调表达。此研究结果提示我们,在流感病毒感染后可以通过使用特异性Dz13阻断c-Jun蛋白表达来抑制感染后的过度炎性反应。结合Dz13的诸多优势,其在抗病毒感染应用中将具有重要的潜能,可以为抗病毒药物的筛选提供参考。
| [1] |
ASKONAS B A, TAYLOR P M, ESQUIVEL F. Cytotoxic T cells in influenza infection. Annals of the New York Academy of Sciences, 1988, 532: 230-237. DOI:10.1111/nyas.1988.532.issue-1 |
| [2] |
MOZDZANOWSKA K, MAIESE K, GERHARD W. Th cell-deficient mice control influenza virus infection more effectively than Th-and B cell-deficient mice:Evidence for a Th-independent contribution by B cells to virus clearance. Journal of Immunology, 2000, 164(5): 2635-2643. DOI:10.4049/jimmunol.164.5.2635 |
| [3] |
ARBOUR N, NANICHE D, HOMANN D, et al. c-Jun NH2- terminal kinase (JNK)1 and JNK2 signaling pathways have divergent roles in CD8+T cell-mediated antiviral immunity. Journal of Experimental Medicine, 2002, 195(7): 801-810. DOI:10.1084/jem.20011481 |
| [4] |
FAHMY R G, WALDMAN A, ZHANG G S, et al. Suppression of vascular permeability and inflammation by targeting of the transcription factor c-Jun. Nature Biotechnology, 2006, 24(7): 856-863. DOI:10.1038/nbt1225 |
| [5] |
ZHANG S P, TIAN H Y, CUI J M, et al. The c-Jun Nterminal kinase (JNK) is involved in H5N1 influenza A virus RNA and protein synthesis. Archives of Virology, 2016, 161(2): 345-351. DOI:10.1007/s00705-015-2668-8 |
| [6] |
XIE J J, ZHANG S P, HU Y X, et al. Regulatory roles of cJun in H5N1 influenza virus replication and host inflammation. Biochimica et Biophysica Acta:Molecular Basis of Disease, 2014, 1842(12): 2479-2488. DOI:10.1016/j.bbadis.2014.04.017 |
| [7] |
WANG Y Q, MA X, LU L L, et al. Defective antiviral CD8 T-cell response and viral clearance in the absence of c-Jun N-terminal kinases. Immunology, 2014, 142(4): 603-613. |
| [8] |
CAI H, SANTIAGO F S, PRADO-LOURENCO L. DNAzyme targeting c-Jun suppresses skin cancer growth. Science Translational Medicine, 2012, 4(139): 139ra82. |
| [9] |
KHACHIGIAN L M, FAHMY R G, ZHANG G S, et al. cJun regulates vascular smooth muscle cell growth and neointima formation after arterial injury.Inhibition by a novel DNA enzyme targeting c-Jun. Journal of Biological Chemistry, 2002, 277(5): 22985-22991. |
| [10] |
ZHANG G S, DASS C R, SUMITHRAN E, et al. Effect of deoxyribozymes targeting c-Jun on solid tumor growth and angiogenesis in rodents. Journal of the National Cancer Institute, 2004, 96(9): 683-696. DOI:10.1093/jnci/djh120 |
 2018, Vol. 44
2018, Vol. 44


