| 浙江及周边地区猪流行性腹泻病毒S基因分子特征分析 |
2. 浙江省畜产品质量安全检测中心,杭州 310020
2. Animal Products Quality Testing Center of Zhejiang Province, Hangzhou 310020, China
猪流行性腹泻(porcine epidemic diarrhea, PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus, PEDV)引起的高度接触性肠道传染病,以呕吐、腹泻、脱水等为主要特征,多发于秋冬季节,主要感染哺乳仔猪,其中7日龄以下的哺乳仔猪死亡率最高[1]。1978年,英国、比利时首次发现该病[2]。近年来,PEDV在包括中国、韩国、日本等国家在内的亚洲地区广泛流行[3-5],给养猪业带来巨大经济损失。PEDV在浙江省的临床检出率由2010年的42.86%提高到了2013年的70%以上[6]。
PEDV是套式病毒目(Nidovirales)冠状病毒科(Coronaviridae)冠状病毒属(Coronavirus)的成员,为有囊膜的、不分节段的、单股正链RNA病毒,其基因组全长约28 kb,包括5′端非编码区、3′端非编码区及至少7个开放阅读框(open reading frame, ORF)[7-8]。其中5个开放阅读框编码主要的结构蛋白,包括纤突(spike, S)蛋白、ORF3、小膜(envelope, E)蛋白、膜(membrane, M)蛋白、核衣壳(nucleocapsid, N)蛋白[9]。PEDV的S蛋白是主要的结构蛋白,属于Ⅰ型膜蛋白,含有主要的抗原决定簇,约由1 383个氨基酸组成,与其他冠状病毒属成员的S蛋白结构相似,包含3个结构域:较长的胞外结构域、跨膜结构域及较短的胞内结构域。根据其他冠状病毒S蛋白保守的基序,可以将PEDV的S蛋白分为S1区(第1~789位氨基酸)和S2区(第790~1 383位氨基酸)[10]。研究表明,PEDV的S蛋白对被感染宿主中和抗体的产生、特异性受体的结合及细胞膜融合方面具有重要的生物学意义,S1可识别受体,S2负责病毒囊膜与宿主细胞膜融合[11]。S蛋白中的4个中和表位区(499~638、748~ 755、764~771和1 368~1 374)均已被鉴别[12-14]。由于受到宿主免疫选择的压力,S蛋白易发生变异,因此,S蛋白对于了解PEDV的流行现状、分子多样性、基因突变的联系及疫苗的研发也有很重要的作用。
为了解现阶段PEDV流行毒株的分子演化特征,本研究采集了2013年4月到2017年4月间浙江省及周边地区仔猪腹泻样品,对引起腹泻的主要病原进行了检测分析,同时对其中16株临床分离PEDV毒株的S基因进行了克隆和分子特征分析。研究结果丰富了PEDV分子流行病学资料,同时为疫病准确诊断和有效防控提供了基础数据。
1 材料与方法 1.1 病料采集和处理采集浙江省及周边24个地区共282份病料,对其进行PEDV等病原的检测。在小肠组织及粪便样品中加入适量灭菌的0.01 mol/L磷酸盐缓冲液(pH 7.4)并研磨,置于-80 ℃冰箱中反复冻融2次,4 ℃、5 000 r/min离心10 min,取上清液。将上清液经0.45 μm滤膜过滤后,保存于-80 ℃冰箱中,备用。
1.2 主要试剂总RNA提取试剂盒购自天根生化科技(北京)有限公司;MMLV购自美国Promega公司;pMD18- T载体、RNA酶抑制剂(HPRI)、dNTP、随机引物、限制性内切酶、DNA分子质量标志物(DL2000、DL5000)等均购自日本TaKaRa公司;琼脂糖购自美国Sigma公司;胶回收试剂盒购自杭州新景生物试剂开发公司。
1.3 聚合酶链式反应(polymerase chain reaction, PCR)引物设计参考GenBank中公布的PEDV、猪传染性胃肠炎病毒(porcine transmissible gastroenteritis virus, TGEV)、猪δ冠状病毒(porcine deltacoronavirus, PDCoV)和轮状病毒A型(porcine group A rotavirus, GARV)全基因序列,利用Geneious 7.1.7软件设计病原检测和S基因克隆所用引物(表 1),其中用3个重叠套式PCR扩增S基因全长。引物均由上海华大基因科技股份有限公司合成。
| 表1 病原检测和序列克隆所用引物 Table 1 Primers for pathogens detecting and sequences cloning |
 |
| 点击放大 |
取-80 ℃保存备用的病料上清液,按总RNA提取试剂盒的操作说明书提取病毒总RNA,核酸经NanoDrop 1000分光光度计检测,质量浓度为1 800~ 2 500 ng/μL,D(260 nm):D(280 nm)=1.95~2.05,保存于-80 ℃冰箱中。
反转录步骤简述如下:1 μg总RNA与1 μL随机引物混匀,用去核酸酶水定容至10 μL,混匀后适当离心,65 ℃温浴5 min后,立即放入冰水中冰浴5 min,适当离心后,加入8 μL 5×RT缓冲液、4 μL 2.5 mmol/L dNTP、0.5 μL RNA酶抑制剂、0.5 μL MMLV反转录酶,用去核酸酶水定容至40 μL,充分混匀后,在42 ℃条件下作用1 h,95 ℃灭活10 min,获得的cDNA保存于-20 ℃冰箱中,备用。
1.5 检测病原的反应体系和条件对PEDV、PDCoV和TGEV均采用一步法TaqMan探针检测,按LightCycler® multiplex RNA virus master试剂盒(购自上海罗氏有限公司)说明书进行反应。反应体系为:RT-PCR反应混合物4.0 μL,PEDV-RTF/RTR或TGEV-F/T或PDCoV-RTF/ RTR各0.4 μ L,PEDV-RTP或TGEV-Probe或PDCoV-RTP 0.1 μL,反转录酶缓冲液0.1 μL,RNA模板5.0 μL,ddH2O 5.0 μL。反应条件为:50 ℃反转录10 min;95 ℃变性30 s;95 ℃扩增5 s,60 ℃扩增40 s,30个循环。扩增循环阈值(CT)小于30为阳性,30~35为可疑,大于35为阴性。
对GARV进行RT-PCR检测,反应体系简述如下:2×Easy Taq mix酶10.0 μL,GARV-VP6-F1/R1各1.0 μL,cDNA 1.0 μL,ddH2O 7.0 μL。反应条件为:95 ℃变性5 min;95 ℃扩增30 s,55 ℃扩增30 s,72 ℃扩增40 s,30个循环;72 ℃延伸1 min。PCR产物用1%琼脂糖凝胶电泳观察,预期片段大小为309 bp。
1.6 PEDV的S基因PCR扩增第1轮PCR扩增体系:cDNA模板2.0 μL,10×缓冲液5.0 μL,10 μmol/L PEDV-gp1-F1/R1或PEDV-S-F3/R3或PEDV-S-F5/R5上下游引物各1.0 μL(表 1),10 mmol/L dNTP 2.0 μL,PrimerSTAR DNA聚合酶0.5 μL,ddH2O 39.5 μL。第2轮PCR扩增体系:模板(第1轮PCR产物)2.0 μL,10 μmol/L PEDV-gp1-F2/R2或PEDV-S-F4/R4或PEDV-SF6/R6上下游引物(表 1)各1.0 μL,其他试剂与剂量同第1轮PCR反应。
2轮反应条件均为:98 ℃变性2 min;98 ℃扩增10 s,58 ℃扩增50 s,72 ℃扩增3 min,30个循环;72 ℃延伸10 min。
1.7 PEDV的S基因克隆、测序和拼接对PCR产物进行1%琼脂糖凝胶电泳,回收获得目的片段,将纯化产物直接送至上海华大基因科技股份有限公司测序。采用DNAStar软件中的SeqMan进行序列拼接。
1.8 序列分析采用DNAStar软件中的MegAlign及DNAman软件对获得的16份PEDV阳性样品和我国其他地区的分离株、国外分离株及PEDV疫苗株CV777等(附表 1,http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2017.06.231)的S基因进行核苷酸及氨基酸序列同源性分析;采用MEGA 5.0中的邻接法(neighbor-joining, NJ)进行系统发育分析[15]。使用SignalP 4.0软件对PEDV的S蛋白信号肽进行预测[16]。使用在线软件(http://www.cbs.dtu.dk/services/NetNGlyc/)进行糖基化位点分析,采用DNAStar软件中的Protean分析抗原指数。
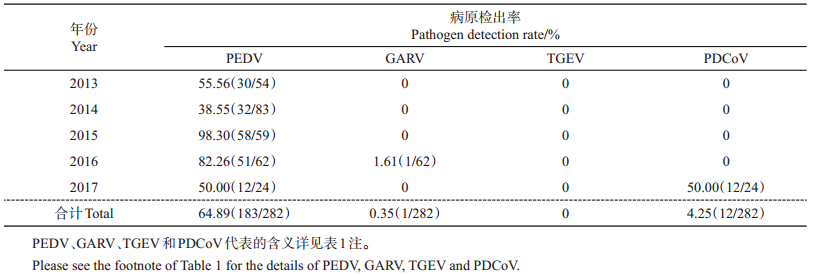
2 结果与分析 2.1 浙江省及周边地区生猪腹泻物中主要病原检测对浙江省及周边24个地区的282份病料进行PEDV、GARV、TGEV及PDCoV等病原的检测,结果(表 2)显示:PEDV、GARV及PDCoV的检出率分别为64.89%(183/282)、0.35%(1/282)和4.25%(12/ 282),而未检出TGEV;PEDV在11月1日至次年4月1日的检出率为74%,其余时间段的检出率为26%(数据未列出)。
| 表2 浙江省及周边地区生猪腹泻物中主要病原检测 Table 2 Investigation on main pathogens of pig diarrhea in Zhejiang Province and surrounding areas |
 |
| 点击放大 |
选取其中16份PEDV阳性样品(包括2013年的4份、2014年的4份、2015年的3份、2016年的3份和2017年的2份),进行S基因克隆和测序。除ZJ13SX1101和YN170101样本扩增获得的S基因全长为4 158 bp,编码1 386个氨基酸外,其他14株S基因的全长均为4 161 bp,编码1 387个氨基酸(图 1)。与经典毒株CV777(JN599150.1)S蛋白相比,16份PEDV阳性样品的S蛋白存在突变,分别为27QSTI30→SANT、56MN57→GE、62S→N、64S→T、68GGIETD74→AGQHPT、84Y→H、86DS87→RG、89Q→ H、120I→T、131N→I、120I→T、150S→F、159D→S、161KNI163→ EHS、178A→S、178A→S、185I→F、196R→K、210T→E、227Y→S、229E→Q、237S→I、246DS247→EP、287W→L、328F→ S、367VTE369→GAT、382K→N、442V→I、637Q→E、728N→S、768L→S、778M→T、810V→A、977H→Y、1 048S→A、1 055I→ V、1 171D→A、1 177GD1 178→DE、1 204L→F、1 302R→Q、1 363G→C;插入58KQGV61、140N(除ZJ13SX1101外);缺失160G;这些突变、插入或缺失主要集中在S1蛋白片段(21~790 aa)。在PEDV疫苗株CV777的S蛋白已鉴别的4个中和表位(COE:499~638;SS2:748-755;SS6:764~771和2C10:1 368~1 374)中,所获阳性样品在其中有2个中和表位(SS2:748~ 755和2C10:1 368~1 374)与疫苗株序列完全一致。具体见附图 1,http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2017.06.231。
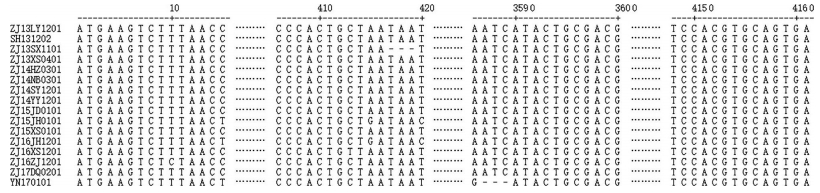 |
| 图1 16份PEDV临床阳性样品的部分S基因同源性比对结果 Fig. 1 Homology comparison result of partial S gene sequences from 16 clinical PEDV positive samples |
与疫苗毒株CV777、SM98和DR13相比,16份阳性样品的核苷酸同源性为93.6%~95.2%,氨基酸的同源性为92.4%~94.9%(表 3)。以PEDV的S蛋白进行分子演化分析表明:PEDV可分成3个群,疫苗株(包括CV777、SM98和DR13)均位于Ⅱa亚群,2012年后的大部分PEDV临床分离株均位于Ⅲ群,但其中分别有1株2014年韩国分离株(KM403158.1)、1株2014年越南分离株(KP455320)和1株2015年比利时分离株(KR003452)位于Ⅱb亚群;分离株也不存在地理分布的差异性(图 2)。
| 表3 PEDV临床阳性样品与参考株核苷酸(上三角区)和氨基酸(下三角区)相似性分析 Table 3 Similarity analysis of nucleotide (in upper triangle area) and amino acid (in lower triangle area) sequences between PEDV positive samples and reference strains |
 |
| 点击放大 |
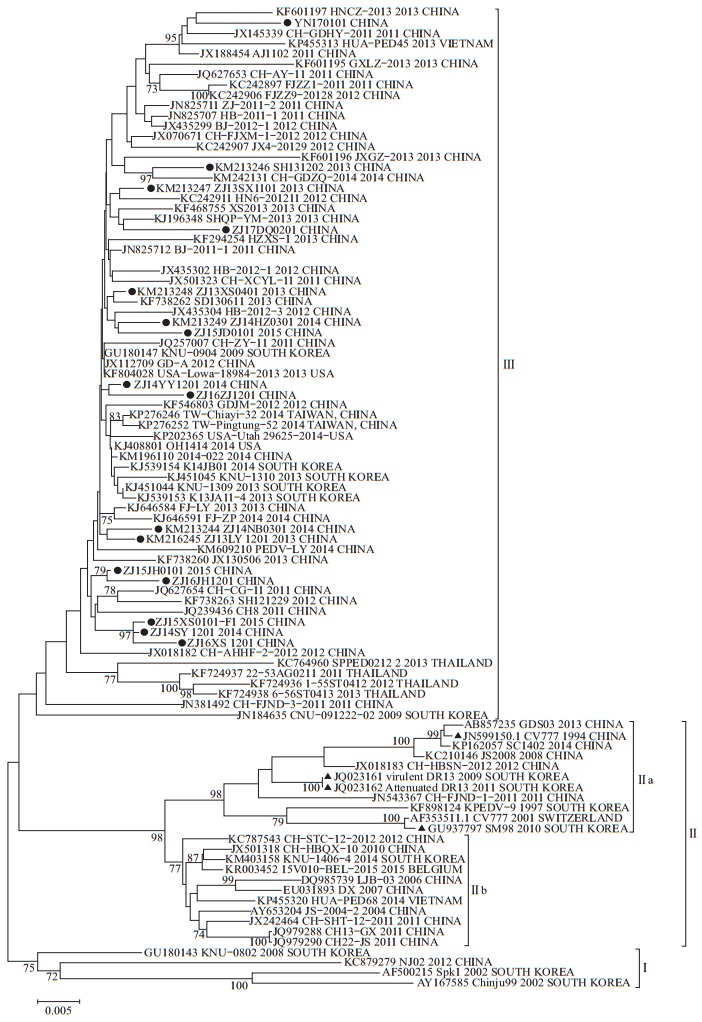 |
| 右侧名称分别表示GenBank收录编号、参考毒株名称、收集国家和时间;●表示本次研究所用毒株;▲表示疫苗用毒株;Bootstrap自展值使用1 000次重复抽样分析。 Names on the right indicate the GenBank accession number, reference strain name, collection country and time, respectively; black solid circle (●) indicates strains used in this study; black solid triangle (▲) indicates vaccine strains; Bootstrap analysis was based on 1 000 replicates. 图2 用邻接法构建的基于S蛋白的PEDV分子进化树 Fig. 2 PEDV molecular evolutionary trees constructed by neighbor-joining method based on S protein |
16份PEDV阳性样品、CV777(JN599150.1,1994,中国)和CV777(AF353511.1,2001,瑞士)的S基因潜在的“Asn-X-Ser/Thr”(X为除Pro外的任何氨基酸)和Asn的N-连接糖基化位点分析如图 3所示。结果表明:在这18个序列中,糖基化位点的数量分别为28个或29个,其中,ZJ13LY1201、ZJ13XS0401、ZJ14NB0301、ZJ14YY1201、ZJ14SY1201、ZJ15JH0101、ZJ15XS0101、ZJ16XS1201、ZJ16ZJ1201的阳性样品及疫苗株CV777(JN599150.1,1994,中国)含有28个潜在的N-糖基化位点,但是流行株与疫苗株潜在糖基化位点的位置存在一定的差异;其余阳性样品及疫苗株CV777(AF353511.1,2001,瑞士)均存在29个潜在的N-糖基化位点,且存在的潜在N-糖基化位点都一样。16份阳性样品与疫苗株CV777(JN599150.1,1994,中国)相比,形成了3个新的N-糖基化位点,分别为第58位的S→N、第116位的I→ T、第1 193位的T→N;另外,第232位的S→I氨基酸突变则破坏了1个疫苗株原有的N-糖基化位点。
 |
| 图3 PEDV的S蛋白序列中Asn-X-Ser/Thr(X为除Pro外的任何氨基酸)和Asn的N-糖基化位点预测 Fig. 3 Prediction of Asn-X-Ser/Thr (X is any amino acid except Pro) and Asn N-glycosylation sites within PEDV S protein |
本研究收集了浙江省及周边24个地区共282份病料,并对其进行了PEDV、GARV、PDCoV和TGEV等病原的检测,其中PEDV的检出率达到64.89%(183/282),感染率较高,但大部分猪场都使用了TGEV-PEDV二联疫苗(基于CV777),说明疫苗不能为现有的流行毒株提供有效的免疫保护。因此,对PEDV流行毒株的主要抗原基因的分子流行动态进行监测,在预防和控制猪流行性腹泻中具有重要的意义。
与猪传染性胃肠炎流行的特征类似,猪流行性腹泻的发生也呈现一定的季节性。浙江省及周边地区PEDV检出率在11月到次年4月期间比其余时间段高出48%。这可能是由于浙江省及周边地区在这一时间段内天气比较寒冷、昼夜温差较大。研究表明,冠状病毒在低温条件下比暴露于高热或阳光条件下更稳定[17],因此,寒冷的天气可能有利于PEDV的存活。
猪流行性腹泻病毒的S蛋白被认为具有较高的遗传变异性[18],不仅免疫原性良好[19-20],而且在感染宿主体内介导中和抗体产生的过程中起着重要作用[12, 21]。针对S基因全长进行的遗传变异分析,可将PEDV分为3个群[5]。对临床分离毒株及疫苗株的S基因进行分析发现,疫苗株均位于Ⅱa亚群,而2012年以后的大部分PEDV分离株均位于Ⅲ群,包括本次获得的16份PEDV阳性样品,这些浙江及周边地区的阳性样品与中国常用疫苗株CV777、2010年韩国疫苗株SM98、2009和2011年韩国疫苗株强弱毒株DR13亲缘关系较远。PEDV新的变异株也无明显的地理分布差异,这也部分解释了基于CV777或SM98等经典毒株的现有疫苗不能很好地控制当前PEDV变异株的流行。至于S基因的变异是否能导致PEDV毒力增强,还有待于进一步研究。S蛋白为Ⅰ型跨膜糖蛋白,富含N-糖基化修饰位点。尽管流行株与中国常用的PEDV CV777疫苗株大部分预测的糖基化位点一致,但流行株由于突变产生了3个新的N-糖基化位点并破坏了1个糖基化位点。流行毒株与CV777(JN599150.1,1994,中国)疫苗毒株之间N-糖基化位点的变化是否会影响病毒本身的致病性及抗原性,值得进一步探究。
4 结论综上所述,PEDV是当前引起仔猪腹泻的主要病原,且在冬季的发生率远远高于其他季节,呈现一定的季节性。虽然迄今为止PEDV只有1个血清型,但是不同毒株之间基因差异较大[22-24]。对浙江省及周边地区的16份PEDV阳性样品及参考株S基因的分析表明,目前在我国广泛流行的PEDV毒株与以往的毒株相比已经发生了较为明显的变异,这可能也是免疫失败的重要原因。因此,防控猪流行性腹泻需要注意季节的波动,也需要加快流行株疫苗的开发。
| [1] |
JUNG K, SAIF L J. Porcine epidemic diarrhea virus infection: Etiology, epidemiology, pathogenesis and immunoprophylaxis. The Veterinary Journal, 2015, 204(2): 134-143. DOI:10.1016/j.tvjl.2015.02.017 |
| [2] |
PENSAERT M B, DE BOUCK P. A new coronavirus-like particle associated with diarrhea in swine. Archives of Virology, 1978, 58(3): 243-247. |
| [3] |
KUSANAGI K I, KUWAHARA H, KATOH T, et al. Isolation and serial propagation of porcine epidemic diarrhea virus in cell cultures and partial characterization of the isolate. Journal of Veterinary Medical Science, 1992, 54(2): 313-318. DOI:10.1292/jvms.54.313 |
| [4] |
PARK S J, KIM H K, MOON H J, et al. Molecular detection of porcine kobuviruses in pigs in Korea and their association with diarrhea. Archives of Virology, 2010, 155(11): 1803-1811. DOI:10.1007/s00705-010-0774-1 |
| [5] |
PURANAVEJA S, POOLPERM P, LERTWATCHA RASA RAKUL P, et al. Chinese-like strain of porcine epidemic diarrhea virus, Thailand. Emerging Infectious Diseases, 2009, 15(7): 1112. DOI:10.3201/eid1507.081256 |
| [6] |
杜晓莉, 王一成, 吴润, 等. 2010-2013年浙江省猪流行性腹泻病毒临床检测及PEDV-S基因型分析. 浙江农业学报, 2014, 26(3): 581-587. DU X L, WANG Y C, WU R, et al. Genotyping and clinical detection of porcine epidemic diarrhea virus during 2010- 2013 in Zhejiang Province. Acta Agriculturae Zhejiangensis, 2014, 26(3): 581-587. (in Chinese with English abstract) DOI:10.3969/j.issn.1004-1524.2014.03.08 |
| [7] |
BRIDGEN A, DUARTE M, TOBLER K, et al. Sequence determination of the nucleocapsid protein gene of the porcine epidemic diarrhoea virus confirms that this virus is a coronavirus related to human coronavirus 229E and porcine transmissible gastroenteritis virus. Journal of General Virology, 1993, 74(9): 1795-1804. DOI:10.1099/0022-1317-74-9-1795 |
| [8] |
SONG D, PARK B. Porcine epidemic diarrhoea virus: A comprehensive review of molecular epidemiology, diagnosis, and vaccines. Virus Genes, 2012, 44(2): 167-175. DOI:10.1007/s11262-012-0713-1 |
| [9] |
LEE C. Porcine epidemic diarrhea virus: An emerging and re-emerging epizootic swine virus. Virology Journal, 2015, 12(1): 193. DOI:10.1186/s12985-015-0421-2 |
| [10] |
SUN D B, FENG L, SHI H Y, et al. Spike protein region (aa 636789) of porcine epidemic diarrhea virus is essential for induction of neutralizing antibodies. Acta Virologica, 2007, 51(3): 149-156. |
| [11] |
DUARTE M, LAUDE H. Sequence of the spike protein of the porcine epidemic diarrhoea virus. Journal of General Virology, 1994, 75(5): 1195-1200. DOI:10.1099/0022-1317-75-5-1195 |
| [12] |
CHANG S H, BAE J L, KANG T J, et al. Identification of the epitope region capable of inducing neutralizing antibodies against the porcine epidemic diarrhea virus. Molecules and Cells, 2002, 14(2): 295-299. |
| [13] |
SUN D B, FENG L, SHI H Y, et al. Identification of two novel B cell epitopes on porcine epidemic diarrhea virus spike protein. Veterinary Microbiology, 2008, 131(1/2): 73-81. |
| [14] |
GODET M, GROSCLAUDE J, DELMAS B, et al. Major receptor-binding and neutralization determinants are located within the same domain of the transmissible gastroenteritis virus (coronavirus) spike protein. Journal of Virology, 1994, 68(12): 8008-8016. |
| [15] |
TAMURA K, PETERSON D, PETERSON N, et al. MEGA 5: Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Molecular Biology and Evolution, 2011, 28(10): 2731-2739. DOI:10.1093/molbev/msr121 |
| [16] |
PETERSEN T N, BRUNAK S, VON HEIJNE G, et al. SignalP 4.0: Discriminating signal peptides from transmembrane regions. Nature Methods, 2011, 8(10): 785-786. DOI:10.1038/nmeth.1701 |
| [17] |
CASANOVA L M, JEON S, RUTALA W A, et al. Effects of air temperature and relative humidity on coronavirus survival on surfaces. Applied and Environmental Microbiology, 2010, 76(9): 2712-2717. DOI:10.1128/AEM.02291-09 |
| [18] |
CAVANAGH D, DAVIS P J, COOK J K A, et al. Location of the amino acid differences in the S1 spike glycoprotein subunit of closely related serotypes of infectious bronchitis virus. Avian Pathology, 1992, 21(1): 33-43. DOI:10.1080/03079459208418816 |
| [19] |
OH J, LEE K W, CHOI H W, et al. Immunogenicity and protective efficacy of recombinant S1 domain of the porcine epidemic diarrhea virus spike protein. Archives of Virology, 2014, 159(11): 2977-2987. DOI:10.1007/s00705-014-2163-7 |
| [20] |
HUY N X, KIM S H, YANG M S, et al. Immunogenicity of a neutralizing epitope from porcine epidemic diarrhea virus: M cell targeting ligand fusion protein expressed in transgenic rice calli. Plant Cell Reports, 2012, 31(10): 1933-1942. DOI:10.1007/s00299-012-1306-0 |
| [21] |
CRUZ D J M, KIM C J, SHIN H J. The GPRLQPY motif located at the carboxy-terminal of the spike protein induces antibodies that neutralize porcine epidemic diarrhea virus. Virus Research, 2008, 132(1/2): 192-196. |
| [22] |
KUBOTA S, SASAKI O, AMIMOTO K, et al. Detection of porcine epidemic diarrhea virus using polymerase chain reaction and comparison of the nucleocapsid protein genes among strains of the virus. Journal of Veterinary Medical Science, 1999, 61(7): 827-830. DOI:10.1292/jvms.61.827 |
| [23] |
BRIDGEN A, KOCHERHANS R, TOBLER K, et al. Further analysis of the genome of porcine epidemic diarrhoea virus//Coronaviruses and Arteriviruses. Boston, USA: Springer, 1998: 781-786.
|
| [24] |
YEO S G, HERNANDEZ M, KRELL P J, et al. Cloning and sequence analysis of the spike gene of porcine epidemic diarrhea virus Chinju99. Virus Genes, 2003, 26(3): 239-246. DOI:10.1023/A:1024443112717 |
 2018, Vol. 44
2018, Vol. 44


