| 茶多酚对肿瘤免疫逃逸的抑制机制研究进展 |
据调查,2015年全球共发生恶性肿瘤1 750万例,其中死亡870万例,2005—2015年,全球恶性肿瘤发病率提高了33%,恶性肿瘤已成为人类第二大死亡原因[1]。茶多酚是茶叶中最主要的活性成分。自1987年富田勋在体外实验中发现茶多酚对人体癌细胞具有抑制作用以来,对茶多酚抗肿瘤研究已经持续了30多年。体外实验和动物模型研究都表明茶多酚对肿瘤具有广谱的防治作用。然而,茶多酚的多羟基、高分子质量等结构特点限制了生物体对它的利用,导致其抗肿瘤的机制至今仍未明确。肿瘤免疫学认为,肿瘤的发生发展与机体免疫存在抑制与反抑制作用,肿瘤能通过其微环境中的免疫抑制细胞对机体起到免疫抑制作用,从而促成肿瘤的免疫逃逸。本文就近年来茶多酚对免疫抑制细胞作用的研究进行了综述,以期为从肿瘤免疫逃逸角度研究茶多酚抗肿瘤机制提供参考。
1 茶多酚抗肿瘤研究进展茶与恶性肿瘤的流行病学调查研究已涉及卵巢癌[2]、胆管癌[3]、前列腺癌[4-6]、肝癌[7]、口腔癌[8]等不同部位的癌症。SUN等[9]对8个国家提供的13篇关于饮用绿茶或红茶与患乳腺癌风险的流行病学研究进行Meta分析,发现饮用绿茶有利于降低患乳腺癌的风险。尽管大多数调查结果表明,饮用一定量的茶(包括绿茶、红茶等)与降低恶性肿瘤发病风险存在正相关性,然而调查研究的结果并不完全一致。TANG等[10]对饮用绿茶或红茶与肺癌发病风险相关的22项研究进行Meta分析,结果显示每天多饮用2杯绿茶可将肺癌发病风险降低18%,而饮用红茶与降低肺癌风险并未显示出明显的相关性。为了综合评估饮茶与癌症发生率之间的关系,ZHANG等[11]对来自87个数据库包括49 812个案例的57篇报告进行了Meta分析,发现高饮茶量对患胃癌、直肠癌、结肠癌、肺癌、胰腺癌、肝癌、乳腺癌、前列腺癌、卵巢癌、膀胱癌、胶质瘤等癌症的风险不具有显著性影响,然而,高饮茶量对于降低口腔癌风险具有显著作用(P=0.021),并且呈浓度依赖性(P=0.022)。亚群分析发现,每天喝1杯红茶会增加乳腺癌的发生率(表 1)。
| 表1 每天喝1杯茶与各类癌症发生风险的亚群分析[11] Table 1 Subgroup analysis of drinking one cup of tea per day and various cancer risks[11] |
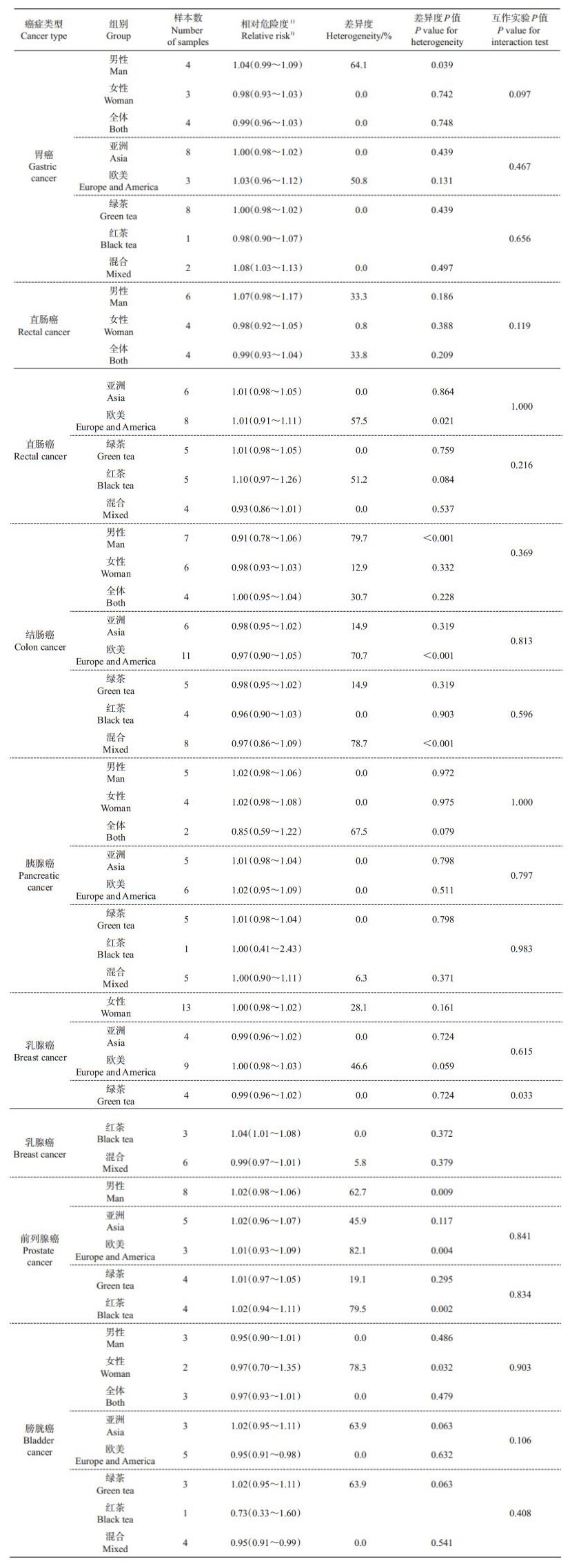 |
| 点击放大 |
对于流行病学调查结果无完全一致性这个问题,陈宗懋院士分析认为,调查人群的复杂性、调查标准的不统一、茶叶类别的差异、饮茶方式的不同等是其重要原因[12]。
与此同时,在体外模型中,茶多酚的抗肿瘤作用已得到广泛认同。研究表明,茶多酚可能通过抗氧化和氧化还原功能、调控致癌过程中关键酶活性、阻碍和修复由癌症引起的DNA损伤、调节转录因子等机制来发挥抗肿瘤作用,并且部分机制已在动物模型中被证明与抑制癌变有关[12-13]。然而,茶多酚抗肿瘤的临床研究却难以形成一致性结论,这使得茶多酚抗肿瘤机制是否成立存疑。一般而言,如果在体外实验浓度较低或与体内浓度相近时,能观察到理想的实验结果,说明这个结果也许会在体内发生。因此,茶多酚在体内的生物活性主要还得依靠它的生物利用率。然而,由于表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG)和很多蛋白的非特异性结合,以及能进入细胞的EGCG数量有限,导致EGCG对体内细胞及组织中的生物酶和纯化过的酶的有效浓度差异很大。当将少量纯酶用于酶法检测时,能观察到极低浓度的EGCG就可以起到抑制作用,但是要在细胞体系或组织中起到抑制作用则需要高浓度的EGCG。这一点表现在EGCG对20个胰凝乳蛋白酶体的抑制作用上:在无细胞体系中观察到EGCG的IC50(半抑制浓度)为0.1~0.2 μmol/L,而它在肿瘤细胞株里为1~40 μmol/L。有报道显示,EGCG可与67 kDa的层粘连蛋白受体(Kd值为0.04 μm)、波形蛋白(Kd值为3.3 nm)及细胞凋亡相关基因Bcl-2(Ki值为0.33 μm)3者结合[14],但要引起对癌细胞生长的抑制和诱导凋亡作用则需要更高浓度的EGCG。在摄入茶或茶多酚后EGCG的峰值浓度(包括它的游离态及结合态)在动物血浆和组织或者人体血浆中通常低于1 μmol/L。当口服大量药效剂量的茶多酚后,人体血浆中EGCG的峰值浓度为7.5 μmol/L。EGCG通常通过粪便排除,而尿液中EGCG的浓度非常低,甚至检测不到[15]。但是用于在体外观察生物效应的EGCG浓度通常超过其在血浆和组织中浓度的10~100倍,这一现象理论上表明EGCG的低生物利用度使其很难在体内有出色的抗肿瘤作用。然而,EGCG在多种癌症动物模型和部分临床研究中却都表现出一定/出色的抗肿瘤效果[16]。基于此,我们有理由推测EGCG可能通过其他途径间接地发挥了抗肿瘤作用。
2 肿瘤免疫逃逸机制肿瘤是指机体的某些细胞由于致癌因子的影响使该细胞失去了正常的增殖调控能力,从而导致细胞的无限度增殖。其中一部分癌变细胞可以通过机体的免疫系统将其清除,而另一部分会逃过机体免疫系统的“追杀”,产生免疫抑制并发展转移[17]。2015年,BEATTY等[18]将肿瘤免疫逃逸机制大致分为3个部分:肿瘤细胞抗原性的丢失、肿瘤细胞免疫原性的减弱、肿瘤微环境的作用。
肿瘤细胞抗原性和免疫原性的丢失或减弱主要归结为肿瘤细胞自身的改变:一方面,通过不表达抗原来使免疫细胞对其不识别,如肿瘤细胞表面由肿瘤浸润骨髓细胞产生的过氧硝酸盐能够修饰主要组织相容性复合体,使肿瘤相关抗原不在质膜上表达,从而细胞毒性T细胞无法识别并溶解癌细胞[19],或者其编码肿瘤抗原的表观遗传信息发生显著变化使其不表达[20];另一方面,肿瘤细胞免疫原性的减弱则是指肿瘤细胞的免疫抑制分子会抑制抗肿瘤淋巴细胞对其的清除作用,如PD-L1[21];再者,肿瘤细胞代谢也会产生变化[19],肿瘤细胞生长通常通过糖酵解途径获得能量,使得机体内的酸度增加。而降低体内的酸度则可以恢复T细胞耐受并增加免疫治疗的效力[22]。另外,肿瘤细胞能破坏细胞凋亡相关受体蛋白的平衡,使凋亡抑制蛋白失调,减弱含半胱氨酸的天冬氨酸蛋白水解酶(caspase)活性来抑制其凋亡[23]。获得肿瘤干细胞同样也是肿瘤免疫逃逸的方法,不同的肿瘤干细胞拥有不同的“免疫赦免”机制[24]。
肿瘤微环境包括肿瘤浸润免疫细胞、细胞因子及微环境基质,对机体免疫具有重要调节作用。微环境中存在大量的免疫抑制细胞,它们对免疫具有负向调节作用,促进肿瘤的免疫逃逸。主要的免疫抑制细胞有:髓系抑制性细胞(myeloidderived suppressor cells, MDSCs),调节T细胞(regulatory T cell, Treg),肿瘤相关巨噬细胞(tumor associated macrophage, TAM)和树突状细胞(dendritic cells, DCs)[21]。
MDSCs是在肿瘤局部大量聚集,能使免疫细胞的应答作用被抑制的一群异质性髓系细胞[25]。MDSCs的免疫应答机制主要归为以下几点:1)分泌精氨酸酶(arginase 1, Arg-1)和诱导型一氧化氮酶(inducible nitric oxide synthase, iNOS),使微环境中的精氨酸和半胱氨酸被消耗,精氨酸的消耗会抑制T细胞的增殖,半胱氨酸的消耗会抑制T细胞功能;2)产生活性氧、过氧亚硝酸盐;3)MDSCs亚群发挥免疫抑制作用,MDSCs分为单核细胞样和粒细胞样2种亚群,目前认为这2种亚群都能够抑制T细胞功能,但只有单核MDSCs能够分化成成熟的树突状细胞和巨噬细胞;4)诱导Treg发育,产生免疫抑制作用。也有文章提到MDSCs分泌的可溶的相关细胞因子(如:MMPs、VEGF、TGF-β等)能够刺激肿瘤新血管生成、入侵、增殖及转移[26]。MDSCs会通过与细胞的相互作用促进巨噬细胞、树突状细胞的免疫抑制作用[27]。然而也有新研究发现,MDSCs在一定情况下能够支持抗肿瘤免疫应答并抑制肿瘤生长。MDSCs的这2种相反功能是由于骨髓细胞的表型可塑性,使它们有不同的形态和功能来应对环境条件[28],所以利用免疫调节剂来克服MDSCs的免疫抑制作用也许是一种潜在的肿瘤治疗方法。
TAM是在肿瘤附近聚集并能促进肿瘤生长的巨噬细胞,一些细胞因子能够促进巨噬细胞向肿瘤局部趋化,促进肿瘤微环境中的巨噬细胞向类似M2型(选择激活型)巨噬细胞极化。巨噬细胞是广泛分布的天然免疫细胞,能够被激活并极化成为具有不同功能表型的细胞,经典激活型(M1型)和选择激活型(M2型)巨噬细胞是2种不同的巨噬细胞亚群。M1型巨噬细胞能表达促炎性细胞因子、趋化因子及效应分子。而M2型巨噬细胞则表达一系列抗感染分子。大多肿瘤浸润巨噬细胞多为M2型巨噬细胞,它能够提供一个免疫抑制微环境以供肿瘤生长;此外,肿瘤相关巨噬细胞会分泌许多细胞因子、趋化因子及蛋白酶,并且能够与肿瘤干细胞相互作用,以促进肿瘤生长、转移和免疫抑制[29-30]。
Treg是一类以Foxp3为转录因子控制体内自身免疫反应性的T细胞亚群,但其介导的免疫抑制作用是有效治疗肿瘤的重要障碍,能够钝化免疫系统运作。Treg的免疫抑制机制主要有:1)分泌可溶的或者细胞膜免疫抑制分子。Treg主要产生的细胞因子有IL-10、TGF-β及IL-35,它们能够抑制效应T细胞的活性。2)细胞具有溶解活性。Treg的另外一个机制就是杀死效应T细胞或肿瘤抗原呈递树突状细胞。Treg能够通过一系列的因子(如:穿孔素、颗粒酶b、肿瘤坏死因子相关诱导配体通路和半乳凝素-1)发挥细胞溶解的作用,这些因子或通路的活化会诱导靶效应细胞(如:自然杀伤细胞、CD8+毒性T细胞)的凋亡。3)对T细胞代谢的破坏。Treg能够抑制效应T细胞的代谢功能,通过消耗IL-2使效应细胞饥饿,从而导致效应细胞的凋亡[31-32],目前该争论比较激烈。此外,Treg能够催化腺苷三磷酸分解为腺苷来抑制效应T细胞的功能。4)与树突状细胞相互作用。一些研究表明,Treg能够通过次级细胞调控免疫抑制。
3 茶多酚对肿瘤免疫逃逸的抑制 3.1 茶多酚与MDSCs2013年,SANTILLI等[33]利用成神经细胞瘤小鼠模型研究发现,标准茶多酚制剂(polyphenol E, PE)能够减少肿瘤浸润的MDSCs,抑制自发性成神经细胞瘤的肿瘤生长(在免疫缺陷的NOD/SCID小鼠中无该作用)。实验中,PE(5 μg/mL)能通过作用于MDSCs和CD8+毒性T细胞来抑制肿瘤生长。在体外,PE会损伤MDSCs的发展和运动性,并通过67 kDa层粘连蛋白信号和诱导粒细胞集落刺激因子(G-CSF)来促进MDSCs分化成更成熟的嗜中性MDSCs,减小MDSCs对成神经细胞瘤的浸润。SANTILLI等[34]认为,PE能够在免疫系统存在的情况下改变肿瘤微环境来发挥抗肿瘤作用,并且PE能够抑制MDSCs招募CD4+ Treg细胞。随后,该项研究得到了ORENTAS[35]的关注,他结合SANTILLI的实验总结出,PE能够使CD11b+Gr-1+(MDSCs表型)减少,在CD66b+细胞存在时PE能够逆转T细胞的抑制,激活免疫反应,使有抑制性的MDSCs转化成有促活性的抗原提呈细胞。因此,EGCG能够影响MDSCs的表面受体,促使MDSCs分化,改变肿瘤微环境中的细胞因子和激素,共同激活肿瘤浸润淋巴细胞来达到抗癌作用。在此基础上,笔者之一徐平[36]应用乳腺癌模型研究发现,EGCG能呈剂量依赖效应地降低荷瘤小鼠外周血、脾和肿瘤局部的MDSCs含量,从而缓解荷瘤小鼠体内的免疫抑制状态,同时,EGCG还能显著地提升荷瘤小鼠体内的CD4+毒性T细胞和CD8+毒性T细胞水平,降低Treg、Arg-1和iNOS的表达。这些结果验证了EGCG可能通过调控MDSCs发挥抗肿瘤(乳腺癌)作用。随后,他又通过从荷瘤小鼠中获得乳腺癌诱导的高纯度MDSCs,研究了EGCG对MDSCs与其介导的免疫抑制关键效应分子的作用。结果发现,EGCG能通过诱导MDSCs凋亡和阻滞其分裂周期,并下调Arg-1、iNOS、gp91、p47、GM-CSF、IL-6、IL-13等效应分子直接或间接地缓解MDSCs介导的免疫抑制作用[36]。
3.2 茶多酚与Treg在茶多酚与Treg的相关研究中,主要分为自身免疫病模型、免疫逃逸炎症模型、糖尿病模型。T细胞,特别是CD4+辅助T细胞(CD4+ T helper cells, CD4+ Th),在调节许多疾病中起到关键作用。当受到抗原刺激后初始CD4+毒性T细胞会增殖并分化成具有不同效应的细胞亚群,Th1和Th17细胞是Th细胞的促炎亚群,会引起自身免疫疾病,而Treg与Th1和Th17细胞有拮抗作用。研究发现,EGCG有改善自身免疫疾病症状的作用[37]。MIN等[38]研究了EGCG(10 mg/kg)对实验关节炎小鼠的免疫调节作用和机制,发现EGCG能够改善小鼠关节炎的相关症状,显著地抑制T细胞增殖和CD4+ Foxp3+ Treg细胞占比,以及抑制CD11b+的DCs表达的吲哚胺- 2,3-双加氧酶(indoleamine- 2, 3- dioxygenase, IDO);进一步研究发现,EGCG能通过IDO依赖途径诱导脾中的树突状细胞来增加Treg的出现频率并活化Nrf-2抗氧化通路,从而改善实验小鼠的关节炎病症;此外,YANG等[39]研究发现,EGCG(每周3次,每次腹腔注射40 mg/kg,共注射2.5周)可使得脾中Foxp3+ Treg细胞比率上升,Th17细胞比率下降,从而改善关节炎症状;在过敏反应模型中,服用从绿茶提取物中分离的EGCG(1 mg/mL)会加强自然杀伤细胞的溶解和腹腔细胞的吞噬作用,以及增加脾细胞的增殖和IL-2、IFN-γ的分泌量。而且绿茶提取物能通过增加脾中Treg比率来减少抗原特异性免疫球蛋白E的产生[40]。在自身免疫性脑脊髓炎模型中,Treg发挥着一定的保护作用,EGCG(10 μmol/L)能够阻碍初始CD4+毒性T细胞向Th1和Th17的分化,抑制IL-6诱导的对Treg的抑制作用。EGCG的保护作用与自体反应T细胞相关,能够减少促炎因子、Th1和Th17细胞,增加淋巴组织和中枢神经系统中Treg细胞群占比[37, 41];在新西兰黑/白鼠狼疮肾炎模型中,EGCG(120 mg/kg)能够加强脾中Treg的活性来预防红斑狼疮肾炎[42]。
YU等[43]研究发现,EGCG(5 mg/kg)对雷公藤甲素引起的肝损伤有保护作用,当Th17/Treg平衡被破坏后会导致肝炎,而EGCG能够恢复Th17/Treg的不平衡,抑制TLR4信号通路,加强Tim3通路的活化,恢复由雷公藤甲素抑制的Treg相关抗感染细胞因子IL-10的分泌,从而改善肝损伤症状。对于溃疡性结肠炎,EGCG也具有潜在的治疗效果:能够减少IL-6和IL-17的分泌,调节小鼠脾中Treg/Th17细胞的比率,增加血浆中IL-10和TGF-β1的水平,降低结肠中HIF-1α和STAT3蛋白表达[44]。此外,EGCG能通过减少甲基转移酶的表达及总体DNA甲基化,促进Foxp3的表达,增加Treg活性与功能[45-46]。
在2型糖尿病模型实验中,红茶的饮用主要使外周血中糖化血红蛋白含量降低,并增加免疫抑制表型的Treg,减少促炎因子及与Th1相关的细胞[47]。MAHMOUD等[48]在2016年研究了一种糖尿病茶(红茶+12种其他成分)的功效,发现其能上调IL-10的表达和Treg/IL-17细胞的比率。此外,有研究显示,在慢性心力衰竭小鼠模型中,儿茶素(50、100 mg/kg)能显著地抑制免疫激活,调节IL- 17/IL-10的不平衡水平,在外周血和脾中逆转Th17和Treg的异常极化[49]。
3.3 茶多酚与TAM有关茶多酚与TAM的相关研究较少。2013年JANG等[50]发现在体外4T1细胞模型中,EGCG(100 μmol/L)能够上调4T1肿瘤细胞和外泌体中的微小RNA-16,通过外泌体被转移到TAM并抑制TAM的浸润和向M2型的极化。说明EGCG通过调控TAM来发挥抗肿瘤活性。WANG等[51]研究发现:在基质细胞中20、40、60 μmol/L EGCG前体药(prodrug of EGCG, pro-EGCG)能下调趋化因子CXCL12并限制巨噬细胞的迁移和分化,因此能抑制表达血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)的TAM对肿瘤的浸润;pro-EGCG的处理不仅能够减少癌细胞分泌VEGFA,而且能够抑制子宫内膜癌的TAM分泌VEGFA[51]。
4 肿瘤免疫治疗与茶多酚的应用目前,肿瘤治疗方法包括:手术治疗、放射治疗、化学治疗、生物治疗和分子靶向治疗、免疫治疗、联合中药治疗[52]。研究表明,茶多酚能够作为肿瘤治疗的辅助药物,与抗癌药物具有协同作用:茶多酚通过调节相关蛋白来对癌细胞的周期、凋亡和血管生成作用造成影响;在激素相关肿瘤中,如乳腺癌、前列腺癌,茶多酚能够下调多抗药蛋白的表达和活性,与激素受体相互作用;茶多酚的抗氧化和促氧化调节作用能够克服抗癌药物的耐药性并与之协同作用。但也有文章指出,茶多酚能够与硼替佐米、舒尼替尼抗癌药物发生拮抗反应[53]。
此外,茶多酚还能够作为放化疗致敏剂,具有辐射敏化作用和协同抗癌作用。茶多酚还能够改善化疗、放疗所带来的副作用(肠胃疾病、血液和免疫系统指标降低、继发肿瘤、放射性皮炎、肾毒性、心脏中毒、耳朵毒性、唾液腺功能障碍及肺纤维化)[53-54]。在免疫治疗中,茶多酚具有免疫调节作用,能够保护免疫细胞膜免受过氧化损伤,还能够激活各种免疫细胞,诱导产生多种细胞因子,促进干扰素、白细胞介素等的合成,提高机体免疫球蛋白水平等[54]。EGCG能够诱导肿瘤细胞凋亡,EGCG联合DNA疫苗能够增强肿瘤特异性T细胞的免疫反应,增加抗癌效果,DNA疫苗外加口服EGCG能够在治愈小鼠中产生长期抗肿瘤保护作用[55]。体内实验表明,在肿瘤初始阶段服用绿茶及茶多酚只有局部的防治效果。然而,当持续服用绿茶与茶多酚后,机体多种器官的癌变前期和肿瘤生成能够被有效地抑制。在体外细胞实验中也有同样的效果。茶多酚主要作为一种抗氧化剂,诱导机体的解毒系统,调节膜结构,与DNA、RNA、蛋白质相互作用并发生表观遗传修饰,影响细胞的增殖能力;同时,它们还能够抑制初始肿瘤的自我更新、繁殖和生存,从而抑制肿瘤代谢和肿瘤的发生与发展。每天喝茶似乎确实能够加强机体的防癌机制,并且,纯茶多酚能够作为治疗剂与传统治疗方法联用以达到更好的抗癌治疗效果[56]。在针对乳腺癌肿瘤干细胞疗法中,许多植物化合物(包括EGCG)能够作用于肿瘤干细胞这种异源群体及其关键信号通路[57]。
5 小结回顾茶多酚抗肿瘤的研究进展,我们可以看到,茶多酚的低生物利用度(即无法在生物体内达到体外模型中的抗肿瘤的有效剂量)限制了其抗肿瘤机制的突破。尽管茶多酚很难在生物体内直接作用于肿瘤细胞,但大量证据表明茶多酚可以在体内发挥抗肿瘤作用。这说明对茶多酚抗肿瘤机制研究可能需要从间接途径着手。因为肿瘤与免疫息息相关,所以茶多酚是否能够通过免疫途径间接地发挥抗肿瘤作用值得深入研究。从已有研究来看,相对于肿瘤细胞,与肿瘤免疫相关的MDSCs、Treg和TAM对EGCG更加敏感,尤其是MDSCs,是近年来肿瘤免疫逃逸领域的“明星分子”,被认为是肿瘤免疫治疗的一个关键靶点。茶多酚可以在较低浓度下(<5 μmol/L)通过调控MDSCs等关键免疫抑制细胞介导的免疫抑制,阻滞肿瘤的免疫逃逸,从而间接地起到了抗肿瘤作用。该发现从免疫学角度为茶多酚抗肿瘤机制研究提供了新的思路。笔者之一徐平应用乳腺癌小鼠模型验证了这个免疫学作用机制,并发现MDSCs对EGCG极为敏感。当然,这一机制是否具有普适性还需要在更多的模型中验证,同时,茶多酚调控MDSCs的分子机制也需要进行深入研究。随着肿瘤治疗手段的不断丰富,尤其是肿瘤免疫治疗时代即将来临,茶多酚在肿瘤防治中的应用也需要进一步探索。
| [1] |
Global Burden of Disease Cancer Collaboration. Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life-years for 32 cancer groups, 1990 to 2015: A systematic analysis for the global burden of disease study. Jama Oncology, 2017, 3(4): 524-548. DOI:10.1001/jamaoncol.2016.5688 |
| [2] |
ZHAN X, WANG J, PAN S F, et al. Tea consumption and the risk of ovarian cancer: A meta-analysis of epidemiological studies. Oncotarget, 2017, 8(23): 37796-37806. |
| [3] |
XIONG J P, LIN J Z, WANG A Q, et al. Tea consumption and the risk of biliary tract cancer: A systematic review and doseresponse meta-analysis of observational studies. Oncotarget, 2017, 8(24): 39649-39657. |
| [4] |
TSE L A, LEE P M Y, HO W M, et al. Bisphenol A and other environmental risk factors for prostate cancer in Hong Kong. Environment International, 2017, 107: 1-7. DOI:10.1016/j.envint.2017.06.012 |
| [5] |
LASSED S, DEUS C M, DJEBBARI R, et al. Protective effect of green tea (Camellia sinensis (L.) Kuntze) against prostate cancer: From in vivo data to Algerian patients. Evidence-based Complementary and Alternative Medicine, 2017, 3: 1691568. |
| [6] |
HOANG V D, LEE A H, PHAM N M, et al. Habitual tea consumption reduces prostate cancer risk in Vietnamese men: A case-control study. Asian Pacific Journal of Cancer Prevention, 2016, 17(11): 4939-4944. |
| [7] |
NI C X, GONG H, LIU Y, et al. Green tea consumption and the risk of liver cancer: A meta-analysis. Nutrition and Cancer, 2017, 69(2): 211-220. DOI:10.1080/01635581.2017.1263754 |
| [8] |
CHEN F, HE B C, YAN L J, et al. Tea consumption and its interactions with tobacco smoking and alcohol drinking on oral cancer in southeast China. European Journal of Clinical Nutrition, 2017, 71(4): 481-485. DOI:10.1038/ejcn.2016.208 |
| [9] |
SUN C L, YUAN J M, KOH W P, et al. Green tea, black tea and breast cancer risk: A meta-analysis of epidemiological studies. Carcinogenesis, 2006, 27(7): 1310-1315. DOI:10.1093/carcin/bgi276 |
| [10] |
TANG N P, WU Y M, ZHOU B, et al. Green tea, black tea consumption and risk of lung cancer: A meta-analysis. Lung Cancer, 2009, 65(3): 274-283. DOI:10.1016/j.lungcan.2008.12.002 |
| [11] |
ZHANG Y F, XU Q, LU J, et al. Tea consumption and the incidence of cancer: A systematic review and meta-analysis of prospective observational studies. European Journal of Cancer Prevention: the Official Journal of the European Cancer Prevention Organisation, 2015, 24(4): 353-362. DOI:10.1097/CEJ.0000000000000094 |
| [12] |
陈宗懋. 茶叶抗癌研究二十年. 茶叶科学, 2009, 29(3): 173-190. CHEN Z M. Twenty years period in the investigation on the anticarcinogenic activity of tea. Journal of Tea Science, 2009, 29(3): 173-190. (in Chinese with English abstract) DOI:10.3969/j.issn.1000-369X.2009.03.001 |
| [13] |
YANG C S, LAMBERT J D, SANG S. Antioxidative and anti-carcinogenic activities of tea polyphenols. Archives of Toxicology, 2009, 83(1): 11-21. DOI:10.1007/s00204-008-0372-0 |
| [14] |
JU J, LU G, LAMBERT J D, et al. Inhibition of carcinogenesis by tea constituents. Seminars in Cancer Biology, 2007, 17(5): 395-402. DOI:10.1016/j.semcancer.2007.06.013 |
| [15] |
YANG C S, LAMBERT J D, HOU Z, et al. Molecular targets for the cancer preventive activity of tea polyphenols. Molecular Carcinogenesis, 2006, 45(6): 431-435. DOI:10.1002/(ISSN)1098-2744 |
| [16] |
YANG C S, LAMBERT J D, JU J, et al. Tea and cancer prevention: Molecular mechanisms and human relevance. Toxicology and Applied Pharmacology, 2007, 224(3): 265-273. DOI:10.1016/j.taap.2006.11.024 |
| [17] |
温伯格R A.癌生物学.詹启敏, 刘芝华, 译.北京: 科学出版社, 2009: 641. WEINBERG R A. The Biology of Cancer. Translation by ZHAN Q M, LIU Z H. Beijing: Science Press, 2009: 641. (in Chinese) |
| [18] |
BEATTY G L, GLADNEY W L. Immune escape mechanisms as a guide for cancer immunotherapy. Clinical Cancer Research: An Official Journal of the American Association for Cancer Research, 2015, 21(4): 687-692. DOI:10.1158/1078-0432.CCR-14-1860 |
| [19] |
VILLALBA M, RATHORE M G, LOPEZ-ROYUELA N, et al. From tumor cell metabolism to tumor immune escape. The International Journal of Biochemistry & Cell Biology, 2013, 45(1): 106-113. |
| [20] |
DUPAGE M, MAZUMDAR C, SCHMIDT L M, et al. Expression of tumour-specific antigens underlies cancer immunoediting. Nature, 2012, 482(7385): 405-409. DOI:10.1038/nature10803 |
| [21] |
梁雪, 陈祥彬, 李广平. 肿瘤免疫逃逸机制研究进展. 生命的化学, 2015, 35(4): 504-508. LIANG X, CHEN X B, LI G P. Mechanism of tumor immune escape. Chemistry of Life, 2015, 35(4): 504-508. (in Chinese with English abstract) |
| [22] |
BELLONE M, CALCINOTTO A, FILIPAZZI P, et al. The acidity of the tumor microenvironment is a mechanism of immune escape that can be overcome by proton pump inhibitors. Oncoimmunology, 2013, 2(1): e22058. DOI:10.4161/onci.22058 |
| [23] |
KOFF J L, RAMACHANDIRAN S, BERNAL-MIZRACHI L. A time to kill: Targeting apoptosis in cancer. International Journal of Molecular Sciences, 2015, 16(2): 2942-2955. DOI:10.3390/ijms16022942 |
| [24] |
BHATIA A, KUMAR Y. Cellular and molecular mechanisms in cancer immune escape: A comprehensive review. Expert Review of Clinical Immunology, 2014, 10(1): 41-62. DOI:10.1586/1744666X.2014.865519 |
| [25] |
GABRILOVICH D I, NAGARAJ S. Myeloid-derived suppressor cells as regulators of the immune system. Nature Reviews Immunology, 2009, 9(3): 162-174. DOI:10.1038/nri2506 |
| [26] |
UMANSKY V, BLATTNER C, GEBHARDT C, et al. The role of myeloid-derived suppressor cells (MDSC) in cancer progression. Vaccines, 2016, 4(4): 36. DOI:10.3390/vaccines4040036 |
| [27] |
OSTRAND-ROSENBERG S, SINHA P, CHORNOGUZ O, et al. Regulating the suppressors: Apoptosis and inflammation govern the survival of tumor-induced myeloid-derived suppressor cells (MDSC). Cancer Immunology, Immunotherapy, 2012, 61(8): 1319-1325. DOI:10.1007/s00262-012-1269-6 |
| [28] |
MANJILI M H. Phenotypic plasticity of MDSC in cancers. Immunological Investigations, 2012, 41(6/7): 711-721. |
| [29] |
GALDIERO M R, GARLANDA C, JAILLON S, et al. Tumor associated macrophages and neutrophils in tumor progression. Journal of Cellular Physiology, 2013, 228(7): 1404-1412. DOI:10.1002/jcp.24260 |
| [30] |
RUFFELL B, AFFARA N I, COUSSENS L M. Differential macrophage programming in the tumor microenvironment. Trends in Immunology, 2012, 33(3): 119-126. DOI:10.1016/j.it.2011.12.001 |
| [31] |
FACCIABENE A, MOTZ G T, COUKOS G. T-regulatory cells: Key players in tumor immune escape and angiogenesis. Cancer Research, 2012, 72(9): 2162-2171. DOI:10.1158/0008-5472.CAN-11-3687 |
| [32] |
CHIKARA S, NAGAPRASHANTHA L D, SINGHAL J, et al. Oxidative stress and dietary phytochemicals: Role in cancer chemoprevention and treatment. Cancer Letters, 2018, 413: 122-134. DOI:10.1016/j.canlet.2017.11.002 |
| [33] |
SANTILLI G, PIOTROWSKA I, CANTILENA S, et al. Polyphenon[corrected] E enhances the antitumor immune response in neuroblastoma by inactivating myeloid suppressor cells. Clinical Cancer Research: an Official. Journal of the American Association for Cancer Research, 2013, 19(5): 1116-1125. |
| [34] |
SANTILLI G, ANDERSON J, THRASHER A J, et al. Catechins and antitumor immunity: Not MDSC' s cup of tea. Oncoimmunology, 2013, 2(6): e24443. DOI:10.4161/onci.24443 |
| [35] |
ORENTAS R J. Reading the tea leaves of tumor-mediated immunosuppression. Clinical Cancer Research: an Official Journal of the American Association for Cancer Research, 2013, 19(5): 955-957. DOI:10.1158/1078-0432.CCR-12-3792 |
| [36] |
徐平.EGCG通过调控MDSCs介导免疫抑制阻滞肿瘤免疫逃逸研究.杭州: 浙江大学, 2016. XU P. Inhibition of EGCG on tumor immune escape by regulating MDSCs-mediated immunosupression. Hangzhou: Zhejiang University, 2016. (in Chinese with English abstract) |
| [37] |
WU D Y, WANG J P, PAE M, et al. Green tea EGCG, T cells, and T cell-mediated autoimmune diseases. Molecular Aspects of Medicine, 2012, 33(1): 107-118. DOI:10.1016/j.mam.2011.10.001 |
| [38] |
MIN S Y, YAN M, KIM S B, et al. Green tea epigallocatechin-3-gallate suppresses autoimmune arthritis through indoleamine-2, 3-dioxygenase expressing dendritic cells and the nuclear factor, erythroid 2-like 2 antioxidant pathway. Journal of Inflammation, 2015, 12: 53. DOI:10.1186/s12950-015-0097-9 |
| [39] |
YANG E J, LEE J, LEE S Y, et al. EGCG attenuates autoimmune arthritis by inhibition of STAT3 and HIF-1 alpha with Th17/Treg control. PloS One, 2014, 9(2): e86062. DOI:10.1371/journal.pone.0086062 |
| [40] |
KUO C L, CHEN T S, LIOU S Y, et al. Immunomodulatory effects of EGCG fraction of green tea extract in innate and adaptive immunity via T regulatory cells in murine model. Immunopharmacology and Immunotoxicology, 2014, 36(5): 364-370. DOI:10.3109/08923973.2014.953637 |
| [41] |
WANG J P, PAE M, MEYDANI S N, et al. Green tea epigallocatechin-3-gallate modulates differentiation of naive CD4+ T cells into specific lineage effector cells. Journal of Molecular Medicine, 2013, 91(4): 485-495. DOI:10.1007/s00109-012-0964-2 |
| [42] |
TSAI P Y, KA S M, CHANG J M, et al. Epigallocatechin-3-gallate prevents lupus nephritis development in mice via enhancing the Nrf2 antioxidant pathway and inhibiting NLRP3 inflammasome activation. Free Radical Biology & Medicine, 2011, 51(3): 744-754. |
| [43] |
YU S J, JIANG R, MAZZU Y Z, et al. Epigallocatechin-3-gallate prevents triptolide-induced hepatic injury by restoring the Th17/Treg balance in mice. The American Journal of Chinese Medicine, 2016, 44(6): 1221-1236. DOI:10.1142/S0192415X16500683 |
| [44] |
XU Z L, WEI C, ZHANG R U, et al. Epigallocatechin-3-gallate-induced inhibition of interleukin-6 release and adjustment of the regulatory T/T helper 17 cell balance in the treatment of colitis in mice. Experimental and Therapeutic Medicine, 2015, 10(6): 2231-2238. DOI:10.3892/etm.2015.2824 |
| [45] |
PATEL S, VAJDY M. Induction of cellular and molecular immunomodulatory pathways by vitamin A and flavonoids. Expert Opinion on Biological Therapy, 2015, 15(10): 1411-1428. DOI:10.1517/14712598.2015.1066331 |
| [46] |
WONG C P, NGUYEN L P, NOH S K, et al. Induction of regulatory T cells by green tea polyphenol EGCG. Immunology Letters, 2011, 139(1/2): 7-13. |
| [47] |
MAHMOUD F, AL-OZAIRI E, HAINES D, et al. Effect of Diabetea teaTM consumption on inflammatory cytokines and metabolic biomarkers in type 2 diabetes patients. Journal of Ethnopharmacology, 2016, 194(24): 1069-1077. |
| [48] |
MAHMOUD F, HAINES D, AL-OZAIRI E, et al. Effect of black tea consumption on intracellular cytokines, regulatory T cells and metabolic biomarkers in type 2 diabetes patients. Phytotherapy Research, 2016, 30(3): 454-462. DOI:10.1002/ptr.v30.3 |
| [49] |
ZHANG Q, HU L Q, YIN C S, et al. Catechin ameliorates cardiac dysfunction in rats with chronic heart failure by regulating the balance between Th17 and Treg cells. Inflammation Research, 2014, 63(8): 619-628. DOI:10.1007/s00011-014-0734-4 |
| [50] |
JANG J Y, LEE J K, JEON Y K, et al. Exosome derived from epigallocatechin gallate treated breast cancer cells suppresses tumor growth by inhibiting tumor-associated macrophage infiltration and M2 polarization. BMC Cancer, 2013, 13(1): 421. DOI:10.1186/1471-2407-13-421 |
| [51] |
WANG J Z, MAN G C W, CHAN T H, et al. A prodrug of green tea polyphenol(-)-epigallocatechin-3-gallate (ProEGCG) serves as a novel angiogenesis inhibitor in endometrial cancer. Cancer Letters, 2018, 412: 10-20. DOI:10.1016/j.canlet.2017.09.054 |
| [52] |
郭勇. 中医肿瘤治疗方法学探讨. 浙江中医药大学学报, 2009, 33(5): 703-704, 708. GUO Y. Discussion on TCM tumor treatment. Journal of Zhejiang University of Traditional Chinese Medicine, 2009, 33(5): 703-704, 708. (in Chinese with English abstract) DOI:10.3969/j.issn.1005-5509.2009.05.030 |
| [53] |
LECUMBERRI E, DUPERTUIS Y M, MIRALBELL R, et al. Green tea polyphenol epigallocatechin-3-gallate (EGCG) as adjuvant in cancer therapy. Clinical Nutrition, 2013, 32(6): 894-903. DOI:10.1016/j.clnu.2013.03.008 |
| [54] |
陈淑珍, 甄永苏. 茶多酚的分子作用靶点及其在抗肿瘤药物实验治疗中的作用. 药学学报, 2013, 48(1): 1-7. CHEN S Z, ZHEN Y S. Molecular targets of tea polyphenols and its roles of anticancer drugs in experimental therapy. Acta Pharmaceutica Sinica, 2013, 48(1): 1-7. (in Chinese with English abstract) DOI:10.3969/j.issn.1008-7303.2013.01.01 |
| [55] |
KANG T H, LEE J H, SONG C K, et al. Epigallocatechin-3-gallate enhances CD8+ T cell-mediated antitumor immunity induced by DNA vaccination. Cancer Research, 2007, 67(2): 802-811. DOI:10.1158/0008-5472.CAN-06-2638 |
| [56] |
SUR S, PANDA C K. Molecular aspects of cancer chemopreventive and therapeutic efficacies of tea and tea polyphenols. Nutrition, 2017, 43/44: 8-15. DOI:10.1016/j.nut.2017.06.006 |
| [57] |
DANDAWATE P R, SUBRAMANIAM D, JENSEN R A, et al. Targeting cancer stem cells and signaling pathways by phytochemicals: Novel approach for breast cancer therapy. Seminars in Cancer Biology, 2016, 40/41: 192-208. DOI:10.1016/j.semcancer.2016.09.001 |
 2018, Vol. 44
2018, Vol. 44


