| 超积累植物内生微生物群落组成特征及其功能研究进展 |
重金属超积累植物是指能够超量吸收和积累重金属的植物,其体内的重金属含量要达到普通植物的100倍以上[1],其典型特征是重金属的运转系数和富集系数都大于1[1-2]。超积累植物对重金属的吸收和积累主要受到植物种类、土壤类型、污染程度和根际环境的影响[3]。定殖在超积累植物根际或根内的细菌或真菌在植物与土壤互作过程中发挥着非常重要的作用[4-5]。这些微生物能够耐受高浓度的重金属,影响土壤重金属的溶解性和生物有效性,影响宿主植物的生长和发育及其对重金属的吸收或耐受能力,最终影响植物对重金属超积累能力和植物提取修复效率[6-8]。尽管有些根际细菌和内生菌发挥着相似的功能,但大量研究表明,植物内生菌的有益作用要强于很多根际细菌[9],且该有益作用在生物或非生物胁迫条件下会被进一步放大[10]。本文从超积累植物内生微生物的群落组成特征及演替规律、对植物生长和重金属吸收积累的影响及其在农业生产中的应用等方面进行综述。
1 植物内生微生物组成特征及其演替规律内生微生物是指定殖在植物组织内部与宿主植物形成互惠共生关系,而不给宿主植物造成症状性感染或不利影响的一类微生物[11-12]。通常,内生微生物定殖在植物的质外体和共质体空间。与根际微生物群落一样,内生微生物群落也受到生物和非生物因子的调控[13-14],但是内生微生物比根际微生物能更好地保护植物免受生物和非生物胁迫[15]。生长在不同环境中的植物内生微生物的群落组成和功能特征各不相同[5]。
以普通植物内生微生物形成机制为例,研究发现:生长在2个不同地点的杨树(Populus deltoides)的内生细菌和真菌群落组成与根际微生物群落显著不同;利用16S rRNA焦磷酸测序发现,内生微生物群落丰度下降了1个数量级,且被变形菌门细菌所主导,而根际微生物群落被酸杆菌门所主导,但它在植物根内的丰度却很低[16]。这一研究结果表明,植物根内微生物群落并非由根际土壤微生物偶然入侵定殖形成。此外,对拟南芥根部细菌群落的研究发现,根内细菌群落与根际和不种植植物的土壤细菌群落的组成和多样性差别巨大[17-18]。值得注意的是,在上述研究中,尽管拟南芥种植在2个大陆的4种不同土壤中,其根内细菌群落的分类学图谱却显著地相似,主要是放线菌门、拟杆菌门和变形菌门。这些结果进一步证明,植物根内微生物群落并不是由根际微生物偶然入侵定殖形成的,并且由此推测,根际与内生微生物群落差异是由不同宿主植物所具有的不同调节机制造成的。
BULGARELLI等[5]结合大量的文献报道提出了植物根内微生物群落形成的“两步法”选择模型理论,它解释了根内微生物群落与根系周围土壤微生物群落之间逐渐出现差异的原因(图 1)。在该模型中,土壤多因子决定土壤微生物群落结构。在第一步选择过程中,根际沉积物为最初由底物驱动的根际微生物群落的演化提供了养分物质;随后,在第二步选择过程中,依赖宿主植物基因型的趋同选择性作用进一步影响根表和根内微生物群落组成。因此,在根际土壤中由底物驱动的微生物选择作用可能会一直延伸至植物组织内部。相比于植物体内环境,在根际区域微生物的选择规模随着植物种类和宿主植物基因型功能的不同而表现出巨大的差异。EDWARDS等[19]以水稻为研究材料,采用大规模Illumina高通量测序佐证了植物内生菌形成的“两步法”理论。在一系列可能造成根际和根内微生物群落组成差异的因子中,植物固有的免疫系统是促成根内微生物群落结构形成的重要因素。植物自身进化出了一套精密的免疫系统,它由2类可以识别宿主植物细胞内部和表面非自我分子的免疫受体组成[20]。非自我识别组分可以通过激活植物体内强大的免疫应激功能来终止病原微生物的增殖。植物根内微生物群落拥有特定的分类学结构,这与当前植物固有的免疫框架理论相吻合,即这类微生物可能像病原微生物一样拥有免疫反应拦截功能[21]。此外,内生微生物可能进化出了针对微生物的高效伪装机制(microbe-associated molecular patterns, MAMPs),巧妙地避开免疫受体识别。最后一种可能是,当内生微生物开始定殖时植物的固有免疫系统已经被激活,但是该免疫系统能将微生物的繁殖速率限制在一定程度内,使其远低于可以造成疾病症状的病原性细菌丰度。所以,未来有必要对这3种模型进行区分,即使这3种理论模型并不相互排斥。综上,目前对植物的根际、根内或叶部微生物群落组成、功能特征及其演替规律做了很多研究,并获得了大量的研究结果。但这些研究主要针对普通植物或作物,涉及环境特异性植物如重金属超积累植物内生微生物的形成或演替机制的研究仍未见报道。与普通植物不同的是,超积累植物的生长环境较为极端,大多数内生微生物对极端环境也有很强的耐性和适应能力。因此,超积累植物内生微生物群落形成过程势必会不同于普通植物,揭示其内生微生物群落的形成机制将有助于我们进一步揭示植物内生微生物的装配或演替规律。
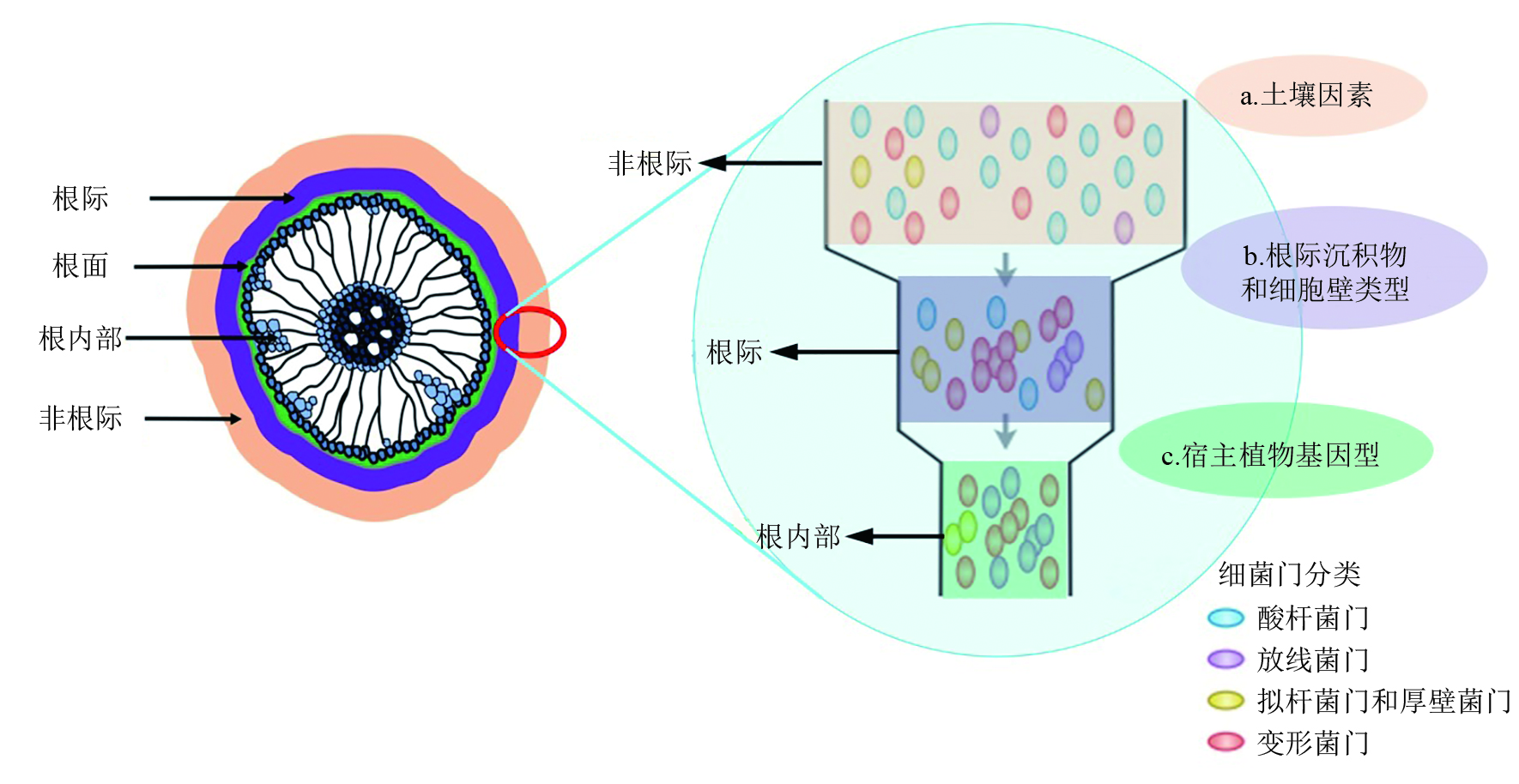 |
| 图1 植物根内微生物群落形成的“两步法”选择过程[5, 19] Fig. 1 A two-step selection model for root microbiota differentiation[5, 19] |
土壤重金属污染不仅影响植物的生长,同时还会改变与植物相关联的微生物群落数量、组成和活性[22]。大量研究表明,不同类型的重金属污染会影响宿主植物内生菌群落的多样性、生物量及活性[23]。细菌受到重金属胁迫后,对重金属更敏感的种群首先死亡,存活下来的细菌进行后续的竞争和适应,最终形成的土壤细菌群落对重金属的抗性会增强[24]。总体上,超积累植物体内的高浓度重金属为能够耐受高浓度重金属胁迫的内生微生物提供了一个特殊的生存环境[25],因此定殖在其中的微生物群落与普通植物中的内生微生物群落组成差异巨大。一方面,在超积累植物不同根际空间内的微生物群落组成和多样性存在明显的差异。如锌镉超积累植物东南景天(Sedum alfredii)根际和根内细菌群落组成差异明显,根际主要由变形菌门中的鞘脂单胞菌科组成,而根内主要由放线菌门中的链霉菌科所主导,且群落的α-多样性指数从根际到根内呈明显的下降趋势[26]。另一方面,超积累植物不同器官或组织因其积累的重金属含量的不同而导致定殖在不同组织内的细菌群落组成有差异。利用可培养方法对超积累植物Thlaspi goesingense的内生菌进行研究发现,其地上部和根部的内生菌群对重金属表现出了不同的耐受能力,说明在超积累植物不同组织内定殖着不同的微生物类群,且大部分内生菌主要由嗜中温甲基杆菌(Methylobacterium mesophilicum)(占近20%)和鞘氨醇单胞菌组成,这类细菌比定殖在根际内的细菌能够耐受更高浓度的镍(Ni)。此外,超积累植物的内生菌群落与其他种类植物(如非超积累植物或普通植物)的内生菌落相比也存在巨大差异。如生长在富硒土壤中的硒超积累植物Stanleya pinnata(十字花科)和Astragalus bisulcatus(豆科)与分别隶属于同一个科的非超积累植物Physaria bellii(十字花科)、紫花苜蓿Medicago sativa(豆科)相比,两者间内生菌群落差异明显,且超积累植物内生菌大都能够耐受高浓度的硒酸盐和亚硒酸盐,并能将它们还原成元素态硒,但是超积累与非超积累生态型之间的内生菌群落多样性差异却很小[27]。在超积累和非超积累生态型东南景天中,两者间的内生菌群落差异主要体现在拟杆菌门、厚壁菌门和浮霉菌门的丰度差异上,且超积累生态型根内细菌群落的α-多样性指数总体上低于非超积累生态型[26]。
目前,从不同的重金属超积累植物伯士隆庭荠(Alyssum bertolonii)、天蓝遏蓝菜(Noccaea caerulescens)、Thlaspi goesingense、普通烟草(Nicotiana tabacum)、沙漠王羽(Stanleya pinnata)和双槽紫云英(Astragalus bisulcatus)体内分离出了大量耐受重金属的内生菌[25, 27-29](表 1)。在大部分超积累植物体内,变形菌门的细菌丰度最高,并且鞘氨醇单胞菌属(α-变形菌纲)在多种超积累植物体内都能被分离得到[25, 29-36],说明该类细菌在超积累植物体内具备强大的生理代谢和适应能力,并且可能为植物适应非生物胁迫提供有益的帮助。微生物-超积累植物-土壤三者之间的相互作用促使植物体内形成了结构稳定的内生菌群落,其在门分类学水平上主要由变形菌门、放线菌门、拟杆菌门和绿弯菌门组成[25-26, 37],并且它们的组成特征随着植物种类、土壤类型和污染程度的不同表现出巨大的差异。例如,SCHLAEPPI等[37]将锌镉超积累拟南芥(Arabidopsis halleri)与其具有亲缘关系的4种拟南芥植物分别培养在2种不同的土壤中,结果发现,几种植物的根部内生细菌群落存在着定量差异,并且随着土壤类型的不同内生菌群落之间表现出显著的差异。此外,培养在3种不同类型土壤中的超积累生态型东南景天根内细菌群落组成存在显著差异(P<0.01),且细菌群落的多样性也随着土壤类型的不同而发生一定的变化[26]。另一方面,土壤污染物浓度的不同也会影响超积累植物根部微生物群落组成,如种植在不同污染程度的锌镉复合污染土壤中的Arabidopsis halleri,相比于高浓度污染土壤,轻度污染土壤对根近距离α-变形菌纲和黄杆菌门细菌具有负面影响,而对γ-变形菌纲细菌有正向影响[38],尽管该结果未涉及内生细菌的变化,但是根际细菌作为植物内生菌形成的来源,前者的变化势必会导致后者的改变。
| 表1 超积累植物内生菌群落组成、代谢特征及对植物生长和金属吸收累积的影响 Table 1 Composition and metabolic features of endophytic bacterial population from hyperaccumulators and its effects on plant growth and metal accumulation |
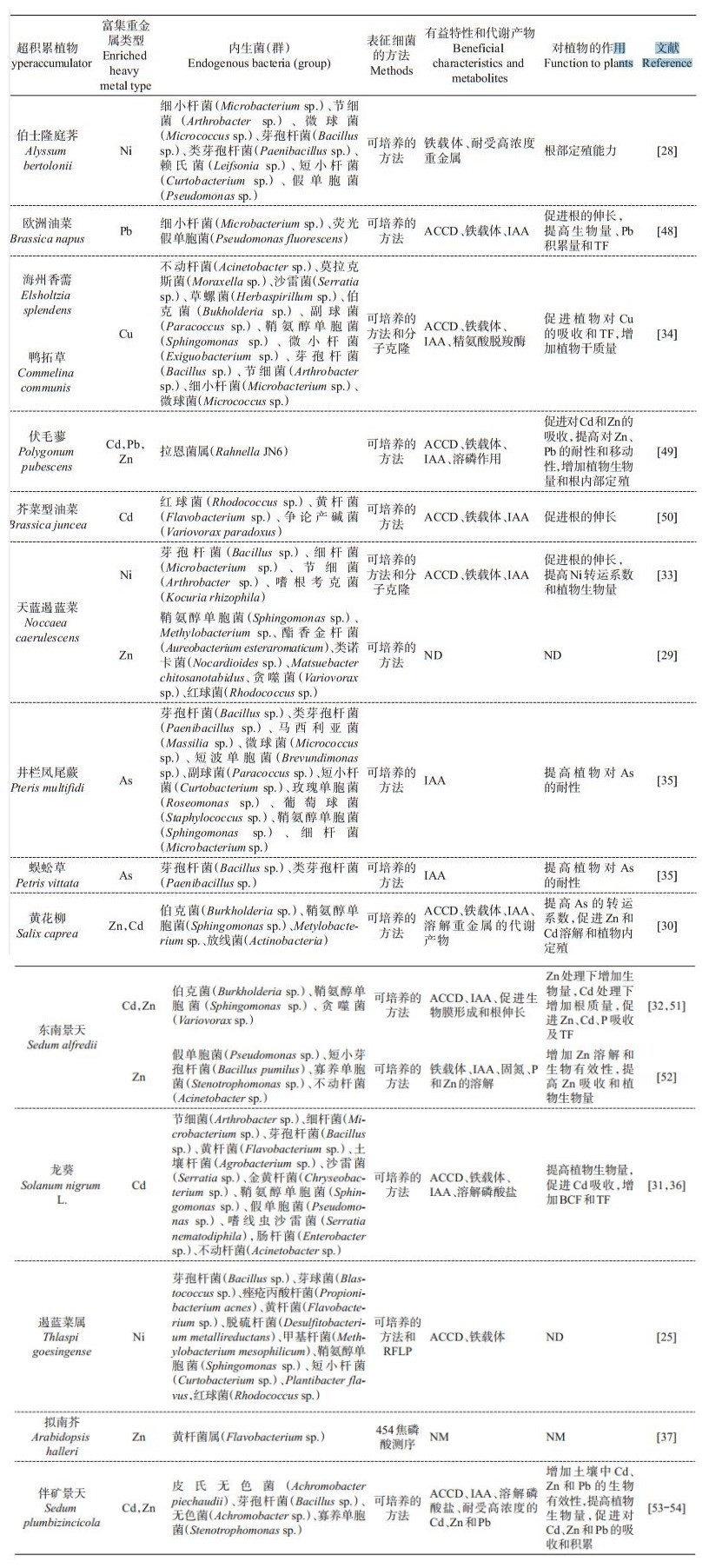 |
| 点击放大 |
综上所述,重金属超积累植物体内定殖着的大量微生物类群大都具备抵抗重金属胁迫的能力,近年来对超积累植物内生微生物群落的研究已有不少报道。但是由于植物种类、植物组织中重金属的浓度和宿主植物生长条件的不同所造成的巨大变异,以及这些研究中运用的表面灭菌技术、培养基质和分离微生物的方法也各不相同,因此很难对不同的研究进行比较。
3 超积累植物内生微生物对植物的促生作用机制当植物遭受重金属污染胁迫时,微生物可以改变植物细胞的代谢活动,协助植物耐受高浓度的重金属胁迫,从而更好地适应环境变化[36, 39-40]。在重金属污染土壤中,内生微生物对植物的促生作用有助于提高植物修复效率[41-44]。大量研究表明,植物促生细菌(如磷酸盐和钾盐溶解菌、游离固氮菌和根际细菌等)和真菌(如丛枝菌根真菌)能够显著地促进植物生长。当前研究认为,微生物对植物的促生作用主要通过分泌生长素[如吲哚-3-乙酸(indole-3-acetic acid, IAA)、细胞分裂素、赤霉素等]、ACC脱氨酶缓解乙烯胁迫、分泌铁载体、螯合物和H+溶解难溶性矿质养分来改善植物营养状况、固氮作用和增加宿主植物对生物胁迫抗性等机制促进植物生长(图 2)。
 |
| IAA:吲哚-3-乙酸;ACC:1-氨基-1-环丙烷羧酸盐;ACS:1-氨基-1-环丙烷羧酸盐合成酶;NH3:氨。 IAA: Indole-3-acetic acid; ACC: 1-amino-cyclopropanecarboxylic acid; ACS: ACC synthetase; NH3: Ammonia. 图2 植物内源促生菌促进植物生长和重金属的积累 Fig. 2 Plant endophytic microbes enhance plant growth and accumulation of heavy metal |
植物促生作用在植物提取或移除土壤重金属元素过程中有着十分重要的意义,植物生物量的简单增加会提高整株植物对重金属元素的积累量。通过接种具有促生作用的植物内生菌提高植物的生物量或产量,这在作物、木材植物和超积累植物中都有相关研究。如在土培试验中,在芥菜上接种一株能够耐受Cr6+胁迫并分泌IAA的内生假单胞菌(Pseudomonas sp.)PsA4后,显著地提高了植物的生物量[45]。从锌镉超积累植物东南景天体内分离的鞘氨醇单胞菌(Sphingomonas sp.)SaMR12能够分泌大量的IAA,显著促进植物的生长[32]。除了植物促生作用外,内生菌还能通过ACC脱氨酶活性降低胁迫条件下植物体内的乙烯水平,从而缓解植物受到的生物或非生物胁迫[46-47]。此外,微生物释放的生长素(如IAA)还能够进一步增强ACC脱氨酶活性,因为生长素能诱导植物体内ACC合酶的生物合成,从而能增加ACC的生物合成[55]。同样地,超积累植物内生菌还能够通过分泌铁载体、螯合物、H+等代谢物活化土壤中难溶态微量元素(如Fe、Cu、Zn),改善植物的营养状况[56]。一方面铁载体可以与Fe3+、Zn2+和Cu2+结合形成复合物,促进植物对该类微量元素的吸收,提高植物的养分状况[57-58]。另一方面,铁载体或其他螯合物与土壤重金属形成胞外络合物也可以提高植物对重金属的耐受能力,并以此促进植物的生长和对环境的适应[59]。另外,与植物共生的固氮菌,如慢生根瘤菌和中慢生根瘤菌通过固氮作用给植物供给氮素营养,促进植物的生长[60]。WANI等[61]发现,给生长在铬污染土壤中的鹰嘴豆接种能够固氮的中慢生根瘤菌(Mesorhizobium)RC3后显著地提高了植物的生物量和地上部氮含量。早期研究认为超积累植物不是菌根共生植物,直到近期的研究发现才推翻了这种论断。Berkheya coddii是第一种被发现的与丛枝菌根共生的Ni超积累植物[62]。形成菌根后的超积累植物Berkheya coddii生物量增加,最终地上部的Ni含量也相应增加[63]。在此之后,许多种超积累植物都发现与丛枝菌根真菌形成共生体,并且丛枝菌根的定殖可以促进植物生长及其对重金属的耐性。除上述微生物促生机制以外,有益性细菌还可以通过产生铁载体[64]、细胞壁裂解酶[65]和抗生素类代谢产物[66],保护植物免受细菌、真菌或病毒性病原微生物的危害。例如,一些耐受金属的植物促生菌释放的几丁质酶、β-1, 3葡聚糖酶、蛋白酶或脂肪酶,可以溶解真菌性病原菌,缓解植物遭受的病原菌危害[67]。需要指出的是,内生微生物具有多重促生作用,只是通过接种该类微生物难以直接证明其特定的促生特性。此外,内生微生物的促生效果还取决于植物种类、土壤性质、微量元素浓度及利用的微生物种类和菌株类型。因此,如何定量描述内生微生物的特定促生作用机制,还需要进一步研究。
4 超积累植物内生微生物对重金属活化和吸收的影响机制内生微生物不仅影响植物的生长,同时参与了超积累植物根际重金属的活化和吸收[68]。当前研究表明,内生微生物释放的代谢产物,如铁载体、生物表面活性剂、有机酸和植物生长因子等可以直接或间接地影响植物对重金属的吸收,即内生微生物通过影响植物的生长动态而间接地影响植物吸收和积累重金属,而在根际土壤中通过酸化、螯合、沉降、活化或氧化-还原反应直接地影响植物吸收和积累重金属[9, 41, 56-57, 69]。
超积累植物内生菌和菌根共生体可以直接或间接地影响植物根系形态发育,改变根系对重金属的吸收和接触面积,最终影响植物对重金属的吸收和积累。例如,从东南景天体内分离的内生菌Sphingomonas sp. SaMR12拥有强大的促生潜质(分泌IAA和ACC脱氨酶活性),接种该内生菌后,显著地增加了东南景天的根长、根表面积和根毛数,最终提高了植物对重金属的吸收和积累[32]。同样地,给砷超积累植物蜈蚣草接种土著丛枝菌根真菌后,植物干质量和砷(As)的吸收量都有所增加[70]。加拿大杨(Populus canadensis)与外生菌根真菌卷缘网褶菌共生后植物体内的镉积累显著增加[71]。
此外,植物内生菌通过分泌H+、有机酸、铁载体和其他螯合物促进难溶态重金属的溶解,增加重金属的生物有效性,并提高植物对重金属的吸收和转运能力。如植物内生固氮醋酸杆菌分泌的5-酮葡萄糖酸(5-ketogluconic acid)可以溶解土壤中的ZnO、ZnCO3或Zn3(PO4)2等不同来源的锌(Zn),从而提高Zn的有效性[72]。从镉超积累植物龙葵体内分离出来的内生菌Pseudomonas sp. Lk9能够分泌酒石酸、苹果酸、甲酸和柠檬酸等有机酸,接种该内生菌后,根际土壤中有效态重金属浓度增加,并且龙葵地上部的镉(Cd)积累量也显著提高[73]。除了有机酸,内生菌分泌的铁载体、重金属螯合物、生物表明活性剂和胞外大分子等物质也能够活化难溶态重金属,提高其生物有效性和移动性。例如,从龙葵体内分离出的4种内生菌Serratia nematodiphila LRE07、Enterobacter aerogenes LRE17、Enterobacter sp. LSE04和Acinetobacter sp. LSE06都能分泌铁载体,将其反接种到龙葵中后,明显地增加了龙葵中Cd的积累量[36]。SHIN等[74]从赤杨皮树体内分离到一株可以产生铁载体的芽孢杆菌(Bacillus sp.),给油菜接种该内生菌后,油菜体内的铅(Pb)含量显著增加。另外,微生物分泌的生物表面活性剂与重金属在土壤界面通过络合反应,将重金属从土壤基质中解吸出来,提高土壤溶液中重金属的溶解性和生物有效性,并增加植物对重金属的积累量。SHENG等[75]向种植西红柿的土壤中接种能产生生物表面活性剂的植物内生芽孢杆菌(Bacillus sp.)J119后,有效地增加了西红柿组织中Cd的积累量。此外,从镉超积累植物龙葵体内分离得到的假单胞菌(Pseudomonas sp.)Lk9能够产生表面活性剂,将其反接种到龙葵体内后,植物体内的Cd积累量明显增加[73]。
另外,一些与植物相关联的微生物还可以通过重金属氧化还原反应改变重金属的有效性,从而影响植物对重金属的吸收和积累[76-77]。例如,在重金属污染土壤中硫氧化细菌可以提高铜(Cu)的移动性而促进植物吸收Cu[78],其主要机制是硫氧化菌在氧化硫的过程中降低了土壤pH,进而提高了Cu的有效性。此外,从硒超积累植物体内分离到的66种内生菌,它们之中大多数可以将亚硒酸盐还原成元素态硒[27]。从上述研究可以看出,尽管微生物分泌的各种代谢产物能有效地提高植物对重金属的吸收积累,但是这些研究大都是以接种细菌菌株的方式间接地证明内生微生物能够促进重金属的活化及其在植物内的吸收积累,缺乏相应的直接证据;另外,这些研究都是在人工污染土壤中进行的,还没有在重金属污染的大田中有关生物表面活性剂促进植物吸收重金属的研究。
5 超积累植物内生微生物在农业生产中的应用 5.1 在强化植物修复中的应用超积累植物内生微生物能够耐受高浓度的重金属,促进植物的生长,提高植物生物量,增加植物对重金属元素的吸收积累。因此,内生微生物在重金属污染土壤的植物提取修复中具有重要的应用前景(表 2)。土培试验表明,接种东南景天非致病内生真菌尖孢镰刀菌(Fusarium oxysporum)后,东南景天根系和地上部生物量显著增加,矿山土和复合污染水稻土中重金属的生物有效性显著提高,东南景天对Zn、Cd和Pb提取效率显著提高[79]。CHEN等[36]从镉超积累植物龙葵体内分离出了大量的有益内生菌,在接种这些细菌后,龙葵的根、茎和叶中Cd、Zn和Pb的积累量显著增加。HE等[49]从锰超积累植物伏毛蓼中分离出1株拉恩菌(Rahnella sp. JN6),采用盆栽试验种植油菜(Brassica napus)并接种该内生菌后,发现其能够大量地定殖在油菜组织内部,显著提高油菜地上部和根部的Cd、Pb和Zn含量。卢文显[80]的研究表明,来自锰超积累植物商陆体内的抗锰(Mn)细菌能够促进商陆的生长,提高Mn的去除能力。张淼[81]的研究发现,来自铬富集植物李氏禾根部的内生菌微杆菌属(Microbacterium sp.)WHYN16能够显著提高李氏禾地上部铬(Cr)含量,提高Cr的提取修复能力。需要指出的是,目前有关超积累植物内生微生物在植物修复中的应用还停留在试验阶段,没有大规模、商品化内生菌剂的制备、生产和田间应用。
| 表2 重金属超积累植物内生微生物提高植物修复效率及其在生物强化中的作用 Table 2 Endophytic microbes derived from metal hyperaccumulators accelerating phytoremediation efficiency and their role in biofortification |
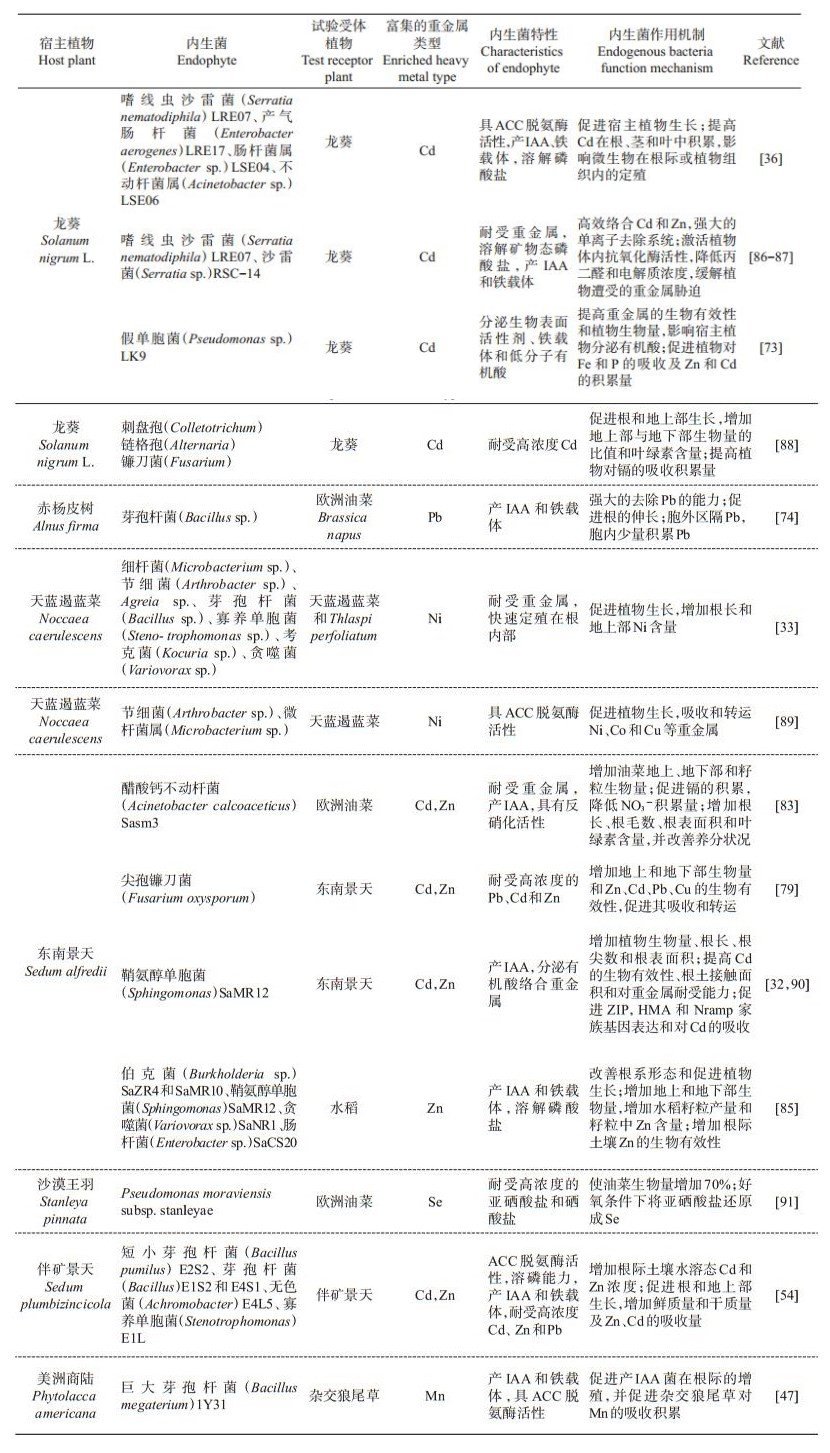 |
| 点击放大 |
在农业生产中利用超积累植物内生微生物强大的促生功能来提高作物的产量具有重要的意义。油菜盆栽试验表明,接种从东南景天体内筛选的内生菌Sphingomonas sp. SaMR12后,油菜的生物量显著增加[82]。在Cd和硝酸盐复合污染土壤中种植欧洲油菜,接种东南景天内生菌Acinetobacter calcoaceticus Sasm3后,油菜地上部生物量和籽粒产量均显著增加,且地上部Cd的积累量增加,而NO3-积累量减少[83]。徐涛英[84]的研究表明,来自锰超累积植物商陆的内生芽孢杆菌(Bacillus sp.)SLS18能够促进甜高粱(Sorghum bicolor L.)的生长,显著提高其生物量。WANG等[85]的研究发现,接种从东南景天体内筛选的内生菌(Sphingomonas sp. SaMR12、Enterobacter SaCS20)72 h后,绿色荧光蛋白(GFP)标记的内生菌能成功定殖在水稻根系内,并显著促进了水稻的生长,提高了籽粒产量。从上述研究可以看出,接种超积累植物内生菌能够提高其他农作物的生物量,这与内生微生物对植物的促生作用密不可分。然而,目前对超积累植物内生微生物在大田作物促生机制的研究还不够深入,大部分研究只是通过接种试验间接证明,缺少直接的试验证据。同时,关于超积累植物内生微生物对土壤肥力状况、养分转化的影响研究还少有报道,对大田作物产量构成因子、矿质养分吸收的影响研究还未见报道。
5.3 在微量元素生物强化中的应用微量元素(如Fe、Mn、Ni或Zn)是人体所必需的营养元素,主要通过植物进入人类食物链中。食用作物中矿质元素的缺乏及人体对其较低的生物利用性,导致人体微量营养元素缺乏。因此,生物强化是改善人体微量元素营养的重要手段,而农艺生物强化措施如接种有益内生菌来促进植物对微量元素的吸收积累,是实现微量元素生物强化的有效途径之一。WANG等[85]研究了东南景天的5种内生菌,Burkholderia SaZR4和SaMR10、Sphingomonas sp. SaMR12、Variovorax SaNR1和Enterobacter SaCS20对稻谷中Zn的生物强化作用,结果表明,在土培试验下接种SaMR12和SaCS20这2种内生菌可以增加水稻籽粒中Zn的积累量。此外,HE等[49]从锰超积累植物伏毛蓼体内分离出了一株能够分泌IAA、铁载体、具有ACC脱氨酶活性并且能够溶解无机态磷酸盐的内生菌Rahnella sp. JN6,采用盆栽试验种植油菜,接种该内生菌后显著地促进了油菜体内Zn的积累量。上述报道中,尽管接种重金属超积累植物内生菌促进了作物对微量元素的吸收积累,实现了微量元素的生物强化作用,但是这些研究都是在模拟条件下(土培或水培)获得的结果,而在大田试验中接种同种微生物是否能够获得和模拟条件下类似的效果,有待于后续的深入研究。
6 研究展望目前有关植物内生微生物的研究主要集中在内生微生物的筛选、生理活性物质的分析等方面,且主要以牧草、草坪草等普通植物为主,有关重金属超积累植物内生微生物的研究不多,尤其是超积累植物内生微生物的演替规律、与宿主植物的互作机制、内生微生物菌剂的制备及其在植物修复中的应用等方面还有待深入研究。
6.1 超积累植物内生微生物演替规律大量研究表明,植物内生微生物群落组成受到土壤类型、宿主植物种类、生育期等因素的影响[92-94]。然而,目前有关重金属超积累植物内生微生物组装特点及演替规律还不清楚,如超积累植物内生微生物群落的组装是否会随着土壤类型、宿主植物种类的不同而发生变化,同种超积累植物内生微生物在不同时间尺度(生育期、种植周期和年限)和不同空间尺度(根际空间,包括根内、根表、根际和非根际)上的演替规律如何,演替后的内生微生物群落是否会影响超积累植物的生长、重金属的吸收积累和解毒等,都值得我们进一步研究。此外,超积累植物内生微生物种群特征和功能基因表达随着植物种类、土壤类型和污染特征的不同而表现出的变异规律也值得深入研究。
6.2 超积累植物与内生微生物的互作机制内生微生物普遍存在于植物组织内,与宿主建立复杂的相互作用关系,并且存在不同的传播方式(垂直和水平传播)[95]。内生微生物与植物的互作关系及对宿主代谢的影响是近年来热点研究领域之一,而有关超积累植物与内生微生物的互作机制理论目前还是空白。一方面,内生微生物通过多种途径来影响超积累植物对重金属的吸收及生理功能,但这种生理功能的实现有赖于双方独特的调控机制,因此,超积累植物与内生微生物双方都进化形成特有的分子调控机制来维持这种互惠共生关系,而这种相互识别、相互适应的分子调控机制目前并不清楚。另一方面,内生微生物影响超积累植物的信号系统途径,内生微生物代谢产物对植物重金属吸收、积累和分布的影响,以及对植物重金属超积累基因表达的影响等,都值得进一步研究。
6.3 内生微生物对土壤功能和微生态环境的影响内生微生物不仅能改变与其共生植物的生理和生长指标,提高重金属污染土壤中的植物修复效率,还可通过宿主植物间接对土壤的理化性质和微生物群落结构产生影响[96-97]。在植物修复过程中根际土壤重金属的浓度逐渐降低,加上接种的内生微生物在根际土壤中的定殖,都会影响宿主植物根系分泌物的组成和含量,改变土壤中有机物的输入,影响土壤碳、氮含量及土壤微生物群落结构和功能,进而对土壤肥力状况、养分转化产生影响[40, 98]。因此,有必要研究植物修复前后与碳、氮和磷循环过程相关的微生物群落组成、功能基因表达及相关土壤酶活性的变化规律,揭示内生微生物介导的植物修复过程如何影响重金属污染土壤的养分转化和微生态环境。
6.4 内生微生物强化菌剂的制备及应用近年来,有关超积累植物内生微生物提高重金属污染土壤植物修复效率的报道不少,但绝大部分都是在实验室条件下获得的结果,缺乏大田试验数据。要将内生微生物应用于大规模污染农田植物修复,首先,要实现内生微生物菌剂的规模化生产,而构建合适的载体,提高微生物菌剂生物活性至关重要,同时需要优化内生微生物菌剂的生产工艺,扩大内生微生物菌剂的生产量;其次,改善内生微生物在田间土壤中的生存和定殖条件,如通过降低土壤中土著微生物活性或多样性来提高内生微生物的竞争力及清除可能抑制内生微生物代谢活性的不利因素等,确保接种到田间土壤中的微生物能成功扩增、繁殖并发挥作用;最后,需研究内生微生物菌剂大田施用技术,包括施用剂量、施用时期等。
| [1] |
MCGRATH S P, ZHAO F J. Phytoextraction of metals and metalloids from contaminated soils. Current Opinion in Biotechnology, 2003, 14(3): 277-282. DOI:10.1016/S0958-1669(03)00060-0 |
| [2] |
BECHER M, TALKE I N, KRALL L, et al. Cross-species microarray transcript profiling reveals high constitutive expression of metal homeostasis genes in shoots of the zinc hyperaccumulator Arabidopsis halleri. The Plant Journal, 2004, 37(2): 251-268. DOI:10.1046/j.1365-313X.2003.01959.x |
| [3] |
POLLARD A J, REEVES R D, BAKER A J M. Facultative hyperaccumulation of heavy metals and metalloids. Plant Science, 2014, 217: 8-17. |
| [4] |
MORADI A B, CONESA H M, ROBINSON B H, et al. Root responses to soil Ni heterogeneity in a hyperaccumulator and a non-accumulator species. Environmental Pollution, 2009, 157(8/9): 2189-2196. |
| [5] |
BULGARELLI D, SCHLAEPPI K, SPAEPEN S, et al. Structure and functions of the bacterial microbiota of plants. Annual Review of Plant Biology, 2013, 64(1): 807-838. DOI:10.1146/annurev-arplant-050312-120106 |
| [6] |
RODRIGUEZ R J, HENSON J, VAN VOLKENBURGH E, et al. Stress tolerance in plants via habitat-adapted symbiosis. The ISME Journal, 2008, 2(4): 404-416. DOI:10.1038/ismej.2007.106 |
| [7] |
VAN DER LELIE D, TAGHAVI S, MONCHY S, et al. Poplar and its bacterial endophytes: Coexistence and harmony. Critical Reviews in Plant Sciences, 2009, 28(5): 346-358. DOI:10.1080/07352680903241204 |
| [8] |
CONRATH U, BECKERS G J, FLORS V, et al. Priming: Getting ready for battle. Molecular Plant-Microbe Interactions, 2006, 19(10): 1062-1071. DOI:10.1094/MPMI-19-1062 |
| [9] |
RAJKUMAR M, SANDHYA S, PRASAD M N V, et al. Perspectives of plant-associated microbes in heavy metal phytoremediation. Biotechnology Advances, 2012, 30(6): 1562-1574. DOI:10.1016/j.biotechadv.2012.04.011 |
| [10] |
HARDOIM P R, VAN OVERBEEK L S, VAN ELSAS J D. Properties of bacterial endophytes and their proposed role in plant growth. Trends in Microbiology, 2008, 16(10): 463-471. DOI:10.1016/j.tim.2008.07.008 |
| [11] |
COMPANT S, DUFFY B, NOWAK J, et al. Use of plant growth-promoting bacteria for biocontrol of plant diseases: Principles, mechanisms of action, and future prospects. Applied and Environmental Microbiology, 2005, 71(9): 4951-4959. DOI:10.1128/AEM.71.9.4951-4959.2005 |
| [12] |
VAN OVERBEEK L, VAN ELSAS J D. Effects of plant genotype and growth stage on the structure of bacterial communities associated with potato (Solanum tuberosum L.). FEMS Microbiology Ecology, 2008, 64(2): 283-296. DOI:10.1111/fem.2008.64.issue-2 |
| [13] |
FUENTES-RAMIREZ L E, CABALLERO-MELLADO J, SEPULVEDA J, et al. Colonization of sugarcane by Acetobacter diazotrophicus is inhibited by high Nfertilization. FEMS Microbiology Ecology, 1999, 29(2): 117-128. DOI:10.1111/fem.1999.29.issue-2 |
| [14] |
SEGHERS D, WITTEBOLLE L, TOP E M, et al. Impact of agricultural practices on the Zea mays L. endophytic community. Applied and Environmental Microbiology, 2004, 70(3): 1475-1482. DOI:10.1128/AEM.70.3.1475-1482.2004 |
| [15] |
HALLMANN J, RODR GUEZ-KÁBANA R, KLOEPPER J W. Chitin-mediated changes in bacterial communities of the soil, rhizosphere and within roots of cotton in relation to nematode control. Soil Biology and Biochemistry, 1999, 31(4): 551-560. DOI:10.1016/S0038-0717(98)00146-1 |
| [16] |
GOTTEL N R, CASTRO H F, KERLEY M, et al. Distinct microbial communities within the endosphere and rhizosphere of Populus deltoides roots across contrasting soil types. Applied and Environmental Microbiology, 2011, 77(17): 5934-5944. DOI:10.1128/AEM.05255-11 |
| [17] |
BULGARELLI D, ROTT M, SCHLAEPPI K, et al. Revealing structure and assembly cues for Arabidopsis root-inhabiting bacterial microbiota. Nature, 2012, 488(7409): 91-95. DOI:10.1038/nature11336 |
| [18] |
LUNDBERG D S, LEBEIS S L, PAREDES S H, et al. Defining the core Arabidopsis thaliana root microbiome. Nature, 2012, 488(7409): 86-90. DOI:10.1038/nature11237 |
| [19] |
EDWARDS J, JOHNSON C, SANTOS-MEDELLÍN C, et al. Structure, variation, and assembly of the root-associated microbiomes of rice. Proceedings of the National Academy of Sciences of the USA, 2015, 112(8): E911-E920. DOI:10.1073/pnas.1414592112 |
| [20] |
JONES J D G, DANGL J L. The plant immune system. Nature, 2006, 444(7117): 323-329. DOI:10.1038/nature05286 |
| [21] |
BOLLER T, HE S Y. Innate immunity in plants: An arms race between pattern recognition receptors in plants and effectors in microbial pathogens. Science, 2009, 324(5928): 742-744. DOI:10.1126/science.1171647 |
| [22] |
GILLER K E, WITTER E, MCGRATH S P. Toxicity of heavy metals to microorganisms and microbial processes in agricultural soils: A review. Soil Biology and Biochemistry, 1998, 30(10): 1389-1414. |
| [23] |
KAMNEV A A, TUGAROVA A V, ANTONYUK L P, et al. Effects of heavy metals on plant-associated rhizobacteria: Comparison of endophytic and non-endophytic strains of Azospirillum brasilense. Journal of Trace Elements in Medicine and Biology, 2005, 19(1): 91-95. DOI:10.1016/j.jtemb.2005.03.002 |
| [24] |
DIAZRAVINA M, BAATH E. Development of metal tolerance in soil bacterial communities exposed to experimentally increased metal levels. Applied and Environmental Microbiology, 1996, 62(8): 2970-2977. |
| [25] |
IDRIS R, TRIFONOVA R, PUSCHENREITER M, et al. Bacterial communities associated with flowering plants of the Ni hyperaccumulator Thlaspi goesingense. Applied and Environmental Microbiology, 2004, 70(5): 2667-2677. DOI:10.1128/AEM.70.5.2667-2677.2004 |
| [26] |
LUO J P, TAO Q, WU K R, et al. Structural and functional variability in root-associated bacterial microbiomes of Cd/ Zn hyperaccumulator Sedum alfredii. Applied Microbiology and Biotechnology, 2017, 101(21): 7961-7976. DOI:10.1007/s00253-017-8469-0 |
| [27] |
SURA-DE JONG M, REYNOLDS R J B, RICHTEROVA K, et al. Selenium hyperaccumulators harbor a diverse endophytic bacterial community characterized by high selenium resistance and plant growth promoting properties. Frontiers in Plant Science, 2015, 6: 113. |
| [28] |
BARZANTI R, OZINO F, BAZZICALUPO M, et al. Isolation and characterization of endophytic bacteria from the nickel hyperaccumulator plant Alyssum bertolonii. Microbial Ecology, 2007, 53(2): 306-316. DOI:10.1007/s00248-006-9164-3 |
| [29] |
LODEWYCKX C, VANGRONSVELD J, PORTEOUS F, et al. Endophytic bacteria and their potential applications. Critical Reviews in Plant Sciences, 2002, 21(6): 583-606. DOI:10.1080/0735-260291044377 |
| [30] |
KUFFNER M, DE MARIA S, PUSCHENREITER M, et al. Culturable bacteria from Zn-and Cd-accumulating Salix caprea with differential effects on plant growth and heavy metal availability. Journal of Applied Microbiology, 2010, 108(4): 1471-1484. DOI:10.1111/jam.2010.108.issue-4 |
| [31] |
LUO S L, CHEN L, CHEN J L, et al. Analysis and characterization of cultivable heavy metal-resistant bacterial endophytes isolated from Cd-hyperaccumulator Solanum nigrum L. and their potential use for phytoremediation. Chemosphere, 2011, 85(7): 1130-1138. DOI:10.1016/j.chemosphere.2011.07.053 |
| [32] |
CHEN B, ZHANG Y B, RAFIQ M T, et al. Improvement of cadmium uptake and accumulation in Sedum alfredii by endophytic bacteria Sphingomonas SaMR12: Effects on plant growth and root exudates. Chemosphere, 2014, 117: 367-373. DOI:10.1016/j.chemosphere.2014.07.078 |
| [33] |
VISIOLI G, D EGIDIO S, VAMERALI T, et al. Culturable endophytic bacteria enhance Ni translocation in the hyperaccumulator Noccaea caerulescens. Chemosphere, 2014, 117: 538-544. DOI:10.1016/j.chemosphere.2014.09.014 |
| [34] |
SUN L N, ZHANG Y F, HE L Y, et al. Genetic diversity and characterization of heavy metal-resistant-endophytic bacteria from two copper-tolerant plant species on copper mine wasteland. Bioresource Technology, 2010, 101(2): 501-509. DOI:10.1016/j.biortech.2009.08.011 |
| [35] |
ZHU L J, GUAN D X, LUO J, et al. Characterization of arsenicresistant endophytic bacteria from hyperaccumulators Pteris vittata and Pteris multifida. Chemosphere, 2014, 113: 9-16. DOI:10.1016/j.chemosphere.2014.03.081 |
| [36] |
CHEN L, LUO S L, XIAO X, et al. Application of plant growthpromoting endophytes (PGPE) isolated from Solanum nigrum L. for phytoextraction of Cd-polluted soils. Applied Soil Ecology, 2010, 46(3): 383-389. DOI:10.1016/j.apsoil.2010.10.003 |
| [37] |
SCHLAEPPI K, DOMBROWSKI N, OTER R G, et al. Quantitative divergence of the bacterial root microbiota in Arabidopsis thaliana relatives. Proceedings of the National Academy of Sciences of the USA, 2014, 111(2): 585-592. DOI:10.1073/pnas.1321597111 |
| [38] |
GOMEZ-BALDERAS C D C, COCHET N, BERT V, et al. 16S rDNA analysis of bacterial communities associated with the hyper accumulator Arabidopsis halleri grown on a Zn and Cd polluted soil. European Journal of Soil Biology, 2014, 60: 16-23. DOI:10.1016/j.ejsobi.2013.10.006 |
| [39] |
GREMION F, CHATZINOTAS A, HARMS H. Comparative 16S rDNA and 16S rRNA sequence analysis indicates that Actinobacteria might be a dominant part of the metabolically active bacteria in heavy metal-contaminated bulk and rhizosphere soil. Environmental Microbiology, 2003, 5(10): 896-907. DOI:10.1046/j.1462-2920.2003.00484.x |
| [40] |
FREY B, PESARO M, RÜDT A, et al. Resilience of the rhizosphere Pseudomonas and ammonia-oxidizing bacterial populations during phytoextraction of heavy metal polluted soil with poplar. Environmental Microbiology, 2008, 10(6): 1433-1449. DOI:10.1111/emi.2008.10.issue-6 |
| [41] |
MA Y, PRASAD M N V, RAJKUMAR M, et al. Plant growth promoting rhizobacteria and endophytes accelerate phytoremediation of metalliferous soils. Biotechnology Advances, 2011, 29(2): 248-258. DOI:10.1016/j.biotechadv.2010.12.001 |
| [42] |
KUFFNER M, PUSCHENREITER M, WIESHAMMER G, et al. Rhizosphere bacteria affect growth and metal uptake of heavy metal accumulating willows. Plant and Soil, 2008, 304(1/2): 35-44. |
| [43] |
KIDD P, BARCELÓ J, BERNAL M P, et al. Trace element behaviour at the root-soil interface: Implications in phytoremediation. Environmental and Experimental Botany, 2009, 67(1): 243-259. DOI:10.1016/j.envexpbot.2009.06.013 |
| [44] |
MA Y, RAJKUMAR M, FREITAS H. Inoculation of plant growth promoting bacterium Achromobacter xylosoxidans strain Ax10 for the improvement of copper phytoextraction by Brassica juncea. Journal of Environmental Management, 2009, 90(2): 831-837. DOI:10.1016/j.jenvman.2008.01.014 |
| [45] |
RAJKUMAR M, NAGENDRAN R, LEE K J, et al. Influence of plant growth promoting bacteria and Cr6+ on the growth of Indian mustard. Chemosphere, 2006, 62(5): 741-748. DOI:10.1016/j.chemosphere.2005.04.117 |
| [46] |
GLICK B R. Teamwork in phytoremediation. Nature Biotechnology, 2004, 22(5): 526-527. DOI:10.1038/nbt0504-526 |
| [47] |
ZHANG W H, CHEN W, HE L Y, et al. Characterization of Mnresistant endophytic bacteria from Mn-hyperaccumulator Phytolacca americana and their impact on Mn accumulation of hybrid penisetum. Ecotoxicology and Environmental Safety, 2015, 120: 369-376. DOI:10.1016/j.ecoenv.2015.06.022 |
| [48] |
SHENG X F, XIA J J, JIANG C Y, et al. Characterization of heavy metal-resistant endophytic bacteria from rape (Brassica napus) roots and their potential in promoting the growth and lead accumulation of rape. Environmental Pollution, 2008, 156(3): 1164-1170. DOI:10.1016/j.envpol.2008.04.007 |
| [49] |
HE H D, YE Z H, YANG D J, et al. Characterization of endophytic Rahnella sp. JN6 from Polygonum pubescens and its potential in promoting growth and Cd, Pb, Zn uptake by Brassica napus. Chemosphere, 2013, 90(6): 1960-1965. DOI:10.1016/j.chemosphere.2012.10.057 |
| [50] |
BELIMOV A A, HONTZEAS N, SAFRONOVA V I, et al. Cadmium-tolerant plant growth-promoting bacteria associated with the roots of Indian mustard (Brassica juncea L. Czern.). Soil Biology and Biochemistry, 2005, 37(2): 241-250. DOI:10.1016/j.soilbio.2004.07.033 |
| [51] |
ZHANG X C, LIN L, ZHU Z Q, et al. Colonization and modulation of host growth and metal uptake by endophytic bacteria of Sedum alfredii. International Journal of Phytoremediation, 2013, 15(1): 51-64. DOI:10.1080/15226514.2012.670315 |
| [52] |
LONG X X, CHEN X M, CHEN Y G, et al. Isolation and characterization endophytic bacteria from hyperaccumulator Sedum alfredii Hance and their potential to promote phytoextraction of zinc polluted soil. World Journal of Microbiology and Biotechnology, 2011, 27(5): 1197-1207. DOI:10.1007/s11274-010-0568-3 |
| [53] |
M AY, ZHANG C, OLIVEIRA R S, et al. Bioaugmentation with endophytic bacterium E6S homologous to Achromobacter piechaudii enhances metal rhizoaccumulation in host Sedum plumbizincicola. Frontiers in Plant Science, 2016, 7: 75. |
| [54] |
MA Y, OLIVEIRA R S, NAI F, et al. The hyperaccumulator Sedum plumbizincicola harbors metal-resistant endophytic bacteria that improve its phytoextraction capacity in multimetal contaminated soil. Journal of Environmental Management, 2015, 156: 62-69. |
| [55] |
ARGUESO C T, HANSEN M, KIEBER J J. Regulation of ethylene biosynthesis. Journal of Plant Growth Regulation, 2007, 26(2): 92-105. DOI:10.1007/s00344-007-0013-5 |
| [56] |
SESSITSCH A, KUFFNER M, KIDD P, et al. The role of plant-associated bacteria in the mobilization and phytoextraction of trace elements in contaminated soils. Soil Biology and Biochemistry, 2013, 60: 182-194. DOI:10.1016/j.soilbio.2013.01.012 |
| [57] |
RAJKUMAR M, AE N, PRASAD M N V, et al. Potential of siderophore-producing bacteria for improving heavy metal phytoextraction. Trends in Biotechnology, 2010, 28(3): 142-149. DOI:10.1016/j.tibtech.2009.12.002 |
| [58] |
HIDER R C, KONG X. Chemistry and biology of siderophores. Natural Product Reports, 2010, 27(5): 637-657. DOI:10.1039/b906679a |
| [59] |
NIES D H. Microbial heavy-metal resistance. Applied Microbiology and Biotechnology, 1999, 51: 730-750. DOI:10.1007/s002530051457 |
| [60] |
WANI P A, KHAN M S, ZAIDI A. Effect of metal tolerant plant growth promoting Bradyrhizobium sp. (vigna) on growth, symbiosis, seed yield and metal uptake by greengram plants. Chemosphere, 2007, 70(1): 36-45. DOI:10.1016/j.chemosphere.2007.07.028 |
| [61] |
WANI P A, KHAN M S, ZAIDI A. Chromium-reducing and plant growth-promoting Mesorhizobium improves chickpea growth in chromium-amended soil. Biotechnology Letters, 2008, 30(1): 159-163. |
| [62] |
DIMKPA C O, MERTEN D, SVATOS A, et al. Siderophores mediate reduced and increased uptake of cadmium by Streptomyces tendae F4 and sunflower (Helianthus annuus), respectively. Journal of Applied Microbiology, 2009, 107(5): 1687-1696. DOI:10.1111/jam.2009.107.issue-5 |
| [63] |
ORŁOWSKA E, PRZYBYŁOWICZ W, ORLOWSKI D, et al. The effect of mycorrhiza on the growth and elemental composition of Ni-hyperaccumulating plant Berkheya coddii Roessler. Environmental Pollution, 2011, 159(12): 3730-3738. DOI:10.1016/j.envpol.2011.07.008 |
| [64] |
MIETHKE M, MARAHIEL M A. Siderophore-based iron acquisition and pathogen control. Microbiology and Molecular Biology Reviews, 2007, 71: 413-451. DOI:10.1128/MMBR.00012-07 |
| [65] |
BACKMAN P A, SIKORA R A. Endophytes: An emerging tool for biological control. Biological Control, 2008, 46(1): 1-3. |
| [66] |
SCHOUTEN A, VAN DEN BERG G, EDEL-HERMANN V, et al. Defense responses of Fusarium oxysporum to 2, 4-diacetylphloroglucinol, a broad-spectrum antibiotic produced by Pseudomonas fluorescens. Molecular Plant-Microbe Interactions, 2004, 17(11): 1201-1211. DOI:10.1094/MPMI.2004.17.11.1201 |
| [67] |
VAN LOON L C, REP M, PIETERSE C M J. Significance of inducible defense-related proteins in infected plants. Annual Review of Phytopathology, 2006, 44(1): 135-162. DOI:10.1146/annurev.phyto.44.070505.143425 |
| [68] |
WENZEL W W. Rhizosphere processes and management in plant-assisted bioremediation (phytoremediation) of soils. Plant and Soil, 2009, 321(1/2): 385-408. |
| [69] |
GADD G M. Microbial influence on metal mobility and application for bioremediation. Geoderma, 2004, 122(2/3/4): 109-119. |
| [70] |
AL AGELY A, SYLVIA D M, MA L Q. Mycorrhizae increase arsenic uptake by the hyperaccumulator Chinese brake fern (Pteris vittata L.). Journal of Environment Quality, 2005, 34(6): 2181. DOI:10.2134/jeq2004.0411 |
| [71] |
SELL J, KAYSER A, SCHULIN R, et al. Contribution of ectomycorrhizal fungi to cadmium uptake of poplars and willows from a heavily polluted soil. Plant and Soil, 2005, 277(1/2): 245-253. |
| [72] |
SARAVANAN V S, MADHAIYAN M, THANGARAJU M. Solubilization of zinc compounds by the diazotrophic, plant growth promoting bacterium Gluconacetobacter diazotrophicus. Chemosphere, 2007, 66(9): 1794-1798. DOI:10.1016/j.chemosphere.2006.07.067 |
| [73] |
CHEN L, LUO S L, LI X J, et al. Interaction of Cdhyperaccumulator Solanum nigrum L. and functional endophyte Pseudomonas sp. Lk9 on soil heavy metals uptake. Soil Biology and Biochemistry, 2014, 68: 300-308. DOI:10.1016/j.soilbio.2013.10.021 |
| [74] |
SHIN M, SHIM J, YOU Y, et al. Characterization of lead resistant endophytic Bacillus sp. MN3-4 and its potential for promoting lead accumulation in metal hyperaccumulator Alnus firma. Journal of Hazardous Materials, 2012, 199/200: 314-320. DOI:10.1016/j.jhazmat.2011.11.010 |
| [75] |
SHENG X F, HE L Y, WANG Q Y, et al. Effects of inoculation of biosurfactant-producing Bacillus sp. J119 on plant growth and cadmium uptake in a cadmium-amended soil. Journal of Hazardous Materials, 2008, 155(1/2): 17-22. |
| [76] |
CHEN S Y, LIN J G. Effect of substrate concentration on bioleaching of metal-contaminated sediment. Journal of Hazardous Materials, 2001, 82(1): 77-89. DOI:10.1016/S0304-3894(00)00357-5 |
| [77] |
BEOLCHINI F, DELL' ANNO A, DE PROPRIS L, et al. Auto-and heterotrophic acidophilic bacteria enhance the bioremediation efficiency of sediments contaminated by heavy metals. Chemosphere, 2009, 74(10): 1321-1326. DOI:10.1016/j.chemosphere.2008.11.057 |
| [78] |
SHI J Y, LIN H R, YUAN X F, et al. Enhancement of copper availability and microbial community changes in rice rhizospheres affected by sulfur. Molecules, 2011, 16(2): 1409-1417. DOI:10.3390/molecules16021409 |
| [79] |
ZHANG X C, LIN L, CHEN M Y, et al. A nonpathogenic Fusarium oxysporum strain enhances phytoextraction of heavy metals by the hyperaccumulator Sedum alfredii Hance. Journal of Hazardous Materials, 2012, 229/230: 361-370. DOI:10.1016/j.jhazmat.2012.06.013 |
| [80] |
卢文显.超富集植物商陆抗锰内生菌的筛选鉴定及其特性的研究.福州: 福建师范大学, 2015. LU W X. Identification and characterization of manganeseresistant endophytic bacteria from manganese hyperaccumulator Phytolacca acinosa. Fuzhou: Fujian Normal University, 2015. |
| [81] |
张淼.内生菌及根际菌对植物修复铬污染土壤促进作用的研究.哈尔滨: 哈尔滨工业大学, 2013. ZHANG M. Promotion on phytoremediation by endophyte and rhizosphere bacteria in chromium-contaminated soil. Harbin: Harbin Institute of Technology, 2013. |
| [82] |
PAN F S, MENG Q, LUO S, et al. Enhanced Cd extraction of oilseed rape (Brassica napus) by plant growth-promoting bacteria isolated from Cd hyperaccumulator Sedum alfredii Hance. International Journal of Phytoremediation, 2017, 19(3): 281-289. DOI:10.1080/15226514.2016.1225280 |
| [83] |
CHEN B, MA X X, LIU G Q, et al. An endophytic bacterium Acinetobacter calcoaceticus Sasm3-enhanced phytoremediation of nitrate-cadmium compound polluted soil by intercropping Sedum alfredii with oilseed rape. Environmental Science and Pollution Research, 2015, 22(22): 17625-17635. DOI:10.1007/s11356-015-4933-5 |
| [84] |
徐涛英.商陆内生菌促进甜高粱生长和重金属土壤修复的研究.长沙: 湖南大学, 2011. XU T Y. Study on promotion of sweet sorghum growth and remediation of heavy metal-polluted land by endophyte Phytolacca acinosa Roxb. Changsha: Hunan University, 2011. |
| [85] |
WANG Y Y, YANG X E, ZHANG X C, et al. Improved plant growth and Zn accumulation in grains of rice (Oryza sativa L.) by inoculation of endophytic microbes isolated from a Zn hyperaccumulator, Sedum alfredii H. Journal of Agricultural and Food Chemistry, 2014, 62(8): 1783-1791. DOI:10.1021/jf404152u |
| [86] |
LUO S L, WAN Y, XIAO X, et al. Isolation and characterization of endophytic bacterium LRE07 from cadmium hyperaccumulator Solanum nigrum L. and its potential for remediation. Applied Microbiology and Biotechnology, 2011, 89(5): 1637-1644. DOI:10.1007/s00253-010-2927-2 |
| [87] |
WAN Y, LUO S L, CHEN J L, et al. Effect of endophyteinfection on growth parameters and Cd-induced phytotoxicity of Cd-hyperaccumulator Solanum nigrum L. Chemosphere, 2012, 89(6): 743-750. DOI:10.1016/j.chemosphere.2012.07.005 |
| [88] |
KHAN A R, WAQAS M, ULLAH I, et al. Culturable endophytic fungal diversity in the cadmium hyperaccumulator Solanum nigrum L. and their role in enhancing phytoremediation. Environmental and Experimental Botany, 2017, 135: 126-135. DOI:10.1016/j.envexpbot.2016.03.005 |
| [89] |
VISIOLI G, VAMERALI T, MATTAROZZI M, et al. Combined endophytic inoculants enhance nickel phytoextraction from serpentine soil in the hyperaccumulator Noccaea caerulescens. Frontiers in Plant Science, 2015, 6: 638. |
| [90] |
PAN F S, LUO S, SHEN J, et al. The effects of endophytic bacterium SaMR12 on Sedum alfredii Hance metal ion uptake and the expression of three transporter family genes after cadmium exposure. Environmental Science and Pollution Research, 2017, 24(10): 9350-9360. DOI:10.1007/s11356-017-8565-9 |
| [91] |
STAICU L C, ACKERSON C J, CORNELIS P, et al. Pseudomonas moraviensis subsp. stanleyae, a bacterial endophyte of hyperaccumulator Stanleya pinnata, is capable of efficient selenite reduction to elemental selenium under aerobic conditions. Journal of Applied Microbiology, 2015, 119(2): 400-410. DOI:10.1111/jam.2015.119.issue-2 |
| [92] |
BERG G, SMALLA K. Plant species and soil type cooperatively shape the structure and function of microbial communities in the rhizosphere. FEMS Microbiology Ecology, 2009, 8(1): 1-13. |
| [93] |
LADYGINA N, HEDLUND K. Plant species influence microbial diversity and carbon allocation in the rhizosphere. Soil Biology and Biochemistry, 2010, 42(2): 162-168. DOI:10.1016/j.soilbio.2009.10.009 |
| [94] |
CHAPARRO J M, BADRI D V, VIVANCO J M. Rhizosphere microbiome assemblage is affected by plant development. The ISME Journal, 2014, 8(4): 790-803. DOI:10.1038/ismej.2013.196 |
| [95] |
HACQUARD S, GARRIDO-OTER R, GONZALEZ A, et al. Microbiota and host nutrition across plant and animal kingdoms. Cell Host & Microbe, 2015, 17(5): 603-616. |
| [96] |
BAIS H P, WEIR T L, PERRY L G, et al. The role of root exudates in rhizosphere interactions with plants and other organisms. Annual Review of Plant Biology, 2006, 57(1): 233-266. DOI:10.1146/annurev.arplant.57.032905.105159 |
| [97] |
HAICHAR F E Z, MAROL C, BERGE O, et al. Plant host habitat and root exudates shape soil bacterial community structure. The ISME Journal, 2008, 2(12): 1221-1230. DOI:10.1038/ismej.2008.80 |
| [98] |
PAWLOWSKA T E, CHANEY R L, CHIN M, et al. Effects of metal phytoextraction practices on the indigenous community of arbuscular mycorrhizal fungi at a metalcontaminated landfill. Applied and Environmental Microbiology, 2000, 66(6): 2526-2530. DOI:10.1128/AEM.66.6.2526-2530.2000 |
 2018, Vol. 44
2018, Vol. 44


