| 铝毒对不同耐铝性大麦品种初生根的影响差异 |
2. 兰州大学生命科学学院,兰州 730000
2. School of Life Sciences, Lanzhou University, Lanzhou 730000, China
由于植物营固着生活,在整个生命周期中,植物体不得不忍受和应对各种各样的环境胁迫,如高温、低温、干旱、水涝、高盐、酸、各类金属离子等,其中铝毒是酸性土壤中阻碍植物生长发育的主要影响因子。铝(Al)是地壳中含量最丰富的第3大元素[1-2],是许多土壤矿物的主要成分。在大多数条件下,土壤中的Al以固体形式存在,如Al(OH)3或黏土矿物[1],对植物细胞无毒性[3]。在酸性条件下(pH<5),土壤中Al的溶解度会大大增加,产生对植物细胞有毒害作用的离子态Al3+,其在微摩尔级浓度下就可抑制植物根的生长,造成植物生理和代谢功能紊乱[2-3]。目前,已知世界上30%~40%的可耕地土壤和大约70%的潜在耕地为酸性土壤(pH≤5.5)[4-6],且化肥的过度使用和酸雨进一步加剧了植物铝毒[2]。在这些酸性土壤中,铝毒是限制农作物生长发育和产量性状的主要影响因子[2, 5, 7],因此,深入开展植物铝毒及其耐铝机制研究具有现实指导意义。
当Al以有毒的形式被作物根系吸收后,会干扰根尖细胞分裂,导致初生根和次生根的生长均被抑制[8]。不同物种、不同基因型之间的耐铝性存在很大差异[9]。目前,有关植物耐铝机制研究的报道较多[1-3, 5, 9],普遍认为植物耐铝性主要通过外部排斥和内部耐受2种机制来实现,但不同物种的耐铝机制也不完全相同[3, 5]。大麦(Hordeum vulgare L.)是铝毒敏感作物[10-14],研究大麦铝毒和耐铝机制对培育耐铝作物品种、提高作物产量与品质均具有重要的参考价值。本文以2个耐铝性差异显著的大麦品种为材料,分析铝毒对其初生根活性、膜脂质过氧化、三磷酸腺苷(adenosine triphosphate, ATP)酶活性和抗氧化酶活性等的影响差异,以期为进一步剖析大麦铝毒和耐铝机制提供新的观点。
1 材料与方法 1.1 材料选用耐铝性不同的2个大麦品种——沪麦8号(Humai 8)和嵊县无芒六棱(Shengxian awnless sixrowed barley, Shengxian 6)进行试验。其中沪麦8号为耐铝品种,嵊县无芒六棱为铝敏感品种,两者的耐铝性差异显著[10-12]。
1.2 幼苗培养及处理大麦种子经自来水浸泡6 h后,用70%乙醇表面消毒2 min,并以无菌ddH2O冲洗3~4次,用体积分数为1.2%的NaClO灭菌30 min,再用无菌ddH2O清洗3~4次。将这些种子置于放有脱脂棉和滤纸并加适量无菌水的培养皿中,于生物培养箱内发芽2~3 d,无光照,温度为(25±1)℃。在150 mL烧杯中放一张塑料网,选取已萌发的、根长1~1.5 cm的种子约40颗,在含50 mmol/L CaCl2的100 mL培养液(pH 4.5)中黑暗培养24 h,温度(25±1)℃。然后进行分组处理培养,设4个不同的Al3+处理浓度(0、50、100和150 µmol/L AlCl3),并分别添加50 mmol/L CaCl2(pH 4.5)。培养条件为28 ℃光照14 h/24 ℃黑暗10 h,光强250 μmol/(m2·s)。处理不同时间后,取根尖(长1 cm)和幼苗进行相关指标的测定[13, 15]。
1.3 初生根活跃吸收面积和质膜透性测定活跃吸收面积的测定采用甲烯蓝法[16-17],在Al3+处理0.5~4 h内取样;质膜透性采用电导率法[16],每次选取处理24 h后的12个根尖,加10 mL ddH2O,以相对外渗率表示质膜透性,同时求出伤害率。
1.4 游离脯氨酸的测定脯氨酸提取和测定参考ÜNYAYAR等[18]和BATES等[19]的方法,并稍加改进。取经Al3+处理4 d的0.1 g幼苗,置于20 mL大试管中,加5 mL 3%磺基水杨酸溶液,于沸水浴中浸提15 min(经常摇动),冷却后过滤至干净的试管中,离心,得到脯氨酸提取液。将2 mL脯氨酸提取液倒入带玻璃塞试管中,加入2 mL乙酸及2 mL酸性茚三酮试剂,沸水浴60 min,溶液即呈红色。冷却后加入4 mL甲苯,摇荡30 s,静置片刻,取上层液至10 mL离心管中,3 000 r/min离心5 min后,用吸管轻轻吸取上层脯氨酸红色甲苯溶液于比色杯中,在520 nm波长处测定吸光度值。根据标准曲线回归方程计算出样品测定液中脯氨酸的浓度,µmol/g,以鲜质量计。
1.5 酶活性和丙二醛含量测定酶液的提取参照GIANNOPOLITI等[20]和CUI等[21]的方法,并稍加改进。取经Al3+处理24 h的根尖,称量后加入液氮并研磨成粉末,按m:V=1:10加入预冷的提取介质[50 mmol/L磷酸缓冲液,0.1 mmol/L EDTANa2,1%聚乙烯吡咯烷酮],不同pH的酶液提取缓冲液,其中超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)的pH值为7.8,过氧化物酶(peroxidase, POD)的pH值为6.2。研磨成匀浆后,4 ℃、1.3×104 g离心15 min,取上清液用于酶活性和蛋白质含量的测定。SOD活性测定采用邻苯三酚自氧化法[22-23];CAT活性通过测定在240 nm波长下H2O2分解量来确定[24-25];POD活性测定采用愈创木酚比色法[26]。根尖组织中丙二醛(malondialdehyde, MDA)的测定采用硫代巴比妥酸法[27]。
取经Al3+处理24 h的根尖制备质膜微囊,其中质膜微囊制剂的制备及纯度估计、Ca2+-ATP酶和Mg2+- ATP酶活性测定参考张芬琴等[28]的方法。反应终止后,参考OHNISHI等[29]的方法测定无机磷含量,采用考马斯亮蓝G-250染色法[30]测定蛋白质含量。
所得数据采用SPSS 11.5软件进行统计分析。
2 结果与分析 2.1 铝毒对大麦初生根活跃吸收面积、质膜相对透性和游离脯氨酸含量的影响植物通过根系吸收水和营养成分,根系的活力直接影响植物的生命活动、生长和作物产量,而根活跃吸收面积是反映根系活力的生理指标之一。经不同Al3+浓度(0、50、100和150 μmol/L AlCl3)处理不同时间(0.5、1、2和4 h)后,2个大麦品种的初生根活跃吸收面积结果见图 1。从中可以看出:不同Al3+浓度处理0.5 h对2个大麦品种初生根活跃吸收面积的抑制作用比较小,且对耐铝品种沪麦8号有一定的刺激作用(图 1A);随着处理时间的延长,抑制作用逐渐显现,尤其是敏感品种嵊县无芒六棱,其初生根活跃吸收面积减小更显著(图 1B)。AlCl(3<100 μmol/L)处理1 h对沪麦8号仍有一定的刺激作用(图 1A),但处理2 h和4 h后,铝毒对嵊县无芒六棱的初生根活跃吸收面积(82.3% ~ 74.6%)的抑制作用明显比沪麦8号(97.1% ~ 93.5%)强。上述结果暗示耐铝品种沪麦8号根尖细胞对铝毒具有更强的抗性,这与铝毒对初生根伸长的抑制作用相一致。
 |
| A:沪麦8号;B:嵊县无芒六棱。数据以“平均值±标准差”表示;*和**分别表示与对照相比在P<0.05和P<0.01水平差异有统计学意义。 A: Humai 8; B: Shengxian 6. Values are showed as"means± standard deviation"; single asterisk (*) and double asterisks (**) indicate statistically significant difference at the 0.05 and 0.01 probability levels, respectively. 图1 不同AlCl3浓度处理对大麦初生根活跃吸收面积的影响 Fig. 1 Effects of different AlCl3 concentrations on active absorbing area in primary roots of barley |
为进一步揭示沪麦8号和嵊县无芒六棱之间的铝毒耐性差异,本研究还测定了不同Al3+浓度处理对初生根细胞质膜相对透性和膜伤害率的影响。结果(图 2)表明:与各自的空白对照相比,铝毒均明显诱导了2个大麦品种的质膜透性,但嵊县无芒六棱质膜透性的增加程度明显高于沪麦8号,并在50 μmol/L AlCl3处理时达显著水平;同样,铝毒诱导嵊县无芒六棱膜伤害率也明显高于沪麦8号。这些结果表明,铝毒通过影响质膜透性从而破坏根尖细胞结构的完整性,而耐铝品种沪麦8号根尖细胞质膜对铝毒具有相对较好的耐受性。
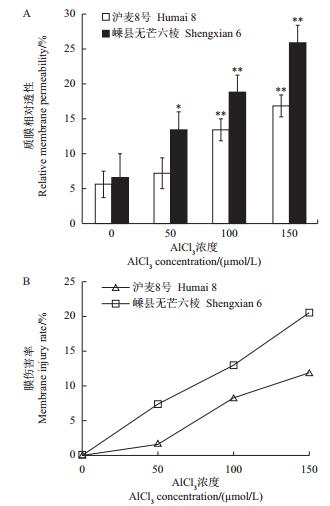 |
| 数据以“平均值±标准差”表示;*和**分别表示与对照相比在P<0.05和P<0.01水平差异有统计学意义。 Values are showed as"means ± standard deviation"; single asterisk (*) and double asterisks (**) indicate statistically significant difference at the 0.05 and 0.01 probability levels, respectively. 图2 不同AlCl3浓度处理对大麦初生根质膜相对透性和膜伤害率的影响 Fig. 2 Effects of different AlCl3 concentrations on relative membrane permeability and membrane injury rate in primary barley roots |
游离脯氨酸含量是间接反映植物逆境胁迫响应的重要生理指标。本研究结果(图 3)表明,铝毒均明显诱导了2个大麦品种根和叶中游离脯氨酸的积累,但铝毒敏感品种嵊县无芒六棱的游离脯氨酸含量比沪麦8号增加更为显著。
 |
| 数据以“平均值±标准差”表示;**表示与对照相比在P<0.01水平差异有统计学意义。 Values are showed as"means ± standard deviation"; double asterisks (**) indicate statistically significant difference at the 0.01 probability level. 图3 铝毒对沪麦8号和嵊县无芒6棱幼苗游离脯氨酸含量的影响 Fig. 3 Effects of Al toxicity on free proline concentration in the seedlings of Humai 8 and Shengxian 6 barleys |
逆境胁迫能诱导植物细胞产生活性氧(reactive oxygen species, ROS),而ROS对细胞膜系统、脂类、蛋白质和核酸等大分子具有很大的破坏作用。为消除ROS对细胞的损伤,植物细胞通过非酶系统(如酚类物质)和氧化还原酶系统2套机制以除去多余活性氧。其中,SOD、POD和CAT是氧化还原酶系统的重要组成部分。ROS诱导脂质过氧化使细胞膜的流动性和通透性发生改变,MDA是最典型的脂质过氧化终产物,能够间接反映脂质过氧化程度或膜损伤程度。本研究结果(图 4)表明,与空白对照相比,Al3+胁迫诱导2个大麦品种中SOD和POD酶活性增加,而CAT酶活性在2个品种中出现差异,表现为嵊县无芒六棱先增强和降低。在100和150 µmol/L AlCl3处理中,沪麦8号的SOD酶活性比嵊县无芒六棱高(图 4A);在50 µmol/LAlCl3处理中,嵊县无芒六棱的CAT酶活性比沪麦8号略高,但在100和150 µmol/LAlCl3处理中,沪麦8号的CAT酶活性远比嵊县无芒六棱高(图 4B);相反,在100和150 µmol/L AlCl3处理中,嵊县无芒六棱POD酶活性始终比沪麦8号高(图 4C)。这一结果表明,铝毒胁迫能够诱导大麦根细胞的氧化还原酶系统发挥作用,且耐铝品种沪麦8号的SOD和CAT酶活性比铝敏感品种嵊县无芒六棱高,而POD酶活性则相反。对MDA含量测定结果(图 5)表明:Al3+处理均促进了2个大麦品种初生根中MDA的积累,且MDA含量与Al3+浓度呈正相关;其中,嵊县无芒六棱根的MDA含量明显比沪麦8号高。这一结果暗示铝毒胁迫使铝敏感品种嵊县无芒六棱的脂质过氧化程度或膜损伤程度比耐铝品种沪麦8号更高。
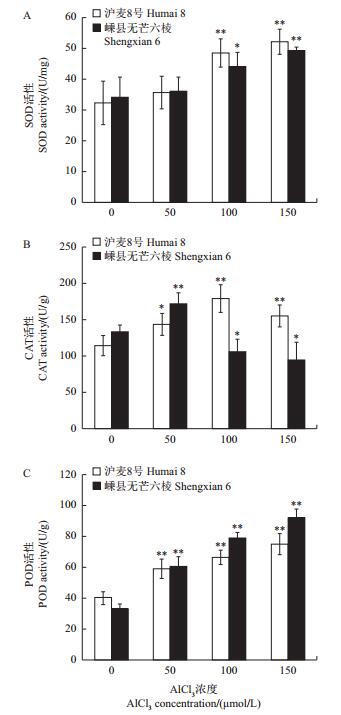 |
| 数据以“平均值±标准差”表示;*和**分别表示与对照相比在P<0.05和P<0.01水平差异有统计学意义。 Values are showed as"means ± standard deviation"; single asterisk (*) and double asterisks (**) indicate statistically significant difference at the 0.05 and 0.01 probability levels, respectively. 图4 铝毒对大麦初生根超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性的影响 Fig. 4 Effects of Al toxicity on superoxide dismutase (SOD), peroxidase (POD) and catalase (CAT) in primary roots of barley |
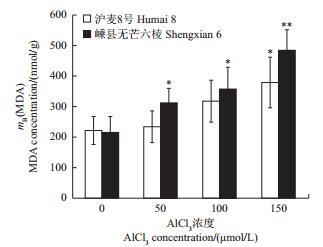 |
| 数据以“平均值±标准差”表示;*和**分别表示与对照相比在P<0.05和P<0.01水平差异有统计学意义。 Values are showed as"means ± standard deviation"; single asterisk (*) and double asterisks (**) indicate statistically significant difference at the 0.05 and 0.01 probability levels, respectively. 图5 铝毒对大麦初生根丙二醛含量的影响 Fig. 5 Effects of Al toxicity on malonaldehyde (MDA) concentration in primary roots of barley |
已有研究表明,植物细胞质膜和液泡膜ATP酶活性对低温、盐及铝毒胁迫敏感[28, 31-34]。为探索质膜Ca2+-ATP酶和Mg2+-ATP酶是否在植物耐铝机制中起作用,本研究分析了铝毒对2个大麦品种初生根Ca2+-ATP酶和Mg2+-ATP酶活性的影响。结果(图 6)表明:与空白对照相比,铝毒均明显抑制了2个大麦品种初生根的Ca2+-ATP酶和Mg2+-ATP酶活性;但铝毒对嵊县无芒六棱中这2种酶活性的抑制作用明显高于沪麦8号,其中50 µmol/L AlCl3处理极显著或显著地抑制了嵊县无芒六棱的Ca2+-ATP酶和Mg2+-ATP酶活性,但对沪麦8号无显著影响;而当AlCl3处理浓度达100 µmol/L时,沪麦8号的Ca2+- ATP酶活性产生显著变化,对Mg2+-ATP酶活性的抑制作用则到150 µmol/L AlCl3处理时才达显著。这一结果暗示,耐铝品种沪麦8号的Ca2+-ATP酶和Mg2+-ATP酶活性比铝敏感品种嵊县无芒六棱对铝毒有更强的耐性。
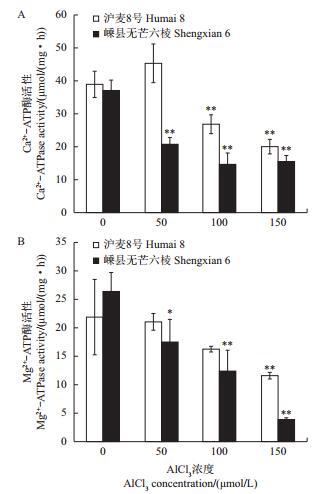 |
| 数据以“平均值±标准差”表示;*和**分别表示与对照相比在P<0.05和P<0.01水平差异有统计学意义。 Values are showed as"means ± standard deviation"; single asterisk (*) and double asterisks (**) indicate statistically significant difference at the 0.05 and 0.01 probability levels, respectively. 图6 铝毒对大麦初生根质膜Ca2+-ATP酶和Mg2+-ATP酶活性的影响 Fig. 6 Effects of Al toxicity on the activities of Ca2+-ATPase and Mg2+-ATPase in plasma membrane of primary roots of barley |
Al3+对植物根的毒性特别明显,能够迅速抑制根的生长,而且只有正在进行细胞分裂和延伸的细胞会受到Al3+的影响,如根的伸长[1];因此,在Al3+对植物的毒性研究中,初生根成为很好的材料。本研究选择2个耐铝性存在显著差异的大麦品种,耐铝的沪麦8号和铝敏感的嵊县无芒六棱,以初生根为材料,经50、100和150 µmol/L AlCl3处理后,测定了初生根活跃吸收面积、质膜相对透性和游离脯氨酸含量,以及3种氧化酶活性和MDA含量,同时,还测定了初生根质膜Ca2+-ATP酶和Mg2+-ATP酶活性,通过多维评价来研究Al3+对大麦的毒害机制。
Al3+会损害正常的细胞生长和新陈代谢,可溶性Al3+在进入细胞质并在胞内起作用前,必须先与细胞壁和质膜外表面相互作用[1],并损伤细胞壁和质膜的正常结构[15]。本研究证明,经Al3+胁迫后,初生根活跃吸收面积减小,质膜相对透性和对膜的伤害率显著增加,这与我们之前的结果一致[15]。细胞膜是细胞的屏障,具有选择通透性,Al3+对质膜的损伤必然会影响正常膜的选择通透性,影响细胞的正常功能,表现出根活跃吸收面积减少,根的生长受抑制。从本研究的结果看,Al3+对耐铝品种沪麦8号质膜的损伤较小,而对铝敏感品种嵊县无芒六棱损伤更加显著,这也是造成两者耐性差异的直接原因之一。
游离脯氨酸的积累是许多植物对渗透胁迫的本能反应[35],在植物胁迫耐受中发挥重要作用[36]。有研究表明,水稻耐盐品种的游离脯氨酸积累低于盐敏感品种[37],故而有研究者认为游离脯氨酸量的高低可以作为鉴定植物抗性的生理指标。在不同AlCl3浓度胁迫下,本研究的铝敏感品种嵊县无芒六棱较耐铝品种沪麦8号均积累了更多的游离脯氨酸,可见游离脯氨酸的累积量也是评价耐铝性的重要生理指标。
Al3+诱导的氧化应激会导致ROS的产生,如超氧自由基(superoxide radicals, O2·-)、羟基自由基(hydroxyl radicals, ·OH)和过氧化氢(hydrogen peroxide, H2O2),它们可能会影响生物大分子如细胞膜中的不饱和脂肪酸,引起膜脂过氧化,进而导致严重的细胞损伤[5, 14]。诱导过氧化胁迫是铝毒的主要表现形式之一,而MDA是反映脂质过氧化的主要产物,其浓度高低反映膜损伤和受胁迫程度的强弱。本研究结果显示,在不同浓度Al3+胁迫下,2个大麦品种的MDA含量均显著增加,但敏感品种嵊县无芒六棱更为显著,并且在较低的Al3+浓度(50 µmol/L)处理后即显著增加,说明铝敏感品种嵊县无芒六棱细胞更易产生氧化应激。同时,植物细胞也有一套清除ROS的酶系统,如SOD、POD、CAT等抗氧化酶,以及非酶抗氧化剂[9]。本研究结果显示,SOD和POD活性在Al3+胁迫下显著提高,而CAT活性则在铝敏感品种嵊县无芒六棱中呈现先增后降的变化趋势,说明植物细胞受Al3+胁迫后,体内各种抗氧化酶基因表达存在明显差异,其中耐性品种沪麦8号的SOD、CAT活性较铝敏感品种嵊县无芒六棱强,而铝敏感品种嵊县无芒六棱的POD活性更强,这与MDA累积一致。
ATP酶是膜上主动转运的酶蛋白,能调节胞内相关离子浓度。Ca2+是一种调节多种细胞功能的胞内第二信使,其作用的中心环节是细胞内Ca2+水平的变化[38],但ATP酶活性高度依赖于Mg2+的存在,而非Ca2+[39],因而,我们选择研究Al3+胁迫对Ca2+- ATP酶和Mg2+-ATP酶活性的影响以揭示Al3+对膜酶的作用。有研究显示,大麦根经1 mmol/L AlCl3处理5 d后,其ATP酶活性降至55.3%[31]。张芬琴等[28]用小麦幼苗根尖制备质膜、液泡膜微囊制剂,加入1 mmol/L Al3+到制剂中,质膜和液泡膜微囊Ca2+- ATP酶和Mg2+-ATP酶活性均明显下降。在本研究中,嵊县无芒六棱初生根的Ca2+-ATP酶和Mg2+- ATP酶在50 µmol/L AlCl3胁迫24 h后就开始显著下降,而该浓度对沪麦8号则无明显抑制作用。有研究认为,质膜Ca2+-ATP酶活性降低可减少胞质Ca2+跨质膜外运,缓解由于Al3+阻塞质膜Ca2+通道造成的胞内Ca2+浓度降低,说明Ca2+-ATP酶活性降低对植物细胞而言也是一种保护机制[40];因此,Ca2+-ATP酶和Mg2+-ATP酶活性可能与耐铝性有关。
Al3+能够破坏膜的结构,诱导ROS引起脂质过氧化,从而损坏膜结构的完整性,增加膜的透性;ROS也能激活Ca2+涌入细胞,导致细胞内Ca2+浓度增加[41],同时对质膜或液泡膜的Mg2+-ATP酶活性亦有明显抑制[33];膜ATP酶活性受脂质结构的调节,尤其是酶蛋白周围的磷脂,而磷脂结构受多种环境因素(如阳离子)的影响[31]。以上问题的核心是Al3+诱导膜产生ROS,因而在铝毒影响下,减少膜ROS产生和降低脂质过氧化是植物耐铝性的内在关键之一。
综上所述,铝毒能诱导2个大麦品种初生根活跃吸收面积的减小,膜渗透率提高,游离脯氨酸的积累增加,诱导产生ROS从而引起质膜过氧化,导致MDA含量增加,Ca2+-ATP酶和Mg2+-ATP酶活性下降,但抗氧化酶(SOD、CAT和POD)活性提高。造成的这种效应与Al3+诱导膜脂质过氧化有直接的关联。虽然植物细胞有抗氧化酶保护系统,但因大麦基因型的差异导致了耐铝性的差异。本研究为进一步剖析大麦铝毒和耐铝机制提供了新的观点。
| [1] |
JONES D L, RYAN P R. Aluminum toxicity. Encyclopedia of Applied Plant Sciences, 2003: 656-664. |
| [2] |
SINGH S, TRIPATHI D K, SINGH S, et al. Toxicity of aluminium on various levels of plant cells and organism: A review. Environmental and Experimental Botany, 2017, 137: 177-193. DOI:10.1016/j.envexpbot.2017.01.005 |
| [3] |
王生银, 袁世力, 谢建平, 等. 植物耐铝分子机制研究进展. 植物生理学报, 2016, 52(12): 1804-1810. WANG S Y, YUAN S L, XIE J P, et al. Progress on molecular mechanisms of aluminum tolerance in plants. Plant Physiology Journal, 2016, 52(12): 1804-1810. (in Chinese with English abstract) |
| [4] |
CHEN Z C, ZHAO X Q, SHEN R F. The alleviating effect of ammonium on aluminum toxicity in Lespedeza bicolor results in decreased aluminum-induced malate secretion from roots compared with nitrate. Plant and Soil, 2010, 337: 389-398. DOI:10.1007/s11104-010-0535-7 |
| [5] |
INOSTROZA-BLANCHETEAU C, RENGEL Z, ALBERDI M, et al. Molecular and physiological strategies to increase aluminum resistance in plants. Molecular Biology Reports, 2012, 39(3): 2069-2079. DOI:10.1007/s11033-011-0954-4 |
| [6] |
KOCHIAN L V, HOEKENGA O A, PINEROS M A. How do crop plants tolerate acid soils? Mechanisms of aluminum tolerance and phosphorous efficiency. Annual Review of Plant Biology, 2004, 55: 459-493. DOI:10.1146/annurev.arplant.55.031903.141655 |
| [7] |
RYAN P R, TYERMAN S D, SASAKI T, et al. The identification of aluminium resistance genes provides opportunities for enhancing crop production on acid soils. Journal of Experimental Botany, 2011, 62(1): 9-20. DOI:10.1093/jxb/erq272 |
| [8] |
RODRIGUES A A, VASCONCELOS-FILHO S C, RODRIGUES C L, et al. Aluminum influence on Hancornia speciosa seedling emergence, nutrient accumulation, growth and root anatomy. Flora, 2017, 236/237: 9-14. DOI:10.1016/j.flora.2017.09.008 |
| [9] |
SILVA S. Aluminium toxicity targets in plants. Journal of Botany, 2012, 2012: 219462. |
| [10] |
朱睦元, 周建华, 徐阿炳. 大麦耐铝性与根际pH值变化的关系. 杭州大学学报(自然科学版), 1995, 22(1): 83-89. ZHU M Y, ZHOU J H, XU A B. Relationship between differential acid aluminum tolerance and rhizosphere pH change of medium in Hordeum vulgare L. Journal of Hangzhou University (Natural Science), 1995, 22(1): 83-89. (in Chinese with English abstract) |
| [11] |
周建华, 潘伟槐, 徐阿炳, 等. 恒定pH系统中不同大麦品种的耐铝性. 杭州大学学报(自然科学版), 1997, 24(1): 85-90. ZHOU J H, PAN W H, XU A B, et al. Aluminum tolerance of different barley cultivars in a constant system of pH. Journal of Hangzhou University (Natural Science), 1997, 24(1): 85-90. (in Chinese with English abstract) |
| [12] |
周建华, 潘建伟, 朱睦元. 铝胁迫下大麦根过氧化物酶同工酶及根中Al、Ca和P含量的变化. 浙江农业学报, 2001, 13(4): 190-196. ZHOU J H, PAN J W, ZHU M Y. The changes of peroxidase isozyme and Al, Ca and P contents in barley roots under Al stress. Acta Agriculturae Zhejiangensis, 2001, 13(4): 190-196. (in Chinese with English abstract) |
| [13] |
PAN J W, YE D, WANG L L, et al. Root border cell development is a temperature-insensitive and Al-sensitive process in barley. Plant and Cell Physiology, 2004, 45(6): 751-760. DOI:10.1093/pcp/pch090 |
| [14] |
GUO T R, ZHANG G P, ZHANG Y H. Physiological changes in barley plants under combined toxicity of aluminum, copper and cadmium. Colloids and Surfaces B, 2007, 57(2): 182-188. DOI:10.1016/j.colsurfb.2007.01.013 |
| [15] |
PAN W H, SHOU J X, ZHOU X R, et al. Al-induced cell wall hydroxyproline-rich glycoprotein accumulation is involved in alleviating Al toxicity in rice. Acta Physiologiae Plantarum, 2011, 33(2): 601-608. DOI:10.1007/s11738-010-0684-6 |
| [16] |
郑炳松. 现代植物生理生化研究技术. 北京:气象出版社, 2006: 234-265. ZHENG B S. Modern Research Techniques of Plant Physiology and Biochemistry. Beijing: China Meteorological Press, 2006: 234-265. (in Chinese with English abstract) |
| [17] |
白书农. 一种改进的排水式体积计. 植物生理学通讯, 1987(5): 51-52. BAI S N. An improved water-displaced volumenomter. Plant Physiology Communications, 1987(5): 51-52. (in Chinese with English abstract) |
| [18] |
ÜNYAYAR S, KELES Y, üNAL E. Proline and ABA levels in two sunflower genotypes subjected to water stress. Bulgarian Journal of Plant Physiology, 2004, 30(3/4): 34-37. |
| [19] |
BATES L S, WALDREN R P, TEARE I D. Rapid determination of free proline for water stress studies. Plant and Soil, 1973, 39(1): 205-207. DOI:10.1007/BF00018060 |
| [20] |
GIANNOPOLITIS C N, RIES S K. Superoxide dismutases: Ⅰ. Occurrence in higher plants. Plant Physiology, 1977, 59(2): 309-314. DOI:10.1104/pp.59.2.309 |
| [21] |
CUI X M, ZHANG Y K, WU X B, et al. The investigation of the alleviated effect of copper toxicity by exogenous nitric oxide in tomato plants. Plant Soil and Environment, 2010, 56(6): 274-281. DOI:10.17221/PSE |
| [22] |
谢卫华, 姚菊芳, 袁勤生. 连苯三酚自氧化法测定超氧化物歧化酶活性的改进. 医药工业, 1988, 19(5): 217-220. XIE W H, YAO J F, YUAN Q S. Modification of pyrogallol autoxidation method for assay of superoxide dismutase. Pharmaceutical Industry, 1988, 19(5): 217-220. (in Chinese with English abstract) |
| [23] |
邹国林, 桂兴芬, 钟晓凌, 等. 一种SOD的测活方法:邻苯三酚自氧化法的改进. 生物化学与生物物理进展, 1986(4): 71-73. SHAO G L, GUI X F, ZHONG X L, et al. A SOD activity assay: Modification of pyrogallol autoxidation method. Progress in Biochemistry and Biophysics, 1986(4): 71-73. (in Chinese with English abstract) |
| [24] |
AEBI H. Catalase in vitro//Methods in Enzymology. New York, USA: Academic Press, 1984, 105: 121-126.
|
| [25] |
CAKMAK I, MARSCHNER H. Magnesium deficiency and high light intensity enhance activities of superoxide dismutase, ascorbate peroxidase, and glutathione reductase in bean leaves. Plant Physiology, 1992, 98(4): 1222-1227. DOI:10.1104/pp.98.4.1222 |
| [26] |
王伟玲, 王展, 王晶英. 植物过氧化物酶活性测定方法优化. 实验室研究与探索, 2010, 29(4): 21-23. WANG W L, WANG Z, WANG J Y. Optimization of determination method of peroxidase activity in plant. Research and Exploration in Laboratory, 2010, 29(4): 21-23. (in Chinese with English abstract) |
| [27] |
KUMAR G N M, KNOWLES N R. Changes in lipid peroxidation and lipolytic and free-radical scavenging enzyme activities during aging and sprouting of potato (Solanum tuberosum) seed- tubers. Plant Physiology, 1993, 102(1): 115-124. DOI:10.1104/pp.102.1.115 |
| [28] |
张芬琴, 沈振国, 刘友良. 铝和铝+钙对小麦幼苗根尖质膜、液泡膜微囊ATP酶和膜流动性的影响. 植物生理学报, 2000, 26(2): 105-110. ZHANG F Q, SHEN Z G, LIU Y L. Effect of Al3+ and Al3++Ca2+ on ATPases and membrane fluidities of plasma membrane and tonoplast vesicles from root tips of wheat seedlings. Acta Phytophysiologica Sinica, 2000, 26(2): 105-110. (in Chinese with English abstract) |
| [29] |
OHNISHI T, GALL R S, MAYER M L. An improved assay of inorganic phosphate in the presence of extralabile phosphate compounds: Application to the ATPase assay in the presence of phosphocreatine. Analytical Biochemistry, 1975, 69(1): 261-267. DOI:10.1016/0003-2697(75)90585-0 |
| [30] |
BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 1976, 72(1/2): 248-254. |
| [31] |
MATSUMOTO H, YAMAMOTO Y, KASAI M. Changes of some properties of the plasma membrane- enriched fraction of barley roots related to aluminum stress: Membraneassociated ATPase, aluminum and calcium. Soil Science and Plant Nutrition, 1992, 38(3): 411-419. DOI:10.1080/00380768.1992.10415073 |
| [32] |
张芬琴, 沈振国. 铝处理下小麦幼苗根系膜脂过氧化作用和质膜微囊ATP酶活性的变化. 西北植物学报, 1999, 19(4): 578-584. ZHANG F Q, SHEN Z G. Changes of lipid peroxidation and ATPases activities of wheat root plasma membrane vesicles under aluminium stress. Acta Botanica BorealiOccidentalia Sinica, 1999, 19(4): 578-584. (in Chinese with English abstract) |
| [33] |
王精明, 李美茹. 低温对水稻幼苗根细胞质膜、液泡膜Mg2+- ATP酶活性的影响. 湖北农学院学报, 2000, 20(4): 295-297. WANG J M, LI M R. Effect of low temperature on the activity of Mg2+-ATPase in root plasma membrane and tonoplast membrane of rice seedlings. Journal of Hubei Agricultural College, 2000, 20(4): 295-297. (in Chinese with English abstract) |
| [34] |
何龙飞, 沈振国, 刘友良. 铝胁迫下钙对小麦根系细胞质膜ATP酶活性和膜脂组成的效应. 中国农业科学, 2003, 36(10): 1139-1142. HE L F, SHEN Z G, LIU Y L. Effects of calcium on ATPase activity and lipid composition of plasma membranes of wheat roots under aluminum stress. Scientia Agricultura Sinica, 2003, 36(10): 1139-1142. (in Chinese with English abstract) DOI:10.3321/j.issn:0578-1752.2003.10.005 |
| [35] |
MILLER G, STEIN H, HONIG A, et al. Responsive modes of Medicago sativa proline dehydrogenase genes during salt stress and recovery dictate free proline accumulation. Planta, 2005, 222: 70-79. DOI:10.1007/s00425-005-1518-4 |
| [36] |
VERBRUGGEN N, HERMANS C. Proline accumulation in plants: A review. Amino Acids, 2008, 35(4): 753-759. DOI:10.1007/s00726-008-0061-6 |
| [37] |
LUTTS S, KINET J M, BOUHARMONT J. Effects of salt stress on growth, mineral nutrition and proline accumulation in relation to osmotic adjustment in rice (Oryza sativa L.) cultivars differing in salinity resistance. Plant Growth Regulation, 1996, 19(3): 207-218. DOI:10.1007/BF00037793 |
| [38] |
张宗申, 利容千, 王建波. Ca2+预处理对热胁迫下辣椒叶肉细胞中Ca2+-ATP酶活性的影响. 植物生理学报, 2004, 27(6): 451-454. ZHANG Z S, LI R Q, WANG J B. Effect of Ca2+ pretreatment on the Ca2+-ATPase activity in the mesophyll cells of pepper seedling under heat stress. Acta Phytophysiologica Sinica, 2004, 27(6): 451-454. (in Chinese with English abstract) |
| [39] |
MATSUMOTO H, YAMAYA T. Inhibition of potassium uptake and regulation of membrane-associated Mg2+-ATPase activity of pea roots by aluminium. Soil Science and Plant Nutrition, 1986, 32(2): 179-188. DOI:10.1080/00380768.1986.10557495 |
| [40] |
RENGEL Z. Uptake of aluminum by plant cells. New Phytologist, 1996, 134(3): 389-406. DOI:10.1111/nph.1996.134.issue-3 |
| [41] |
KAWANO T, KADONO T, FURUICHI T, et al. Aluminuminduced distortion in calcium signaling involving oxidative bursts and channel regulation in tobacco BY-2 cells. Biochemical and Biophysical Research Communications, 2003, 308(1): 35-42. DOI:10.1016/S0006-291X(03)01286-5 |
 2018, Vol. 44
2018, Vol. 44


