| 头孢噻呋纳米乳的制备及其抗奶牛乳腺炎主要致病菌的研究 |
奶牛乳腺炎是由病原菌引起的乳腺组织炎症,在炎症过程中乳腺组织受到破坏,泌乳量下降,是造成奶牛业经济效益损失最严重的疾病之一。乳房内灌注抗菌药物是治疗奶牛乳腺炎、清除乳腺感染的常用方法。然而,在临床实践中该方法对奶牛乳腺炎的治疗效果并不理想。除了细菌对抗菌药物产生耐药性之外,另一个原因可能是给药后药物和病原菌在乳腺内的分布不一致。曹立亭等[1]的研究提出,由于牛乳含乳脂成分,水溶性抗菌药物在乳房内灌注后趋向于往下分布,而病原菌往往附着在乳脂中趋向于分布在乳房的上部,二者不能充分接触,使药物的抗菌作用降低。头孢噻呋(ceftiofur)是第3代动物专用头孢类抗生素,其抗菌谱广,抗菌活性强,不易产生耐药性,对耐甲氧西林金黄色葡萄球菌(Staphylococcus aureus)也有较好的抗性作用[2]。为了提高临床使用效率,将不溶于水的头孢噻呋改造成头孢噻呋钠(ceftiofur sodium, CS)溶解在水中供临床使用。为克服水溶性药物在奶牛乳房灌注后不能和病原菌充分接触的问题,本研究将头孢噻呋制成一种稳定的纳米乳剂,研究头孢噻呋纳米乳(ceftiofur nanoemulsion, CNE)在牛乳中的分布及对金黄色葡萄球菌感染小鼠的治疗作用,为临床治疗奶牛乳腺炎提供一定的参考依据。
1 材料与方法 1.1 试验材料 1.1.1 试验菌株金黄色葡萄球菌ATCC 29740株和ATCC 25923株、大肠埃希菌ATCC 25922株均由浙江大学中兽医实验室保存。
1.1.2 试剂吐温-80、甘油购自上海阿拉丁生化科技股份有限公司;注射用大豆油由浙江田雨山药用油有限公司生产;头孢噻呋由武汉远成共创科技有限公司生产;头孢噻呋钠由齐鲁动物保健品有限公司生产;碳酸氢钠、二甲基亚砜购自国药集团化学试剂有限公司;MH(Mueller-Hinton)液体培养基、MH琼脂培养基购自杭州微生物试剂有限公司;牛乳(细菌学检测阴性)由浙江省杭州市杭江奶牛场生产。
1.1.3 试验动物ICR雌性小鼠(18~22 g),由江苏新药研究中心有限公司提供。
1.1.4 仪器85-2型数显恒温磁力搅拌器(杭州仪表电机有限公司);SK8210HP型超声波清洗(上海科导超声仪器有限公司);NDJ-8S型旋转黏度计(上海昌吉地质仪器有限公司);Nano-ZS型纳米粒度电位分析仪(英国马尔文仪器有限公司);MaxQ6000型恒温冷冻摇床(美国Thermo Fisher科技公司)。
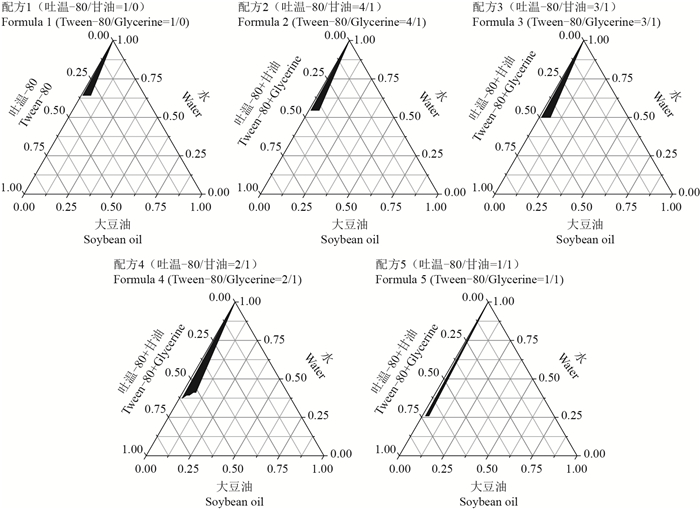
1.2 方法 1.2.1 头孢噻呋纳米乳的制备为筛选出合适的纳米乳配方,将吐温-80和甘油按质量比1:0、4:1、3:1、2:1、1:1混合作为乳化剂,再分别将这5种乳化剂与注射用大豆油按质量比9.75:0.25、9.5:0.5、9.25:0.75、9:1、8.75:1.25、8.5:1.5、8:2、7:3、6:4、5:5混合,边搅拌边缓慢加入水相。随着水相的增加,体系逐渐变稠,变浑浊,达到临界点后又逐渐变稀,直至形成澄清透明的液体;记录体系由黏稠转变至澄清的临界值。以水相、油相和乳化剂分别作为三相,运用Origin 8.0软件制作伪三元相图,标定临界点的质量比来确定纳米乳形成区间,考察区间的面积大小以确定易形成稳定纳米乳的范围。
在此基础上,制备12.5 mg/mL头孢噻呋纳米乳。具体步骤为:在20~25 ℃下,用200 μL二甲基亚砜溶解125 mg头孢噻呋后与0.58 g大豆油混合均匀,加入吐温-80(3.12 g)和甘油(1.56 g)组成的乳化剂中,磁力搅拌5 min使其混合均匀,转至超声仪中水浴超声15 min(控制超声温度<40 ℃),然后用磁力搅拌器边搅拌边缓慢滴加5.5 g去离子水,直至水相完全加入到体系中,最后再转至超声仪中超声处理10 min,即得头孢噻呋纳米乳。
1.2.2 头孢噻呋纳米乳性状检验乳剂类型检测:分别用水溶性染料亚甲蓝和脂溶性染料苏丹红Ⅲ进行染色,比较其在纳米乳中的扩散速度。若亚甲蓝扩散速度大于苏丹红Ⅲ,则说明制得的头孢噻呋纳米乳为水包油型;反之,则为油包水型[3]。
稳定性检测:取10 mL制得的纳米乳经1.2万r/min离心15 min后,观察分层和药物析出现象;用去离子水对纳米乳分别稀释5、10、20、40倍,观察分层和沉淀现象;将纳米乳在121 ℃高压蒸汽灭菌15 min后恢复到室温,观察沉淀和分层现象。
流动性检测:在20 ℃室温下,用NDJ-8S型旋转黏度计测定纳米乳的黏滞度。
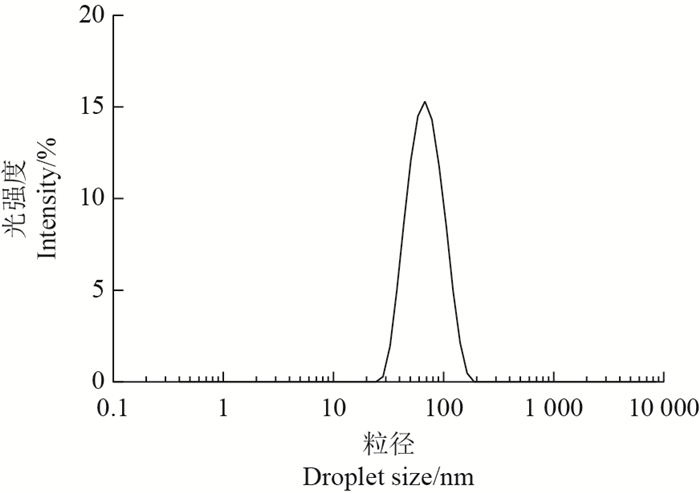
粒径检测:用Nano-ZS型纳米粒度电位分析仪测定头孢噻呋纳米乳的粒径分布及Zeta电位分布,测定温度为25 ℃。
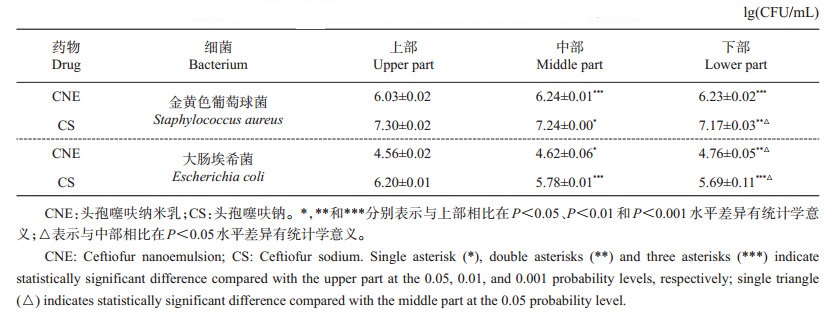
1.2.3 头孢噻呋纳米在牛乳中的分布参照曹立亭等[1]的方法,用生理盐水稀释头孢噻呋纳米乳和头孢噻呋钠,将这2种药物质量浓度调整至31.25和15.625 μg/mL。在盛有48 mL无菌牛乳的圆柱形塑料管(直径27 mm、高100 mm)中加入1 mL药物溶液和1 mL细菌悬液(金黄色葡萄球菌ATCC 29740株或大肠埃希菌ATCC 25922株,2.5×107 CFU/mL),充分混匀,使细菌最终浓度为5×105 CFU/mL,抗菌药物最终质量浓度为0.625 μg/mL(金黄色葡萄球菌)或0.312 5 μg/mL(大肠埃希菌),垂直于地面在37 ℃静置培养12 h后,置于-20 ℃冰箱冷冻8 h,将冰柱分割成上、中、下3等份,融化后用生理盐水稀释。取各部分稀释的含菌牛乳100 μL涂布于MH琼脂平板,每个样品2个重复,于37 ℃培养24 h后进行菌落计数(参考GB 4789.2—2016)。
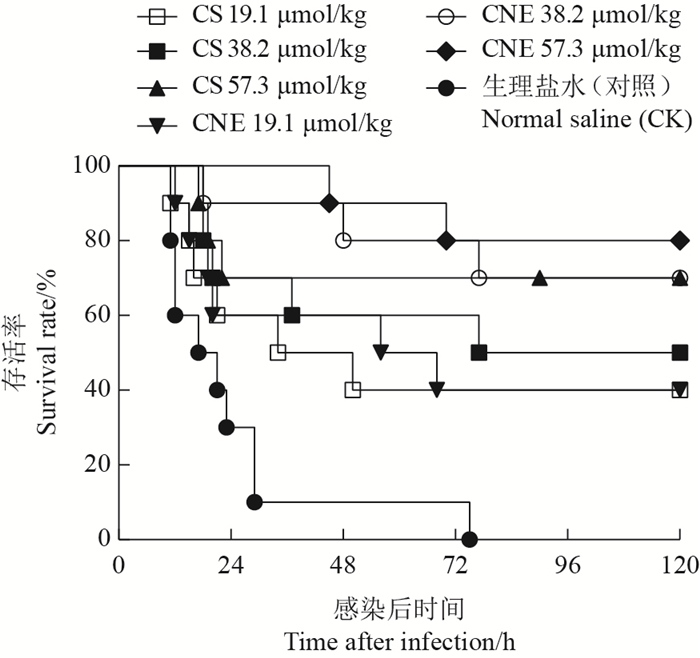
1.2.4 头孢噻呋纳米乳对感染金黄色葡萄球菌小鼠的治疗处理将70只雌性ICR小鼠(18~22 g)随机分成7组,每组10只。每只小鼠腹腔内注射0.4 mL金黄色葡萄球菌(ATCC 25923)悬液(5×109 CFU)。3 h后小鼠出现精神不振、抱团、呼吸急促、鼠毛蓬乱等症状。第1~3组的每只小鼠一次肌内注射头孢噻呋钠(CS),剂量分别为19.1、38.2和57.3 μmol/kg;第4~6组的每只小鼠一次肌内注射头孢噻呋纳米乳(CNE),剂量分别为19.1、38.2和57.3 μmol/kg;第7组小鼠仅肌内注射0.1 mL生理盐水,作为对照组。观察感染后120 h内各组小鼠的死亡情况。
2 结果与分析 2.1 纳米乳配方筛选为了使体系在形成澄清纳米乳的同时,油相占比达到最大值,我们绘制了5个配方的伪三元相图以观察各种不同成分配比形成的纳米乳区域面积(图 1黑色部分)。从中可以看出,配方4(Km=2:1)的黑色面积最大,说明能形成澄清透明纳米乳的范围最大。在油相比例最大时,各组分占比分别是大豆油7.35%,吐温-80 34.29%,甘油17.18%和水41.18%。
 |
| 图1 纳米乳配方伪三元相图 Fig. 1 Pseudo ternary phase diagram of different nanoemulsion formulas |
头孢噻呋纳米乳外观为淡黄色澄清透明均一液体。亲水性染料亚甲蓝在纳米乳中扩散迅速,而疏水性染料苏丹红Ⅲ在纳米乳中基本不扩散,表明头孢噻呋纳米乳为水包油型。经5、10、20和40倍稀释后液体仍保持澄清,无浑浊或分层现象;经121 ℃高压蒸汽灭菌15 min后放置于室温,液体颜色显著加深,变浑浊,表明不能耐受高压灭菌;经1.2万r/min离心15 min后,液体无分层和沉淀。在20 ℃时,头孢噻呋纳米乳的黏滞度为371 mPa· s。在25 ℃时,头孢噻呋纳米乳的平均粒径为60.54 nm,呈单峰分布(图 2);测得的聚合物分散系数(polymer dispersity index, PDI)为0.161,表明分布范围较窄。Zeta电位分布(图 3)显示,峰1均值为-5.11 mV(88.8%),峰2均值为36.0 mV(11%)。
 |
| 图2 头孢噻呋纳米乳粒径分布 Fig. 2 Droplet size distribution of ceftiofur nanoemulsion |
 |
| 图3 头孢噻呋纳米乳Zeta电位分布 Fig. 3 Zeta potential distribution of ceftiofur nanoemulsion |
表 1中的结果显示:在用头孢噻呋纳米乳(CNE)处理的牛乳中,金黄色葡萄球菌和大肠埃希菌的菌落数由下而上逐渐减少;而在头孢噻呋钠(CS)处理的牛乳中,金黄色葡萄球菌和大肠埃希菌的菌落数由下而上逐渐增加。
| 表1 头孢噻呋纳米乳和头孢噻呋钠对上、中、下部牛乳中细菌数量的影响 Table 1 Effects of CNE and CS on bacterial counts in three parts of milk |
 |
| 点击放大 |
由图 4可知:对照组小鼠感染金黄色葡萄球菌后的最终存活率为0%;120 h后,用头孢噻呋钠3个剂量(19.1、38.2或57.3 μmol/kg)治疗的小鼠存活率依次为40%、50%和70%;用头孢噻呋纳米乳3个剂量(19.1、38.2或57.3 μmol/kg)治疗的小鼠存活率依次为40%、70%和80%。
 |
| CS:头孢噻呋钠;CNE:头孢噻呋纳米乳。 CS: Ceftiofur sodium; CNE: Ceftiofur nanoemulsion. 图4 头孢噻呋纳米乳和头孢噻呋钠治疗后金黄色葡萄球菌感染小鼠的存活率 Fig. 4 Survival rates of mice infected S. aureus after treatments with ceftiofur nanoemulsion and ceftiofur sodium |
纳米乳是指粒径范围在1~100 nm,由水相、油相、表面活性剂、助表面活性剂等组成的均一稳定体系[4]。水包油型纳米乳可用于难溶性药物的增溶。本研究将不溶于水的头孢噻呋制成水包油型纳米乳,便于灌注和注射[5]。制备纳米乳所选表面活性剂需满足乳化性能好、安全、无毒、无刺激等要求[6]。由于非离子表面活性剂可以在广泛的pH范围内发挥作用,受体系中无机盐、电解质、酸、碱的影响较小,毒性和刺激性小,被广泛应用于纳米乳的制备中[7]。吐温-80在聚山梨醇酯类中安全性最好,亲水亲油平衡(hydrophilic lipophilic balance, HLB)值为15,增溶作用和乳化作用较好,适用于制作水包油型纳米乳[8]。助表面活性剂可以降低界面张力,增加界面的流动性,调节HLB值,使纳米乳可以自发形成[9-10]。本研究随着体系中加入助表面活性剂甘油的比例逐渐增加,能形成纳米乳的范围逐渐增大,当Km值为2:1时范围最大,且转相时临界状态的黏滞度也降低,便于制备;当Km值为1:1时,体系变得不稳定,可形成纳米乳的范围反而降低。纳米乳的外观一般为澄清透明或半透明,有蓝色乳光,平行光入射有丁达尔现象,高速离心后稳定[11]。纳米乳的粒径会影响药物吸收的速率,乳滴粒径越小,油水界面的面积越大,则纳米乳的吸收越好[12]。本研究发现纳米乳不能耐受高压灭菌,可以通过0.22 μm滤菌膜,因此,在生产中可以用过滤的方法除菌。
牛乳中的乳脂以脂肪球的形式分散在牛乳中,乳脂肪球密度较低,多分布于牛乳的上部。有研究表明,乳脂肪球有黏附大肠埃希菌的功能,这可能是病原菌在牛乳中更多分布于上部的原因之一[13]。本研究将抗菌药物和细菌在牛乳中培养,对上、中、下不同部位的金黄色葡萄球菌和大肠埃希菌进行菌落计数,比较头孢噻呋纳米乳和头孢噻呋钠在牛乳中不同部位的抗菌作用。结果显示,头孢噻呋纳米乳对2种受试菌株的抗菌作用均优于头孢噻呋钠,且对细菌分布最多的牛乳上部抗菌作用显著优于中、下部,而头孢噻呋钠组的结果则相反。这可能与2组药物在牛乳中的分布不同有关。
本研究以头孢噻呋钠或头孢噻呋纳米乳治疗感染金黄色葡萄球菌小鼠均可显著提高其存活率。存活率大小与用药剂量有关,也与药物的剂型有关。有研究报道,以20 mg/kg头孢噻呋钠治疗经30 mg/kg脂多糖攻毒的小鼠,小鼠存活率从0%提高至70%[14]。本研究在相同剂量下,用头孢噻呋纳米乳治疗的小鼠存活率高于头孢噻呋钠治疗组,说明纳米乳更具优越性。
4 结论本研究制备的头孢噻呋纳米乳稳定性好,在牛乳中主要分布于上部。在相同剂量下,头孢噻呋纳米乳对感染金黄色葡萄球菌小鼠的治疗作用优于头孢噻呋钠。
| [1] |
曹立亭, 胡松华. 奶牛乳腺炎重要致病菌和常用抗菌药物体外在牛奶中的分布. 中国兽医学报, 2010(10): 1381-1384. CAO L T, HU S H. Distribution of major mastitis-causing bacteria and common antimicrobial drugs in milk. Chinese Journal of Veterinary Science, 2010(10): 1381-1384. (in Chinese with English abstract) |
| [2] | SCHUKKEN Y H, BENNET G J, ZURAKOWWSKI M J, et al. Randomized clinical trial to evaluate the efficacy of a fiveday ceftiofur hydrochloride intramammary treatment on nonsevere gram-negative clinical mastitis. Journal of Dairy Science, 2011, 94(12): 6203-6215. DOI:10.3168/jds.2011-4290 |
| [3] |
孙红武. 黄连素纳米乳给药系统的研究. 陕西, 杨凌: 西北农林科技大学, 2007: 70-72. SUN H W. The study on nanoemulsion drug delivery system of bererine. Yangling, Shannxi: Northwest A & F University, 2007: 70-72. (in Chinese with English abstract) |
| [4] | BAZYLINSKA U, SACZKO J. Nanoemulsion-templated polylelectrolyte multifunctional nanocapsules for DNA entrapment and bioimaging. Colloids and Surfaces B: Biointerfaces, 2016, 137: 191-202. DOI:10.1016/j.colsurfb.2015.07.056 |
| [5] | ABOLNAJA K O, YAGHMOOR S, KUMOSANI T A, et al. Utilization of nanoemulsions to enhance bioactivity of pharmaceuticals, supplements, and nutraceuticals: Nanoemulsion delivery systems and nanoemulsion excipient systems. Expert Opinion on Drug Delivery, 2016, 13(9): 1327-1336. DOI:10.1517/17425247.2016.1162154 |
| [6] | ISHAK K A, Annuar M S M, AHMAD N. Optimization of water/oil/surfactant system for preparation of medium-chainlength poly-3-hydroxyalkanoates (mcl-PHA)-incorporated nanoparticles via nanoemulsion templating technique. Applied Biochemistry and Biotechnology, 2017, 183(4): 1191-1208. DOI:10.1007/s12010-017-2492-6 |
| [7] |
陈风平, 刘晨光. 纳米乳研究进展. 生物技术通报, 2013(12): 43-48. CHEN F P, LIU C G. Advances in nanoemulsion research. Biotechnology Bulletin, 2013(12): 43-48. (in Chinese with English abstract) |
| [8] |
吴毅, 金少鸿. 药用辅料吐温80的药理、药动学及分析方法研究进展. 中国药事, 2008(8): 717-720. WU Y, JIN S H. Progress of pharmacological properties, pharmacokinetics properties and analytic method of pharmaceutical adjuvant Tween 80. Chinese Pharmaceutical Affairs, 2008(8): 717-720. (in Chinese with English abstract) |
| [9] |
刘根新, 张继瑜, 吴培星, 等. 不同助表面活性剂对药用微乳形成的影响. 中国医院药学杂志, 2009(3): 177-180. LIU G X, ZHANG J Y, WU P X, et al. Basic study on different co- surfactant O/W pharmaceutical microemusions. Chinese Journal of Hospital Pharmacy, 2009(3): 177-180. (in Chinese with English abstract) |
| [10] | AHMED S, GULL A, ALAM M, et al. Ultrasonically tailored, chemically engineered and"QbD"enabled fabrication of agomelatine nanoemulsion; optimization, characterization, exvivo permeation and stability study. Ultrasonics Sonochemistry, 2018, 41: 213-226. DOI:10.1016/j.ultsonch.2017.09.042 |
| [11] |
杨鹏飞, 陈卫东. 纳米乳提高难溶性药物生物利用度的研究进展. 中国药学杂志, 2013(15): 1238-1244. YANG P F, CHEN W D. Research progress of nanoemulsions' applications in improving the bioavailability of poor watersoluble drugs. Chinese Pharmaceutical Journal, 2013(15): 1238-1244. (in Chinese with English abstract) |
| [12] | GAO Y N, QI X J, ZHENG Y P, et al. Nanoemulsion enhances α-tocopherol succinate bioavailability in rats. International Journal of Pharmaceutics, 2016, 515(1/2): 506-514. |
| [13] | SCHTOTEN H, NANISCH F G, PLOGMANN R, et al. Inhibition of adhesion of S-fimbriated Escherichia coli to buccal epithelial cells by human milk fat globule membrane components: A novel aspect of the protective function of mucins in the nonimmunoglobulin fraction. Infection and Immunity, 1992, 60(7): 2893-2899. |
| [14] | CI X X, LI H Y, SONG Y, et al. Ceftiofur regulates LPSinduced production of cytokines and improves LPS-induced survival rate in mice. Inflammation, 2008, 31(6): 422. DOI:10.1007/s10753-008-9094-y |
 2018, Vol. 44
2018, Vol. 44


