| 细菌促进肠道病毒感染及其机制研究进展 |
人体内共生着数量巨大的微生物群落,其中尤以肠道为甚,数量达到惊人的百亿量级,包含1 000多种不同的细菌,以及数量庞大的病毒、真菌和古细菌[1-2]。因此,人体仿佛是一个行走着的巨大“发酵罐”。肠道微生物群落并非单一封闭的系统,环境因素、饮食习惯和宿主遗传特性等都能对其造成影响[3-4]。近年来,越来越多的科研团队开始聚焦于肠道微生物对哺乳动物内稳态和疾病状态的影响。肠道微生物之间有着非常复杂的共生关系,而这种共生关系对维系宿主的健康状态至关重要。例如,肠道菌群能将食物分解供机体吸收,并产生能量供细胞进行生化代谢、免疫反应等活动,以维系机体的内稳状态[5-6]。免疫学前沿研究也证实,肠道微生物在哺乳动物免疫系统发育、行使功能和形成记忆的过程中至关重要。与野生型正常小鼠相比,无菌小鼠的肠道次级免疫器官无论在结构还是功能上都会出现严重的异常,其肠道中分泌型IgA和T淋巴细胞水平都极显著地降低[7-9]。此外,有些肠道菌能够诱导上皮细胞分泌抗菌类蛋白,例如,血管生成素和C型凝集素RegⅢγ能保护机体抵抗病原微生物的入侵[10-11]。总之,肠道细菌影响广泛,在维系宿主生理功能、促进免疫系统成熟和抵抗病原侵染方面均不可或缺。
最为人熟知的肠道病毒有3种,分别是轮状病毒、诺如病毒和星状病毒,它们均为单股正链RNA病毒,可通过粪口途径传染,主要导致易感人群的流行性胃肠炎。据世界卫生组织估算,这3种病毒在世界范围内每年可导致20万5岁以下幼儿死亡。这还有赖于美国在2008年成功研制了高效的轮状病毒口服疫苗,在此疫苗面世之前,死亡数字甚至高达45.3万,其危害性可见一斑[12-13]。轮状病毒在口服疫苗迅速推广后的临床感染病例越来越少,但由于暂无可用的诺如病毒有效疫苗,因此,已逐渐取代轮状病毒成为发达国家幼儿流行性腹泻的主要食源性病原[14-16]。诺如病毒可导致各类人群的传染性腹泻,在世界范围内约占所有急性胃肠炎病例的18%[17]。另一类引起幼儿腹泻的肠道病毒是星状病毒,流行病学调查显示,由此病毒引起的腹泻在所有幼儿腹泻病例中仅占2%~9%。然而,近年来新型星状病毒的发现不断被报道,且与之前发现的经典毒株差异明显,说明星状病毒腹泻的发生率远高于流行病学调查结果,只是之前未能确认其病原[18]。另外,并非所有肠道病毒都仅限于肠道感染,例如脊髓灰质炎病毒和柯萨奇病毒,虽然其感染起始于肠道,却能造成小儿麻痹、幼儿心肌炎等严重的系统性疾病。除此之外,还有些肠道病毒虽然能在肠道中复制,但不表现临床症状(例如呼肠孤病毒);还有一些反转录病毒,如鼠乳腺癌病毒(mouse mammary tumor virus, MMTV),能够通过乳汁由母鼠传播给仔鼠,虽然未归类为肠道病毒,却具有感染肠道的天然属性[19]。
既然肠道病毒在感染时必然与宿主肠黏膜上数量巨大的肠道菌群相遇,那么细菌与病毒相遇时会否产生相互作用,这些互作能否影响肠道病毒的入侵,其影响的实质是促进还是拮抗,都是肠道病毒研究领域极为关心的科学问题。近年来,相关研究团队对此做了细致深入的研究,结果证实,肠道细菌的确能够与肠道病毒互作,并在其感染宿主的过程中起着极为重要的作用。笔者对这一领域近期重要进展进行了综述,重点阐述了细菌调节肠道病毒体内入侵,特别是促进入侵的相关机制,最后对如何将这些发现应用于新型疫苗的研发和新型抗病毒治疗方案的制定进行了讨论。
1 肠道细菌对病毒感染的促进作用 1.1 肠道细菌缺失小鼠模型的构建目前,构建肠道菌群缺失小鼠模型通常有2种方案:一是通过隔离屏障体系饲养无菌小鼠,即采用剖腹产手术获得仔鼠,并在无菌环境下饲养,达到完全无菌的状态;二是通过给正常小鼠饲喂高浓度的联合抗生素(以下称为抗生素处理组),达到清除大部分肠道细菌的目的。这2种方案各有利弊。对于无菌小鼠而言,自出生开始即未接触过任何微生物,处于完全无菌状态,无任何背景微生物的干扰,简单直接,易于分析;然而,肠道菌群对于哺乳动物形成正常的肠道生理结构和黏膜相关免疫器官的发育成熟必不可少,而无菌小鼠的肠黏膜层显著变薄,且肠道相关淋巴组织(gut-associated lymphoid tissues, GALTs)发育不完全(例如无菌小鼠无法形成派氏结节),因此,在使用该模型时应慎重考虑黏膜功能不全对实验结果造成的影响。而对于使用联合抗生素清除肠道菌群而言,虽然小鼠的黏膜结构正常,免疫功能完备,且高浓度的广谱抗生素能够清除绝大多数肠道菌群(约90%),但由于肠道细菌并未被完全去除,如何排除那些具有抗生素抗性的剩余菌群对实验结果的影响,是无法回避也难以回答的问题;因此,应该根据相关科学问题选择合理的肠道细菌缺失模型。如果同时用抗生素处理和无菌动物系统互相印证,结果和结论更为可靠。
1.2 肠道细菌是肠道病毒体内复制的“助推器”2011年,KANE等[20]和KUSS等[21]分别以脊髓灰质炎病毒、呼肠孤病毒和MMTV为对象,对肠道细菌影响肠道病毒体内感染的机制进行了研究,研究成果相继发表在《科学》杂志上。这2篇具有里程碑意义的论文正式开启了肠道细菌与肠道病毒互作研究的热潮。
KUSS等[21]在研究中首先发现:与肠道菌群正常小鼠对照相比,在脊髓灰质炎病毒感染小鼠的抗生素处理组中,病毒毒力显著减弱,感染小鼠死亡率降低,排毒量减少,且病毒在肠道内复制水平降低;对抗生素处理组饲喂正常小鼠肠道内容物后再进行脊髓灰质炎病毒感染,则病毒毒力完全恢复;此外,通过腹腔注射途径对2种小鼠进行病毒接种,则病毒致病性未见变化。这说明脊髓灰质炎病毒必须通过肠道感染才能利用细菌促进其体内复制,增强其致病力。由于呼肠孤病毒在正常小鼠中感染并不引起临床症状,因此,KUSS等[21]还构建了Ⅰ型干扰素(typeⅠinterferon, IFN)缺陷型小鼠的感染模型。与脊髓灰质炎病毒相似,呼肠孤病毒感染菌群正常的IFN敲除小鼠能够导致粪便形态异常,且肠道出现病理变化,而抗生素处理的IFN缺失小鼠感染呼肠孤病毒未见临床症状;此外,呼肠孤病毒在抗生素处理小鼠肠道中的复制效率显著降低,这与肠道病理变化显示的结果具有一致性。
无独有偶,KANE等[20]几乎在同一时间报道了另一种肠道侵染病原MMTV需在肠道细菌的辅助下才能感染的现象。抗生素处理的母鼠感染MMTV后不能通过乳汁将病毒传播给仔鼠,但用正常小鼠肠道内容物在无菌小鼠体内重构肠道菌群后再进行MMTV感染,则病毒的传播能力完全恢复。综合多种肠道病毒(脊髓灰质炎病毒、呼肠孤病毒和MMTV)在2种肠道菌群缺失模型上观察到的类似现象,可以得出肠道细菌能够促进肠道病毒体内感染的结论。
此后,研究者们在轮状病毒和诺如病毒的研究中也取得了类似结果。UCHIYAMA等[22]的研究表明:抗生素处理组在感染轮状病毒后,无论是粪便中的病毒含量还是肠组织中的病毒基因组拷贝数均显著低于正常小鼠对照,且排毒时间显著缩短;抗生素处理还能显著降低哺乳仔鼠感染轮状病毒后腹泻的发生率,并显著缩短发病周期。2014—2015年,JONES等[23]、BALDRIDGE等[24]和KERNBAUER等[25]分别在《科学》和《自然》杂志上连续发表了3篇关于肠道菌群促进诺如病毒感染的研究论文。JONES等[23]证实,诺如病毒急性感染的抗生素处理组的空肠末端、结肠和肠系膜淋巴结中的病毒滴度显著低于正常菌群对照组,表明肠道菌群能够促进诺如病毒在这些组织中的复制。KERNBAUER等[25]用诺如病毒感染无菌小鼠,发现病毒排毒量显著低于正常小鼠。BALDRIGE等[24]发现:原本能够在正常小鼠上导致持续性感染的诺如病毒毒株MNV-3,在抗生素处理小鼠中却无法建立持续性感染;但对抗生素处理组进行粪菌移植后,MNV-3的感染性却被完全恢复;与脊髓灰质炎病毒的研究结果相似,诺如病毒导致的系统性感染并不依赖于肠道菌群,说明肠道病毒通过循环系统形成的感染与肠道黏膜的局部内稳态并不直接相关。
2 肠道细菌促进肠道病毒感染的相关机制 2.1 直接作用机制肠道细菌促进肠道病毒感染的直接机制主要包括2点:1)促进病毒粒子的稳定性(图 1A);2)促进病毒对靶细胞的黏附作用(图 1B)。
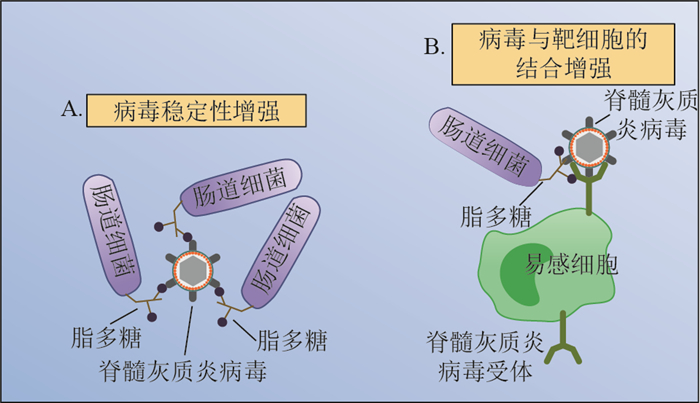 |
| 图1 肠道细菌脂多糖对脊髓灰质炎病毒稳定(A)性及其与靶细胞结合能力(B)的促进作用 Fig. 1 Lipopolysaccharide of intestinal bacteria promotes poliovirus stabilization (A) and stimulates viral binding to target cells (B) |
如前所述,KUSS等[21]以脊髓灰质炎病毒为感染模型揭示了肠道细菌促进病毒粒子稳定性的机制,其研究显示:感染后2 h,取自正常小鼠肠道内容物中的脊髓灰质炎病毒比取自抗生素处理小鼠和无菌小鼠肠道内容物中的脊髓灰质炎病毒具有更强的感染力;不仅如此,将脊髓灰质炎病毒与取自正常小鼠的肠道内容物进行孵育后,该病毒的活力显著高于抗生素处理小鼠和无菌小鼠肠道内容物孵育组。值得一提的是,脊髓灰质炎病毒感染性的增强并不需要活菌,细菌表面的脂多糖(lipopolysaccharide, LPS)便能达到促进感染的效果。以上研究表明,细菌表面的LPS或其他N-乙酰氨基葡糖只需含有6个以上单糖侧链便足以促进病毒的感染效力[21, 26]。将脊髓灰质炎病毒与细菌或LPS进行孵育可有效增加病毒粒子的热稳定性并提高其对含氯消毒剂的抗性,这一现象正好与脊髓灰质炎病毒入侵时缓慢释放基因组的特点相一致[26]。由此认为,脊髓灰质炎病毒能与细菌表面的LPS结合,提高病毒粒子的稳定性,同时也防止病毒与靶细胞表面受体结合之前病毒配体的构象变化过快,导致病毒脱衣壳提前发生(图 1A)。更为重要的是,作为入侵的第一步,病毒脱衣壳过程是在衣壳蛋白稳定性和受体-配体构象变化的黏性之间达成动态平衡,而细菌如何精妙地调控这一平衡点,值得深入研究。
2.1.2 促进病毒的吸附作用除了促进病毒粒子的稳定性,细菌表面LPS还能促进病毒对靶细胞的黏附作用(图 1B)。仍以脊髓灰质炎病毒为例,将其与LPS孵育后病毒结合靶细胞的效率显著高于未与LPS孵育组,而将靶细胞与脊髓灰质炎受体(poliovirus receptor, PVR)的特异性抗体先行孵育后,再用LPS处理过的脊髓灰质炎病毒感染,则病毒黏附过程受阻。结合以上2点,说明LPS能增强脊髓灰质炎病毒与PVR的结合能力,从而促进病毒对靶细胞的感染[26](图 1B)。
肠道细菌促进诺如病毒感染的机制也和病毒与靶细胞的黏附效率有关。2014年,JONES等[23]报道,人源性和鼠源性诺如病毒能够感染B淋巴细胞。由于人源性诺如病毒无体外培养细胞系统已有40年,所以此次发现为诺如病毒细胞嗜性方面研究的一大突破。JONES等[23]研究显示,含有人源性诺如病毒的粪便样品如未经过滤处理直接接种于人B淋巴细胞传代细胞系BJAB上,诺如病毒能够增殖,而经0.2 μm滤器过滤的粪样却未见增殖,说明未能通过滤器的肠道菌群中含有能促进诺如病毒在B细胞上复制的辅助因子;进一步研究表明,在过滤粪样中加入热灭活的阴渠杆菌能够完全恢复诺如病毒在B细胞上的增殖能力。与肠道细菌通过LPS促进脊髓灰质炎病毒感染的机制不同,LPS并不能增强诺如病毒的感染作用。为了进一步阐明阴渠杆菌促进诺如病毒感染B细胞的分子机制,人们将目标选定在阴渠杆菌表达的一种多糖分子——人组织血型抗原(histo-blood group antigen, HBGA)上。由于HBGA是公认的诺如病毒受体[27],且表达HBGA的细菌能够和诺如病毒粒子结合,形成感染复合物[28],因而可验证阴渠杆菌表达的H型HBGA对诺如病毒结合B细胞的影响。从图 2可以看出,H型HBGA能够显著增强诺如病毒在B细胞上的黏附效率,从而达到促进病毒复制的效果。虽然脊髓灰质炎病毒和诺如病毒促进自身复制所借助的细菌和多糖并不相同,但它们采取的策略却非常相似,都是通过细菌表面的多糖提高与靶细胞表面受体的结合能力,进而促进其复制。因此,我们可以综合以上2种直接机制,针对病毒-细菌的互作关系设计新的抗病毒策略。
 |
| 图2 诺如病毒与阴渠杆菌表达的HBGA互作对病毒在B细胞系中增殖的促进作用 Fig. 2 Human norovirus infection of B cells is stimulated by HBGA-expressing E. cloacae |
除了直接作用机制外,肠道病毒还可以借助细菌调节宿主抗病毒免疫的间接机制促进自身感染:1)诱导机体产生免疫耐受的肠道微环境;2)抑制病毒特异性抗体的产生;3)抑制干扰素产生的信号通路。
2.2.1 诱导免疫耐受的肠道微环境在正常生理状态下,肠上皮细胞能通过先天性免疫相关受体识别肠道细菌的分子模式,分泌一些抑制免疫反应的细胞因子,维持肠道“免疫耐受”的内稳态[29-30]。此外,在肠组织中游弋着大量识别各种肠道菌群的调节性T淋巴细胞(regulatory T lymphocytes, Tregs),用以维持机体对数量庞大的非致病性微生物的免疫耐受状态,防止自身免疫病的发生[31-34]。然而,这种由细胞因子和Tregs介导的“免疫耐受”状态理论上对宿主抗病毒免疫也有抑制作用。因此,肠道病毒有可能与非致病性细菌形成感染复合物,并借助Tregs的免疫抑制效应逃逸宿主的抗病毒免疫反应。
以MMTV在仔鼠中形成持续性感染为例。首先,MMTV如通过母乳感染乳鼠,则需要与其肠道细菌LPS相结合,这一推测从对其体内分离到的感染复合物进行密度梯度超速离心结果中得到了验证,即MMTV、细菌LPS和MMTV-LPS复合物出现在了同一梯度层中,表明病毒可直接与细菌LPS结合[20]。其次,识别细菌LPS的4型Toll样受体(Tolllike receptor 4, TLR4)和抗炎性细胞因子白细胞介素10(interleukin-10, IL-10)的敲除小鼠不能有效感染MMTV,说明MMTV形成持续性感染需要宿主TLR4和IL-10参与其中[20]。此外,进一步研究阐明了MMTV与LPS的互作机制,即MMTV能与宿主表达的LPS结合蛋白CD14、MD2(也被称为LY96)和TLR4互作,将它们纳入囊膜之中,形成感染复合物[35]。再次,MMTV感染后主要激活的是树突状细胞(dendritic cell, DC)及巨噬细胞表面的TLR4,且IL-10主要来源于B淋巴细胞[20]。至此,MMTV-LPS激活TLR4炎性途径的上下游关系得到了进一步确认。此后,KANE等[20]基于上述研究结果提出了MMTV在乳鼠中形成持续性感染的模型,此模型完整地阐述了MMTV结合细菌LPS形成感染复合物,并与DC表面TLR4结合,诱导其产生白细胞介素6(interleukin-6, IL-6)的过程;在此基础上,IL-6与B细胞表面IL-6受体结合,刺激B细胞分泌IL-10,导致肠道产生免疫耐受的内环境,抑制宿主的抗病毒免疫反应,促进MMTV的持续性感染(图 3)。此外,LPS-MMTV感染复合体比LPS本身更容易刺激脾细胞产生IL-6,表明LPS和MMTV互作进一步增强了LPS的免疫调节作用[20]。
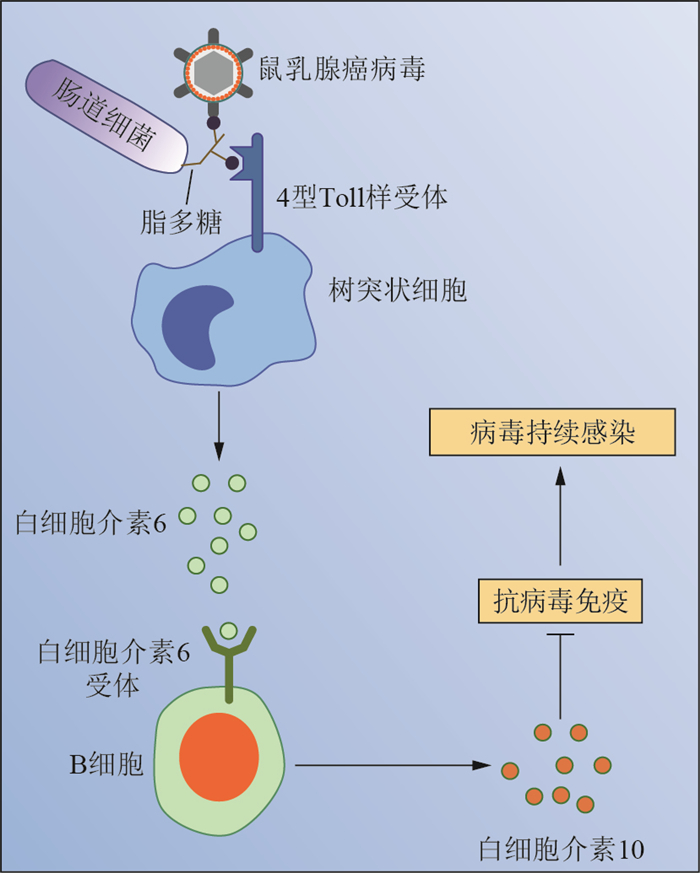 |
| 图3 肠道菌群对鼠乳腺癌病毒建立持续性感染的促进作用 Fig. 3 Intestinal bacteria facilitate the establishment of MMTV persistence |
MMTV借助肠道细菌诱导的IL-10抑制宿主抗病毒免疫,促进自身感染的现象并非孤例。2014年,BASIC等[36]证实了诺如病毒也可以通过类似的间接途径促进其体内感染。诺如病毒感染与轮状病毒类似,在肠道中不引起明显的炎性反应[37-40],而BASIC等[36]却在诺如病毒感染的IL-10缺失小鼠(IL-10-/-小鼠)肠道中观察到了明显的炎症,说明IL-10能够抑制病毒急性感染引发的炎症。但如果诺如病毒感染的是IL-10缺失的无菌小鼠,则炎性反应消失;而将特定肠道菌群定殖于IL-10-/-无菌小鼠体内,则病毒感染诱发炎症的现象得以复现,这说明诺如病毒感染诱发的炎性反应具有肠道细菌依赖性[36]。至于细菌依赖性IL-10对炎性反应的抑制作用究竟对诺如病毒急性感染和获得性免疫应答有何影响,还有待进一步研究。
2.2.2 抑制宿主生成抗体肠道细菌调节宿主抗病毒免疫的第2个机制是抑制病毒特异性抗体的生成。UCHIYAMA等[22]发现:轮状病毒感染的抗生素处理小鼠产生的特异性抗体显著高于病毒感染的正常小鼠;尽管2组小鼠在感染后9周内抗体水平趋同,但感染后9~11周细菌缺失组粪便和血清中IgA以及血清中IgG的水平均显著高于正常小鼠。此外,他们又在无菌小鼠系统中验证了此现象,发现无菌小鼠血清中抗体水平显著高于对照小鼠,说明肠道细菌能显著抑制宿主在感染后期抗轮状病毒特异性抗体的产生。之后对肠道固有层及派氏结节中抗体分泌细胞的数量检测发现,感染后2周抗生素处理组和对照组并无差异,而在感染后7周,前者的抗体分泌细胞数量显著高于后者[22],这也从另一方面印证了抗体水平的检测结果。
然而,肠道细菌抑制轮状病毒抗体产生的现象并不一定适用于其他病毒。BALDRIGE等[24]报道了鼠源诺如病毒(murine norovirus, MNV)感染的小鼠经抗生素处理35 d后,其血清IgG水平低于对照小鼠,这与上文中提到的轮状病毒在肠道菌群缺失情况下抗体水平升高的研究结果相反。因此,为了探明肠道细菌对诺如病毒体液免疫应答的影响,仅检测单一时间点的抗体反应还不够,必须对感染后2种处理的小鼠在不同时间点的抗体消长曲线进行研究,才能得出更为严谨的结论。更为重要的是,病毒特异性抗体是为诺如病毒2次感染提供保护的主要效应因子,探明肠道细菌与病毒特异性抗体产生之间有何关联性具有重要的意义。
2.2.3 抑制宿主干扰素的信号通路肠道细菌调节宿主抗病毒免疫的第3个机制是抑制干扰素产生的信号通路。为了验证肠道细菌是否通过调节宿主抗病毒免疫反应来促进诺如病毒的持续性感染,同时确定其中决定性的免疫因子,BALDRIGE等[24]对不同种系的基因敲除小鼠进行抗生素处理后感染MNV,观察其持续性感染的变化,结果显示:Ⅰ型和Ⅱ型干扰素不能拮抗病毒的持续性感染;TLR2、TLR4和黑色素瘤分化相关蛋白5等模式识别受体,获得性免疫反应相关的T、B淋巴细胞,以及细胞自噬相关因子也都没有拮抗病毒持续性感染的效应;然而,MNV能在抗生素处理的Ⅲ型干扰素(IFN-λ)受体、信号转导和转录激活子1和干扰素调节因子3基因敲除小鼠中形成持续性感染。这些结果为我们提供了细菌通过抑制IFN-λ信号通路促进诺如病毒持续性感染的工作模型(图 4)。最新研究[23, 41-44]显示,IFN-λ能作用于结肠组织中的非造血细胞,行使拮抗MNV持续性感染的重要功能,且诺如病毒具有免疫细胞嗜性。这说明IFN-λ很可能并非直接作用于感染细胞,而是通过一种不为大家熟知的方式间接拮抗诺如病毒的持续性感染。此外,IFN-λ对轮状病毒感染也具有保护作用[45]。
 |
| 图4 肠道菌群对鼠诺如病毒建立持续性感染的促进作用 Fig. 4 Intestinal bacteria facilitate the establishment of murine norovirus persistence |
总之,肠道菌群可以与宿主免疫系统中的相关因子进行互作,调节宿主的抗病毒免疫,促进肠道病毒的体内感染。而IFN-λ是否具有拮抗肠道病毒入侵的广谱效应,肠道细菌和肠道病毒互作是否对IFN-λ的产生具有病毒非特异性的调节作用,这些问题目前还不得而知,需要对其相关机制进行更为深入的研究。
3 展望尽管探索细菌和肠道病毒之间的相互作用只有短短几年,但越来越多的研究都证实,菌群对肠道病毒的毒力及感染后的病程发展具有重要影响。了解细菌和病毒二者之间的互作关系有助于设计有效的治疗方案和预防策略。本文述及的5种肠道病毒(脊髓灰质炎病毒、呼肠孤病毒、轮状病毒、肠道反转录病毒和诺如病毒)均能利用肠道细菌促进自身的感染。通过对细菌介导的促进机制进行深入解析,我们发现肠道病毒在进化过程中发展出多种利用肠道微生物增强复制的策略。虽然各种病毒采取的方式有所不同,但可归纳为2大类:一类是促进体内感染的直接辅助模式,包括提高病毒粒子稳定性和提高病毒结合靶细胞表面受体效率2种直接机制;另一类是通过抑制宿主抗病毒免疫,辅助病毒感染的间接手段。
毫无疑问,深入理解细菌-病毒互作分子机制是发明新抗病毒方法的基础。例如,基于细菌能够增强脊髓灰质炎病毒粒子的热稳定性及消毒液抗性的现象,可以设计针对脊髓灰质炎病毒结合菌株的抗菌制剂来拮抗宿主局部环境中的病毒感染。此外,还可以从病毒-细菌互作的角度入手,找到两者的结合位点或结合方式,设计针对特定靶点的抗病毒药物。探究病毒-细菌互作机制的最终目的是设计新的免疫方法(如设计新型疫苗、新型免疫佐剂等)。由于细菌抑制宿主免疫系统后会形成对肠道病毒感染性增强的“旁效应”,因此这种“非特异性增强”将是我们需要克服的最大障碍。其中一种较为直接的解决方案就是使用免疫刺激剂抵消细菌性抗原激发的“免疫耐受”信号,增强宿主黏膜免疫系统的敏感性。最近一项研究显示,对小鼠使用细菌鞭毛抗原这种免疫刺激剂能有效帮助其抵抗轮状病毒感染[46],该结果佐证了这一方案的可行性。当然,免疫增强剂的使用一定要非常慎重,错误使用会走向“免疫耐受”的反面,导致自身免疫病的发生。
最后,需要强调的是,使用大剂量抗生素消除模式动物的肠道菌群是为了研究细菌在肠道病毒感染中的作用,虽然得出的结论是细菌能够促进这些肠道病毒在体内的增殖,但是若在临床上通过使用广谱抗生素消除菌群来抑制病毒感染,则是一种舍本逐末的做法,因为菌群失调带来的恶果将大大超过控制几种肠道病毒带来的益处。更有甚者,抗生素滥用将导致“超级细菌”的产生,对人类生命产生更大的威胁。
展望未来,肠道细菌促进肠道病毒感染的分子机制正逐渐成为科学家们竞相研究的热点,活跃在这一领域的科研团队将继续揭示肠道菌群与肠道病毒之间的互作机制,而这些研究将无一例外地加深人们对食品动物肠道微生态与动物重要肠道病毒(如猪流行性腹泻病毒、丁型冠状病毒等)之间复杂联系的了解。
| [1] | QIN J J, LI R Q, RAES J, et al. A human gut microbial gene catalogue established by metagenomic sequencing. Nature, 2010, 464(7285): 59-65. DOI:10.1038/nature08821 |
| [2] | NORMAN J M, HANDLEY S A, VIRGIN H W. Kingdomagnostic metagenomics and the importance of complete characterization of enteric microbial communities. Gastroenterology, 2014, 146(6): 1459-1469. DOI:10.1053/j.gastro.2014.02.001 |
| [3] | KAU A L, AHERN P P, GRIFFIN N W, et al. Human nutrition, the gut microbiome and the immune system. Nature, 2011, 474(7351): 327-336. DOI:10.1038/nature10213 |
| [4] | SOMMER F, BÄCKHED F. The gut microbiota—masters of host development and physiology. Nature Reviews Microbiology, 2013, 11(4): 227-238. DOI:10.1038/nrmicro2974 |
| [5] | NICHOLSON J K, HOLMES E, KINROSS J, et al. Hostgut microbiota metabolic interactions. Science, 2012, 336: 1262-1267. DOI:10.1126/science.1223813 |
| [6] | TREMAROLI V, BÄCKHED F. Functional interactions between the gut microbiota and host metabolism. Nature, 2012, 489(7415): 242-249. DOI:10.1038/nature11552 |
| [7] | HOOPER L V, LITTMAN D R, MACPHERSON A J. Interactions between the microbiota and the immune system. Science, 2012, 336(6086): 1268-1273. DOI:10.1126/science.1223490 |
| [8] | KAMADA N, NÚÑEZ G. Regulation of the immune system by the resident intestinal bacteria. Gastroenterology, 2014, 146(6): 1477-1488. DOI:10.1053/j.gastro.2014.01.060 |
| [9] | ROUND J L, MAZMANIAN S K. Inducible Foxp3+ regulatory T-cell development by a commensal bacterium of the intestinal microbiota. Proceedings of the National Academy of Sciences of the USA, 2010, 107(27): 12204-12209. DOI:10.1073/pnas.0909122107 |
| [10] | HOOPER L V, STAPPENBECK T S, HONG C V, et al. Angiogenins: A new class of microbicidal proteins involved in innate immunity. Nature Immunology, 2003, 4(3): 269-273. DOI:10.1038/ni888 |
| [11] | VAISHNAVS S, YAMAMOTO M, SEVERSON K M, et al. The antibacterial lectin Reg Ⅲ gamma promotes the spatial segregation of microbiota and host in the intestine. Science, 2011, 334(6053): 255-258. |
| [12] | LANATA C F, FISCHER-WALKER C L, OLASCOAGA A C, et al. Global causes of diarrheal disease mortality in children < 5 years of age: A systematic review. PLoS One, 2013, 8(9): e72788. DOI:10.1371/journal.pone.0072788 |
| [13] | TATE J E, BURTON A H, BOSCHI-PINTO C, et al. 2008 estimate of worldwide rotavirus-associated mortality in children younger than five years before the introduction of universal rotavirus vaccination programmes: A systematic review and meta-analysis. The Lancet Infectious Diseases, 2012, 12(2): 136-141. DOI:10.1016/S1473-3099(11)70253-5 |
| [14] | PAYNE D C, VINJÉ J, SZILAGYI P G, et al. Norovirus and medically attended gastroenteritis in U.S. children. New England Journal of Medicine, 2013, 368(12): 1121-1130. DOI:10.1056/NEJMsa1206589 |
| [15] | KOO H L, AJAMI N, ATAMAR R L, et al. Noroviruses: The leading cause of gastroenteritis worldwide. Discovery Medicine, 2010, 10(50): 61-70. |
| [16] | AHMED S M, HALL A J, ROBINSON A E, et al. Global prevalence of norovirus in cases of gastroenteritis: A systematic review and meta-analysis. The Lancet Infectious Diseases, 2014, 14(8): 725-730. DOI:10.1016/S1473-3099(14)70767-4 |
| [17] | KOO H L, NEILL F H, ESTES M K, et al. Noroviruses: The most common pediatric viral enteric pathogen at a large university hospital after introduction of rotavirus vaccination. Journal of the Pediatric Infectious Diseases Society, 2013, 2(1): 57-60. DOI:10.1093/jpids/pis070 |
| [18] | BOSCH A, PINTÓ R M, GUIX S. Human astroviruses. Clinical Microbiology Reviews, 2014, 27(4): 1048-1074. DOI:10.1128/CMR.00013-14 |
| [19] | ROSS S R. Mouse mammary tumor virus molecular biology and oncogenesis. Viruses, 2010, 2(9): 2000-2012. DOI:10.3390/v2092000 |
| [20] | KANE M, CASE L K, KOPASKIE K, et al. Successful transmission of a retrovirus depends on the commensal microbiota. Science, 2011, 334(6053): 245-249. DOI:10.1126/science.1210718 |
| [21] | KUSS S K, BEST G T, ETHEREDQE C A, et al. Intestinal microbiota promote enteric virus replication and systemic pathogenesis. Science, 2011, 334(6053): 249-252. DOI:10.1126/science.1211057 |
| [22] | UCHIYAMA R, CHASSING B, ZHANG B, et al. Antibiotic treatment suppresses rotavirus infection and enhances specific humoral immunity. Journal of Infectious Diseases, 2014, 210(2): 171-182. DOI:10.1093/infdis/jiu037 |
| [23] | JONES M K, WATANABE M, ZHU S, et al. Enteric bacteria promote human and mouse norovirus infection of B cells. Science, 2014, 346(6210): 755-759. DOI:10.1126/science.1257147 |
| [24] | BALDRIDGE M T, NICE T J, MCCUNE B T, et al. Commensal microbes and interferon-λ determine persistence of enteric murine norovirus infection. Science, 2015, 347(6219): 266-269. DOI:10.1126/science.1258025 |
| [25] | KERNBAUER E, DING Y, CADWELL K. An enteric virus can replace the beneficial function of commensal bacteria. Nature, 2014, 516(7529): 94-98. |
| [26] | ROBINSON C M, JESUDHASAN P R, PFEIFFER J K. Bacterial lipopolysaccharide binding enhances virion stability and promotes environmental fitness of an enteric virus. Cell Host & Microbe, 2014, 15(1): 36-46. |
| [27] | TAN M, JIANG X. Norovirus and its histo-blood group antigen receptors: An answer to a historical puzzle. Trends in Microbiology, 2005, 13(6): 285-293. DOI:10.1016/j.tim.2005.04.004 |
| [28] | MIURA T, SANO D, SUENAGA A, et al. Histo-blood group antigen-like substances of human enteric bacteria as specific adsorbents for human noroviruses. Journal of Virology, 2013, 87(17): 9441-9451. DOI:10.1128/JVI.01060-13 |
| [29] | ABREU M T. Toll-like receptor signalling in the intestinal epithelium: How bacterial recognition shapes intestinal function. Nature Reviews Immunology, 2010, 10(2): 131-144. DOI:10.1038/nri2707 |
| [30] | MUKHERJI A, KOBⅡTA A, YE T, et al. Homeostasis in intestinal epithelium is orchestrated by the circadian clock and microbiota cues transduced by TLRs. Cell, 2013, 153(4): 812-827. DOI:10.1016/j.cell.2013.04.020 |
| [31] | CARIDADE M, GRACA L, RIBEIRO R M. Mechanisms underlying CD4+ Treg immune regulation in the adult: From experiments to models. Frontiers in Immunology, 2013, 4: 378. |
| [32] | SAKAGUCHI S, WING K, ONISHI Y, et al. Regulatory T cells: How do they suppress immune responses?. International Immunology, 2009, 21(10): 1105-1111. DOI:10.1093/intimm/dxp095 |
| [33] | TAKAHASHI T, KUNIYASU Y, TODA M, et al. Immunologic self-tolerance maintained by CD25+CD4+ naturally anergic and suppressive T cells: Induction of autoimmune disease by breaking their anergic/suppressive state. International Immunology, 1998, 10(12): 1969-1980. DOI:10.1093/intimm/10.12.1969 |
| [34] | THORNTON A M, SHEVACH E M. Suppressor effector function of CD4+CD25+ immunoregulatory T cells is antigen nonspecific. The Journal of Immunology, 2000, 164(1): 183-190. DOI:10.4049/jimmunol.164.1.183 |
| [35] | JUDE B A, POBEZINSKAYA Y, BISHOP J, et al. Subversion of the innate immune system by a retrovirus. Nature Immunology, 2003, 4(6): 573-578. DOI:10.1038/ni926 |
| [36] | BASIC M, KEUBLER L M, BUETTNER M, et al. Norovirus triggered microbiota-driven mucosal inflammation in interleukin 10-deficient mice. Inflammatory Bowel Diseases, 2014, 20(3): 431-443. DOI:10.1097/01.MIB.0000441346.86827.ed |
| [37] | MUMPHREY S M, CHANGOTRA H, MOORE T N, et al. Murine norovirus 1 infection is associated with histopathological changes in immunocompetent hosts, but clinical disease is prevented by STAT1-dependent interferon responses. Journal of Virology, 2007, 81(7): 3251-3263. DOI:10.1128/JVI.02096-06 |
| [38] | SOUZA M, AZEVEDO M S P, JUNG K, et al. Pathogenesis and immune responses in gnotobiotic calves after infection with the genogroup Ⅱ.4-HS66 strain of human norovirus. Journal of Virology, 2008, 82(4): 1777-1786. DOI:10.1128/JVI.01347-07 |
| [39] | TROEGER H, LODDENKEMPER C, SCHNEIDER T, et al. Structural and functional changes of the duodenum in human norovirus infection. Gut, 2009, 58(8): 1070-1077. DOI:10.1136/gut.2008.160150 |
| [40] | KAHAN S M, LIU G, REINHARD M K, et al. Comparative murine norovirus studies reveal a lack of correlation between intestinal virus titers and enteric pathology. Virology, 2011, 421(2): 202-210. DOI:10.1016/j.virol.2011.09.030 |
| [41] | NICE T J, BALDRIDGE M T, MCCUNE B T, et al. Interferonlambda cures persistent murine norovirus infection in the absence of adaptive immunity. Science, 2015, 347(6219): 269-273. DOI:10.1126/science.1258100 |
| [42] | WOBUS C E, KARST S M, THACKRAY L B, et al. Replication of norovirus in cell culture reveals a tropism for dendritic cells and macrophages. PLoS Biology, 2004, 2(12): e432. DOI:10.1371/journal.pbio.0020432 |
| [43] | BOK K, PARRA G I, MITRA T, et al. Chimpanzees as an animal model for human norovirus infection and vaccine development. Proceedings of the National Academy of Sciences of the USA, 2011, 108(1): 325-330. DOI:10.1073/pnas.1014577107 |
| [44] | DUIZER E, SCHWAB K J, NEILL F H, et al. Laboratory efforts to cultivate noroviruses. Journal of General Virology, 2004, 85(1): 79-87. DOI:10.1099/vir.0.19478-0 |
| [45] | POTT J, MAHLAKÕIV T, MORDSTEIN M, et al. IFN-λ determines the intestinal epithelial antiviral host defense. Proceedings of the National Academy of Sciences of the USA, 2011, 108(19): 7944-7949. DOI:10.1073/pnas.1100552108 |
| [46] | ZHANG B Y, CHASSAING B, SHI Z D, et al. Prevention and cure of rotavirus infection via TLR5/NLRC4-mediated production of IL-22 and IL-18. Science, 2014, 346(6211): 861-865. DOI:10.1126/science.1256999 |
 2018, Vol. 44
2018, Vol. 44


