| 秀珍菇不同生长发育阶段蛋白质组学分析 |
2. 杭州市农业科学研究院生物技术研究所,杭州 310024
2. Institute of Biology, Hangzhou Academy of Agricultural Sciences, Hangzhou 310024, China
食用菌的生长发育过程极为复杂,在不同的生长发育阶段受新陈代谢、营养物质合成及转运、细胞分裂及分化、激素调控、信号转导等多个代谢途径的协同作用[1]。了解食用菌的生长发育机制对其遗传育种和栽培技术的研究具有重要指导意义,因此,食用菌尤其是可食用担子菌子实体的形态建成一直是研究的重点。
蛋白质组学技术已经成为当今生命科学领域的研究热点,是生物学中破译基因功能、服务育种程序及提高作物品质的重要途径[2]。目前,蛋白质组学技术在食用菌研究中的应用还处于起步阶段,主要涉及食用菌不同生长发育阶段、不同组织形态阶段等遗传机制和逆境胁迫下差异表达蛋白的研究[3],研究品种主要集中在双孢蘑菇(Agaricusbisporus)[4]、金针菇(Flammulina velutipes)[5]、斑玉蕈(Hypsizigus marmoreus)[6]、灵芝(Ganoderma lucidum)[7]等。而利用蛋白质组学技术开展珍稀食用菌秀珍菇(Pleurotus pulmonarius)的生长发育机制研究尚未见报道。
秀珍菇隶属于担子菌纲、伞菌目、侧耳科、侧耳属,其生长发育过程包含营养生长和生殖生长2个阶段。秀珍菇菌丝体在适宜的养分和环境条件下逐渐达到生理成熟形成原基,并进一步分化成为成熟的子实体[8]。这一系列生理过程除了受栽培环境、基质营养成分等外在因素的影响外,主要还由其自身的遗传因子所决定,即通过调控相关基因的表达来编码蛋白质表达,从而指导完成复杂的生理过程。因此,本文研究了秀珍菇不同生长阶段的差异表达蛋白,探讨了其生长发育过程中菌丝生长、原基形成分化及子实体的建成机制,从而进一步揭示秀珍菇生长发育的分子机制,为加快其遗传育种过程奠定基础。
1 材料与方法 1.1 实验材料供试秀珍菇菌株“台秀5766”由浙江临安鼎新生物科技有限公司提供。4个生长发育阶段,即菌丝体阶段(S1)、原基形成期(S2)、珊瑚期(S3)和子实体成熟期(S4)的秀珍菇均采自杭州市农业科学研究院蔬菜研究所菌种站大棚。菌包基质配方为棉籽壳30%,木屑54%,麸皮15%,石灰1%。
1.2 秀珍菇蛋白的提取及定量称取每个阶段新鲜秀珍菇材料1 g, 在液氮中研磨成细粉,分装入1.5 mL离心管中,加入1 mL蛋白质提取液Ⅰ(含10%三氯乙酸和0.07% β-巯基乙醇的丙酮溶液)沉淀粗蛋白(-20 ℃,1 h),然后于4 ℃、1.3万r/min下离心20 min。再加入相同体积蛋白提取液Ⅱ(含0.07% β-巯基乙醇的丙酮溶液)悬浮粗蛋白(-20 ℃,1 h),然后于4 ℃、1.3万r/min下离心20 min。弃上清液,将沉淀用蛋白提取液Ⅱ悬浮清洗2次(-20 ℃,1 h),真空抽干得粗蛋白粉。准确称取50 mg粉末,加入1 mL裂解液(8 mol/L尿素、10 mmol/L二硫代苏糖醇、2 mmol/L乙二胺四乙酸和1 mmol/L苯甲基磺酰氟)中,振荡混匀,在4 ℃静置1 h, 期间取出振荡3~5次,然后在20 ℃、1.3万r/min下离心15 min, 取上清液。用Bradford法蛋白定量后分装并保存于-80 ℃备用。
1.3 蛋白溶液内酶解与除盐取约100 μg蛋白样本进行酶解:加入10 mmol/L二硫代苏糖醇(Sigma公司,美国),56 ℃还原反应1 h;冷却至室温后,加入50 mmol/L碘乙酰胺(Sigma公司,美国),避光反应45 min;再加入10%三氯乙酸(Sigma公司,美国),4 ℃沉淀2 h;然后用冷丙酮洗后离心得沉淀颗粒,溶于100 mmol/LNH4HCO3中,超声5 min;按酶与蛋白质量比1:50加入胰蛋白酶,37 ℃反应12 h。酶解后的肽段除盐后真空干燥。
1.4 液质鉴定与差异蛋白相对定量分析真空干燥后的肽段用含0.1%甲酸的水溶液复溶至0.5 μg/μL,每组分上样4 μL(约2 μg蛋白)。采用纳升级EASY-nLC 1000液相和Q-Exactive高分辨率质谱联用系统(Thermo Fisher公司,美国)的液相色谱-串联质谱(liquid chromatography-tandem massspectrometry, LC-MS/MS)法对各个时期的样品肽段进行鉴定。流动相A液:含0.1%甲酸的水溶液;B液:含0.1%甲酸的乙腈。线性洗脱梯度(B液):1%~40%,120 min;40%~65%,5 min;65%,保持5 min;65%~1%,1 min;1%,20 min平衡。流速为200 nL/min。Q-Exactive质谱扫描范围为350~1 800(m/z),每个一级谱图自动选择3个最强母离子进行二级扫描。每个时期进行3次生物学重复。
鉴于秀珍菇为非模式生物,基因组序列未完全可知,所以利用分类学上级近缘物种伞菌目(Agaricales)数据库进行同源搜库比对。搜库鉴定软件为Proteome Discoverer 1.4(Thermo Fisher公司,美国),并借助Sieve 2.2软件(Thermo Fisher公司,美国)对差异表达的蛋白谱峰强度加以对比,进行非标记相对定量(P<0.05)
1.5 生物信息学分析利用Uniprot蛋白数据库(http://www.ebi.uniprot.org)对所鉴定到的蛋白质进行基因本体(geneontology, GO)注释,依据蛋白质参与的生物学过程、细胞学组分和分子功能属性,以S1期为对照,对秀珍菇不同生长发育时期出现的差异蛋白分别进行GO分析。利用KEGG网络信号数据库(http://www.genome.jp/kegg/pathway.html)对鉴定到的差异蛋白进行匹配,挖掘秀珍菇在发育过程中由差异蛋白表达变化导致发生改变的重要代谢信号通路(P<0.05)。
2 结果与分析 2.1 不同生长发育阶段秀珍菇的形态学观察秀珍菇菌丝生长期(S1)培养条件为(26±2)℃,避光;待菌丝发满菌袋并后熟培养50 d, 再将菌包在5 ℃下放置12 h, 然后移入温度为(30±2)℃的菇棚,1~2 d后形成原基(S2);经16~20 h进入珊瑚期(S3);再经6~8 h即为秀珍菇子实体成熟期(S4)。取S1、S2、S3和S4期(图 1)生长发育状态良好的样品用作后续实验。
 |
| S1:菌丝生长期;S2:原基形成期;S3:珊瑚期;S4:子实体成熟期。 S1: Mycelium phase; S2: Promordium phase; S3: Coral-like phase; S4: Fruit body phase. 图1 秀珍菇4个生长发育阶段的形态特征 Fig. 1 Morphological characteristics of four different growth phases of Pleurotus pulmonarius |
对秀珍菇4个生长发育阶段的蛋白数进行鉴定。结果(图 2)显示:不同生物学重复间具有很好的重复性;根据每个阶段3次重复实验中至少2次鉴定到同一蛋白的原则,总共同源鉴定到秀珍菇菌丝生长期、原基形成期、珊瑚期和子实体成熟期的蛋白数分别为962、1 165、1 338和1 434个。
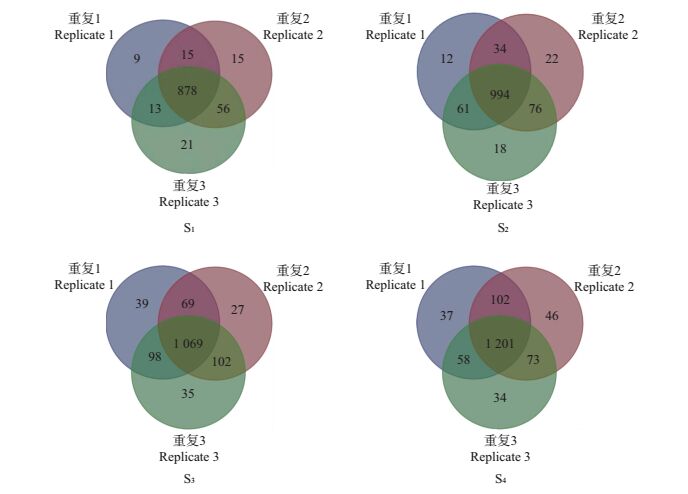 |
| 图2 秀珍菇4个生长发育阶段3次重复实验鉴定到的蛋白数 Fig. 2 Number of proteins identified from four different phases of P.pulmonarius with three biological replicates |
通过Uniprot蛋白注释和Sieve 2.2软件对差异表达的蛋白谱峰强度进行对比和非标记相对定量。结果(表 1)显示,以S1为对照,在S2、S3和S4中鉴定到的差异表达蛋白分别为376、642和692个,分别占鉴定到的蛋白总数的22.1%、37.8%和40.8%。除去重复蛋白数,共有885个蛋白与S1相比至少在1个阶段的差异表达倍数达到1.5倍以上(P<0.05),其中上调表达的蛋白742个,下调表达的蛋白143个;差异表达倍数达3倍以上(P<0.01)且在3次重复实验中(图 2)都被鉴定到的高可信蛋白有46个(附表 1,http://www.zjujournals.com/agr/EN/article/showSupportInfo.do?id=10508)
| 表1 4个生长发育阶段鉴定到的总蛋白及差异蛋白数 Table 1 Number of total identified proteins and differential proteins in four different phases |
 |
| 点击放大 |
从图 3A中可以看出:有789个蛋白在4个生长发育阶段中均被鉴定到,而只在1个阶段中出现的特异表达蛋白共351个,对应到各阶段分别有11、23、136和181个(图 3A,表 2);其中涉及生殖发育和糖类合成的特异表达蛋白数量分别占总特异表达蛋白的23.9%和21.9%。由图 3B可知,大部分蛋白等电点(pI)为4~12,分子质量聚集在10~100 kDa之间。
 |
| A:4个生长发育阶段鉴定到的蛋白数;B:鉴定到的蛋白等电点和分子质量分布情况。 A: Number of identified proteins in four different phases; B: Distribution of isoelectric point and molecular mass of identified proteins. 图3 秀珍菇4个生长发育阶段蛋白质组鉴定概况 Fig. 3 Preliminary proteomic analysis of four different phases of P.pulmonarius |
| 表2 4个生长发育阶段鉴定到的特异表达蛋白数及功能分类 Table 2 Number of specifically expressed proteins and function class in four different phases |
 |
| 点击放大 |
对885个变化1.5倍以上的差异表达蛋白进行GO功能注释发现,在差异表达蛋白参与的相关生物学过程中,分别有26%、20%、15%和11%的蛋白与糖类合成、生殖结构发育、器官合成和蛋白大分子代谢相关(图 4A)。经细胞组分分析发现,差异表达蛋白主要富集在线粒体(29%)、细胞核(15%)和内质网(13%)3大区域(图 4B)。由于大量蛋白质的合成变化往往需要核蛋白复合物、内质网和线粒体的协同作用,因此推测这很可能与秀珍菇原基分化形成子实体过程中大量蛋白质合成变化相关。同时,对差异表达蛋白的分子功能聚类发现,21%的蛋白具有转移酶活性,15%的蛋白具有水解酶活性(图 4C)。
 |
| 图4 秀珍菇885个差异表达蛋白GO功能注释情况 Fig. 4 GO analysis of 885 differentially expressed proteins of P.pulmonarius |
885个变化1.5倍以上的差异表达蛋白不但广泛参与了众多的生物学过程,而且还行使着诸多不同的分子生物学功能。KEGG注释结果表明,差异表达蛋白主要参与了三羧酸循环(图 5)和糖酵解/糖异生途径(图 6)2条代谢通路。可见,这些通路的改变可能对秀珍菇的生长发育过程起着重要作用。
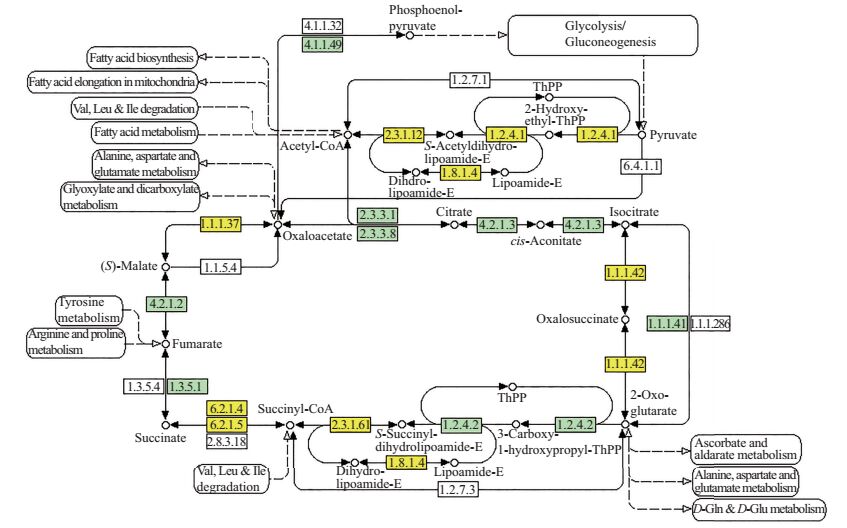 |
| 黄色代表鉴定到的差异表达蛋白。 Yellow box represents differentially expressed protein. 图5 秀珍菇发育过程中差异表达蛋白参与的三羧酸循环 Fig. 5 Differentially expressed proteins of P.pulmonarius involved in the tricarboxylic acid (TCA) cycle |
 |
| 黄色代表鉴定到的差异表达蛋白。 Yellow box represents differentially expressed protein. 图6 秀珍菇发育过程中差异蛋白参与的糖酵解/糖异生途径 Fig. 6 Differentially expressed proteins of P.pulmonarius involved in the glycolysis/gluconeogenesis pathway |
生物体在不同生长发育阶段的蛋白质组会发生变化,这些不同的蛋白质组是构成生物体某一时刻特征性生命活动的基础,是认识生物体生命活动本质的直接途径[9]。蛋白质组学研究旨在建立不同时间与空间的生物组织细胞所有表达蛋白质的动态表达谱,不仅能为生命活动规律提供物质基础,也能为生物体遗传育种提供理论根据和解决途径。通过对不同生长发育阶段食用菌蛋白质组进行比较分析,我们可以找到某些“特定生长发育阶段特异性蛋白质分子”,它们可成为遗传育种的靶向效应蛋白,有利于揭示内外环境对生物机体生长发育的影响机制,在食用菌乃至作物的遗传育种中都具有重要意义。因此,我们运用蛋白质组学技术对秀珍菇生长发育过程中动态变化的蛋白质进行了研究。
本研究对秀珍菇商业菌株“台秀5766”的4个生长发育阶段,即菌丝生长期、原基形成期、珊瑚期和子实体成熟期的样品肽段进行了LC-MS/MS分析,共鉴定到885个具有相对定量信息的差异蛋白,这些差异蛋白的功能主要涉及糖类合成、生殖结构发育、器官合成和蛋白大分子代谢等。本研究还发现,秀珍菇4个生长发育阶段的特异表达蛋白数随着发育进程而增加,且29.3%的特异表达蛋白与生殖发育相关。这说明这些特异表达蛋白很可能参与了秀珍菇子实体生殖器官的形态建成,但其具体生理功能还有待进一步研究。KEGG分析发现,参与三羧酸循环和糖酵解/糖异生途径这2个不同代谢通路的差异蛋白显著富集,提示这些差异蛋白引发的这2条代谢通路的改变可能对秀珍菇的生长发育过程起着重要作用。
本研究还鉴定到在4个生长发育阶段中差异表达的46个高可信蛋白。通过Uniprot蛋白注释发现,近17%的蛋白参与了胞内应激修复过程,包括热休克蛋白70(heat shock protein 70),细胞分裂控制蛋白3(cell division control protein 3),septin基因家族4(spn4)等。其中热休克蛋白70由应激诱导产生,参与胞内应激修复,其主要生物学功能之一是作为分子伴侣,在胞内帮助其他多肽进行正确的折叠、组装、运转和降解[10],可能对秀珍菇子实体的正常发育起着重要作用。研究表明,植物中HSP70的表达受到多种非生物胁迫的诱导,如高温[11]、低温[12]、干旱[13]等,也与植物个体生长发育相关[14-15]。过表达HSP70可提高植物对高温的耐受性已得到研究证实[16]。本研究发现,HSP70在4个生长发育阶段的变化显著,推测可能与秀珍菇不同生长阶段受温度刺激有关。今后可深入研究HSP70基因家族成员的功能,为秀珍菇抗逆品种的选育提供参考。
本研究获得了秀珍菇4个生长发育阶段的差异表达蛋白,以菌丝生长期为对照,将其余3个生长发育阶段共885个差异表达蛋白与之进行了初步比较研究。后续将进一步对相邻阶段的差异表达蛋白进行比较,以及对各阶段特异表达的蛋白质进行筛选和功能验证,并结合秀珍菇对应阶段的转录组学测序分析,开展mRNA和蛋白质在表达量和表达趋势上的相关性研究。本研究初步探讨了秀珍菇菌丝生长、原基形成与分化、子实体成熟的分子机制,逐步解析了秀珍菇生长发育过程中遗传、生理生化等变化规律,对秀珍菇育种及栽培技术研究具有重要的指导意义。
4 结论本研究分析了秀珍菇在生长期、原基形成期、珊瑚期和子实体成熟期4个不同生长发育阶段蛋白质组的表达变化,发现了不同生长发育阶段之间的差异信号响应通路及差异表达蛋白,说明这些差异表达蛋白在秀珍菇子实体形态建成及抵抗不良环境等方面起到了非常重要的作用。本研究结果也为解析秀珍菇生长发育过程中遗传、生理生化及生物学特性等方面的研究提供了参考。这有利于揭示内外环境对秀珍菇机体生长发育的影响,为进一步深入研究秀珍菇机体生长发育机制提供了支撑,也为后续秀珍菇育种及相关栽培技术研究奠定了理论基础。
| [1] |
刘靖宇, 江玉姬, 谢宝贵, 等. 草菇子实体不同成熟阶段的比较蛋白质组学分析. 菌物学报, 2014, 33(1): 55-68. LIU J Y, JIANG Y J, XIE B G, et al. A comparative proteome analysis of Volvariella volvacea fruit-bodies developed at different stages. Mycosystema, 2014, 33(1): 55-68. (in Chinese with English abstract) |
| [2] |
吕晓菡, 方献平, 柴伟国, 等. 辣椒胞质不育系与保持系花药的细胞学和蛋白质组学差异分析. 浙江大学学报(农业与生命科学版), 2015, 41(1): 44-55. LÜ X H, FANG X P, CHAI W G, et al. Comparative analysis of cytology and proteomics in anthers between cytoplasmic male sterile line and its maintainer line of peppers. Journal of Zhejiang University (Agriculture and Life Sciences), 2015, 41(1): 44-55. (in Chinese with English abstract) DOI:10.3785/j.issn.1008-9209.2014.04.242 |
| [3] |
陶永新, 朱坚, 廖剑华. 差异蛋白质组学在食用真菌中的研究进展. 中国农学通报, 2011, 27(14): 55-59. TAO Y X, ZHU J, LIAO J H. Advance in differential proteomics of edible fungi. Chinese Agricultural Science Bulletin, 2011, 27(14): 55-59. (in Chinese with English abstract) |
| [4] |
白雪, 陈兰芬, 宋思扬, 等. 高温诱导双孢蘑菇蛋白质表达变化的分析. 厦门大学学报(自然科学版), 2001, 40(6): 1342-1345. BAI X, CHEN L F, SONG S Y, et al. Analysis of the protein expression of Agaricus bisporus strains after growing at high temperature. Journal of Xiamen University (Natural Science), 2001, 40(6): 1342-1345. (in Chinese with English abstract) |
| [5] | SAKAMOTO Y. Protein expression during Flammulina velutipes fruiting body formation. Mycoscience, 2010, 51(3): 163-169. DOI:10.1007/S10267-010-0032-0 |
| [6] |
胡开辉, 黄桂英, 颜松, 等. 斑玉蕈低温胁迫下菌丝体酶活变化及差异蛋白质组学研究. 菌物学报, 2009, 28(4): 584-590. HU K H, HUANG G Y, YAN S, et al. Differential proteomics and enzyme changes of Hypsizigus marmoreus mycelium under cold stress. Mycosystema, 2009, 28(4): 584-590. (in Chinese with English abstract) |
| [7] |
刘晓云, 苏明声, 杨俊璋, 等. 灵芝子实体原基双向电泳和总蛋白质提取方法的建立. 菌物学报, 2009, 28(6): 802-805. LIU X Y, SU M S, YANG J Z, et al. Two-dimensional electrophoresis and extraction methods of total protein of Ganoderma lucidum primordium. Mycosystema, 2009, 28(6): 802-805. (in Chinese with English abstract) |
| [8] |
黄年来, 林志彬, 陈国良, 等. 中国食药用菌学. 上海: 上海科学技术文献出版社, 2010: 36-50. HUANG N L, LIN Z B, CHEN G L, et al. Chinese Medicinal and Edible Fungi. Shanghai: Shanghai Scientific and Technological Literature Press, 2010: 36-50. (in Chinese with English abstract) |
| [9] |
何大澄, 肖雪媛. 差异蛋白质组学及其应用. 北京师范大学学报(自然科学版), 2002, 38(4): 558-562. HE D C, XIAO X Y. Differential proteomics and its applications. Journal of Beijing Normal University (Natural Science), 2002, 38(4): 558-562. (in Chinese with English abstract) |
| [10] |
朱玉贤, 李毅, 郑晓峰, 等. 现代分子生物学. 4版. 北京: 高等教育出版社, 2013: 146-148. ZHU Y X, LI Y, ZHENG X F, et al. Modern Molecular Biology. 4th ed. Beijing: Higher Education Press, 2013: 146-148. (in Chinese with English abstract) |
| [11] | SRIKANTHBABU V, GANESHKUMAR, KRISHNAPRASAD B T, et al. Identification of pea genotypes with enhanced thermotolerance using temperature induction response technique (TIR). Journal of Plant Physiology, 2002, 159(5): 535-545. DOI:10.1078/0176-1617-00650 |
| [12] | ANDERSON J V, LI Q B, HASKELL D W, et al. Structural organization of the spinach endoplasmic reticulum-luminal 70-kilodalton heat-shock cognate gene and expression of 70-kilodalton heat-shock genes during cold acclimation. Plant Physiology, 1994, 104: 1359-1370. DOI:10.1104/pp.104.4.1359 |
| [13] |
胡秀丽, 李艳辉, 杨海荣, 等. HSP70可提高干旱高温复合胁迫诱导的玉米叶片抗氧化防护能力. 作物学报, 2010, 36(4): 636-644. HU X L, LI Y H, YANG H R, et al. Heat shock protein 70 may improve the ability of antioxidant defense induced by the combination of drought and heat in maize leaves. Acta Agronomica Sinica, 2010, 36(4): 636-644. (in Chinese with English abstract) |
| [14] | JUNGKUNZ I, LINK K, VOGEL F, et al. AtHsp70-15-deficient Arabidopsis plants are characterized by reduced growth, a constitutive cytosolic protein response and enhanced resistance to TuMV. The Plant Journal, 2011, 66(6): 983-995. DOI:10.1111/tpj.2011.66.issue-6 |
| [15] | SU P H, LI H M. Stromal Hsp70 is important for protein translocation into pea and Arabidopsis chloroplasts. The Plant Cell, 2010, 22: 1516-1531. DOI:10.1105/tpc.109.071415 |
| [16] | SCHUERMANN J P, JIANG J W, CUELLAR J, et al. Structure of the Hsp110: Hsc70 nucleotide exchange machine. Molecular Cell, 2008, 31(2): 232-243. DOI:10.1016/j.molcel.2008.05.006 |
 2017, Vol. 43
2017, Vol. 43


