| 中国东部5省猪呼肠孤病毒流行病学调查与分析 |
2. 杭州贝尔塔生物技术有限公司,杭州 310004
2. Hangzhou Belta-Biotechnology Co., Ltd., Hangzhou 310004, China
近年来,新生仔猪腹泻持续在中国爆发,发病仔猪呈现腹泻、呕吐等症状,严重的能导致仔猪迅速脱水、死亡,给养猪产业带来了巨大的经济损失。目前,引起仔猪腹泻的病原还没有完全弄清,各国学者普遍认为猪流行性腹泻病毒(porcine epidemic diarrhea virus, PEDV)[1]主要以猪传染性胃肠炎病毒(transmissible gastroenteritis virus, TGEV)[2]、轮状病毒(rotavirus, RV)[3]等病毒性病原为主导,细菌性病原体和寄生虫参与其中。近年来,一些新发腹泻病毒如猪丁型冠状病毒(porcine deltacoronavirus, PDCoV)[4]、哺乳动物呼肠孤病毒(mammalian orthoreovirus, MRV)[5-11]也受到各国学者的关注。
MRV属于呼肠孤病毒科(Reoviridae)正呼肠孤病毒属(Orthoreovirus)的双链RNA病毒,其基因组由10条分节段的双链RNA组成,根据10个节段大小可分为L(L1,L2,L3)、M(M1,M2,M3)和S(S1,S2,S3,S4)3种类型,是一类能引起人和哺乳动物呼吸道和消化道疾病的病原。自20世纪50年代起,先后在人类[12]、狗[13]、牛[14]、水貂[15]、果子狸[16]、蝙蝠[17-18]等哺乳动物上被分离到。MRV被证实不仅能引起人类出血性肠炎、急性呼吸道感染、脑炎等疾病,还能导致其他哺乳动物如狗、水貂等腹泻。但是,关于猪呼肠孤病毒的研究相对较少,直到近10年,猪呼肠孤病毒才先后在中国、韩国、美国以及欧洲等地的腹泻猪粪便样品中被分离到[5-8, 11, 19]。NARAYANAPPA等[10]用从美国分离到的猪呼肠孤病毒感染新生仔猪,发现仔猪出现严重腹泻,并且死亡率高达100%;LELLI等[20]对牛、猪、马以及狗等的血清进行检测,发现抗呼肠孤病毒中和抗体广泛存在于各种哺乳动物中;KWON等[8]在对韩国78个猪场进行检测时发现,猪呼肠孤病毒样品阳性率达到19%。上述报道说明猪呼肠孤病毒可能广泛流行于各个猪场。但是,目前关于我国猪呼肠孤病毒的流行情况报道还比较少。因此,本研究从核酸和抗体水平对我国东部5个省份多个猪场的猪呼肠孤病毒流行情况进行调查,为全面了解猪呼肠孤病毒在我国的流行情况提供数据支持,同时对该病毒的防控也具有指导意义。
1 材料与方法 1.1 试验材料猪呼肠孤病毒(MRV3-ZJ2013,GenBank登录号:KY419120~KY419129)、大肠埃希菌(Escherichia coli)Rosetta菌株、pET-22b(+)载体,猪流行性腹泻病毒(PEDV)、猪丁型冠状病毒(PDCoV)的阳性血清由笔者之一黄耀伟实验室保存。一步法RT-PCR试剂盒(EasyScript one-step RT-PCR SuperMix kit)、、2×EasyTaq PCR SuperMix酶以及蛋白纯化树脂(ProteinIso Ni-NTA resin)均购自北京全式金公司,限制性内切酶购自美国NEB公司,TRizol购自美国Life公司,核酸仪用病毒RNA提取试剂盒购自西安天隆科技有限公司,四甲基联苯胺(tetramethylbenzidine, TMB)单组分显色液购自北京索来宝公司。
224份腹泻猪粪便样品由2013—2014年从浙江、江西、山东、河南、黑龙江等省共58个猪场收集而来。262份腹泻猪血清样本由2015—2016年从上述5省共25个猪场收集而来,其中86份为母猪血清样本,95份为1周龄仔猪血清样本,81份为3周龄仔猪血清样本。
1.2 猪呼肠孤病毒巢式反转录聚合酶链式反应(reverse transcription-polymerase chain reaction, RT-PCR)检测方法的建立与样品检测 1.2.1 巢式RT-PCR方法建立比对分析报道的猪呼肠孤病毒基因序列,选择L1 基因序列设计巢式PCR检测引物(以MRV3-ZJ2013毒株为准,GenBank登录号:KY419120),由杭州博尚生物有限公司合成。利用TRizol抽提MRV3-ZJ2013毒株的基因组RNA作为模板摸索检测条件。巢式PCR第1轮利用EasyScript One-Step RT-PCR SuperMix试剂盒扩增。反应体系为:10 μL 2×One-Step Reaction Mix、0.4 μL TransScript Ⅱ OneStep Enzyme Mix、2 μL总RNA、正向和反向引物(10 μmol/L)各0.4 μL,加双蒸水至25 μL。反应条件为:50 ℃反转录30 min;94 ℃预变性5 min;94 ℃变性30 s,退火30 s,72 ℃延伸30 s,共扩增35个循环;72 ℃延伸10 min。将上一轮获得的PCR产物稀释100倍作为模板,利用2×EasyTaq PCR SuperMix酶进行第2轮扩增。反应体系为:12.5 μL 2 × EasyTaq PCR SuperMix、1 μL模板、正向和反向引物(10 μmol/L)各0.5 μL,加双蒸水至25 μL。反应条件为:94 ℃预变性5 min;94 ℃变性30 s,退火30 s,72 ℃延伸30 s,共扩增35个循环;72 ℃延伸10 min。在2轮反应中,采用温度梯度PCR摸索最佳退火温度,PCR产物经过1%琼脂糖凝胶电泳鉴定。
1.2.2 临床样本检测将所采集的具有腹泻仔猪粪便拭子用300 μL 1×磷酸盐缓冲液(phosphate buffered saline, PBS)稀释,反复冻融3次后,取100 μL用核酸提取仪NP968(西安天隆科技有限公司)按照天隆科技病毒RNA提取试剂盒说明书提取病毒总RNA。用1.2.1节摸索的最佳条件进行巢式PCR检测,每一轮设置阴性对照和阳性对照,其中阳性对照为MRV3-ZJ2013病毒总RNA。
1.3 基于猪呼肠孤病毒δ1蛋白间接酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA)方法的建立 1.3.1 δ1蛋白原核表达及纯化设计特异性引物扩增S1 基因片段(F:5'-GGA ATTCCATATGGATCCTCGTTTACGTG-3';R:5'-CC CAAGCTTCGTGAAACTGCGTGGATA-3'),经NdeⅠ和HindⅢ双酶切后克隆于pET22b(+)载体中,并转化Rosetta感受态细胞,经菌落PCR筛选出阳性克隆并测序验证。将验证正确的重组菌扩大培养至D (600 nm)等于0.6时,用1 mmol/L异丙基-β-D-硫代半乳糖苷(isopropylthio-β-D-galactoside, IPTG)诱导表达。用Ni-NTA层析柱纯化蛋白,并用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis, SDS-PAGE)检验纯化。
1.3.2 阴性和阳性血清样本筛选由分离MRV3-ZJ2013毒株的猪场提供的具有腹泻症状的20份仔猪血清用于筛选阳性血清,由本实验室自行培育的后备母猪所产的10份仔猪血清用于筛选阴性血清。参考本实验室已建立的方法筛选猪呼肠孤病毒阴性和阳性血清样本[21]。
1.3.3 反应条件优化采用棋盘滴定法,确定最佳的抗原包被浓度、血清稀释度以及二抗稀释度。用碳酸盐包被缓冲液(pH 9.6)2倍梯度稀释δ1蛋白,然后包被不同稀释度蛋白,4 ℃过夜。每孔用300 μL PBS-T洗涤缓冲液(0.01 mol/L PBS,0.05% Tween-20,pH 7.4)洗涤3次,用PBS-T配制的5%脱脂乳37 ℃封闭2 h。将MRV3阳性猪血清按照1:10、1:100、1:200、1:400、1:800、1:1 600稀释后每孔加入100 μL,每组6个重复,并在37 ℃孵育1 h。然后用PBS-T洗涤缓冲液(0.01 mol/L PBS,0.05% Tween-20,pH 7.4)洗涤3次。将按1:1 000、1:2 000、1:4 000、1:5 000、1:8 000、1:10 000等6个梯度稀释的HRP标记的山羊抗猪Ig G以100 μL/孔分别加入上述6个板中,37 ℃孵育30 min。每孔加入100 μL TMB单组分显色液,并于室温孵育15 min。最后每孔加入50 μL 2 mol/L硫酸终止反应,在450 nm波长处读数。上述试验重复3次以确定最佳反应条件。
1.3.4 临界(cut-off)值确定利用构建好的间接ELISA方法测定阴性血清在450 nm波长处的吸光度值,并计算标准差(standard deviation, SD)。临界值为平均值+3SD。收集的血清样本在450 nm波长处的吸光度值若低于临界值则判定为阴性,若等于或者高于临界值则判定为阳性。
1.3.5 间接ELISA检测方法可靠性验证从待检血清样品中随机选取37份测定抗MRV3中和抗体。用DMEM(Dulbecco’ s modified Eagle medium)2倍系列稀释血清样品,每个样品设置12个稀释梯度,每个梯度8个重复。将稀释的血清放入56 ℃水浴锅中灭活30 min。将MRV3-ZJ2013病毒液用维持培养基(maintenance medium, MM)稀释到100 TCID50(50% tissue culture infective dose,半数组织感染剂量)。取100 μL稀释后的病毒与100 μL灭活的各稀释度的血清混合均匀,置于37 ℃孵育1 h后加入到96孔板中,37 ℃孵育2 h。弃上清液,加入添加胰酶的维持培养基(maintenance medium with trypsin, MMT)继续培养72 h。每份血清设3个重复。观察细胞病变并记录,按Reed-Muench法计算血清中和效价。
1.3.6 临床样品检测应用建立的ELISA检测方法,对收集具有腹泻症状的262份猪血清样品进行检测,分别设置阳性和阴性对照。
2 结果 2.1 巢式RT-PCR检测方法的建立针对L1基因共设计3对引物,组合之后进行条件摸索(图 1),最终确定的检测引物如表 1所示。反应条件为第1轮循环数35,熔解温度(tm)=55 ℃,第2轮循环数30,tm=57 ℃。
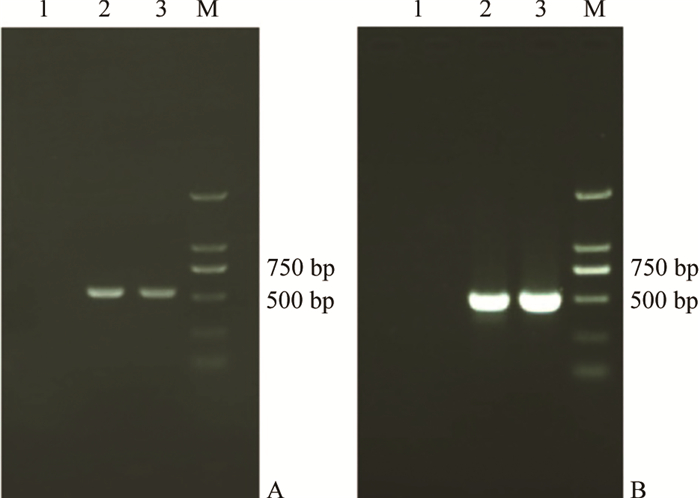 |
| A:第1轮RT-PCR结果(tm=55 ℃);B:第2轮PCR结果(tm= 57 ℃)。泳道(1~3)依次为阴性对照;M:DNA标志物。 A: Result of the 1st round RT-PCR (tm=55 ℃); B: Result of the 2nd round PCR (tm=57 ℃). Lanes 1-3 represent negative control, respectively; M: DNA marker. 图1 巢式RT-PCR检测条件摸索结果 Fig. 1 Electropherogram of the nested RT-PCR product |
| 表1 巢式RT-PCR检测引物 Table 1 Primers of the nested RT-PCR |
 |
| 点击放大 |
对从浙江、江西、山东、河南、黑龙江等5省共58个猪场采集的224份腹泻仔猪粪便样品进行巢式RT-PCR检测。结果(附表1,http://www.zjujournals.com/agr/EN/article/showSupportInfo.do?id=10520)显示:从55个猪场中共检出147个阳性样品,猪场阳性率和样品阳性率分别为94.8%和65.6%,其中第1轮从16个猪场(阳性率为27.5%)中检出阳性样品28个(阳性率为12.5%);从地区来看,不同地区采集样本量不同,样本量最小的是黑龙江省,其阳性率也最高,达75%,浙江省采集的样本量最大,从43个猪场中共采集到159份腹泻样品,其中在41个猪场中检测到猪呼肠孤病毒,样品阳性率达67.9%,且第1轮检出阳性样品的比例也最高,达15.7%(表 2)。
| 表2 各地区样品MRV3检测结果汇总 Table 2 Summary of positive rate of the MRV3 |
 |
| 点击放大 |
参考本实验室已经建立的方法,从20份具有腹泻症状的猪血清中最终筛选到3份阳性血清,结果如图 2所示。同时对初生仔猪血清进行筛选,确定了4份阴性血清。将上述3份阳性血清混合,用于摸索基于δ1蛋白间接ELISA检测方法的最佳条件。最终确定的条件如下:抗原最佳包被量为0.387 ng/孔,血清样品稀释度为1:100,HRP标记的羊抗猪抗体按照1:2 000稀释。间接ELISA检测的临界(cut-off)值为对照组(4份阴性血清)在450 nm波长处的吸光度平均值+3SD,即为0.32。若收集的血清样本在450 nm波长处的吸光度值低于0.32则判定为阴性,若等于或者高于0.32则判定为阳性。
 |
| 图2 阳性血清免疫印迹结果 Fig. 2 Result of Western blot analysis of positive serum |
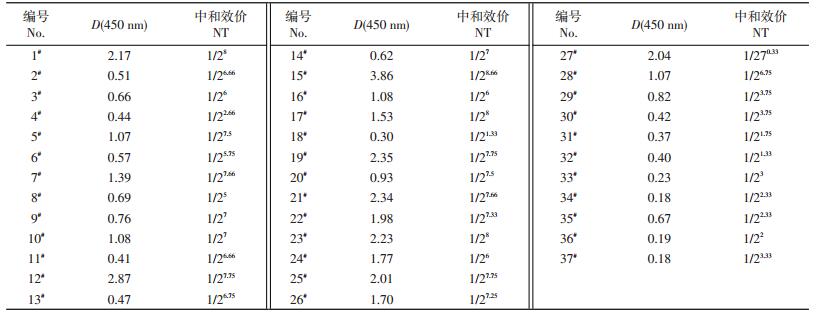
从收集的血清样品中随机选取37份血清样品测定中和效价。经过多次试验认定,中和抗体滴度小于等于4时,无法判断是否由非特异性结合产生干扰。在37份血清样本中,中和抗体效价高于4的有33份(89.2%)。而用建立的间接ELISA方法测定血清样品的阳性率为86.49%(表 3),二者具有较高的一致性,说明建立的间接ELISA方法比较可靠。
| 表3 血清样品在450 nm处的吸光度值和中和抗体效价对比结果 Table 3 Comparison of absorbance value at 450 nm and neutralization antibody titer (NT) of serum samples |
 |
| 点击放大 |
利用建立的间接ELISA对收集的262份血清样品进行检测。结果(表 4)表明:从整体来看,中国东部5省不同年龄段的猪中MRV3抗体阳性率比较高,达到84.4%。从不同年龄段来看,阳性率最高的是1周龄以内仔猪,达到89.5%;最低的是3周龄仔猪,阳性率为75.3%。从地区来看,江西省阳性率最高,达到95.7%;河南省最低,为72.5%。但是在450 nm处的吸光度平均值各省差异不明显,最高的是山东省,而最低的是黑龙江省(图 3)。
| 表4 不同地区不同年龄猪血清样品中MRV3抗体阳性率汇总 Table 4 Summary of antibody positive rates of the MRV3 in pig serum samples of different ages from different regions |
 |
| 点击放大 |
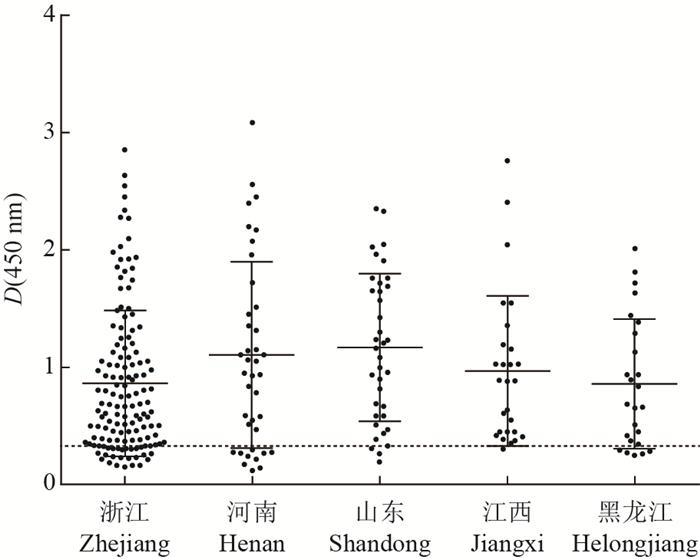 |
| 虚线(--)表示阳性临界(cut-off)值,为0.32。 Positive cut-off value (0.32) for the ELISA is indicated by dotted line (--). 图3 不同地区血清抗体水平散点分布图 Fig. 3 Distribution of σ1-based ELISA results (anti-MRV3 IgG antibodies) among serum samples collected from different regions |
仔猪腹泻一直是困扰全球养猪产业发展的一大难题,对于引起腹泻的病原也存在争议。过去认为,引起仔猪腹泻的病毒性病原主要是PEDV、TGEV、RV以及一些肠道病毒(EV),但是,近年来一些使用过疫苗的猪场仍然再次暴发腹泻疫情,特别是一些新发病原例如PDCoV、MRV,引起了各国学者的注意。
目前针对猪呼肠孤病毒的报道主要集中在基因组分析以及致病性等,对于猪呼肠孤病毒的流行病学调查比较少。谈晨[22]用RT-PCR方法检测了2012年3月到2013年2月从上海、安徽、广西、江苏、浙江、广东、四川、山东、湖北等省共31个规模猪场收集的102份腹泻病料样品,结果显示,猪场阳性率为45.16%,病料样品阳性率为26.47%。KWON等[8]对2004年1月至2005年12月从韩国78个猪场收集的237份2日龄至70日龄腹泻猪粪便样品检测发现,呼肠孤病毒阳性率达到19%。XIAO等[19]利用荧光定量PCR技术检测了2015年4月至5月从美国41个猪场收集的277份腹泻粪便样品,结果显示,从8个猪场中(8/41,19.5%)检测到了16份阳性样品(16/277,5.7%)。本研究针对MRV L1 基因保守区设计引物建立了巢式RT-PCR检测方法。L1 基因编码的λ1蛋白具有RNA依赖的RNA聚合酶活性,在不同血清型呼肠孤病毒之间具有较高的保守性。理论上,针对L1基因保守区设计引物能够检测到不同血清型的呼肠孤病毒。S1基因是呼肠孤病毒基因组中保守性最低的基因,不同血清型MRV中的S1序列差异比较大,因此,针对MRV3 S1基因设计的检测引物可能不能有效地检测到其他血清型MRV。因此,针对L1基因建立的检测方法灵敏性更高。这可能是XIAO等[19]的检测结果明显低于本研究以及其他报道的原因之一。本研究建立的巢式PCR第2轮引物位于第1轮PCR产物内部,而非目的片段包含2套引物结合位点的可能性极小,因此确保了第2轮PCR产物几乎或者完全没有引物配对特异性不强造成的非特异性扩增的污染。因此,相对于KWON等[8]和谈晨[22]针对L1 建立的传统RTPCR方法,本研究建立的检测方法特异性更高。
本研究利用巢氏RT-PCR检测了2013—2014年从浙江、江西、山东、河南、黑龙江等省共58个猪场收集的腹泻样品。结果显示,从55个猪场中检出了147份阳性样品,猪场阳性率和样品阳性率分别为94.8%和65.6%。这说明猪呼肠孤病毒广泛存在于具有腹泻症状的仔猪体内,可能单独或者与其他病原共感染引起腹泻。
本研究还建立了呼肠孤病毒中和抗体测定方法以及以δ1蛋白为包被抗原的间接ELISA检测方法,首次从抗体水平调查了我国猪MRV3流行情况。间接ELISA检测结果显示,在2015—2016年从山东、河南、江西、黑龙江和浙江等省共25个猪场收集到的262份腹泻猪血清样品中,阳性率达84.4%,并且各地区阳性样品率以及在450 nm处的吸光度平均值差异不显著。这从另一角度说明呼肠孤病毒广泛存在于各个猪场中。
间接ELISA检测样品主要来自具有腹泻症状的母猪、1周龄内仔猪以及3周龄仔猪。从不同年龄段来看,1周龄内仔猪样品阳性率最高,母猪次之,3周龄仔猪最低。新生仔猪体内抗体主要是通过奶水从母体获得的母源抗体。因此,我们推测母猪很有可能是仔猪感染的病毒源。到3周龄断奶时母源抗体基本消失,病原入侵时自身免疫系统将会产生免疫应答,这可能是出现上述现象的原因之一。
尽管血清样品和腹泻粪便样品采集时间以及来源有所差异,上述数据不能完全准确反映真实的感染情况,但可以说明猪呼肠孤病毒广泛存在于中国东部5省各猪场中,在实际生产中应该做好该病毒的防控。
| [1] | SONG D, PARK B. Porcine epidemic diarrhoea virus: A comprehensive review of molecular epidemiology, diagnosis, and vaccines. Virus Genes, 2012, 44(2): 167-175. DOI:10.1007/s11262-012-0713-1 |
| [2] | KIM L, HAYES J, LEWIS P, et al. Molecular characterization and pathogenesis of transmissible gastroenteritis coronavirus (TGEV) and porcine respiratory coronavirus (PRCV) field isolates co-circulating in a swine herd. Archives of Virology, 2000, 145(6): 1133-1147. DOI:10.1007/s007050070114 |
| [3] | SANTOS N, HOSHINO Y. Global distribution of rotavirus serotypes/genotypes and its implication for the development and implementation of an effective rotavirus vaccine. Reviews in Medical Virology, 2005, 15(1): 29-56. DOI:10.1002/(ISSN)1099-1654 |
| [4] | JUNG K, HU H, SAIF L J. Porcine deltacoronavirus infection: Etiology, cell culture for virus isolation and propagation, molecular epidemiology and pathogenesis. Virus Research, 2016, 226: 50-59. DOI:10.1016/j.virusres.2016.04.009 |
| [5] |
曾智勇, 郭万柱, 徐志文, 等. 仔猪腹泻粪样中猪呼肠孤病毒的分离鉴定. 畜牧兽医学报, 2007, 38(6): 574-580. ZENG Z Y, GUO W Z, XU Z W, et al. Isolation, identification of porcine reovirus from diarrhea feces of pigs. Acta Veterinaria et Zootechnica Sinica, 2007, 38(6): 574-580. (in Chinese with English abstract) |
| [6] | ZHANG C F, LIU L C, WANG P Z, et al. A potentially novel reovirus isolated from swine in northeastern China in 2007. Virus Genes, 2011, 43(3): 342-349. DOI:10.1007/s11262-011-0642-4 |
| [7] | DAI Y M, ZHOU Q F, ZHANG C W, et al. Complete genome sequence of a porcine orthoreovirus from southern China. Journal of Virology, 2012, 86(22): 12456. DOI:10.1128/JVI.02254-12 |
| [8] | KWON H J, KIM H H, KIM H J, et al. Detection and molecular characterization of porcine type 3 orthoreoviruses circulating in South Korea. Veterinary Microbiology, 2012, 157(3/4): 456-463. |
| [9] |
何小明, 姚火春, 张洪彪, 等. 一株猪源1型呼肠孤病毒的分离及鉴定. 中国兽医科学, 2013, 43(1): 22-29. HE X M, YAO H C, ZHANG H B, et al. Isolation and identification of a strain of porcine reoviruses serotype 1 in China. Chinese Veterinary Science, 2013, 43(1): 22-29. (in Chinese with English abstract) |
| [10] | NARAYANAPPA A T, SOORYANARAIN H, DEVENTHIRAN J, et al. A novel pathogenic mammalian orthoreovirus from diarrheic pigs and swine blood meal in the United States. MBio, 2015, 6(3): e00593-15. |
| [11] | LELLI D, BEATO M S, CAVICCHIO L, et al. First identification of mammalian orthoreovirus type 3 in diarrheic pigs in Europe. Virology Journal, 2016, 13: 139. DOI:10.1186/s12985-016-0593-4 |
| [12] | CHUA K B, VOON K, CRAMERI G, et al. Identification and characterization of a new orthoreovirus from patients with acute respiratory infections. PLoS One, 2008, 3(11): e3803. DOI:10.1371/journal.pone.0003803 |
| [13] | DECARO N, CAMPOLO M, DESARIO C, et al. Virological and molecular characterization of a mammalian orthoreovirus type 3 strain isolated from a dog in Italy. Veterinary Microbiology, 2005, 109(1/2): 19-27. |
| [14] | ANBALAGAN S, SPAANS T, HAUSE B M. Genome sequence of the novel reassortant mammalian orthoreovirus strain MRV00304/ 13, isolated from a calf with diarrhea from the United States. Genome Announcements, 2014, 2(3): e00451-14. |
| [15] | LIAN H, LIU Y, ZHANG S F, et al. Novel orthoreovirus from mink, China, 2011. Emerging Infectious Diseases, 2013, 19(12): 1985-1988. DOI:10.3201/eid1912.130043 |
| [16] | LI Z J, SHAO Y H, LIU C G, et al. Isolation and pathogenicity of the mammalian orthoreovirus MPC/04 from masked civet cats. Infection, Genetics and Evolution, 2015, 36: 55-61. DOI:10.1016/j.meegid.2015.08.037 |
| [17] | HU T S, QIU W, HE B, et al. Characterization of a novel orthoreovirus isolated from fruit bat, China. BMC Microbiology, 2014, 14: 293. DOI:10.1186/s12866-014-0293-4 |
| [18] | YANG X L, TAN B, WANG B, et al. Isolation and identification of bat viruses closely related to human, porcine, and mink orthoreoviruses. Journal of General Virology, 2015, 96(12): 3525-3531. DOI:10.1099/jgv.0.000314 |
| [19] | XIAO C T, MENG X J, OPRIESSNIG T. Prevalence of the novel orthoreovirus 3 (MRV3) in diarrhea cases in US pigs in 2015// 24th International Pig Veterinary Society Congress and 8th European Symposium of Porcine Health Management 2016, Dublin, 2016. Berlin Royal Dublin Society, Dublin, Ireland. |
| [20] | LELLI D, MORENO A, STEYER A, et al. Detection and characterization of a novel reassortant mammalian orthoreovirus in bats in Europe. Viruses, 2015, 7(11): 5844-5854. DOI:10.3390/v7112908 |
| [21] | HUANG Y W, HARRALL K K, DRYMAN B A, et al. Expression of the putative ORF1 capsid protein of Torque teno sus virus 2 (TTSuV2) and development of Western blot and ELISA serodiagnostic assays: Correlation between TTSuV2 viral load and IgG antibody level in pigs. Virus Research, 2011, 158(1/2): 79-88. |
| [22] |
谈晨. 初生仔猪腹泻两种相关病毒分子流行病学调查及病毒分离和鉴定. 南京: 南京农业大学, 2013: 69-77. TAN C. Molecular epidemiological investigation, isolation and identification of two viruses in neonatal piglets with epidemic dirrhea. Nanjing: Nanjing Agricultural University, 2013:69-77. (in Chinese with English abstract) http://cdmd.cnki.com.cn/article/cdmd-10307-1014219167.htm |
 2017, Vol. 43
2017, Vol. 43


