| 勐库大叶种茶树多酚氧化酶粗酶的酶学性质 |
多酚氧化酶(polyphenol oxidase, PPO,EC1.10.3.1)是一种Cu2+辅基结合酶[1],在自然界中通常是以无活性的前体形式定位于质体内囊体中,由核基因编码且由多个核基因控制,其数量、类型在不同物种和品种间均存在差异[2-3]。PPO在茶树生长发育[4-5]和茶叶加工过程[6]中均起着重要作用,是形成发酵茶色泽与香气的关键,其催化产物对茶叶香气[7]、滋味[8-9]有直接影响,催化形成的茶黄素总含量与红茶整体品质及估值呈极显著正相关[10]。
为探究茶树PPO的性质,提升茶叶品质,茶树PPO的分离纯化与性质分析一直以来都受到国内外的关注。研究发现,不同茶树品种的分离纯化方法、最适条件及性质均存在差异,这能在一定程度上解释不同品种茶树的适制性差异。这方面的研究现已涉及福鼎大白、福云6号、乌牛早等诸多茶树品种[11-13],但对遗传信息较原始[14]、适制红茶的云南大叶种PPO的研究尚未见报道。本试验选用云南大叶种代表性品种——勐库大叶种茶树鲜叶为原料,经硫酸铵沉淀获得PPO粗酶,对其酶学性质进行研究,为调节PPO活性和阐明云南大叶种茶树的红茶适制性提供理论依据。
1 材料与方法 1.1 材料勐库大叶种茶树(Camellia sinensis var.assamica cv.Mengku)鲜叶于2016年春季采摘自华中农业大学茶学教学实习基地,采摘规格为一芽二叶。磷酸氢二钠、聚乙烯吡咯烷酮、硫酸铵、脯氨酸、尿素、邻苯二酚、对苯二酚、间苯二酚、焦性没食子酸、亚硫酸钠、抗坏血酸、L-半胱氨酸等均为分析纯,购自国药集团化学试剂有限公司。
1.2 勐库大叶种PPO的制备取茶树鲜叶20 g, 加入3 g聚乙烯吡咯烷酮(PVP)和适量海砂,用60 mL柠檬酸-磷酸盐缓冲液(0.1 mol/L,pH 7.2)冰浴研磨均匀后,于4 ℃冰箱静置浸提12 h。浸提液于4 ℃、9 000 r/min离心40 min后,取上清液,得PPO粗酶液Ⅰ(简称为PPO粗酶Ⅰ)。PPO粗酶液Ⅰ用终质量分数为30%的硫酸铵饱和沉淀3 h后,于4 ℃、9 000 r/min离心30 min, 取上清液;上清液再用终质量分数为80%的硫酸铵饱和沉淀6 h, 然后于4 ℃、9 000 r/min离心30 min, 弃上清液,得沉淀;沉淀用0.02 mol/L磷酸盐缓冲液(pH 7.2)溶解后,于4 ℃、3 500 r/min离心至洗脱液呈淡黄色,上清液经脱盐浓缩后,得到勐库大叶种PPO粗酶液Ⅱ(简称为PPO粗酶),为本文研究对象。
1.3 PPO酶活性与蛋白质含量测定 1.3.1 PPO活性测定方法取10 μL酶液于酶标板中,加入50 μL柠檬酸-磷酸盐缓冲液(0.1 mol/L,pH 5.6)和75 μL酶反应混合液[m(0.1 mol/L柠檬酸-磷酸盐缓冲液):m(0.1%脯氨酸):m(1%邻苯二酚)=10:2:3,现配现用],置于37 ℃恒温水浴锅中反应30 min后,立即加入50μL 6 mol/L尿素终止反应,置于酶标仪中于410 nm下测定吸光度值。对照组中加入煮沸10 min的酶液代替。在本试验条件下,将反应液的吸光度值每分钟增加0.001定义为1个酶活力单位,U。
1.3.2 PPO蛋白浓度测定方法依照BRADFORD法[15],使用蛋白定量试剂盒(上海碧云天生物试剂有限公司)进行蛋白含量测定。取10 μL酶液于酶标板中,依次加入10 μL磷酸盐缓冲液(0.05 mol/L,pH 7.2)、200 μL G250染色液(0.01%),室温反应10 min, 置于酶标仪中于595 nm下测定吸光度值。以牛血清蛋白(BSA)为标样制作蛋白标准曲线,吸光度值与蛋白质浓度成正比。
1.4 不同反应条件对PPO活性影响试验 1.4.1 不同pH值对PPO活性影响试验依照1.3.1节的方法测定PPO酶活性,其中酶反应缓冲液分别选用pH值为4.0、4.4、4.8、5.2、5.6、6.0、6.4、6.8、7.2、7.6、8.0的0.1 mol/L柠檬酸-磷酸盐缓冲液。将测得的最大单位酶活力值记为100%,计算其他反应pH下的PPO相对酶活力。
1.4.2 不同反应温度对PPO活性影响试验依照1.3.1节的方法测定PPO酶活性,其中反应温度分别设置为20、25、30、35、37、40、45、50、55、60 ℃。将测得的最大单位酶活力值记为100%,计算其他反应温度下的PPO相对酶活力。
1.4.3 不同底物对PPO活性影响试验依照1.3.1节的方法测定PPO酶活性,其中底物分别为邻苯二酚、对苯二酚、间苯二酚和焦性没食子酸溶液,各底物浓度设置为4、12、16、20、24、30 mmol/L。
1.4.4 PPO动力学常数测依照1.3.1节的方法测定PPO酶活性,其中反应底物分别选用反应体系中终浓度分别为4、12、16、20、24、30 mmol/L的邻苯二酚、焦性没食子酸溶液。作反应底物浓度与单位酶活力的双倒数图,根据斜率公式计算米氏常数(Km)和最大单位酶活力(Vmax)值。
1.4.5 抑制剂对PPO活性影响试验依照1.3.1节的方法测定PPO活性,其中缓冲液分别选用含有乙二胺四乙酸二钠(EDTA-2Na)、亚硫酸钠、抗坏血酸(Vc)、L-半胱氨酸、柠檬酸(各抑制剂在缓冲液中的终浓度分别设置为0、0.05、0.10、0.20、0.50、1.00 mmol/L)的0.1 mol/L柠檬酸-磷酸盐缓冲液(pH 5.6)。以未加抑制剂条件下的酶样品单位酶活力值记为100%,计算添加不同浓度抑制剂的PPO相对酶活力。
1.4.6 金属离子对PPO活性影响试验依照1.3.1节的方法测定PPO酶活性,其中缓冲液分别选用含有Na+、K+、Cu2+、Mg2+(各金属离子在缓冲液中的终浓度分别设置为0、0.05、0.10、0.50、1.00、5.00、10.00 mmol/L)的0.1 mol/L柠檬酸-磷酸盐缓冲液(pH 5.6)。以未加金属离子条件下的酶样品单位酶活力值记为100%,计算添加不同浓度金属离子的PPO相对酶活力。
1.5 数据分析所有数据均是3次重复试验的平均值,误差线表示3次重复试验的标准偏差。使用SPSS 18.0对试验数据进行方差分析和显著性检验。
2 结果与分析 2.1 勐库大叶种茶树PPO粗酶的制备经匀浆浸提法提取勐库大叶种茶树PPO后,分别以终质量分数为30%、80%的硫酸铵对其进行沉淀和脱盐浓缩,得到PPO粗酶液Ⅱ(后简称为PPO粗酶)。由表 1可看出,经硫酸铵沉淀后,总酶活虽略有降低,但比活力和纯化倍数依次升高。总酶活回收率为70.71%,表明制备获得大部分勐库大叶种PPO。经测定,PPO粗酶的单位酶活为3 493.33 U/mL,比活力为5 744.26 U/mg。
| 表1 勐库大叶种茶树PPO纯化结果 Table 1 Purification of PPO isolated from Camellia sinensis var.assamica cv.Mengku |
 |
| 点击放大 |
在不同pH值的缓冲液中测定勐库大叶种PPO粗酶的活性。结果(图 1)显示:当pH为4.4时,PPO酶活性达到最大值;当pH降为4.0时,PPO相对酶活性为90.48%,极显著低于pH 4.4时的活性(P<0.01);当pH从4.4逐渐增加到8.0时,PPO酶活性逐渐下降,且相互之间均存在统计学上的极显著差异(P<0.01)。COGGON等[11]测得美国立顿茶园的茶树鲜叶PPO粗酶最适pH为5.7;赵淑娟等[16]测得槠叶齐茶树PPO粗酶的最适pH为5.6;孙慕芳等[17]测得信阳群体种茶树PPO粗酶的最适pH为5.5。以上的茶树PPO最适pH均大于5.0,而在本试验中,勐库大叶种茶树PPO粗酶的最适pH呈偏酸性(pH4.4),与这些报道存在明显差异。结合红茶发酵叶pH值逐渐降低的变化趋势[18],这可能是导致云南大叶种在茶树品种特性、茶类适制性等方面区别于其他茶树品种的内在原因之一。
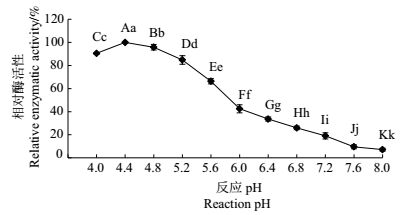 |
| 短栅上的不同大写和小写字母分别表示在P<0.01和P<0.05水平差异有统计学意义。 Different uppercase letters and lowercase letters above barsrepresent statistically significant differences at the 0.01 and 0.05probability levels, respectively. 图1 勐库大叶种茶树PPO粗酶在不同反应pH值下的相对酶活性 Fig. 1 Relative enzymatic activity of crude PPO under differentreaction pH values |
在不同反应温度下测定勐库大叶种PPO粗酶的活性,结果见图 2。从中可知:在反应温度从20 ℃增至60 ℃的过程中,PPO粗酶的相对酶活性整体呈现出先增大后减少的变化趋势,且在37 ℃时的相对酶活性最高;当反应温度由20 ℃升至30 ℃过程中,PPO相对酶活性由51.00%逐渐增至63.47%,相互间差异有统计学意义(P<0.05);反应温度从30 ℃上升到35 ℃时,PPO相对酶活性由63.47%陡然增至97.70%,相互之间在统计学上有极显著差异(P<0.01);在35~40 ℃之间,PPO相对酶活性保持稳定,且相互间无显著差异(P>0.05);当反应温度升高到45 ℃时,PPO相对酶活性呈现极显著的下降(P<0.01);之后随反应温度的上升,PPO相对酶活性均表现为极显著的下降(P<0.01);至反应温度为55 ℃和60 ℃时,PPO粗酶的相对酶活性分别降至35.97%和16.89%。茶树PPO的最适反应温度随品种与生长条件的不同而各有差异:槠叶齐茶树PPO的最适反应温度为50 ℃[16];信阳群体种茶树PPO的最适反应温度为35~40 ℃[17];以采自四川同一茶园的名山131、福鼎大白茶、福选9号、乌牛早和平阳特早为酶源制得的PPO最适反应温度均为45 ℃[19]。由此可见,云南大叶种PPO粗酶最适反应温度与信阳群体种相似,但低于其他很多茶树品种的PPO最适反应温度。
 |
| 短栅上的不同大写和小写字母分别表示在P<0.01和P<0.05水平差异有统计学意义。 Different uppercase letters and lowercase letters above barsrepresent statistically significant differences at the 0.01 and 0.05probability levels, respectively. 图2 勐库大叶种茶树PPO粗酶在不同反应温度下的相对酶活性 Fig. 2 Relative enzymatic activity of crude PPO at different reaction temperatures |
选择邻苯二酚、对苯二酚、间苯二酚和焦性没食子酸为反应底物,分别以不同浓度进行酶反应,测得勐库大叶种PPO粗酶的酶活性。结果(图 3)表明:以对苯二酚和间苯二酚为底物时,在较高底物浓度(30 mmol/L)条件下PPO粗酶的单位酶活仍旧很低,接近于0;而以邻苯二酚和焦性没食子酸为反应底物时,均能在较低的底物浓度时就显现出较高的单位酶活力,其中当底物浓度为4 mmol/L时,PPO粗酶的单位酶活分别为492.22 U/mL和1 030.00 U/mL。纯化自碧螺春鲜叶原料的PPOⅠ对上述底物均有催化活性,而其PPOⅡ对对苯二酚无催化能力[13];凤庆PPOⅠ和PPOⅡ对上述底物及没食子酸均表现出催化活性[20];纯化自土耳其黑海地区茶叶的PPO对邻苯二酚、4-甲基邻苯二酚和焦性没食子酸均有催化活性,而对没食子酸无催化活性[12];纯化自白毫早[21]、龙井43[22]、福云6号[23]、乌牛早等[19]茶树品种的PPO均能以邻苯二酚为底物进行催化反应。这表明来自不同茶树品种的PPO对底物具有选择性,而这种催化活性差异可能会对各茶树品种的适制性产生影响。
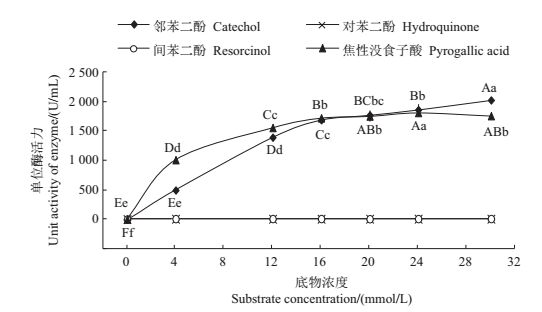 |
| 短栅上的不同大写和小写字母分别表示在P<0.01和P<0.05水平差异有统计学意义。 Different uppercase letters and lowercase letters above bars represent statistically significant differences at the 0.01 and 0.05 probability levels, respectively. 图3 勐库大叶种茶树PPO粗酶在不同底物条件下的相对酶活性 Fig. 3 Relative enzymatic activity of crude PPO under different substrate conditions |
依据勐库大叶种PPO对底物的选择性(图 3),分别以邻苯二酚、焦性没食子酸为底物,以双倒数作图法测定勐库大叶种PPO粗酶的酶动力学常数(Km)。结果(图 4)表明:以邻苯二酚为底物时,Km为36.5 mmol/L,Vmax为5 000 U/mL;以焦性没食子酸为底物时,Km为4.2 mmol/L,Vmax为2 000 U/mL。根据Vmax/Km比值,勐库大叶种PPO粗酶对焦性没食子酸的Vmax/Km大于邻苯二酚,表明其对底物焦性没食子酸具有更好的催化效果。以邻苯二酚为底物时,信阳群体种PPO酶的Km为140.6 mmol/L[17],凤庆PPOⅠ和Ⅱ的Km分别为4.424和3.457 mmol/L,Vmax(单位时间内在460 nm波长处的吸光度值)分别为0.146和0.305[20],而龙井43号PPOⅡ的Km和Vmax(单位时间内在460 nm波长处的吸光度值)分别为13.05 mmol/L和0.019[24],龙井43号PPOⅠ和Ⅲ的Km分别为91.34和51.65 mmol/L[22];以焦性没食子酸为底物时,凤庆PPOⅡ的Km为3.455 mmol/L,Vmax(单位时间内在460 nm波长处的吸光度值)为0.291[20]。这说明同一种PPO对不同底物的亲和力不同,PPO与某一底物间的亲和力与酶源及同工酶构成有关。
 |
| 图4 勐库大叶种茶树PPO粗酶催化不同底物的双倒数关系图 Fig. 4 Double reciprocal plots of crude PPO using catechol andpyrogallic acid as substrate |
在0~1.00 mmol/L浓度范围内,不同抑制剂对勐库大叶种PPO粗酶活性的影响如图 5所示。从中可知:在0~1.00 mmol/L浓度范围内,尽管柠檬酸浓度的增加使PPO活性略微增加,但其影响未达统计学上的显著水平(P>0.05)。随着EDTA-2Na浓度的增加,PPO相对酶活性呈显著下降的趋势(P<0.05),但当浓度高达1.00 mmol/L时,相对酶活性依然维持在96.36%(抑制率仅为3.64%)。PPO相对酶活性随着亚硫酸钠、抗坏血酸、L-半胱氨酸浓度的增加,均呈现出显著下降的趋势(P<0.05),其中:当亚硫酸钠浓度增加到0.50 mmol/L时,已测不出PPO相对酶活性;当抗坏血酸浓度为0.50 mmol/L时,PPO相对酶活性仅剩27.22%,当浓度为1.00 mmol/L时则仅剩1.66%;当L-半胱氨酸浓度为0.20 mmol/L时,PPO相对酶活性仅剩39.47%,而当浓度为0.50 mmol/L时仅剩12.87%。由此可见,亚硫酸钠和L-半胱氨酸对勐库大叶种PPO酶活性抑制最强,其次为抗坏血酸,而EDTA-2Na和柠檬酸在本试验条件下对PPO酶活性的影响相对较小。
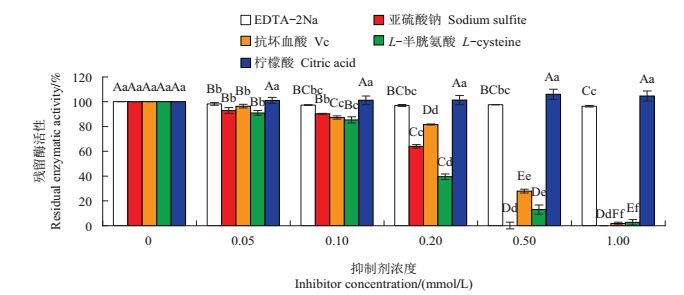 |
| 短栅上的不同大写和小写字母分别表示不同浓度的同种抑制剂之间在P<0.01和P<0.05水平差异有统计学意义。 Different uppercase letters and lowercase letters above bars represent statistically significant differences at different concentrations of the sameinhibitor at the 0.01 and 0.05 probability levels, respectively. 图5 不同抑制剂对勐库大叶种茶树PPO粗酶活性的影响 Fig. 5 Effects of different concentrations of inhibitors on the activities of crude PPO |
赵淑娟等[16]研究发现,当抗坏血酸、亚硫酸钠和L-半胱氨酸的添加量分别达到0.2、0.3、0.4 mmol/L时,均可完全抑制槠叶齐茶树PPO的活性;虞昕磊[20]在研究不同抑制剂对凤庆茶树PPO同工酶活性的影响时发现,抗坏血酸的抑制效果强于亚硫酸钠;陈昌辉等[19]研究发现,添加相同浓度的抗坏血酸、EDTA和NaCl均能抑制名山131、福鼎大白茶等5种茶树PPO的活性,且抗坏血酸的抑制效果最佳;许雷[22]研究发现,当抗坏血酸和L-半胱氨酸的添加量为0.1 mmol/L时可完全抑制龙井43号PPOⅠ的活性,而当亚硫酸钠的添加量为0.2 mmol/L时才能达到相同的抑制效果。上述研究结果与本试验得到的结果存在一定差异,说明抑制剂对不同PPO酶活性的抑制效果存在差异。这可能是由于不同来源的PPO及不同PPO同工酶的蛋白质结构不同,使得各抑制剂的作用效果存在差异。
2.7 金属离子对PPO粗酶活性的影响在不同金属离子浓度下,勐库大叶种PPO粗酶活性的变化情况如图 6所示。从中可知:随Na+浓度的增加,PPO酶活显著下降(P<0.05),但当Na+浓度高达10.00 mmol/L时,PPO相对酶活性依然有78.68%。随K+、Mg2+浓度的增加,PPO酶活均呈现出整体增加的趋势,且不同Mg2+浓度间的PPO活性在统计学上无显著差异(P>0.05),但不同K+浓度间的PPO活性大多具有显著差异(P<0.05)。当Cu2+浓度在0~1.00 mmol/L之间时对PPO酶活性无显著影响,但达到5.00 mmol/L和10.00 mmol/L时,PPO酶活性极显著地增加了142.19%和172.85%(P<0.01)。以往的研究显示:在0.1~10.0 mmol/L浓度范围内,Na+、K+均能对碧螺春PPOⅠ、PPOⅡ产生不同程度的抑制作用,Cu2+能抑制碧螺春PPOⅠ的活性,但对碧螺春PPOⅡ活性有促进作用,Mg2+也对碧螺春PPOⅡ活性有促进作用[13];在0.1~1.5 mmol/L浓度范围内,Na+能显著抑制茄子的PPO活力,而2.0~4.0 mmol/L的Cu2 +则对茄子PPO活性有促进作用,0.5~4.0mmol/L的Mg2+使茄子PPO活性有所增加,但各数值间无显著差异[25];在0~3.0×10-4 mmol/L浓度范围内,添加Cu2+对凤庆PPOⅠ、PPOⅡ活力的影响呈钟形变化,其酶活性分别在Cu2+浓度为1.0×10-4、0.5×10-4 mmol/L时达到最高[20]。这说明部分金属离子可对PPO酶活性产生促进或抑制作用,其中Na+、K+和Mg2+对PPO酶活性的影响规律在不同品种间表现出较高的一致性,但其影响程度随PPO来源及PPO同工酶的不同而有所差异。
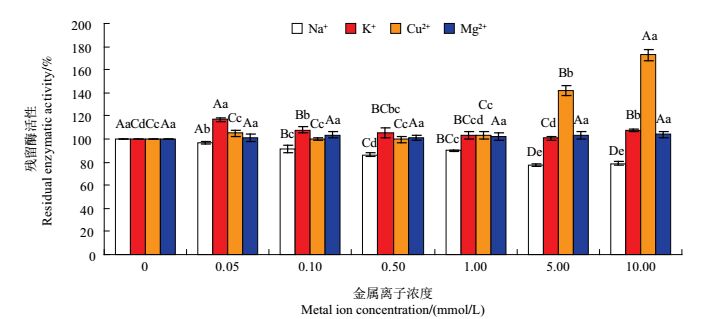 |
| 短栅上的不同大写和小写字母分别表示不同浓度的同种金属离子之间在P<0.01和P<0.05水平差异有统计学意义。 Different uppercase letters and lowercase letters above bars represent statistically significant differences at different concentrations of the samemetal ion at the 0.01 and 0.05 probability levels, respectively. 图6 不同金属离子对勐库大叶种茶树PPO粗酶活性的影响 Fig. 6 Effects of different concentrations of metal ions on the activities of crude PPO |
本试验发现勐库大叶种PPO粗酶的最适反应pH为4.4,酶活力在酸性条件下整体上较碱性条件下高。通过对比前人的研究可以发现,不同品种间茶树PPO的最适pH存在差异[11,16-17],这很可能是产生不同品种适制性的原因。在红茶渥红发酵过程中,发酵叶的pH值整体呈现降低的趋势[18],本研究勐库种茶树PPO的最适pH偏酸性意味着其更易适应红茶发酵过程中pH降低的变化,从而在发酵过程中易保持较高的酶活性,促进渥红发酵,因此勐库种茶树更适制红茶。徐斌[26]的研究表明,偏酸性条件更利于与红茶品质相关的茶黄素的形成,且茶黄素在酸性条件下更稳定。勐库大叶种茶树适制红茶可能与其PPO的最适pH偏酸性有关。我们已有的研究结果表明,勐库大叶种茶树PPO在偏酸性下更有利于催化合成酯型茶黄素[27],这也可能是云南大叶种适制红茶的根本原因。适制绿茶的品种如龙井43号[24]、碧螺春[13]、乌牛早[19]的最适pH分别为6.0、6.5和8.6,明显高于勐库大叶种茶树PPO的最适pH,这也较好地支持了这一推断。在茶树PPO粗酶中存在多条PPO同工酶,其最适pH会受到同工酶的数量、比例及性质的影响。本课题组以往的研究[28]发现,龙井43号的PPO粗酶在pH 5.2和8.0下有2个酶活力峰值,但其分离得到的同工酶PPOⅢ-2和PPO Ⅴ-3的最适pH均为4.4,表明PPO粗酶的最适pH并非其内含同工酶最适pH的简单加成,两者间可能存在更为复杂的联系,有待于深入探讨。
3.2 PPO的最适反应温度发酵是红茶品质特征成分形成的关键时期,而PPO在这一过程中起了重要作用[29]。发酵温度的变化能对PPO活性进行调控,进而影响红茶品质的形成。本试验测得勐库种茶树PPO粗酶的最适反应温度为37 ℃,在反应温度为35~45 ℃时的相对酶活均高于94%,在反应温度为25~30 ℃时的相对酶活约60%。在传统的红茶生产中发酵时的叶温一般控制在30 ℃,气温一般为24~25 ℃[30],此时勐库种茶树PPO的活性较为适宜,不会因酶活性过高而导致茶黄素含量的降低和茶褐素的大量累积[31],且与红茶品质呈正相关的茶黄素和茶红素都能够较多地生成与保存[32]。提取自福鼎大白茶、乌牛早等茶树品种的PPO的最适反应温度均高于37 ℃,在反应温度为25 ℃时的相对酶活较低[19],因此,在25 ℃下发酵可能会因PPO活性过低而影响茶黄素[28]、香气物质等红茶品质成分[32]的形成。这可能是勐库种茶树鲜叶的红茶适制性优于其他品种茶树鲜叶的原因之一。
3.3 PPO的蛋白结构推测本试验发现亚硫酸钠对勐库大叶种PPO粗酶的抑制作用最强,而大多数研究都显示抗坏血酸对PPO的抑制效果最佳,优于亚硫酸钠[13,16,20,22,33]。抗坏血酸和亚硫酸钠对PPO的抑制机制不同:前者是抗氧化剂,主要通过降低氧含量来抑制酶促反应,也能将醌还原成酚从而抑制PPO的活力[19];后者能还原PPO活性中心的Cu2+,使其失活,同时能与邻醌发生不可逆的加成反应[23],抑制酶活性。基于其抑制机制的差异性,结合本试验结果,我们推测勐库种茶树由于在进化上保留了茶树原始特性[14],其携带的PPO编码基因可能与其他茶树品种差异较大,具体表现为勐库大叶种PPO蛋白比其他酶源的PPO蛋白存在更多可与亚硫酸钠以共价键结合的必需基团,或其活性中心的Cu2+辅基相对较少,使得亚硫酸钠对其抑制效果更强。而勐库大叶种PPO的蛋白质结构是否与其他品种茶树PPO存在较大差异,以及是否具有一定的规律性等问题,都值得进一步研究。
3.4 Cu2+对PPO活性的影响PPO的活性中心含有Cu2+,一般认为Cu2+是影响茶树PPO活性的重要因素[13,20,22,24]。在本试验中,EDTA-2Na、亚硫酸钠等抑制剂都可有效抑制勐库大叶种PPO粗酶活性,其中EDTA-2Na可通过与PPO的辅基Cu2+螯合来实现对PPO粗酶的抑制[19],而亚硫酸钠可通过将Cu2+还原为Cu+来抑制PPO粗酶的活性[23],其抑制机制都涉及与辅基Cu2+的相互作用,表明Cu2+与茶树PPO活性息息相关。张书芹[24]以龙井43号PPO同工酶为研究对象,发现当添加的Cu2+浓度为0.25×10-4 mmol/L时PPOⅡ活性最高,之后酶活性随添加的Cu2+浓度的增加而呈波动状态减小;虞昕磊[20]以凤庆PPO同工酶为研究对象,发现PPOⅠ和PPOⅡ分别在Cu2+浓度为0.50×10-4、1.00×10-4 mmol/L时的活力最大,之后随浓度的增加同样呈波动状态降低。两者都认为添加Cu2+对PPO活性的影响表现为低浓度促进、高浓度抑制。陈盛虎[28]在探究Cu2+对龙井43号PPO同工酶活性的影响时发现,Cu2+浓度在0.1~10 mmol/L时,酶活力随浓度增加依次增大,当Cu2+浓度超过25 mmol/L后开始出现抑制作用,这与本试验结果基本吻合,但与张书芹[24]和虞昕磊[20]的结果存在差异。由此推测:Cu2+对PPO活性的影响可能是随Cu2+浓度的增大表现出先增后降交替出现的波动式的变化趋势;Cu2+除了与PPO催化活性中心结合外,还可能与底物或PPO的其他部分结合来抑制酶活性,而这2种结合方式应该都是可逆的,且存在竞争关系,有待进一步的验证。
4 结论相较于其他品种的茶树PPO,勐库大叶种茶树PPO粗酶的最适反应pH和最适反应温度均较低,有利于茶黄素和茶红素等成分的形成与积累,这可能与勐库大叶种茶树适制红茶的特性有关。勐库大叶种茶树PPO粗酶对焦性没食子酸的催化活性大于邻苯二酚,而对对苯二酚和间苯二酚几乎没有催化活性。勐库大叶种茶树PPO粗酶的最有效抑制剂为亚硫酸钠,而前人提取自槠叶齐、碧螺春、龙井43号等茶树品种PPO粗酶的最有效抑制剂均为抗坏血酸。在本研究中,Na+、K+和Mg2+对勐库大叶种茶树PPO粗酶活性的影响与前人的研究结果高度一致,其中Na+表现出抑制作用,K+和Mg2+则表现出不同程度的促进作用。在本试验中,Cu2+对勐库大叶种茶树PPO粗酶活性有极强的促进作用,但综合本课题组以往的研究结果发现,添加Cu2+对勐库大叶种茶树PPO粗酶活性的影响与剂量的选择存在一定联系。不同茶树品种PPO酶学特性的差异可能是导致品种适制性的原因之一,这可能与其蛋白质结构相关。本文对勐库大叶种茶树PPO酶学特性的研究,有利于更好地对PPO活性进行调控,从而为红茶生产中的品质控制与茶黄素体外制备的条件优化提供理论依据。
| [1] |
马惠民, 刘琨, 钱和, 等. 茶叶中多酚氧化酶的特性. 食品工业, 2012, 33(11): 151-154. MA H M, LIU K, QIAN H, et al. The characterization of tea polyphenol oxidase (PPO). The Food Industry, 2012, 33(11): 151-154. (in Chinese with English abstract) |
| [2] |
杨昭, 何春兰, 黄佳佳, 等. 巴西蕉多酚氧化酶的基因克隆及序列分析. 安徽农学通报, 2016, 22(11): 23-27. YANG Z, HE C L, HUANG J J, et al. Cloning and sequencing of the Brazilian banana polyphenol oxidase. Anhui Agricultural Science Bulletin, 2016, 22(11): 23-27. (in Chinese with English abstract) DOI:10.3969/j.issn.1007-7731.2016.11.012 |
| [3] |
张洁. 魔芋多酚氧化酶基因的克隆与序列分析. 重庆: 西南大学, 2014: 5-21. ZHANG J. Cloning and sequence analysis of polyphenol oxidase of Amorphophallus. Chongqing: Southwest University, 2014:5-21. (in Chinese with English abstract) http://cdmd.cnki.com.cn/Article/CDMD-10635-1014260664.htm |
| [4] | YANG Z W, DUAN X N, JIN S, et al. Regurgitant derived from the tea geometrid Ectropis obliqua suppresses wound-induced polyphenol oxidases activity in tea plants. Journal of Chemical Ecology, 2013, 39(6): 744-751. DOI:10.1007/s10886-013-0296-x |
| [5] | UPADHYAYA H, PANDA S K, DUTTA B K. Variation of physiological and antioxidative responses in tea cultivars subjected to elevated water stress followed by rehydration recovery. Acta Physiologiae Planttarum, 2008, 30(4): 457-468. DOI:10.1007/s11738-008-0143-9 |
| [6] |
夏涛, 童启庆. 红茶制造中多酚氧化酶和过氧化物酶的变化与调控. 蚕桑茶叶通讯, 1995(4): 6-9. XIA T, TONG Q Q. Changes and regulation of polyphenol oxidase and peroxidase during the black tea manufacture. Newsletter of Sericulture and Tea, 1995(4): 6-9. (in Chinese with English abstract) |
| [7] |
李远志. 茶叶中多酚氧化酶的性质及其在茶叶加工中的作用. 食品科学, 1988, 9(11): 5-8. LI Y Z. Properties of polyphenol oxidase in tea and its application in tea processing. Food Science, 1988, 9(11): 5-8. (in Chinese with English abstract) |
| [8] |
刘政权. 多酚氧化酶体外氧化技术优化速溶红茶品质的工艺研究. 北京: 中国农业科学院, 2012: 9-37. LIU Z Q. Studies on the technology to optimize the quality of instant black tea by in-vitro oxidation with polyphenol oxidase. Beijing: Chinese Academy of Agricultural Sciences, 2012:9-37. (in Chinese with English abstract) http://cdmd.cnki.com.cn/Article/CDMD-82101-1012418901.htm |
| [9] |
熊昌云, 彭远菊. 红茶色素与红茶品质关系及其生物学活性研究进展. 西南农业学报, 2006, 19(增刊1): 518-520. XIONG C Y, PENG Y J. The relation between the pigment and quality of black tea and research advance of its biological activity. Southwest China Journal of Agricultural Sciences, 2006, 19(Suppl. 1): 518-520. (in Chinese with English abstract) |
| [10] | WRIGHT L P, MPHANGWE N, NYIRENDA H E, et al. Analysis of the theaflavin composition in black tea (Camellia sinensis) for predicting the quality of tea produced in Central and Southern Africa. Journal of the Science of Food and Agriculture, 2002, 82(5): 517-525. DOI:10.1002/(ISSN)1097-0010 |
| [11] | COGGON P, MOSS G A, SANDERSON G W. Tea catechol oxidase: Isolation, purification and kinetic characterization. Phytochemistry, 1973, 12(8): 1947-1955. DOI:10.1016/S0031-9422(00)91515-2 |
| [12] | üMIT üNAL M, YABACI S N, SENER A. Extraction, partial purification and characterisation of polyphenol oxidase from tea leaf (Camellia sinensis). GIDA, 2011, 36(3): 137-144. |
| [13] |
刘琨. 茶叶多酚氧化酶酶学特性及红外对其活力与构象的影响. 江苏, 无锡: 江南大学, 2013: 8-25. LIU K. Research on enzymological characteristics of polyphenol oxidase from tea and the effect of infrared on its activity and conformation. Wuxi, Jiangsu: Jiangnan University, 2013:8-25. (in Chinese with English abstract) http://cdmd.cnki.com.cn/Article/CDMD-10295-1013309237.htm |
| [14] |
刘本英, 王丽鸳, 周健, 等. 云南大叶种茶树种质资源ISSR指纹图谱构建及遗传多样性分析. 植物遗传资源学报, 2008, 9(4): 458-464. LIU B Y, WANG L Y, ZHOU J, et al. Fingerprinting construction and genetic diversity analysis of Yunnan Dayezhong tea germplasm resources by ISSR markers. Journal of Plant Genetic Resources, 2008, 9(4): 458-464. (in Chinese with English abstract) |
| [15] | BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 1976, 72(1/2): 248-254. |
| [16] |
赵淑娟, 王坤波, 傅冬和, 等. 茶多酚氧化酶酶学性质研究. 湖南农业大学学报(自然科学版), 2008, 34(1): 84-86. ZHAO S J, WANG K B, FU D H, et al. On the enzymological feature of polyphenol oxidase from tea. Journal of Hunan Agricultural University (Natural Sciences), 2008, 34(1): 84-86. (in Chinese with English abstract) |
| [17] |
孙慕芳, 陈义. 信阳群体种多酚氧化酶特性研究. 食品科技, 2014, 39(4): 51-53. SUN M F, CHEN Y. Property of polyphenol oxidase from Xinyang population cultivar. Food Sciences and Technology, 2014, 39(4): 51-53. (in Chinese with English abstract) |
| [18] |
潘科, 沈强, 申东, 等. 红茶通氧发酵过程中发酵叶相变化分析. 食品科学, 2014, 35(15): 198-201. PAN K, SHEN Q, SHEN D, et al. Changes in sensory and physicochemical characteristics of tea leaves during aerobic fermentation for black tea. Food Sciences, 2014, 35(15): 198-201. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201415040 |
| [19] |
陈昌辉, 齐桂年, 汪艳霞. 四川主栽茶树品种的多酚氧化酶活性. 贵州农业科学, 2011, 39(1): 51-53. CHEN C H, QI G N, WANG Y X. Study on polyphenol oxidase activities of tea cultivars grown in Sichuan. Guizhou Agricultural Sciences, 2011, 39(1): 51-53. (in Chinese with English abstract) |
| [20] |
虞昕磊. 云南大叶种茶树多酚氧化酶的分离纯化与性质研究. 武汉: 华中农业大学, 2015: 10-58. YU X L. Isolation, purification and characterization of polyphenol oxidase from Camellia sinensis var. assamica. Wuhan: Huazhong Agricultural University, 2015:10-58. (in Chinese with English abstract) http://cdmd.cnki.com.cn/Article/CDMD-10504-1015380661.htm |
| [21] |
孙慕芳, 张洁, 郭桂义. 白毫早鲜叶茶多酚氧化酶酶学特性. 贵州农业科学, 2014, 42(6): 140-143. SUN M F, ZHANG J, GUO G Y. Features of polyphenol oxidase in Baihaozao fresh tea leaves. Guizhou Agricultural Sciences, 2014, 42(6): 140-143. (in Chinese with English abstract) |
| [22] |
许雷. 茶树多酚氧化酶的提取、分离纯化及其部分酶性质研究. 武汉: 华中农业大学, 2014: 9-43. XU L. Extraction, isolation, purification and partial characteristics of polyphenol oxidase from Camellia sinensis. Wuhan: Huazhong Agricultural University, 2014:9-43. (in Chinese with English abstract) http://cdmd.cnki.com.cn/Article/CDMD-10504-1014213740.htm |
| [23] |
王丽霞, 陆蒸, 林启训, 等. 福云6号茶叶茶多酚氧化酶特性的研究. 江苏农业科学, 2008(1): 213-215. WANG L X, LU Z, LIN Q X, et al. Study on polyphenol oxidase characteristics from tea"Fuyun No. 6". Jiangsu Agricultural Sciences, 2008(1): 213-215. (in Chinese with English abstract) |
| [24] |
张书芹. 龙井43号多酚氧化酶同工酶质谱鉴定与酶性质研究. 武汉: 华中农业大学, 2014: 8-32. ZHANG S Q. Mass spectrum identification and enzymatic properties of polyphenol oxidase isozyme from Camellia sinensis cv. Longjin 43. Wuhan: Huazhong Agricultural University, 2014: 8-32. (in Chinese with English abstract) http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hbny201606033&dbname=CJFD&dbcode=CJFQ |
| [25] |
王丽璞, 郁军, 岳鹏翔, 等. 不同金属离子对多酚氧化酶的影响. 食品科学, 2011, 32(13): 244-247. WANG L P, YU J, YUE P X, et al. Effect of different metal ions on polyphenol oxidase from eggplant fruit. Food Science, 2011, 32(13): 244-247. (in Chinese with English abstract) |
| [26] |
徐斌. 不同体系条件下聚酯型儿茶素的形成特性及其与茶黄素的竞争性形成. 北京: 中国农业科学院, 2015: 12-52. XU B. Formation characteristics of theasinensins (TSs) and competition between TSs and theaflavins (TFs) under various conditions. Beijing: Chinese Academy of Agricultural Sciences, 2015:12-52. (in Chinese with English abstract) http://d.wanfangdata.com.cn/Thesis/Y2787763 |
| [27] |
黄莹捷, 伍梦瑶, 姚燕妮, 等. 不同条件对勐库大叶种多酚氧化酶合成茶黄素的影响. 食品科学: 1-8. http://www.cnki.net/kcms/detail/11.2206.TS.20170118.1520.026.html HUANG Y J, WU M Y, YAO Y N, et al. Effects of different conditions on theaflavins synthesis by polyphenol oxidase of Camellia sinensis var. assamica cv. Mengku. Food Science: 1-8. http:// www.cnki.net/kcms/detail/11.2206.TS.20170118.1520.026.html |
| [28] |
陈盛虎. 龙井43号茶树多酚氧化酶同工酶的分离纯化与PPO Ⅲ-2、PPO Ⅴ-3性质研究. 武汉: 华中农业大学, 2016: 12-56. CHEN S H. Isolation and purification of polyphenol oxidase isoenzyme from Camellia sinensis cv. Longjing 43, and enzymatic properties of PPO Ⅲ-2 and PPO Ⅴ-3. Wuhan: Huazhong Agricultural University, 2016:12-56. (in Chinese with English abstract) http://cdmd.cnki.com.cn/Article/CDMD-10504-1016155372.htm |
| [29] |
俞露婷, 袁海波, 王伟伟, 等. 红茶发酵过程生理生化变化及调控技术研究进展. 中国农学通报, 2015, 31(22): 263-269. YU L T, YUAN H B, WANG W W, et al. Research progress of physiological and biochemical changes and new techniques in fermentation of black tea. Chinese Agricultural Science Bulletin, 2015, 31(22): 263-269. (in Chinese with English abstract) DOI:10.11924/j.issn.1000-6850.casb15030076 |
| [30] |
李辉. 红茶发酵技术研究进展. 蚕桑茶叶通讯, 2001(2): 21-23. LI H. Headway of the studies on the fermention technology of black tea. Newsletter of Sericulture and Tea, 2001(2): 21-23. (in Chinese with English abstract) |
| [31] |
毛清黎, 朱旗, 刘仲华, 等. 红茶发酵中pH调控对多酚氧化酶活性及茶黄素形成的影响. 湖南农业大学学报(自然科学版), 2005, 31(5): 66-68. MAO Q L, ZHU Q, LIU Z H, et al. Effects of pH modification on activity of polyphenol oxidases and formation of theaflavins. Journal of Hunan Agricultural University (Natural Sciences), 2005, 31(5): 66-68. (in Chinese with English abstract) |
| [32] |
王伟伟. 萎凋发酵条件对茶黄素形成关键因子的影响. 北京: 中国农业科学院, 2013: 23-38. WANG W W. Effects of withering and fermentation conditions on key factors for the formation of theaflavins. Beijing: Chinese Academy of Agricultural Sciences, 2013:23-38. (in Chinese with English abstract) http://cdmd.cnki.com.cn/Article/CDMD-82101-1013357216.htm |
| [33] |
高梦祥, 杨凤琴. 冬瓜多酚氧化酶的特性及抑制剂研究. 食品科技, 2008, 32(2): 11-14. GAO M X, YANG F Q. Study on the characteristic of polyphenoloxidase and inhibitor in wax-gourd. Food Sciences and Technology, 2008, 32(2): 11-14. (in Chinese with English abstract) |
 2017, Vol. 43
2017, Vol. 43


