| 油菜种子休眠性对脂肪酸积累的影响及其分子机制 |
油脂、蛋白质与淀粉(多糖)是人类赖以生存的三大营养要素,是农作物的主要营养储藏物质。芸薹属油料作物(俗称油菜)是我国长江流域主要冬季作物之一,具有易种植管理、适应性强、可油蔬两用的特点。2016年我国油菜播种面积达到710万hm2;菜籽油占据国产食用植物油总量的55%以上,是我国第一大食用油来源[1]。尽管中国与加拿大、欧洲、印度、澳洲等国家(地区)是世界上几大主要油菜产区,然而在我国2016—2017年度3 000万t的植物油总消费量中,将近20%(约1/5)依赖进口[2]。减少食用植物油的进口是保障国家粮油供给安全的重大需求。此外,近年来我国油菜生产面临着油菜种植面积下滑、广适高抗强优品种缺乏等一系列问题[3],其中最突出的问题是国产菜籽的含油量偏低,大部分冬油菜主栽品种的种子含油量在41%左右,比德国、加拿大油菜品种的种子含油量(绝对值)低3~5个百分点,直接造成国产油菜籽在油品加工市场上竞争能力低下的局面。因此,大幅提高国产油菜籽的含油量是提升菜籽品质、改变我国植物油依赖进口现状的突破口。
影响油菜籽含油量的因素有很多,其中在种子成熟过程中发生的油脂消减现象是影响含油量的重要因素。油脂消减是指含油量达到一个高峰之后,在收获之前含油量下降的现象[4]。我们在科研实践中发现:在一些雨水较多的年份,一些品种(基因型)由于休眠机制不完善,其种子能在母体植株开裂的角果中萌动并发芽;发生在收获之前的种子萌动会严重影响含油量,而且对菜籽的其他营养品质也具有不良影响,这样的品种(基因型)在不同年份之间种子含油量不稳定。因此,油菜种子休眠充足和完善与否也显著地影响着最终的油菜籽含油量。本综述着重介绍了近年来发表的有关油菜种子休眠性与脂肪酸含量的相关性及其分子机制方面的最新研究进展。
1 种子中的油脂代谢脂类是植物体内最重要的有机物质之一,它不仅是生物膜的结构部分,而且是主要的储藏组分,此外它还有光保护、使膜免受自由基伤害、表面保护以及蛋白修饰等一系列作用[5]。三酰甘油(triacylglycerol, TAG)是植物体内最重要的储存物质之一,由脂肪酸与甘油酯化而成。
植物油脂的合成分为3个阶段:首先,乙酰辅酶A(CoA)在质体中合成为16~18碳脂肪酸;然后,脂肪酸被运输到内质网中进行碳链的延长和脱饱和;最后,脂肪酸与甘油被加工成TAG[6-7],种子中的脂肪酸主要以TAG的形式存在。当植物需要能量与碳架的时候,TAG在三酰甘油脂肪酶的作用下分解成游离脂肪酸与甘油,游离脂肪酸通过β氧化途径分解,释放能量与碳架[8](图 1)。实际上,种子含油量的形成是一种动态平衡,一方面进行着油脂的积累,另一方面同步发生着油脂的消减。如果油脂积累多于消减,种子含油量便升高;反之,种子含油量则逐渐降低[9]。在植物生命世代交替过程中,受精胚的膨大与发育是典型的油脂积累多于分解的过程,而种子吸水萌动、幼苗形态建成是典型的油脂消减多于积累的阶段。
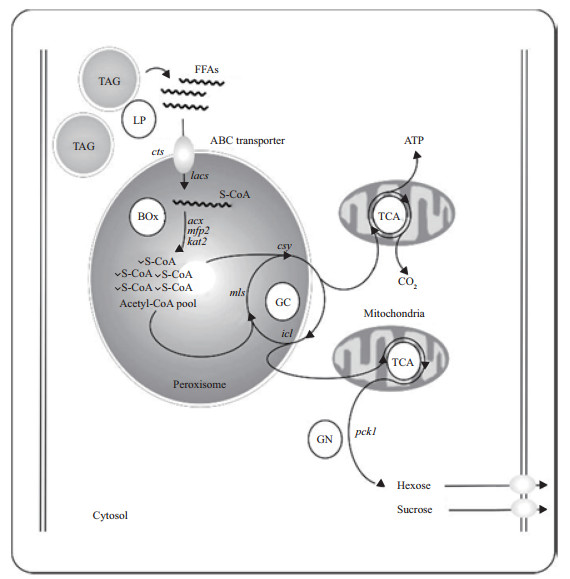 |
| TAG:三酰甘油;LP:脂解作用;FFAs:游离脂肪酸;cts:脂肪酸转运体;ABC:ATP结合盒;lacs:长链酰基辅酶A合酶;BOx:β氧化;CoA:辅酶A;GC:乙醛酸循环;TCA:三羧酸循环;GN:糖异生。 TAG: Triacylglycerol; LP: Lipolysis; FFAs: Free fatty acid; cts: Comatose; ABC: ATP-binding cassette; lacs: Long chain acyl-coenzyme A synthase; BOx: β oxidation; CoA: Coenzyme A; GC: Glyoxylate cycle; TCA: Tricarboxylic acid cycle; GN: Gluconeogenesis. 图1 植物种子油脂的分解代谢以及之后的糖异生过程[8 Fig. 1 Catabolism of seed storage oil and conversion to carbohydrate by gluconeogenesis[8] |
过去人们认为,当种子进入萌发状态时才需要消减大量油脂,然而,CHEN等[4]发现,油脂消减在种子成熟的后期便已经开始。种子休眠机制完善与否直接影响着种子成熟期油脂的积累或消减。
2.1 种子休眠的定义休眠是和萌发相对应的。种子萌发是指种子的胚根突破种子周围结构的过程[9];相对应的,种子休眠是指具有活力的种子在适宜的温度、水分和氧气等条件下却依然不能萌发的现象,是一种可遗传的、受到多基因控制的数量性状。
种子休眠是植物为增强对周围环境的适应性而进化出的重要生理性状[10]。若种子休眠性过低,种子会在适宜生长季节之前萌发,长出的幼苗不易生存;若种子休眠性过高,种子的萌发会被推迟,而且植物的生长时间会被缩短[11]。种子休眠表现为低水平的代谢和暂时性的对生长促进信号的不敏感性[12]。最初,种子休眠定义仅是局限于1粒种子上。近年来,随着研究发展,发现在特定环境、某一时点上虽然单粒种子是处于“1”或者“0”的状态(不是萌发便是休眠),但对于一个种子群体而言,群体中个体之间的生理状态却有很大不同,因此常用一批种子的发芽率来描述这批种子在该时点的休眠程度[13]。
2.2 种子休眠的分类植物界造成种子休眠的原因主要有两方面:一方面是胚本身造成的,包括种胚生理上未成熟、缺少必需的激素或存在抑制萌发的物质;另一方面是种壳的限制造成的,包括种壳的机械阻碍、不透水性、不透气性以及种壳中存在抑制萌发的物质等,一旦种壳发育完善,或者种壳内抑制萌发的物质分解,休眠即被打破[14-15]。正常的植物种子在成熟末期需要一次休眠来完成发育成熟,被称为初生休眠;而当吸涨的种子处于后熟阶段时,若此时的环境条件不适合萌发(如温度不适、氮元素不足等),则种子会再次进入休眠,被称为次生休眠[13]。
此外,有学者将植物种子的休眠分为生理休眠、形态休眠、形态生理休眠、物理休眠和复合休眠等5种休眠类型。油菜因种(species)与品种(cultivar)的不同,其休眠性与休眠机制存在明显的基因型差异,种子成熟阶段的油脂消减幅度也有很大差别。目前尚缺乏标准的方法对基因型休眠性的差异进行准确的描述与界定。对于单粒种子而言,萌发是一种“全有”或“全无”的事件;而特定种子发育时期的批量种子萌发率与萌发速率,能在某种程度上体现基因型的休眠程度[16]。
2.3 种子休眠的生理机制以及分子机制通常认为,植物种子的休眠是环境因素与内在因素共同作用的。种子中的各种组织共同调节着种子休眠状态,胚根的生长力和种子周围组织(如胚乳、种皮等)的抵抗力之间的平衡决定着种子是萌发还是休眠[12]。
种子休眠不仅受多个基因调控,还和转录组、蛋白组等有关系。种子的休眠和萌发也是植物内源激素平衡的调节过程,不同植物内源激素之间的相互促进或相互拮抗共同影响着种子的休眠与萌发[13,17]。一般认为,脱落酸(abscisic acid, ABA)是诱导种子休眠、抑制种子萌发的激素,而赤霉素(gibberellin, GA)则起到打破休眠、促进种子萌发的作用[16,18-20],这2类激素的平衡状态影响着种子的休眠或萌发。FINCH-SAVAGE等[21]提出了ABA和GA响应环境因子调控种子休眠与萌发的模型,该模型很好地解释了ABA和GA与外界环境因子的相互作用对种子休眠或萌发的影响。环境因子(诸如温度)会影响ABA与GA之间的微妙平衡,以及种子对激素的敏感性[22]。除ABA与GA外,乙烯对种子的休眠也具有调节作用[23]。
3 种子休眠与油脂代谢的相关性 3.1 脂肪酸转运体不仅是油料作物,即使是在谷类作物的种子中,胚和糊粉层在种子发育阶段也会积累可观的油脂[24]。在休眠种子萌发之前,油脂分解途径中的许多酶会开始发生作用。在种子成熟的末期,种子的含油量会显著下降[25-26]。
TAG在种子中一般被储存在脂质体中。TAG首先由TAG脂酶催化水解为脂肪酸和甘油,游离的脂肪酸被转移到过氧化物酶体中进行β氧化。有学者发现,在拟南芥种子过氧化物酶体的生物膜上,存在着一类ABC(ATP-binding cassette)转运体,参与游离脂肪酸从胞质进入过氧化物酶体的转运过程,同时该转运体的突变体又会引发种子的“永远休眠”(forever dormancy),因此编码该转运体的基因被称为脂肪酸转运体(comatose,cts)[27-28]。cts对种子从休眠状态到萌发状态的过渡起着十分重要的作用。
3.2 β氧化与种子休眠在过氧化物酶体中进行的β氧化是脂肪酸分解最重要的途径。以长链饱和脂肪酸为例,脂肪酸链首先在长链酰基CoA合成酶(long-chain acyl-CoAsynthases, LACS)的催化作用下合成长链酰基CoA(Cn),接着在一系列酶的催化作用下脱出乙酰CoA(C2)形成少2个C的长链酰基CoA(Cn-2),接下来进入下一轮的β氧化。在这一系列的过程中涉及3种最主要的酶:乙酰CoA氧化酶(acyl-CoA oxidases, ACXs),多功能蛋白(multifunctional protein, MFP)以及3-L-酮脂酰-CoA硫解酶(3-L-ketoacyl-CoAthiolase, KATs)[29]。ACXs是β氧化的第一个关键酶。对拟南芥的研究发现:ACXs包含6个子酶,6个子酶的功能部分重叠,但各自又带有独特的功能,最终将乙酰CoA氧化分解为反式△2CoA;MFP在β氧化途径中功能多样,包括水化作用和脱氢作用等;KATs催化分解一轮β氧化的最后一步—将3-L-酮脂酰-CoA硫解为少2个C的长链脂酰CoA和乙酰CoA(C2)。
β氧化从各种途径影响着种子休眠。首先,β氧化途径中的一系列酶如ACXs和KATs功能的缺失会引起种子的休眠,突变后的植株种子的休眠表型与cts相似[5]。唯一的例外是β氧化开始阶段起作用的是LACS,虽然lacs6 lacs7双突变体的脂肪酸分解显著减弱,但是其种子的萌发仍是正常水平[30-31]。其次,β氧化不仅通过脂肪酸代谢影响种子休眠,它还与植物激素尤其是赤霉素的信号传导途径有关。对拟南芥的研究发现,β氧化功能缺失的一系列突变体如cts、kat2、acx1 acx2等的种子、种皮都对种子的萌发有抑制作用,破坏或者除去其种皮都可打破种子休眠。这与赤霉素信号传导途径关键酶功能缺失的突变体gal-3呈现的性状相似[28,31]。因此,推测β氧化发生在赤霉素合成途径的下游,并且与赤霉素信号传导共同影响由种皮主导的种子休眠。此外,β氧化还极显著地影响着植物细胞的氧化还原反应。β氧化过程中的关键酶ACX产生的活性氧中间体,是植物活性氧(如NO)信号的重要来源[32],而在种子萌发期间活性氧类(reactive oxygenspecies,ROS)能够调节种子的休眠[33]。
3.3 脂质转化与种子休眠脂质转化的主要途径是乙醛酸循环和糖异生过程。脂肪酸链β氧化产生的乙酰CoA会进入乙醛酸循环。乙醛酸循环可以被视为一种“特殊”的三羧酸循环,它不会进入脱羧过程,因此不会产生CO2[34]。乙醛酸循环产生的碳产物会进入糖异生过程。乙醛酸循环涉及5种酶,其中异柠檬酸裂合酶(isocitrate lyase, ICL)和苹果酸合酶(malatesynthase,MLS)这2种酶是乙醛酸循环特有的,而柠檬酸合酶(citrate synthase, CSY)、顺乌头酸酶(aconitase, ACO)以及苹果酸脱氢酶(malatedehydrogenase, MDH)这3种酶与三羧酸循环共享。而糖异生阶段的关键酶是磷酸烯醇丙酮酸羧基酶(phosphoenolpyruvate carboxykinase, PCK)。
对拟南芥的研究发现,ICL和MLS不涉及β氧化途径[35-36],而它们的突变体也不会促使种子的休眠。PCK的突变效应也与此类似,pck1突变体虽然会呈现畸形的幼苗生长和胚乳营养物质输送到胚中的功能缺失,但还是能够正常催化分解脂肪酸,其萌发效果与野生型也相似[37]。可以推测,脂质转化为可溶性糖的过程对种子休眠几乎没有影响,在过氧化物酶体上进行的脂肪酸β氧化途径才是调节种子休眠的关键过程。
4 结语过去,为了提高油菜种子的含油量,科学家们往往更多地研究如何增加种子油脂合成的底物、抑制其竞争底物(如贮藏蛋白、色素、粗纤维等)的合成或者利用基因工程增加中间产物的转运与合成[38-40]。比如,拟南芥同型乙酰辅酶A羧化酶(HO-ACCase)在油菜种子中过量表达后可以使丙二酸单酰CoA产量增加,从而使油菜种子含油量提高3到5个百分点[41]。又如,二脂酰甘油酰基转移酶(DGAT)的过量表达可以使油菜籽相对含油量提高30%~40%[42]。后来,由于单个基因的影响有限,通过调控转录因子来增加脂肪酸合成的思路开始被关注。例如,WRI1是一种调控植物体内碳源由葡萄糖向油脂合成的关键转录因子[43],其过量表达可以显著提高油菜种子含油量。除WRI1外,还有一些关键的转录因子在调控种子发育和油脂积累的过程中发挥重要作用。包括WRI1在内,按照其表达的先后顺序,这些转录因子分别是LEC2、LEC1、WRI1、FUS3与ABI3,调控这些转录因子已经成为提高种子含油量的重要手段[44-45]。除此之外,我们实验室在过去几年的研究中发现:TESTA TRANSPARENT2(TT2)、TT8等基因可以通过与上述转录因子的结合,抑制其转录,从而降低种子油脂合成;通过敲除或者修饰TT2、TT8等基因可以显著提高种子含油量[46-49]。最近我们提出了一条目前仍被忽视的思路,即通过抑制种子成熟过程中的油脂消减来提高种子含油量。一些研究显示,赤霉素(GA)能够显著上调部分GDSL类脂肪酸消减基因(seed fatty acid reducer, SFAR)的表达,从而降低种子含油量。其中SFAR是近年命名与发表的一类基因[9],泛指在种子成熟期间表达的脂肪酸积累的负向调控因子,其狭义是指编码种子油脂消减的GDSL类脂酶基因。在实验中,敲除某些SFAR基因(SFAR1~SFAR5)或者直接抑制GA的信号传导,能够显著提高种子含油量[4]。
抑制收获前油菜种子在母体植株上的萌动,降低含油量达到高峰后的油脂消减,显然也是增加油菜种子含油量的有效策略。然而,这方面的研究前人鲜有报道,一系列基础的科学问题尚待阐明。未来应重点围绕以下科学问题开展研究:1)油菜不同种(species)以及品种(cultivar)之间是否存在休眠性的差异?差异程度有多大?2)基因型间休眠性的差异是否直接导致了含油量差异?基因型之间的含油量差别在多大程度上是由收获前种子提早萌动造成的?3)油菜种子成熟阶段与萌动阶段的基因表达谱存在怎样的差异?哪些关键基因导致下游众多油脂消减基因(靶的)的表达?4)如何通过基因操纵手段定时表达一些关键基因,以影响种子成熟阶段GA/ABA之间的平衡,从而抑制种子油脂消减?针对上述科学问题设计相应的研究内容,以探明油菜种子休眠性对含油量的影响程度及其分子机制,并找到一些关键的基因位点,从而在油菜育种过程中,通过选择相关的等位位点来强化或完善种子的休眠机制,以抑制种子油脂消减,大幅提高含油量。
| [1] |
国家粮油信息中心. 2016年1—12月中国进口食用植物油数据. http://www.askci.com/news/dxf/20170113/16305887825.shtml. China National Grain and Oils Information Center. Data of imported edible oil in 2016. http://www.askci.com/news/dxf/20170113/16305887825.shtml. (in Chinese) |
| [2] |
2016年中国食用油市场供求状况及变动原因分析. http://www.chyxx.com/industry/201611/470848.html Analysis of market supply and demand of China's edible oil in 2016 and its fluctuant reasons. http://www.chyxx.com/industry/201611/470848.html. (in Chinese) |
| [3] |
关周博, 田建华, 董育红. 我国油菜发展的现状、面临的问题以及应对策略. 陕西农业科学, 2016, 62(3): 99-101. GUAN Z B, TIAN J H, DONG Y H. Current situation, problems and countermeasures of rapeseed development in China. Shaanxi Journal of Agricultural Sciences, 2016, 62(3): 99-101. (in Chinese with English abstract) |
| [4] | CHEN M X, DU X, ZHU Y, et al. Seed fatty acid reducer acts downstream of gibberellin signaling pathway to lower seed fatty acid storage in Arabidopsis. Plant, Cell and Environment, 2012, 35(12): 2155-2169. DOI:10.1111/j.1365-3040.2012.02546.x |
| [5] | BRADFORD K J, NONAGAKI H. Seed Development, Dormancy and Germination. UK: Wiley-Blackwell, 2007: 133-149. |
| [6] | OHLROGGE J, BROWSE J. Lipid biosynthesis. The Plant Cell, 1995, 7(7): 957-970. DOI:10.1105/tpc.7.7.957 |
| [7] | SHAMSI I H, SHAMSI B H, JIANG L X. Biochemistry of fatty acids//GUPTA S K. Technological Innovations in Major World Oil Crops. Volume 2. New York, USA: Springer, 2012:123-150. |
| [8] | GRAHAM I A, EASTMOND P J. Pathways of straight and branched chain fatty acid catabolism in higher plants. Progress in Lipid Research, 2002, 41(2): 156-181. DOI:10.1016/S0163-7827(01)00022-4 |
| [9] | HOLDSWORTH M J, BENTSINK L, SOPPE W J J. Molecular networks regulating Arabidopsis seed maturation, after-ripening, dormancy and germination. New Phytologist, 2008, 179(1): 33-54. DOI:10.1111/nph.2008.179.issue-1 |
| [10] | HUANG X Q, SCHMITT J, DORN L, et al. The earliest stages of adaptation in an experimental plant population: Strong selection on QTLs for seed dormancy. Molecular Ecology, 2010, 19(7): 1335-1351. DOI:10.1111/mec.2010.19.issue-7 |
| [11] | DONOHUE K, DE CASAS R R, BURGHARDT L, et al. Germination, postgermination adaptation, and species ecological ranges. Annual Review of Ecology, Evolution, and Systematics, 2010, 41: 293-319. DOI:10.1146/annurev-ecolsys-102209-144715 |
| [12] | GRAEBER K, NAKABAYASHI K, MIATTON E, et al. Molecular mechanisms of seed dormancy. Plant, Cell and Environment, 2012, 35(10): 1769-1786. DOI:10.1111/pce.2012.35.issue-10 |
| [13] | FINKELSTEIN R, REEVES W, ARIIZUMI T, et al. Molecular aspects of seed dormancy. Annual Review of Plant Biology, 2008, 59: 387-415. DOI:10.1146/annurev.arplant.59.032607.092740 |
| [14] | BEWLEY J D. Seed germination and dormancy. The Plant Cell, 1997, 9(7): 1055-1066. DOI:10.1105/tpc.9.7.1055 |
| [15] | DE GIORGI J, PISKUREWICZ U, LOUBERY S, et al. An endosperm-associated cuticle is required for Arabidopsis seed viability, dormancy and early control of germination. PLoS Genetics, 2015, 11(12): e1005708. DOI:10.1371/journal.pgen.1005708 |
| [16] |
付婷婷, 程红焱, 宋松泉. 种子休眠的研究进展. 植物学报, 2009, 44(5): 629-641. FU T T, CHENG H Y, SONG S Q. Advances in studies of seed dormancy. Chinese Bulletin of Botany, 2009, 44(5): 629-641. (in Chinese with English abstract) |
| [17] |
潘琳, 徐程阳. 种子休眠与萌发过程的生理调节机制. 种子, 2010, 29(6): 41-47. PAN L, XU C Y. Review on mechanisms of physiological modulation in the process of seed dormancy and germination. Seed, 2010, 29(6): 41-47. (in Chinese with English abstract) |
| [18] | KUCERA B, COHN M A, LEUBNER-METZGER G. Plant hormone interactions during seed dormancy release and germination. Seed Science Research, 2005, 15(4): 281-307. DOI:10.1079/SSR2005218 |
| [19] | DEKKERS B J W, COSTA M C, MAIA J, et al. Acquisition and loss of desiccation tolerance in seeds: From experimental model to biological relevance. Planta, 2015, 241(3): 563-577. DOI:10.1007/s00425-014-2240-x |
| [20] | CEMBROWSKA-LECH D, KĘPCZYŃSKI J. Gibberellin-like effects of KAR1 on dormancy release of Avena fatua caryopses include participation of non-enzymatic antioxidants and cell cycle activation in embryos. Planta, 2016, 243(2): 531-548. DOI:10.1007/s00425-015-2422-1 |
| [21] | FINCH-SAVAGE W, LEUBNER-METZGER. Seed dormancy and the control of germination. New Phytologist, 2006, 171(3): 501-523. DOI:10.1111/nph.2006.171.issue-3 |
| [22] | LIU Y, MüLLER K, EL-KASSABY Y A, et al. Changes in hormone flux and signaling in white spruce (Picea glauca) seeds during the transition from dormancy to germination in response to temperature cues. BMC Plant Biology, 2015, 15: 292. DOI:10.1186/s12870-015-0638-7 |
| [23] | MATILLA J, MATILLA-VA′ZQUEZ M A. Involvement of ethylene in seed physiology. Plant Science, 2008, 175(1/2): 87-97. |
| [24] | GRAM N H. The ultrastructure of germinating barley seeds. Ⅰ. Changes in the scutellum and aleurone layer in Nordal barley. Carlsberg Research Communications, 1982, 47: 143-162. DOI:10.1007/BF02914032 |
| [25] | BAUD S, BOUTIN J P, MIQUEL M, et al. An integrated overview of seed development in Arabidopsis thaliana ecotype WS. Plant Physiology and Biochemistry, 2002, 40(2): 151-160. DOI:10.1016/S0981-9428(01)01350-X |
| [26] | CHIA T Y P, PIKE M J, RAWSTHORNE S. Storage oil breakdown during embryo development of Brassica napus (L.). Journal of Experimental Botany, 2005, 56(415): 1285-1296. DOI:10.1093/jxb/eri129 |
| [27] | RUSSELL L, LARNER L, KURUP S, et al. The Arabidopsis COMATOSE locus regulates germination potential. Development, 2000, 127(17): 3759-3767. |
| [28] | FOOTITT S, SLOCOMBE S, LARNER V, et al. Control of germination and lipid mobilization by COMATOSE, the Arabidopsis homologue of human ALDP. The EMBO Journal, 2002, 21(12): 2912-2922. DOI:10.1093/emboj/cdf300 |
| [29] | HOOKS M A, KELLAS F, GRAHAM I A. Long-chain acyl-CoA oxidases of Arabidopsis. The Plant Journal, 1999, 20(1): 1-13. DOI:10.1046/j.1365-313X.1999.00559.x |
| [30] | FULDA M, SCHNURR J, ABBADI A, et al. Peroxisomal acyl CoA synthetase activity is essential for seedling development in Arabidopsis thaliana. The Plant Cell, 2004, 16: 394-405. DOI:10.1105/tpc.019646 |
| [31] | PENFIELD S, JOSSE E M, KANNANGARA R, et al. Cold and light control seed germination through the bHLH transcription factor SPATULA. Current Biology, 2005, 15(22): 1998-2006. DOI:10.1016/j.cub.2005.11.010 |
| [32] | CORPAS F J, BARROSO J B, DEL RIO L A. Peroxisomes as a source of reactive oxygen species and nitric oxide signal molecules in plant cells. Trends in Plant Science, 2001, 6(4): 145-150. DOI:10.1016/S1360-1385(01)01898-2 |
| [33] | BAILLY C. Active oxygen species and antioxidants in seed biology. Seed Science Research, 2004, 14(2): 93-107. DOI:10.1079/SSR2004159 |
| [34] | EASTMOND P J, GRAHAM I A. Re-examining the role of the glyoxylate cycle in oilseeds. Trends in Plant Science, 2001, 6(2): 72-78. DOI:10.1016/S1360-1385(00)01835-5 |
| [35] | EASTMOND P J, GERMAIN V, LANGE P R, et al. Postgerminative growth and lipid catabolism in oilseeds lacking the glyoxylate cycle. Proceedings of the National Academy of Sciences of the USA, 2000, 97(10): 5669-5674. DOI:10.1073/pnas.97.10.5669 |
| [36] | CORNAH J E, GERMIANE V, WARD J L, et al. Lipid utilization, gluconeogenesis and seedling growth in Arabidopsis mutants lacking the glyoxylate cycle enzyme malate synthase. Journal of Biological Chemistry, 2004, 279: 42916-42923. DOI:10.1074/jbc.M407380200 |
| [37] | PENFIELD S, RYLOTT E L, GLIDAY A D, et al. Reserve mobilization in the Arabidopsis endosperm fuels hypocotyl elongation in the dark, is independent of abscisic acid, and requires PHOSPHOENOLPYRUVATE CARBOXYKINASE1. The Plant Cell, 2004, 16(10): 2705-2718. DOI:10.1105/tpc.104.024711 |
| [38] | CAHOON E B, SHANKLIN J. Substrate-dependent mutant complementation to select fatty acid desaturase variants for metabolic engineering of plant seed oils. Proceedings of the National Academy of Sciences of the USA, 2000, 97(22): 12350-12355. DOI:10.1073/pnas.210276297 |
| [39] | KIM S, YAMAOKA Y, ONO H, et al. AtABCA9 transporter supplies fatty acids for lipid synthesis to the endoplasmic reticulum. Proceedings of the National Academy of Sciences of the USA, 2013, 110(2): 773-778. DOI:10.1073/pnas.1214159110 |
| [40] | WU X L, LIU Z H, HU Z H, et al. BnWRI1 coordinates fatty acid biosynthesis and photosynthesis pathways during oil accumulation in rapeseed. Journal of Integrative Plant Biology, 2014, 56(6): 582-593. DOI:10.1111/jipb.v56.6 |
| [41] | ROESLER K, SHINTANI D, SAVAGE L, et al. Targeting of the Arabidopsis homomeric acetyl-CoA carboxylase to plastids of rapeseeds. Plant Physiology, 1997, 113(1): 75-81. DOI:10.1104/pp.113.1.75 |
| [42] | JAKO C, KUMAR A, WEI Y D, et al. Seed-specific over-expression of an Arabidopsis cDNA encoding a diacylglycerol acyltransferase enhances seed oil content and seed weight. Plant Physiology, 2001, 126(2): 861-874. DOI:10.1104/pp.126.2.861 |
| [43] | RUUSKA S A, GIRKE T, BENNING C, et al. Contrapuntal networks of gene expression during Arabidopsis seed filling. The Plant Cell, 2002, 14(6): 1191-1206. DOI:10.1105/tpc.000877 |
| [44] | KROJ T, SAVINO G, VALON C, et al. Regulation of storage protein gene expression in Arabidopsis. Development, 2003, 130(24): 6065-6073. DOI:10.1242/dev.00814 |
| [45] | TCHAGANG A B, BUI K V, MCGINNIS T, et al. Extracting biologically significant patterns from short time series gene expression data. BMC Bioinformatics, 2009, 10: 255. DOI:10.1186/1471-2105-10-255 |
| [46] | CHEN M X, WANG Z, ZHU Y N, et al. The effect of TRANSPARENT TESTA 2 on seed fatty acid biosynthesis and tolerance to environmental stresses during young seedling establishment in Arabidopsis. Plant Physiology, 2012, 160(2): 1023-1036. DOI:10.1104/pp.112.202945 |
| [47] | CHEN M X, XUAN L J, WANG Z, et al. TRANSPARENT TESTA8 inhibits seed fatty acid accumulation by targeting several seed development regulators in Arabidopsis. Plant Physiology, 2014, 165(2): 905-916. DOI:10.1104/pp.114.235507 |
| [48] | WANG Z, CHEN M X, CHEN T L, et al. TRANSPARENT TESTA2 regulates embryonic fatty acid biosynthesis by targeting FUSCA3 during the early developmental stage of Arabidopsis seeds. The Plant Journal, 2014, 77(5): 757-769. DOI:10.1111/tpj.12426 |
| [49] | ZHOU L H, LI Y L, HUSSAIN N, et al. Allelic variation of BnaC.TT2.a and its association with seed coat color and fatty acids in rapeseed (Brassica napus L.). PLoS ONE, 2016, 11(1): e0146661. DOI:10.1371/journal.pone.0146661 |
 2017, Vol. 43
2017, Vol. 43


