| 野生郁金香种子无菌萌发及小鳞茎形成 |
2. 曼苏尔大学农学院园艺系,埃及 曼苏尔 35516
2. Department of Horticulture, Faculty of Agriculture, Mansoura University, Mansoura 35516, Egypt
郁金香为百合科(Liliaceae)郁金香属(Tulipa)多年生球根花卉,在世界球根产业中位列第一[1]。郁金香是我国重要的野生种质资源,起源于西藏、天山西部和帕米尔-阿赖以及喜马拉雅山脉地区,至今,40%的野生郁金香仍生长在该区域。新疆的野生郁金香具很强的抗逆(寒冷、干旱、炎热)性,且花多色艳,花形独特,是获得抗性高、观赏性强的杂交新品种的优良种质资源[2]。新疆郁金香(Tulipa sinkiangensi)属于无毛组中的多花品种。目前,国内外对我国野生郁金香的研究还较少,但国内不少学者已开始意识到保护和利用我国野生郁金香资源的重要性,加快相关研究可为国内郁金香育种奠定理论基础。研究表明,组织培养技术可有效稳定地保存种质资源,通过无菌播种获得组培苗是其中一条途径。
本实验室(浙江大学观赏植物组培实验室)近年来建立了药百合(Lilium speciosum var. gloriosoides)[3]和巨球百合(L. brownii var. giganteum)[4]的无菌播种体系,并得出细胞分裂素与生长素比值较高有利于百合属种子无菌萌发的结论,这与在兰属植物中的发现相同[5]。有研究表明,外源生长调节剂加入与否对野生郁金香萌发无显著影响[6]。因此,本试验确定了培养基配方为1.0 mg/L 6-苄氨基腺嘌呤(6-BA)+ 0.1 mg/L萘乙酸(NAA)+ 30 g/L蔗糖+ 8 g/L琼脂,pH值为5.7。陈芳等[7]和TANG等[8]报道,低温是伊犁郁金香(T. iliensis)种子萌发的首要条件。赤霉素(gibberellin, GA3)处理可显著提高杂种郁金香种子的发芽率和发芽势;聚乙二醇(polyethylene glycol,PEG)处理也有一定作用,但效果不如GA3 [9]。吴昀等[3]研究表明,种皮是制约百合种子萌发的关键因素,进行剥皮处理或采取其他物理措施破坏种皮可有效提高其萌发率。到目前为止,还未见种皮对野生郁金香种子离体萌发影响的相关报道,也未见野生郁金香种子消毒方式和基本培养基的比较研究。此外,相关研究表明,当球根植物鳞茎离体成球时,移栽成活率更高[10]。
本研究从消毒方式、剥皮与否、GA3预处理浓度、基本培养基、培养温度等方面系统研究了相关因子对野生郁金香种子无菌萌发及离体鳞茎形成的影响。此外,为验证无菌播种的优势,还进行了土壤播种试验比较。
1 材料与方法 1.1 材料供试材料为2015年9月于新疆采集的野生郁金香种子(T. sinkiangensi)。接种前在4 ℃冰箱中保存8周以打破休眠,选择饱满、胚清晰(胚长≥1/2种长)的种子为试验材料(图 1)。种子千粒质量为5.65 g。
 |
| 图1 新疆野生郁金香种子 Fig. 1 Seeds of wild T. sinkiangensi from Xinjiang |
试验于2015年12月至2016年6月在浙江大学观赏植物组培实验室进行。无菌培养室光强为60 μmol/ (m2·s),温度为(25±2) ℃。
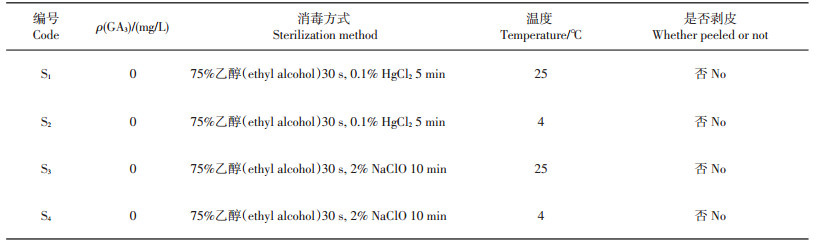
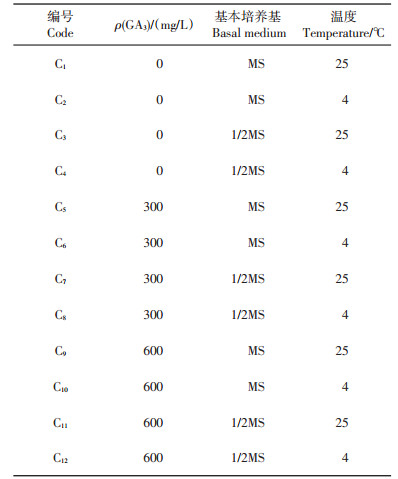
无菌播种:试验参考吴昀等[3]药百合种子无菌播种的方法并做少量改动。将种子置于加有吐温-20及洗洁精各1~2滴的水溶液中浸泡30 min,流水冲洗2 h,再用不同质量浓度的GA3浸泡24 h;接种前,在超净工作台上用75%乙醇振荡消毒30 s,继而采用质量体积分数为0.1%的氯化汞(HgCl2)处理5 min或有效氯质量体积分数为2%的次氯酸钠(NaClO)处理10 min,无菌水冲洗3~5次;再分别置于25 ℃和4 ℃下培养,对应的消毒处理方式(S1~S4)见表 1。用手术刀轻轻刮掉种皮,接种于培养基上,在室温或4 ℃冷柜中黑暗培养;共12种培养条件(C1~C12),具体见表 2。60 d后将发芽的郁金香种子接种到蔗糖质量浓度为60 g/L的MS基本培养基中进行增殖成球培养。
| 表1 消毒方式和培养温度 Table 1 Sterilization methods and culture temperature |
 |
| 点击放大 |
| 表2 培养条件 Table 2 Culture conditions |
 |
| 点击放大 |
土壤播种:播种前用温水催芽[V(开水):V(冷水)= 3:1],用多菌灵浸泡15 min,然后播种于穴盘中,基质为m [加拿大进口泥炭土(Fafard)]:m(珍珠岩):m(黄沙)= 4:1:1,常规管理。
1.3 观察与统计每组处理接种10粒种子,4个重复。萌发前每天观察,以胚根或幼芽突破种皮为准,记录开始萌发日;萌发后每3 d观察1次。60 d后统计污染率、萌发高峰期、萌发率、生长势等。转接60 d后记录增殖成球情况,并拍照记录。其中:发芽高峰期为发芽种子数超过发芽种子总数1/2的阶段;污染率=污染种子数/种子总数×100%;萌发率=发芽种子数/种子总数×100%。
1.4 数据处理试验数据用平均值±标准误表示,采用Excel 2007和SPSS 20.0对数据进行方差分析和因素内多重比较,并制图。
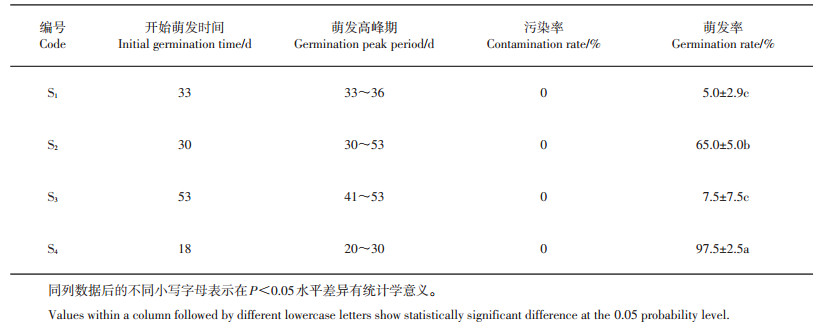
2 结果与分析 2.1 消毒方式和温度对种子萌发的影响以未经GA3浸泡的种子为材料,MS为基本培养基,进行不同消毒方式和在25 ℃及4 ℃下的培养,具体处理方式见表 1,发芽情况见图 2。试验结果表明:2种消毒方式的杀菌效果都较好,污染率均为0%;在相同温度下,经2% NaClO消毒处理后种子萌发率比0.1% HgCl2处理的种子更高,且当培养温度为4 ℃时,这种差异达到统计学上的显著水平(表 3)。试验也尝试了仅使用75%乙醇消毒,并延长消毒时间,发现无论剥皮与否,乙醇消毒超过15 min会造成种子难以发芽,试验观察到只有零星几粒发芽,芽短而且弱(数据未显示),这可能与乙醇的强渗透性相关。
| 表3 不同消毒方式和温度下的种子萌发 Table 3 Seed germination at different sterilization methods and temperatures |
 |
| 点击放大 |
 |
| 照片从左至右分别为处理编号S1、S2、S3、S4(表 1)下的种子发芽情况。 Photos from left to right are the seed germination status with treatment S1, S2, S3 and S4 (Table 1), respectively. 图2 消毒方式和温度对种子发芽的影响 Fig. 2 Effects of sterilization method and temperature on seed germination |
在相同消毒方式、不同接种温度条件下,开始萌发时间不同,萌发率差异显著,以4 ℃更佳,发芽率平均为81.25%;在25 ℃条件下则发芽困难,平均仅为6.28%(表 3)。初步推测低温更利于郁金香种子发芽。
总体而言,S4处理效果最佳,18 d时开始萌发,污染率为0%,萌发率达97.5%(表 3)。在此试验条件下虽消毒效果良好,萌发率亦较高,但后期发芽缓慢,且芽较细长,难以形成小鳞茎。推测主要原因是种皮的抑制作用,因此,为排除该影响,后续进行了去除种皮试验。
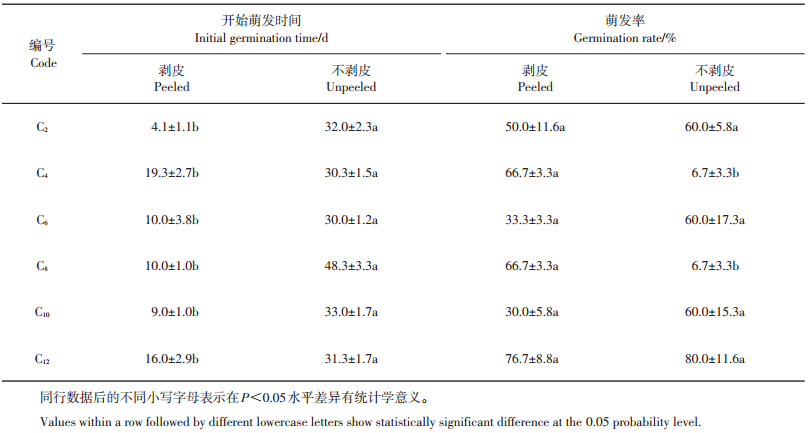
2.2 剥皮处理对种子萌发的影响在12种培养条件下,选择在4 ℃下进行剥皮与不剥皮对比试验,即编号C2、C4、C6、C8、C10、C12处理(表 2)。
由表 4可见:在6种培养条件下,未剥皮种子的萌发时间均滞后于剥皮处理的种子,且差异有统计学意义;在萌发率上,剥皮处理与不剥皮处理仅在2种培养条件下(C4和C8)差异显著,均为剥皮处理的萌发率较高,虽然在部分培养条件下不剥皮处理的萌发率也较高,但未达到统计学上的显著水平,且在试验中发现,在不剥皮条件下萌发率不稳定。从图 3可见,虽然不剥皮处理的发芽率也较高,但芽多细长柔弱,难以培养形成小鳞茎。因此,剥去野生郁金香的种皮更利于种子萌发,且可显著缩短种子萌发时间。
| 表4 4 ℃时剥皮与不剥皮处理的种子萌发 Table 4 Seed germination under peeled and unpeeled treatments at 4 ℃ |
 |
| 点击放大 |
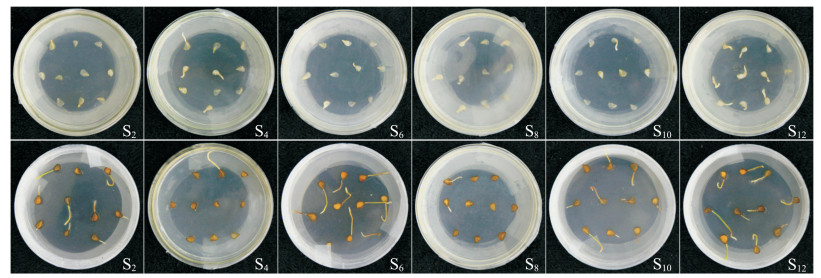 |
| 上排为剥皮种子的发芽情况,下排为不剥皮种子的发芽情况。 The upper row is the peeled seed germination; the lower row is the unpeeled seed germination. 图3 剥皮处理对种子发芽的影响 Fig. 3 Effects of peeling on seed germination |
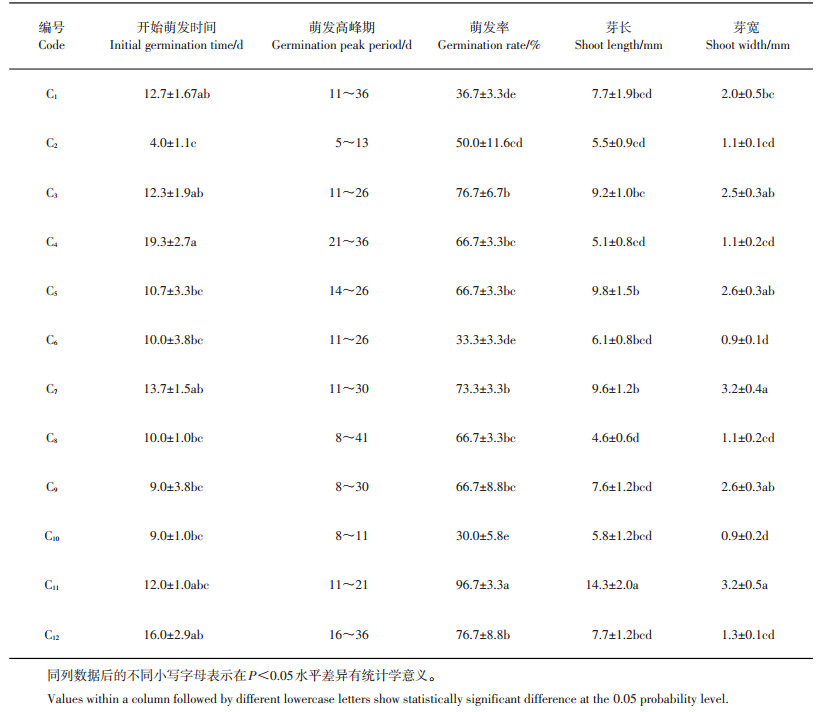
本试验对GA3质量浓度(0、300、600 mg/L)、基本培养基(MS、1/2MS)、培养温度(4 ℃、25 ℃)进行均匀试验设计,共得出12种组合,即12种培养条件(表 2)。经过记录和统计,在C11号培养条件下萌发高峰期较集中,发芽率和芽长最高,显著高于其余11个处理,芽宽均值最高;除C2、C4号培养条件外,开始萌发时间在各培养条件间差异不大(表 5)。综上表明,处理C11为野生郁金香种子的最佳萌发条件,即GA3预处理质量浓度为600 mg/L,1/2MS为基本培养基,25 ℃培养,在此条件下发芽率接近100%,并且出芽强壮(图 4)。
| 表5 不同培养条件下的种子萌发 Table 5 Seed germination under different culture conditions |
 |
| 点击放大 |
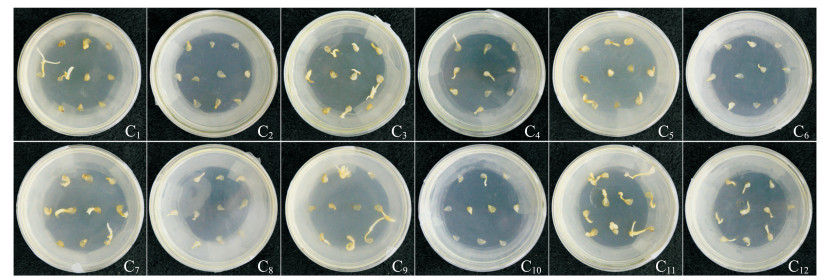 |
| 上排为培养条件C1~C6(表 2)的种子发芽情况,下排为培养条件C7~C12(表 2)的种子发芽情况。 The upper row is the culture conditions of C1-C6(Table 2); the lower row is the culture conditions of C7-C12 (Table 2). 图4 培养条件对种子发芽的影响 Fig. 4 Effects of culture conditions on seed germination |
由图 5A可以看出:除C1、C2号培养条件外,其余均是在25 ℃下的萌发率较高;C1号萌发率虽然低于C2号,但差异无统计学意义,并且C1号的芽长和芽宽均高于C2号(表 5)。说明25 ℃的培养条件更有利于郁金香种子的发芽。这与2.1节基于NaClO的消毒方式、MS为基本培养基、未剥皮的试验中初步显示的4 ℃更有利于郁金香种子萌发的结果相悖。根据现有的试验结果推测是温度和剥皮处理之间有制约关系,在未剥去种皮时,4 ℃下发芽率高,而在剥去种皮后,25 ℃下发芽率高,其原因包括:种子本身可能存在的抑制机制;或是低温条件下种皮对发芽的阻碍作用较小;也可能是种皮内的某些物质在发挥作用;在25 ℃条件下,种皮抑制种子发芽的作用较大,或是由于接种前已经过冷藏处理打破休眠,所以在培养时较高温度适宜发芽。
 |
| A:温度;B:基本培养基;C:GA3预处理质量浓度。培养条件编号1~12对应于表 2的C1~C12。短栅上的星号(*)表示各处理间在P<0.05水平差异有统计学意义。 A: Temperature; B: Basal medium; C: GA3 pretreatment concentra⁃ tion. Culture condition number 1-12 is corresponding to C1-C12 at Table 2. Single asterisk (*) above bars shows statistically significant difference under different culture conditions at the 0.05 probability level. 图5 不同培养条件对种子发芽的影响 Fig. 5 Effects of different culture conditions on seed germination |
由图 5B可以看出,在6种GA3质量浓度和温度的组合中,使用1/2MS作为基本培养基的萌发率均高于使用MS作为基本培养基的萌发率。说明1/2MS是更适宜郁金香种子萌发的基本培养基。这是有关野生郁金香种子无菌萌发基本培养基的首次报道。
2.3.3 GA3预处理质量浓度对野生郁金香种子萌发率的影响GA3有助于打破休眠,可提高种子发芽率和发芽势。由图 5C可以看出,除了培养条件C2、C6、C10,随着GA3预处理质量浓度的升高,野生郁金香种子萌发率基本呈逐渐升高的趋势。说明使用较高质量浓度的GA3浸泡郁金香种子有助于种子发芽。而MS培养基及4 ℃是制约性培养条件,萌发率均较低,因此在C2、C6、C10培养条件下,萌发率均较低,且随着GA3质量浓度的增加而递减,但未形成显著差异。因此,在本试验中,600 mg/L GA3浸泡处理可促进野生郁金香种子萌发。这也说明低温处理和GA3处理种子有叠加作用,两者结合可更有效地打破休眠,促进种子萌发。
2.4 离体小鳞茎形成将萌发的郁金香种子转移到仅含60 g/L蔗糖及8 g/L琼脂的MS基本培养基中,在60 d和90 d时观察郁金香芽的生长情况。
由图 6可以看出,培养60 d后,郁金香小芽的形态差异较大,相对于本实验室建立的百合体系而言,郁金香生长较缓慢。不剥皮处理形成的芽细长柔弱,生长畸形,而剥皮处理形成的芽较健壮,可以看出小鳞茎的初级形态。
 |
| 上排为剥皮种子形成的小鳞茎,下排为未剥皮种子的畸形芽。 The upper row is the bulblets formed from the peeled seeds; the lower row is the abnormal buds of the unpeeled seeds. 图6 增殖培养60 d后芽的不同状态 Fig. 6 Different statuses of buds after cultured for 60 days |
从图 7可以看出,培养90 d后,部分芽形成了小鳞茎,初期选用健壮芽可更好地在后期发育为鳞茎,未剥皮处理的种子形成的芽细长柔弱,基本不能形成小鳞茎,而经剥皮处理的种子形成的较健壮芽,经过持续培养,80%以上可以形成小鳞茎,成球率显著高于未剥皮处理。因此,获得长度和宽度比例适宜的壮芽非常必要,即剥皮处理是小鳞茎形成的重要前提。在筛选出的最佳萌发条件(C11号处理)下,萌发率、芽长、芽宽均达到最大值,小鳞茎形成的数量亦最多,也最强壮;因此,试验筛选出的最佳种子萌发条件对于后续获得野生郁金香离体小鳞茎同样有持续影响。
 |
| 增殖培养90 d后,原本健壮的小鳞茎继续生长,原本细弱的芽逐渐死亡。照片为部分培养条件下挑选出的典型单株。 The original robust shoots continue to grow to form bulblet, and the original thin shoots gradually die. The photos show the typical individual bulblets selected from several culture conditions after cultured for 90 days. 图7 增殖培养90 d后小鳞茎的不同状态 Fig. 7 Different bulblet statuses of shoots after cultured for 90 days |
综上所述,本研究建立了新疆野生郁金香(T. sinkiangensi)的无菌萌发和小鳞茎形成体系:首先采用4 ℃冷藏8周以打破休眠,接种前用600 mg/L的GA3浸泡24 h,接种时用75%乙醇消毒30 s后,用2%的NaClO振荡消毒10 min,并用手术刀剥去种皮,接种在1/2MS基本培养基上,于25 ℃下遮光培养,60 d后移出到仅含60 g/L蔗糖及8 g/L琼脂的MS基本培养基上。
3 讨论成功的离体组织培养具有以下优点:能够在短时间内获得大批量的植物材料[11],并且所需空间较小, 可大大节省人力、物力及土地;保存期可避免由病原菌引起的退化、绝种;不经检疫便可直接进行种质发放或国际的种质交换;也使所保存的离体种质能用于生产和研究[12]。新疆野生郁金香是我国特有的优质种植资源,虽然种类多,分布广,但是由于放牧,牛羊啃食以及农田、林场的改造等原因,其生境遭到破坏,因此野生郁金香的保护、开发及利用等问题已经迫在眉睫。并且由于气候条件的局限和病害的影响,除北方一些地区自然条件较适合外,在一些夏季湿热的地区, 在克服种球退化、种球越夏管理等方面还存在一些问题[13]。由于受到采样与观察条件的限制,对一些园艺性状优良、具潜在育种价值的野生郁金香的研究也还无人涉及[14]。因此,野生郁金香的离体保存一方面对其资源保护和开发利用具有重要意义,另一方面,也为利用我国重要野生资源进行杂交育种和种球繁殖提供了可能。
本试验采用2%的NaClO处理10 min,获得了比HgCl2消毒更高的发芽率。因此,在除菌效果均较好的情况下,使用NaClO消毒更有利于郁金香种子发芽。原因可能是NaClO具有软化种皮的作用,也可能是NaCIO相对HgCl2而言毒性较低,对种子的伤害小,因此更利于种子萌发。由于消毒方式筛选和最佳培养条件试验同时进行,筛选最佳条件时采取的依旧是HgCl2消毒,若采用NaCIO消毒,可能会获得更高的发芽率。尽管如此,利用HgCl2消毒亦获得了较高的萌发率。目前,在郁金香鳞茎类观赏植物的无菌播种研究中,未见消毒方式优化的报道。
陈芳等[7]研究表明,低温(7 ℃)是野生郁金香种子萌发的首要条件,在低温条件下用GA3浸种处理可显著提高发芽率,并且发芽日期也缩短。在低温条件下郁金香种子发芽时间过长,新疆郁金香和伊犁郁金香的适宜萌发温度均为10 ℃,GA3处理可以替代层积作用[15]。郁金香杂交种子在15 ℃和24 ℃下暗培养或12 h/d光照培养均不萌发,只有在4 ℃条件下接种36~67 d才能萌发[6]。塔城郁金香(T. tarbagataica)和伊犁郁金香种子在室温条件下均不发芽,GA3对解除种子休眠效果显著,但不能代替低温,两者结合效果好[16]。张爱勤等[17]在探讨常温条件下种子萌发情况时发现,在4 ℃条件下刺破种子,500 mg/L GA3处理对打破郁金香休眠有效,培养基可提供充足营养,相对纸床而言又有较低的污染率。本试验也表明,较高质量浓度的GA3处理(600 mg/L)对野生郁金香发芽有促进作用,试验所用的野生郁金香种子在接种前均在4 ℃下冷藏了8周来打破休眠,然后在室温下培养,因此试验结论是室温条件较适宜野生郁金香种子的萌发,不同于已有研究。这表明,虽然4 ℃条件是发芽的必要条件,但发芽率仍旧不高,并且萌发时间过长。说明低温的作用主要为打破休眠,并不适宜郁金香种子的芽生长;因此,本试验采取先冷藏打破休眠,再在室温下培养获得了较好的效果,且在生产中利于节能。
在对兰科种子的无菌播种研究中发现,相对于MS和1/3MS,以1/2MS为基本培养基时获得的原球茎增殖量最多,生长快而健壮[18]。本试验也首次对比了MS和1/2MS 2种基本培养基对郁金香种子萌发的影响。结果表明,1/2MS对野生郁金香种子发芽更有效,优化了萌发条件。
王彩霞等[6]研究表明,在培养基中添加外源生长调节物质对提高野生杂交郁金香种子的萌发率无显著效果,但对促进鳞茎增殖和诱导畸形芽形成鳞茎有一定作用。本试验在使用仅含有60 g/L蔗糖、不含激素的培养基中获得了小鳞茎,但生长较慢,部分形成的细弱芽畸形,难以辨别状态。因此,在后续研究中可考虑添加外源生长调节剂以促进鳞茎的增殖和状态保持。在室外播种试验中,虽然获得了较高的发芽率,但未见鳞茎形成:表明组织培养是获得郁金香小鳞茎的一种稳定有效的手段。此外,我们也进行了室外土壤播种试验,发现2月播种后,4月出叶约1 cm,发芽整齐,发芽率高,但生长至5月份,叶子相继掉落,直至9月未见鳞茎形成,初步判定种子死亡。可能是由于小苗柔弱,难以适应露地环境,并且不耐高温。具体原因尚不明确,需要进一步探究。
4 结论本试验筛选出了新疆野生郁金香种子接种前的最佳处理方式和最佳培养条件,证明了首先采用4 ℃冷藏打破休眠,再置于25 ℃下培养比其他研究中的直接置于低温下培养效果好。郁金香种子剥皮处理是形成健壮芽的必要条件,而健壮芽又是离体小鳞茎形成的必要条件。试验通过建立的无菌萌发体系,成功获得了离体小鳞茎,实现了野生郁金香非原生生境的保存及扩繁。
| [1] | DU F, JIANG J, JIA H M, et al. Selection of generally applicable SSR markers for evaluation of genetic diversity and identity in Lilium. Biochemical Systematics and Ecology, 2015, 61: 278-285. DOI:10.1016/j.bse.2015.05.002 |
| [2] |
谭敦炎. 新疆的郁金香属种质资源. 植物杂志, 2001(6): 1-2. TAN D Y. Germplasm resources of tulip in Xinjiang. Plants, 2001(6): 1-2. (in Chinese with English abstract) |
| [3] |
吴昀, 马怡迪, 张琳, 等. 药百合种子萌发及染色体倍性检测. 中国农学通报, 2013, 13: 153-157. WU Y, MA Y D, ZHANG L, et al. Studies on seeds germination and ploidy levels of Lilium speciosum var. gloriosoides. Chinese Agricultural Science Bulletin, 2013, 13: 153-157. (in Chinese with English abstract) DOI:10.3969/j.issn.1000-6850.2013.03.031 |
| [4] |
马怡迪, 李岳, 李丹青, 等. 巨球百合无菌播种影响因素的研究. 湖南农业大学学报(自然科学版), 2015, 41(3): 271-275. MA Y D, LI Y, LI D Q, et al. Study on the factors influencing sterile sowing of Lilium brownii F. E. Brown ex Miellez var. giganteum. Journal of Hunan Agricultural University (Natural Sciences), 2015, 41(3): 271-275. (in Chinese with English abstract) |
| [5] |
段金玉, 谢亚红. 在无菌条件下激素和种子处理对兰属十种植物种子萌发的影响. 云南植物研究, 1982, 4(2): 197-201. DUAN J Y, XIE Y H. Effects of hormones and seed treatment on the germination of seeds of cymbidium species under sterile condition. Acta Botanica Yunnanica, 1982, 4(2): 197-201. (in Chinese with English abstract) |
| [6] |
王彩霞, 欧阳彤, 姜彦成. 新疆野生种与栽培种郁金香的杂交种子无菌萌发和鳞茎形成. 植物生理学通讯, 2009, 45(11): 1098-1100. WANG C X, OUYANG T, JIANG Y C. Aseptic germination and bulblet formation of interspecific hybrids between wild species and cultivar of tulip. Plant Physiology Communications, 2009, 45(11): 1098-1100. (in Chinese with English abstract) |
| [7] |
陈芳, 刘彤, 周玲玲. 新疆野生郁金香生物学特性及种子发芽特性的研究. 石河子大学学报(自然科学版), 2001, 5(3): 197-200. CHEN F, LIU T, ZHOU L L. Research on the biological and germinating characters of wild Tulipa. Journal of Shihezi University (Natural Science), 2001, 5(3): 197-200. (in Chinese with English abstract) |
| [8] | TANG A J, TIAN M H, LONG C L. Seed dormancy and germination of three herbaceous perennial desert ephemerals from the Junggar Basin, China. Seed Science Research, 2009, 19(3): 183-189. DOI:10.1017/S096025850999002X |
| [9] |
杨宏光, 谭莹莹, 孙晓梅. 郁金香杂交种子催芽技术的研究. 山东林业科技, 2009(1): 17-19. YANG H G, TAN Y Y, SUN X M. Technique about accelerating germination of tulip hybrid combination seed. Shandong Forestry Science and Technology, 2009(1): 17-19. (in Chinese with English abstract) |
| [10] | KLERK G J D. Micropropagation of bulbous crops: Technology and present state. Floriculture Ornamental Biotechnology, 2012(6): 1-8. |
| [11] | CHANG C, CHEN C T, TSAI Y C, et al. A tissue culture protocol for propagation of a rare plant Lilium speciosum Thunb. var. gloriosoides Baker. Botanical Bulletin-Academia Sinica Taipei, 2000, 41(2): 139-142. |
| [12] |
张巧仙, 范冬梅. 植物种质资源的保存:离体保存. 太原师范学院学报(自然科学版), 2005, 4(1): 82-85. ZHANG Q X, FAN D M. Research advances of germplasm conservation: In vitro conservation. Journal of Taiyuan Teachers College (Natural Science Edition), 2005, 4(1): 82-85. (in Chinese with English abstract) |
| [13] |
李宗仁. 西宁地区郁金香引种栽培试验. 北方园艺, 1997(4): 28-29. LI Z R. Introduction and cultivation experiment of tulip in Xining. Northern Horticulture, 1997(4): 28-29. (in Chinese with English abstract) |
| [14] |
康晓珊, 陆婷, 苏志豪, 等. 新疆野生郁金香资源的保护及其开发利用//中国植物学会. 生态文明建设中的植物学: 现在与未来. 中国植物学会第十五届会员代表大会暨八十周年学术年会论文集第4分会场: 资源植物学, 2013. KANG X S, LU T, SU Z H, et al. Protection and exploitation of Xinjiang wild tulip resources//Chinese Botanical Society. Botany in the Construction of Ecological Civilization: Present and Future. Proceedings of the 15th Session of the Chinese Botanical Society and the 80th Anniversary Symposium-Session 4, Resource Botany, 2013. (in Chinese) |
| [15] |
焦芳, 刘倩, 孙国峰, 等. 两种新疆野生郁金香种子萌发特性的研究. 北方园艺, 2015(2): 55-60. JIAO F, LIU Q, SUN G F, et al. Study on the germination traits of two kinds of wild tulip seeds in Sinkiang. Northern Horticulture, 2015(2): 55-60. (in Chinese with English abstract) |
| [16] |
朱新霞, 孙黎, 乐锦华. 野生郁金香的室内萌发研究. 种子, 2005, 24(11): 66-67. ZHU X X, SUN L, YUE J H. Study on the indoor germination of wild tulip. Seed, 2005, 24(11): 66-67. (in Chinese with English abstract) |
| [17] |
张爱勤, 景辉, 殷禅明, 等. 郁金香种子休眠特性及发芽条件的研究. 草业科学, 2010, 27(10): 48-53. ZHANG A Q, JING H, YIN C M, et al. Seed dormancy characteristics and germination condition of Tulipa gesnersiana. Pratacultural Science, 2010, 27(10): 48-53. (in Chinese with English abstract) |
| [18] |
王静, 娄玉霞, 郝再彬, 等. 大量元素、有机添加物、激素对蝴蝶兰原球茎增殖的影响. 上海农业科技, 2004(3): 21-23. WANG J, LOU Y X, HAO Z B, et al. Effects of macro elements, organic additives and hormones on the proliferation of protocorm multiplication of butterfly orchid. Shanghai Agricultural Science and Technology, 2004(3): 21-23. (in Chinese with English abstract) |
 2017, Vol. 43
2017, Vol. 43


