| 盐胁迫对不同耐盐性棉花幼苗生长与生理及无机离子器官分布的影响 |
2. 温州科技职业学院,浙江 温州 320056
2. Wenzhou Vocational College of Science and Technology, Wenzhou 320056, Zhejiang, China
土壤盐渍化是限制全球作物产量的最主要的非生物胁迫之一。据联合国教科文组织(UNESCO)和粮农组织(FAO)不完全统计,全世界盐渍化土地面积约为10亿hm2[1]。我国盐渍土的分布较广,主要分布在东北、华北、西北内陆地区以及长江以北沿海地带,盐渍土总面积约为0.36亿hm2,占全国可利用土地面积的41.88%[2]。近年来,由于环境污染和不合理的化肥施用,我国土壤盐渍化有加重趋势,同时,由于多种原因造成耕地面积逐渐减少,所以筛选和培育耐盐的作物品种是开发利用盐碱地的有效途径之一。
探究盐分胁迫下植物生长及生理代谢反应,是培育耐盐作物品种的重要基础。盐分胁迫对植物的伤害主要有离子毒害、渗透胁迫、营养失衡、激素失调和产生活性氧[3]。大量研究表明,活性氧代谢失调是盐胁迫导致植物细胞氧化损伤与细胞凋亡的重要原因之一[4-5]。植物经过长期进化形成了有效清除体内活性氧的保护系统(酶系统和非酶系统),该系统主要有:超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)、过氧化氢酶(catalase, CAT)等抗氧化酶,以及一些非酶促物质,如维生素E、维生素A、维生素C、谷胱甘肽、类胡萝卜素等[6]。这些物质通过植物体内普遍存在的抗坏血酸-谷胱甘肽循环直接或逐步分解活性氧自由基并实现自我再生[7]。
棉花(Gossypium hirsutum L.)被认为是比较耐盐的非盐生作物之一,也是盐碱地的先锋作物。研究表明:棉花在苗期和开花期对盐分比较敏感[8];棉花耐盐能力在不同品种之间、不同生育时期以及器官组织之间存在明显的差异[9]。棉花的耐盐机制是一个复杂的问题,虽然前人对不同耐盐性棉花品系间的农艺性状、抗氧化酶、离子运输等分别进行了研究[10-12],但从多个角度系统分析棉花耐盐性的生理机制相对较少。本研究通过对氯化钠(NaCl)胁迫下不同耐盐性棉花品系生长、生理生化特性的变化及主要无机离子的吸收分布特点进行研究与系统性分析,以进一步了解棉花的耐盐机制。
1 材料与方法 1.1 试验材料陆地棉(Gossypium hirsutum L.)耐盐品系早熟长绒7号(中期库编号:M111066)和盐敏感品系南丹巴地大花(中期库编号:M130293)均由中国农业科学院棉花研究所国家棉花种质资源中期库提供。
1.2 试验处理选择籽粒饱满且均匀一致的种子若干,用15%的过氧化氢消毒4 h,无菌水冲洗4次,再用无菌水室温下浸泡24 h。将浸泡过的种子置于含蛭石的育苗盆里,浇灌适量的清水,放置在28 ℃的人工气候室中3 d,待种子子叶刚刚伸展开时,将幼苗转移至体积为5 L的塑料黑桶中,每桶种植7株,用改良的Hoagland营养液进行培养,每2 d更换1次营养液,24 h通气1次。人工气候室参数设置:光照强度为450 μmol/(m2·s);昼夜温度为28 ℃/22 ℃;光照时间(昼/夜)为14 h/10 h;CO2浓度>720 mg/m3;空气湿度为60%~80%。待幼苗长至第三真叶出现时,进行盐处理,每隔24 h营养液中NaCl浓度分别增加25 mmol/L和50 mmol/L,直至营养液中NaCl浓度分别达到150 mmol/L和300 mmol/L;并以在不加盐营养液中生长的植株为对照。每个处理3次重复。幼苗在最终盐浓度下培养7 d后,进行相关指标的测定与取样分析。
1.3 测定方法 1.3.1 光合速率与农艺性状测定光合气体交换参数测定:在晴天上午10:00—12:00最强光照下,用Li-6400光合仪(Li-COR公司, 美国)测定幼苗主茎倒4叶的光合速率。
测定每株棉花幼苗的苗高、根长,统计主根上的一级侧根数,并用电子天平(BSA124S-CW, Sartorius公司, 德国)对植株地上部(包括根、茎、叶和子叶)和地下部(根)鲜质量进行称量。
1.3.2 生理指标测定称取棉花叶片0.5 g,加液氮研磨成粉末,转入10 mL离心管中,加入5 mL 50 mmol/L磷酸盐缓冲液(pH 7.8),振荡摇匀,4 ℃、1万r/min离心20 min,取上清液即粗酶液,用于酶活性和丙二醛(malondialdehyde, MDA)含量测定。
参照李合生等[13]的方法:SOD活性的测定采用氮蓝四唑(nitro-blue tetrazolium, NBT)光还原法,以抑制NBT光还原50%的酶量为1个酶活力单位;POD活性测定采用愈创木酚法,以1 min内D(470 nm)变化0.01的酶量为1个酶活力单位,U;MDA含量的测定采用硫代巴比妥酸显色法。
1.3.3 Na+、K+、Ca2+、Mg2+含量的测定分别取新鲜的根、茎和叶,在105 ℃条件下杀青30 min,于70 ℃下烘至恒量。将烘干后的样品粉碎过筛(0.3 mm),分别称取0.2 g样品,加入6 mL浓硝酸(HNO3)和200 μL 30%过氧化氢(H2O2)进行微波消解。将消解后的样品用去离子水定容至50 mL,用电感耦合等离子体原子发射光谱法(ICP-AES)(Optima 2100DV, PerkinElmer公司, 美国)测定无机离子Na+、K+、Ca2+和Mg2+含量。
1.4 数据统计试验数据采用SPSS 17.0软件进行方差分析,结果用平均数±标准误表示;以最小显著性差异法进行多重比较和差异显著性检验。
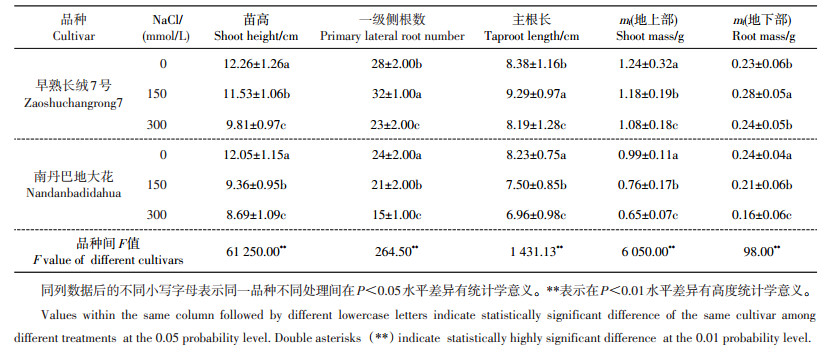
2 结果与分析 2.1 NaCl胁迫对棉花幼苗生长的影响从表 1可以看出,随NaCl浓度的升高,2种不同耐盐性棉花幼苗的生长差异显著。在NaCl胁迫下,耐盐品系早熟长绒7号与盐敏感品系南丹巴地大花的苗高都呈显著降低的趋势。在150 mmol/L NaCl条件下,早熟长绒7号的一级侧根数、主根长和地下部鲜质量与对照相比分别增长14.3%、10.9%、21.7%:说明在一定盐浓度条件下,NaCl能促进耐盐植株根系的生长。盐胁迫会导致根内细胞失水,产生生理性干旱,耐盐植株通过增加侧根数量和促进主根生长来扩大根系表面积,从而减缓盐胁迫导致的生理性干旱。NaCl处理后,南丹巴地大花地上部和地下部生长的受抑制程度明显高于早熟长绒7号:说明早熟长绒7号的耐盐性强于南丹巴地大花。
| 表1 NaCl胁迫对棉花幼苗生长的影响 Table 1 Effects of NaCl stress on growth of cotton seedlings |
 |
| 点击放大 |
从图 1可以看出,与对照相比,NaCl胁迫导致棉花幼苗叶片的净光合速率显著降低。在150和300 mmol/L NaCl胁迫条件下,南丹巴地大花的光合速率分别比对照降低22.5%和46.2%,早熟长绒7号分别比对照降低20.1%和33.2%。相较而言,南丹巴地大花光合速率的下降幅度高于早熟长绒7号,说明盐胁迫下耐盐品系早熟长绒7号依然能保持相对较高的光合速率。光合作用是植物生长的必要条件,因此,耐盐植株在盐胁迫下维持相对较高的光合作用水平,是保证植株正常生长的基础,也是耐盐特征之一。
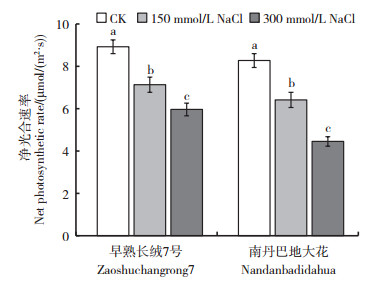 |
| CK:0 mmol/L NaCl。短栅上的不同小写字母表示同一品种不同处理间在P<0.05水平差异有统计学意义。 CK: 0 mmol/L NaCl. Different lowercase letters above bars indicate statistically significant differences of the same cultivar among different treatments at the 0.05 probability level. 图1 NaCl胁迫对棉花幼苗叶片净光合速率的影响 Fig. 1 Effects of NaCl stress on net photosynthetic rate in the leaves of cotton seedlings |
随NaCl浓度的升高,早熟长绒7号的POD和SOD活性呈逐渐升高的趋势,而南丹巴地大花的POD和SOD活性呈先升高然后降低的趋势(图 2,3)。说明在一定的盐胁迫条件下,通过提高植株体内的抗氧化酶活性,是棉花响应盐胁迫的基本调节机制。在150和300 mmol/L NaCl处理下,早熟长绒7号的SOD活性比对照分别提高了8.3%和14%,POD活性比对照分别提高了22.0%和34.6%。在高盐浓度条件下,只有耐盐植株依然能维持相对较高的抗氧化酶活性:说明耐盐植株具有较强的抗氧化酶系统。
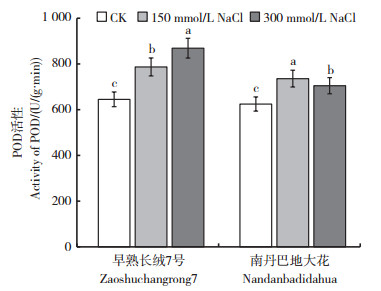 |
| CK:0 mmol/L NaCl。短栅上的不同小写字母表示同一品种不同处理间在P<0.05水平差异有统计学意义。 CK: 0 mmol/L NaCl. Different lowercase letters above bars indicate statistically significant differences of the same cultivar among different treatments at the 0.05 probability level. 图2 NaCl胁迫对棉花幼苗叶片POD活性的影响 Fig. 2 Effects of NaCl stress on the activity of peroxidase (POD) in the leaves of cotton seedlings |
 |
| CK:0 mmol/L NaCl。短栅上的不同小写字母表示同一品种不同处理间在P<0.05水平差异有统计学意义。 CK: 0 mmol/L NaCl. Different lowercase letters above bars indicate statistically significant differences of the same cultivar among different treatments at the 0.05 probability level. 图3 NaCl胁迫对棉花幼苗叶片SOD酶活性的影响 Fig. 3 Effects of NaCl stress on the activity of superoxide dismutase (SOD) in the leaves of cotton seedlings |
从图 4可以看出,早熟长绒7号和南丹巴地大花的MDA含量随NaCl浓度的升高而显著升高。在150和300 mmol/L NaCl处理条件下,早熟长绒7号的MDA含量比对照分别提高了21.6%和64.7%,南丹巴地大花的MDA含量比对照分别提高了30.3%和83.5%。随NaCl浓度的升高,南丹巴地大花的MDA含量上升幅度显著高于早熟长绒7号(品种间F值为40 044.50,P<0.01)。盐胁迫可以致使细胞膜氧化损伤,从而积累MDA代谢产物。在盐胁迫下,耐盐能力弱的植株体内更易积累相对较高的MDA。
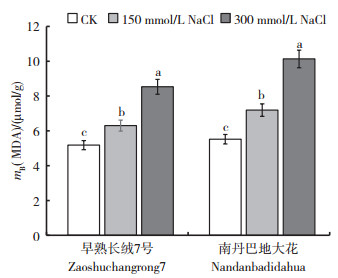 |
| CK:0 mmol/L NaCl。短栅上的不同小写字母表示同一品种不同处理间在P<0.05水平差异有统计学意义。 CK: 0 mmol/L NaCl. Different lowercase letters above bars indicate statistically significant differences of the same cultivar among different treatments at the 0.05 probability level. 图4 NaCl胁迫对棉花幼苗叶片MDA含量的影响 Fig. 4 Effects of NaCl stress on the content of malondialdehyde (MDA) in the leaves of cotton seedlings |
在NaCl胁迫条件下,2个品系不同器官(根、茎、叶)中的Na+含量随NaCl浓度的升高均大幅上升(表 2)。在同一NaCl浓度条件下,不同器官Na+含量为根>茎和叶:表明根系能蓄积部分Na+。耐盐性不同的2个棉花品系在器官水平上Na+含量差异均不显著。
| 表2 NaCl胁迫对棉花幼苗K+、Na+、Ca2+、Mg2+含量及Na+/K+的影响 Table 2 Effects of NaCl stress on the contents of K+, Na+, Ca2+, Mg2+ and Na+/K+ in cotton seedlings |
 |
| 点击放大 |
与对照相比,经NaCl胁迫处理后2个品系不同组织中的K+含量均呈降低趋势(表 2),盐胁迫处理能抑制棉花幼苗对K+的吸收。在150和300 mmol/L NaCl条件下,早熟长绒7号不同器官中的K+含量均高于南丹巴地大花。对Na+/K+的计算表明,南丹巴地大花的Na+/K+显著高于早熟长绒7号:说明在盐胁迫下耐盐品系幼苗比盐敏感品系能保持相对较高的K+含量。在高盐条件下,耐盐植株能使体内K+含量维持在较高水平,减缓由细胞内Na+迅速增加所导致的细胞渗透压失衡。
与对照相比,经NaCl胁迫处理后,棉花幼苗中的Ca2+含量呈逐渐降低的趋势(表 2):表明盐胁迫显著抑制了棉花幼苗对Ca2+的吸收。盐胁迫对棉花幼苗根和茎中Mg2+含量影响不大,而叶片中的变化较为显著(表 2)。在150和300 mmol/L NaCl条件下,耐盐品系早熟长绒7号叶片中的Mg2+含量分别比对照升高了32.6%和49.7%。随NaCl浓度的升高,盐敏感品系南丹巴地大花叶片中的Mg2+含量先上升后降低。
3 讨论盐碱、低温、病害等逆境条件会阻碍植物根系从土壤中吸收水分,从而引起体内水分亏缺,造成植物生理性干旱。为适应盐分胁迫导致的生理性干旱,具有强大的根系系统,已成为耐盐植物的普遍特征。本研究表明,在150 mmol/L NaCl条件下,早熟长绒7号的一级侧根数、主根长和地下部鲜质量与对照相比呈显著的增长趋势:说明在一定的盐胁迫条件下,耐盐品系的棉花幼苗通过促使主根和侧根的生长,扩大根系面积,增加根系生长量,以提高根系对水分和矿物质的吸收能力,从而缓解盐胁迫导致的生理性干旱。这可能是耐盐棉花幼苗响应盐胁迫的机制之一。
盐胁迫对棉花幼苗叶片的光合速率有明显的抑制作用。在盐胁迫处理下,耐盐品系早熟长绒7号和盐敏感品系南丹巴地大花的光合速率均呈显著降低的趋势。BRUGNOLI等[14]认为,棉花叶片光合速率的降低主要是由于气孔导度降低;但刘金定等[15]研究认为,盐胁迫抑制氮的吸收,导致蛋白质含量降低,从而影响光合作用所需的酶活性,致使光合速率下降。
相关研究[16-17]表明,棉花的抗氧化能力与耐盐性呈正相关,在盐胁迫下棉花通过上调抗氧化酶活性缓解盐诱导的氧化胁迫,使棉花表现出耐盐性。耐盐品系早熟长绒7号在盐胁迫下叶片的SOD、POD活性与对照相比表现出显著增长的趋势。而在同一盐浓度处理条件下,盐敏感品系南丹巴地大花的SOD、POD活性均显著低于早熟长绒7号,这与GOSSETT等[18]和彭振等[19]的研究结果一致。表明在盐胁迫条件下,耐盐品系比盐敏感品系具有较高的抗氧化酶活性,能帮助其清除体内产生的活性氧自由基。
丙二醛含量的多少可以反映细胞膜损伤程度的高低,因此可用丙二醛含量高低作为耐盐性高低的生理指标之一[20]。据研究报道,NaCl胁迫使细胞产生超氧自由基,诱导膜脂过氧化,产生丙二醛[21]。在盐胁迫下,耐盐性不同的2个棉花品系中的丙二醛含量随着盐胁迫浓度的升高均呈显著上升的趋势。这与马丽等[22]和辛承松等[23]的研究结果不太一致,可能是由于试验材料的品种差异所致。但在同一盐浓度下,耐盐品系的丙二醛含量与盐敏感品系相比明显较低,这可能是因为耐盐品系具有较强的抗氧化酶系统,能减少细胞内超氧自由基,缓解膜脂过氧化,从而降低了丙二醛含量。
盐胁迫使棉花体内的无机离子含量发生显著变化。Na+是NaCl胁迫的主要毒害因子之一[24]。在同一盐浓度下,对于耐盐性不同的2个棉花品系,在器官水平上,Na+含量为根>茎和叶:表明根系能蓄积部分Na+。这与KONG等[25]和裘丽珍等[26]的研究结果一致。K+对维持细胞渗透压和保持正常的生化反应至关重要。在盐胁迫下,耐盐品系与盐敏感品系相比,其根、茎、叶中能保持相对较低的Na+/K+:说明耐盐品系能维持相对较高的K+含量,这也是植物盐适应的决定因素之一[27]。Ca2+在盐胁迫下可保护细胞的膜结构,保障细胞信号通路畅通[28]。在同一盐浓度处理下,耐盐品系地上部(茎和叶)中的Ca2+含量高于盐敏感品系;因此,耐盐植株的根系可以选择性向上运输Ca2+。Mg2+是蛋白质合成过程中必不可少的元素。随着盐浓度的升高,耐盐品系早熟长绒7号叶片中的Mg2+含量显著升高,这与SOD和POD酶活性变化趋势一致。蛋白质的合成启动需要Mg2+参与,在盐胁迫下耐盐性强的棉花品系可能通过提高Mg2+的吸收,加强体内SOD、POD、CAT等抗氧化酶活性,从而有效清除细胞内活性氧自由基,减轻盐胁迫所致的氧化损伤。
综上所述,棉花耐盐品系通过调节自身根系的生长、增强抗氧化酶系统及协调不同离子间的平衡,以减轻盐胁迫导致的离子毒害和氧化损伤;地上部维持相对较高的K+、Ca2+、Mg2+含量,减小Na+毒害作用,使叶片保持较高的光合作用,从而减小盐胁迫对棉花幼苗生长的影响。
| [1] |
王遵亲, 祝寿泉, 俞仁培, 等. 中国盐渍土. 北京: 科学出版社, 1993: 325-344. WANG Z Q, ZHU S Q, YU R P, et al. Saline Soil in China. Beijing: Science Press, 1993: 325-344. (in Chinese with English abstract) |
| [2] |
杨劲松. 中国盐渍土研究的发展历程与展望. 土壤学报, 2008, 45(5): 837-845. YANG J S. Development and prospect of the research on salt affected soils in China. Acta Pedologica Sinica, 2008, 45(5): 837-845. (in Chinese with English abstract) |
| [3] | ASHRAF M, FOOLAD M R. Roles of glycine betaine and proline in improving plant abiotic stress resistance. Environmental and Experimental Botany, 2007, 59(2): 206-216. DOI:10.1016/j.envexpbot.2005.12.006 |
| [4] | LIU T, STADEN J V, CRESS W A. Salinity induced nuclear and DNA degradation in meristematic cells of soybean (Glycine max L.) roots. Plant Growth Regulation, 2000, 30(1): 49-54. DOI:10.1023/A:1006311619937 |
| [5] | BETHKE P C, JONES R L. Cell death of barley aleurone protoplasts is mediated by reactive oxygen species. Plant Journal, 2001, 25(1): 19-29. DOI:10.1046/j.1365-313x.2001.00930.x |
| [6] |
杜秀敏, 殷文璇, 赵彦修, 等. 植物中活性氧的产生及清除机制. 生物工程学报, 2001, 17(2): 121-125. DU X M, YIN W X, ZHAO Y X, et al. The production and scavenging of reactive oxygen species in plants. Chinese Journal of Biotechnology, 2001, 17(2): 121-125. (in Chinese with English abstract) |
| [7] |
李向前, 王艳, 张富春. 棉花耐盐性及抗氧化性研究进展. 生物技术通报, 2009(6): 20-24. LI X Q, WANG Y, ZHANG F C. Research progress of salt tolerance and antioxidation of cotton. Biotechnology Bulletin, 2009(6): 20-24. (in Chinese with English abstract) |
| [8] |
孙小芳, 刘友良, 陈沁. 棉花耐盐性研究进展. 棉花学报, 1998, 10(3): 118-124. SUN X F, LIU Y L, CHEN Q. Recent progress in studies on salinity tolerance in cotton. CottonScience, 1998, 10(3): 118-124. (in Chinese with English abstract) |
| [9] |
蒋玉蓉, 吕有军, 祝水金. 棉花耐盐机理与盐害控制研究进展. 棉花学报, 2006, 18(4): 248-254. JIANG Y R, Lü Y J, ZHU S J. Advance in studies of the mechanism of salt tolerance and controlling of salt damage in upland cotton. Cotton Science, 2006, 18(4): 248-254. (in Chinese with English abstract) |
| [10] | GOSSETT D R, MILLHOLLON E P, LUCAS M C, et al. The effects of NaCl on antioxidant enzyme activities in callus tissue of salt-tolerant and salt-sensitive cotton cultivars (Gossypiumhirsutum L.). Plant Cell Reports, 1994, 13(9): 498-503. |
| [11] | ASHRAF M, AHMAD S. Influence of sodium chloride on ion accumulation, yield components and fibre characteristics in salt tolerant and salt-sensitive lines of cotton (Gossypium hirsutum L.). Field Crops Research, 2000, 66(2): 115-127. DOI:10.1016/S0378-4290(00)00064-2 |
| [12] |
李向前, 鲍乾, 王艳, 等. 棉花两品种耐盐性与抗氧化能力的相关性. 植物生理学通讯, 2010, 46(11): 1129-1134. LI X Q, BAO Q, WANG Y, et al. The relationship between salt tolerance and antioxidation of two cotton cultivars. Plant Physiology Communications, 2010, 46(11): 1129-1134. (in Chinese with English abstract) |
| [13] |
李合生, 孙群, 赵世杰, 等. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000: 164-261. LI H S, SUN Q, ZHAO S J, et al. The Experiment Principle and Technique on Plant Physiology and Biochemistry. Beijing: Higher Education Press, 2000: 164-261. (in Chinese with English abstract) |
| [14] | BRUGNOLI E, LAUTERI M. Effects of salinity on stomatal conductance, photosynthetic capacity, and carbon isotope discrimination of salt-tolerant (Gossypium hirsutum L.) and salt sensitive (Phaseolus vulgaris L.) C3 non-halophytes. Plant Physiology, 1991, 95(2): 628-635. DOI:10.1104/pp.95.2.628 |
| [15] |
刘金定, 朱召勇, 樊宝香. 棉花品种在不同浓度盐胁迫下的生理表现. 中国棉花, 1995, 22(9): 16-17. LIU J D, ZHU Z Y, FAN B X. The physiological performance of cotton cultivars under different concentrations of salt stress. China Cotton, 1995, 22(9): 16-17. (in Chinese with English abstract) |
| [16] | GARRATT L C, JANAGOUDAR B S, LOWE K C, et al. Salinity tolerance and antioxidant status in cotton cultures. Free Radical Biology and Medicine, 2002, 33(4): 502-511. DOI:10.1016/S0891-5849(02)00838-9 |
| [17] | MELONI D A, OLIVA M A, MARTINEZ C A, et al. Photosynthesis and activity of superoxide dismutase, peroxidase and glutathione reductase in cotton under salt stress. Environmental and Experimental Botany, 2003, 49(1): 69-76. DOI:10.1016/S0098-8472(02)00058-8 |
| [18] | GOSSETT D R, MILLHOLLON E P, LUCAS M C. Antioxidant response to NaCl stress in salt tolerant and salt sensitive cultivars of cotton. Crop Science, 1994, 34(3): 706-714. DOI:10.2135/cropsci1994.0011183X003400030020x |
| [19] |
彭振, 何守朴, 孙君灵, 等. 陆地棉苗期耐盐性的高效鉴定方法. 作物学报, 2014, 40(3): 476-486. PENG Z, HE S P, SUN J L, et al. An efficient approach to identify salt tolerance of upland cotton at seedling stage. Acta Agronomica Sinica, 2014, 40(3): 476-486. (in Chinese with English abstract) |
| [20] |
张亚冰, 刘崇怀, 潘兴, 等. 盐胁迫下不同耐盐性葡萄砧木丙二醛和脯氨酸含量的变化. 河南农业科学, 2006, 35(4): 84-86. ZHANG Y B, LIU C H, PAN X, et al. Changes of MDA and proline contents in grape rootstocks under NaCl stress. Journal of Henan Agricultural Sciences, 2006, 35(4): 84-86. (in Chinese with English abstract) |
| [21] |
王秀玲, 程序, 谢光辉, 等. NaCl胁迫对甜高粱发芽期生理生化特性的影响. 生态环境学报, 2010, 19(10): 2285-2290. WANG X L, CHENG X, XIE G H, et al. Effect of NaCl stress on physiological characteristics of sweet sorghum in sprout stages. Ecology and Environmental Sciences, 2010, 19(10): 2285-2290. (in Chinese with English abstract) DOI:10.3969/j.issn.1674-5906.2010.10.004 |
| [22] |
马丽, 侯振安, 梁永超, 等. NaCl胁迫对棉花幼苗生理特性的影响. 石河子大学学报(自然科学版), 2008, 26(2): 180-184. MA L, HOU Z A, LIANG Y C, et al. Effects of NaCl stress on physiological characteristics of different cotton cultivars in seedling stage. Journal of Shihezi University (Natural Science), 2008, 26(2): 180-184. (in Chinese with English abstract) |
| [23] |
辛承松, 董合忠, 唐薇, 等. 棉花盐害与耐盐性的生理和分子机理研究进展. 棉花学报, 2005, 17(5): 309-313. XIN C S, DONG H Z, TANG W, et al. Physiological and molecular mechanisms of salt injury and salt tolerance in cotton. Cotton Science, 2005, 17(5): 309-313. (in Chinese with English abstract) |
| [24] |
朱小梅, 洪立洲, 王茂文, 等. NaCl胁迫下作物对离子的吸收及分配. 中国土壤与肥料, 2010(4): 1-4. ZHU X M, HONG L Z, WANG M W, et al. Absorption and transportation of ions in crops under NaCl stress. Soil and Fertilizer Sciences in China, 2010(4): 1-4. (in Chinese with English abstract) |
| [25] | KONG X, LUO I, DONG H, et al. Effects of non-uniform root zone salinity on water use, Na+ recirculation, and Na+ and H+ flux in cotton. Journal of Experimental Botany, 2012, 63(5): 2105-2116. DOI:10.1093/jxb/err420 |
| [26] |
裘丽珍, 黄有军, 黄坚钦, 等. 不同耐盐性植物在盐胁迫下的生长与生理特性比较研究. 浙江大学学报(农业与生命科学版), 2006, 32(4): 420-427. QIU L Z, HUANG Y J, HUANG J Q, et al. Comparative study on vegetal and physiological characteristics of different salt-tolerant plants under salt stress. Journal of Zhejiang University (Agriculture and Life Sciences), 2006, 32(4): 420-427. (in Chinese with English abstract) |
| [27] | WU H, SHABALA L, BARRY K, et al. Ability of leaf mesophyll to retain potassium correlates with salinity tolerance in wheat and barley. Physiologia Plantarum, 2013, 149(4): 515-527. DOI:10.1111/ppl.2013.149.issue-4 |
| [28] |
王芳, 万书波, 孟庆伟, 等. Ca2+在植物盐胁迫响应机制中的调控作用. 生命科学研究, 2012, 16(4): 362-367. WANG F, WAN S B, MENG Q W, et al. Regulation of Ca2+ in plant response mechanisms under salt stress. Life Science Research, 2012, 16(4): 362-367. (in Chinese with English abstract) |
 2017, Vol. 43
2017, Vol. 43


