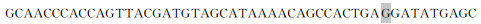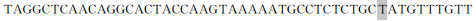| 鸭RIG-1启动子克隆、序列分析及在鸭胚胎期发育性表达 |
5′ flanking promoter sequence of duck RIG-1 was obtained by PCR amplification and was analyzed by bioinformatics. The expression profiles of RIG-1 were detected by qRT-PCR in immune organs during duck embryonic development, as well as the predicted transcription factors regulating RIG-1 transcription.
4 372 bp of duck RIG-1 promoter region was finally obtained. Bioinformatics analysis showed that typical elements, including TATA-box, CAAT-box, and binding sites of transcription factors, such as IRF-1, RXR, RAR, AP1, NF-κB, SP1, IL6 and Pax-2, were distributed in duck RIG-1 promoter region. Studies had demonstrated that IRF-1 can promote the expression of human RIG-1 and Pax-2 can inhibit the expression of mouse RIG-1. Besides, a CpG island with 65.8% GC content was predicted in duck RIG-1 promoter region, which has been found in mouse too. These data indicated that a similar transcription regulation manner may exist in duck with human and mouse. The results of qRT-PCR demonstrated that RIG-1 expression levels were dynamic in immune organs during duck embryo stages, and the expression of RIG-1 in bursa of Fabricius is higher than in spleen and thymus. Clustering of gene expression pattern showed that RIG-1 had similar expression patterns with IRF-1, RXR, AP1, NF-κB and IL6 in bursa of Fabricius, which may be due to that the bursa of Fabricius, compared with thymus and spleen, had relatively complete structure and function in duck embryo stages. This result indicated that they might regulate the transcription of RIG-1. Moreover, RIG-1 always had similar expression pattern with IRF-1 and NF-κB in bursa of Fabricius, spleen and thymus, which suggested that IRF-1 and NF-κB could regulate the expression of RIG-1.
It was the first report about the promoter sequence of duck RIG-1. The findings in characteristics of duck RIG-1 promoter region, and the relationships between RIG-1 and its transcription factors reflected by mRNA expression profiles in immune organs of embryonic stages may provide a basis and direction to explore transcriptional regulation and expression of duck RIG-1.
维甲酸诱导基因1样受体 (retinoic acid inducible gene-1-like receptors, RLRs) 作为模式识别受体 (pattern-recognition receptors, PRRs) 的一员在天然免疫系统中发挥着重要的作用[1]。维甲酸诱导基因1(RIG-1) 作为RLRs家族的重要成员, 属于胞内识别受体, 能有效识别逃避细胞膜上Toll样受体 (Toll-like receptors, TLRs) 识别而入侵到细胞质中的5′-末端磷酸化结构 (5′-ppp) 的单链RNA (ssRNA) 和双链RNA (dsRNA) 病毒, 通过信号通路级联放大作用诱导细胞因子、趋化因子和干扰素 (interferon, IFN) 等的产生[2-4]。KATO等[5]通过敲除小鼠RIG-1基因证明, RIG-1能识别细胞内的A型禽流感病毒、新城疫病毒、仙台病、日本乙型脑炎病毒、水疱性口炎病毒等, 并特异性产生IFN-β, 提示RIG-1在天然抗病毒感染中具有重要作用。
近年来, 抗病育种已经成为禽类育种的一个重要方向。已经证实, 鸡基因组中缺失RIG-1基因, 而水禽基因组中均有RIG-1基因并均在先天抗病毒免疫中发挥着重要作用[6-8]。BARBER等[7]研究发现将鸭源RIG-1基因瞬时转染到鸡DF-1细胞中, 能够诱导IFN-β启动子的激活; 并且当用高、低禽流感病毒感染鸡DF-1后, 再瞬时转染鸭源RIG-1基因后可以抑制禽流感病毒的复制, 说明RIG-1对禽流感病毒的识别和抑制具有一定作用。SUN等[8]研究发现将鹅源RIG-1瞬时转染293T细胞后, 能够诱导IFN-β的产生和降低新城疫病毒的滴度。以上研究提示, RIG-1基因可能是水禽较鸡具有较强抵抗天然流感病毒能力的原因之一。
启动子作为基因表达调控的重要元件, 可通过控制基因转录来调控基因的表达从而影响基因的功能。目前, RIG-1启动子的序列仅在人和小鼠上被克隆研究。YUAN等[9]扩增得到小鼠RIG-1基因ATG前2.3 kb基因组DNA序列, 发现视网膜母细胞瘤蛋白 (RB) 可以抑制RIG-1启动子的活性和Pax-2可以上调RIG-1的表达并与其存在着共表达。JIANG等[10]扩增得到人RIG-1基因前14 920 bp基因组DNA序列, 通过构建启动子荧光素酶报告缺失载体证明了人RIG-1启动子区域包含一个功能性的DR5 RARE, 它可以通过结合视黄素类维生素AX受体 (RXR) 和维甲酸受体 (RAR) 的异二聚体来调节RIG-1启动子的反式激活; 除此之外, SU等[11]发现人RIG-1启动子存在一个IRF-1结合位点, 并且IFN-β基因的表达可以提高该结合位点结合IRF-1的能力。迄今为止, 鸟类RIG-1基因启动子相关研究尚属空白, 研究鸭RIG-1启动子结构与功能, 有助于探究RIG-1基因在先天抗病毒免疫中的作用。
因此, 本研究拟克隆鸭RIG-1启动子序列, 分析其启动子区域特点, 以及预测的重要转录因子与RIG-1表达调控的可能关系, 为探究鸭RIG-1基因转录调控与表达奠定基础。
1 材料与方法 1.1 组织样品采集本试验所用的鸭胚均来自于四川农业大学家禽育种场。分别随机选取在相同孵化条件下, 胚龄为第18天 (ED18)、第22天 (ED22) 和第26天 (ED26) 的鸭胚及出生后1 d (D1) 的农华肉鸭 (NH-JS) 各5只, 快速分离出各样品的胸腺、脾脏和法氏囊组织, 速冻于液氮。组织样品液氮研磨成粉后立刻放置-80 ℃冰箱保存, 用于提取总RNA。
1.2 鸭RIG-1基因启动子的克隆测序按照DNA提取试剂盒 (天根生化科技有限公司, 北京, 中国) 操作步骤提取鸭基因组DNA。根据NCBI鸭RIG-1基因预测序列 (登录号:NW_004685070.1), 用Primer Premier 5.0设计5条扩增引物 (表 1) 用于鸭RIG-1启动子序列的克隆, 引物由华大生物技术有限公司合成。PCR反应体系:10 μL总体积中包含模板DNA 1 μL, 上、下游引物各0.5 μL, PCR Master Mix 5 μL, ddH2O 3.2 μL。PCR扩增程序:95 ℃预变性5 min; 95 ℃变性30 s, 55.4 ℃(P1, P2)、57.6 ℃(P3, P5)、53.8 ℃(P4) 退火30 s, 72 ℃延伸70 s (P1, P2)、60 s (P3, P5)、40 s (P4), 35个循环; 72 ℃延伸10 min。将扩增产物在1.5%琼脂糖凝胶中电泳, 用Gel Extraction Kit胶回收试剂盒 (Omega, USA) 回收目的序列片段, 纯化后的目标序列片段与pMDl9-T载体 (TaKaRa, Japan) 连接并转化到DH5α感受态细胞中, 菌液PCR鉴定挑选阳性克隆送上海英骏生物技术有限公司测序。
| 表1 鸭RIG-1启动子扩增引物 Table 1 Primers used to amplify the promoter of RIG-1 |
 |
| 点击放大 |
用DNAstar进行人工校对、多序列比对和拼接; NCBI Blast进行序列的同源性比对; Neural Network (http://www.fruitfly.org/seqtools/promoter.html) 预测核心启动子区; Plant Care (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/) 预测启动子典型结构域位点; TRANSFAC®(http://www.gene-regulation.com/pub/databases.html) 预测转录因子结合位点, CpG Island Searcher (http://cpgislands.usc.edu/) 进行CpG岛的预测分析。
1.4 qRT-PCR检测基因相对表达量利用RNA抽提试剂盒提取鸭胸腺、脾脏和法氏囊总RNA, 1.5%琼脂糖凝胶电泳检测总RNA质量, 利用Prime Scrip RT reagent kit (TaKaRa, Japan) 反转录, 合成cDNA第一链, 稀释成150 ng/μL, -20 ℃保存。
根据表 2中NCBI登录号、使用软件Oligo 6.0和Primer 5.0分别设计了8对实时荧光定量引物, 通过克隆测序验证引物正确。反应体系:定量Mix 6.25 μL, 上下游引物各1 μL, 稀释后的模板cDNA 4.25 μL; 反应程序:95 ℃预变性0.5 min; 95 ℃ 5 s, 退火30 s, 共39个循环; 95 ℃ 10 s, 65 ℃ 5 s, 95 ℃最终延伸。
| 表2 定量PCR引物 Table 2 Primers used for qRT-PCR |
 |
| 点击放大 |
运用Bio-Rad iQ5软件的2-ΔΔCT法对qRT-PCR结果进行分析, 计算目的基因相对内参的表达量; 采用单因素方差分析处理数据, 采用Duncan分析计算显著性; 所有结果以平均值±标准误表示。数据均使用SPSS 19.0软件进行处理, 显著性设定为P < 0.05。
2 结果与分析 2.1 鸭RIG-1启动子区序列扩增通过PCR扩增鸭RIG-1基因ATG上游启动子片段, 扩增的目的片段长度分别为1 194 bp、1 170 bp、1 006 bp、530 bp、1 060 bp (图 1A)。运用DNAStar软件对5段扩增序列进行接拼后获得4 372 bp序列。克隆测序后结果经NCBI比对, 与鸭RIG-1启动子预测序列同源性达99%(图 1B), 表明所扩增序列为鸭RIG-1启动子序列。
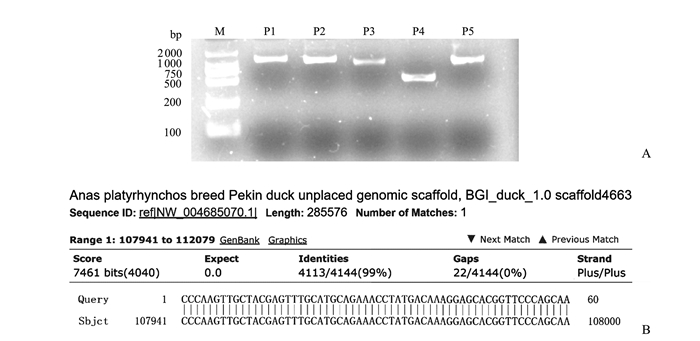 |
| M:DL2000分子质量标准; (P1~P5):分别为1 194 bp、1 170 bp、1 006 bp、530 bp、1 060 bp。 M: standard molecular mass of the marker DL2000; (P1-P5): represent 1 194 bp, 1 170 bp, 1 006 bp, 530 bp, 1 060 bp, respectively. 图1 1.5%琼脂糖凝胶电泳检测胶图 (A) 与NCBI Blast比对结果 (B) Fig. 1 Detection figure of 1.5% agarose gel electrophoresis (A) and the comparison results from NCBI Blast (B) |
序列分析结果表明, 扩增得到的鸭RIG-1基因启动子序列存在3个潜在的核心活性区域 (表 3), 其中活性区1为核心转录区域可能性最大。
| 表3 鸭RIG-1启动子核心转录区域预测 Table 3 Prediction results of RIG-1 core transcriptional promoter region |
 |
| 点击放大 |
通过在线软件CpG Island Searcher预测分析发现, 鸭RIG-1基因启动子上存在一个典型CpG岛区域 (-578~-1 bp)(图 2), CpG岛区域长度为582 bp, GC含量为65.8%。
 |
| 图2 鸭RIG-1启动子甲基化区域预测 Fig. 2 Prediction results of RIG-1 promoter methylation region |
序列分析表明, 鸭RIG-1基因启动子存在典型的TATA-box、CAAT-box以及IRF-1、RXR、RAR、AP1、NF-κB、SP1、IL6及Pax-2等多个与细胞增殖分裂和免疫相关的转录因子结合位点 (图 3)。
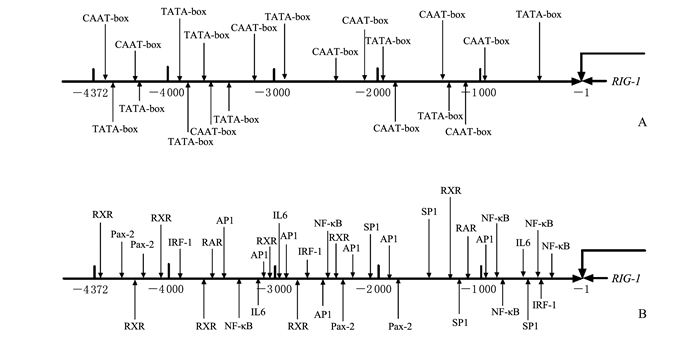 |
| 图3 典型结构域位点和转录因子调控元件结合位点预测 Fig. 3 Prediction results of typical structure domain sites and transcription factors regulating element binding sites |
实时荧光定量PCR检测RIG-1在法氏囊、脾脏、胸腺4个时期的表达量 (图 4)。在法氏囊中, RIG-1在D1时期表达量显著高于其他3个时期 (P < 0.05);在胸腺中, RIG-1在ED26却有最高的表达量, 显著高于其他3个时期 (P < 0.05);在脾脏中, RIG-1在4个时期的表达没有显著性 (P > 0.05)。除此之外, RIG-1在法氏囊4个时期的表达量整体上均高于脾脏和胸腺。
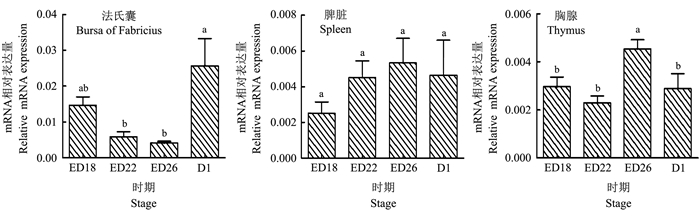 |
| 图4 RIG-1在3个组织中的相对表达量 Fig. 4 Relative expression of RIG-1 in three tissues |
为了进一步研究RIG-1的表达与其相关转录因子的关系, 检测了RIG-1及其转录因子 (IRF-1、RXR-α-like、AP1、NF-κB、IL6) 的mRNA表达量, 并运用Mev软件进行双向聚类分析,描绘其在鸭胚胎期法氏囊、脾脏、胸腺发育过程中的分布趋势 (图 5)。如图 5所示, 在法氏囊当中所有的转录因子与RIG-1的变化趋势趋于一致, 表达量均先下降后上升。根据聚类热图显示, 在法氏囊中RIG-1与AP1、NF-κB、IL6、IRF-1基因有较相似的表达模式, 同源性接近0.9。RIG-1与RXR-α-like基因的同源性也接近0.8;然而相对于法氏囊, 在脾脏中RIG-1与IL6和RXR-α-like却有完全相反的表达模式, 同源性为-0.701;在胸腺中, 相对与其他转录因子, RIG-1与NF-κB、IRF-1基因的mRNA表达量具有相似的表达模式。除此之外, NF-κB与IRF-1基因的mRNA表达量在3个组织中始终被聚类在一起, 有相似的表达模式; 在3个组织当中, 相对于其他转录调控因子, RXR-α-like与RIG-1的基因mRNA表达量都有最大的差异。
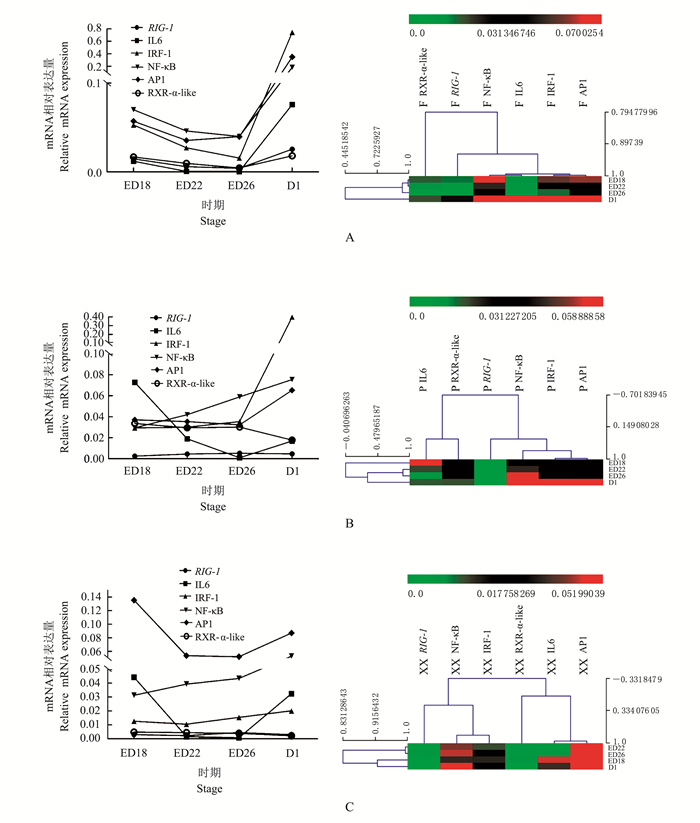 |
| A:RIG-1及预测转录因子的mRNA表达量在法氏囊中的聚类分析。F代表法氏囊; B:RIG-1及预测转录因子的mRNA表达量在脾脏中的聚类分析。P代表皮脏; C:RIG-1及预测转录因子的mRNA表达量在胸腺中的聚类分析。XX代表胸腺。 A: clustering analysis of the mRNA expression levels of RIG-1 and predicted transcription factors in bursa of Fabricius. F means the bursa of Fabricius; B: clustering analysis of the mRNA expression levels of RIG-1 and predicted transcription factors in spleen. P means spleen; C: clustering analysis of the mRNA expression levels of RIG-1 and predicted transcription factors in thymus. XX means thymus. 图5 鸭RIG-1与预测转录因子的mRNA表达量的聚类分析 Fig. 5 Clustering analysis of the mRNA expression levels of RIG-1 and predicted transcription factors |
RIG-1属于胞内识别受体, 与天然抗病毒免疫密切相关, 目前对RIG-1基因的研究主要集中于蛋白的分子结构和在天然抗病毒免疫中的作用, 以及RIG-1通过介导炎症因子来抑制细胞增殖的作用。本研究首次通过实时荧光定量PCR测定RIG-1基因分别在鸭胚胎4个时期的3个主要免疫器官中的相对表达量。结果发现RIG-1基因在胚胎时期的表达呈动态变化, 并在法氏囊和胸腺的各个时期具有显著性差异。LAURA等[12]通过原位杂交技术测定RIG-1在小鼠胚胎期第8.5天到第12.5天的变化, 同样发现RIG-1的表达在小鼠胚胎中枢神经系统中呈动态变化的表达模式。RIG-1作为Robo基因家族的一员, 在细胞迁移、细胞分化及对细胞增殖的抑制中发挥着作用[10, 12]; 同时, 研究发现在鸡胚胎孵化前后, 鸡法氏囊中有大量的B细胞向外迁移,同时B细胞发生程序化凋亡[13], 这可能是导致鸭RIG-1在法氏囊中D1时期表达量显著高于其他3个时期的原因。
启动子作为转录激活过程中起发动作用的特异DNA序列, 它能与特定的转录因子结合后调节基因的转录, 直接影响了基因的功能[14]。然而, 关于RIG-1的转录调控仅只在人和小鼠被报道, 禽类上却没有任何相关报道。本研究获得鸭RIG-1启动子4 372 bp (-4 372~-1 bp) 序列, 分析和预测发现该序列存在IRF-1、RXR-α-like、AP1、NF-κB、IL6等多个转录因子结合位点、典型的结构域位点TATA-box和CAAT-box和3处潜在的启动子核心调控区域。同时预测到一个典型的CpG岛, GC含量高达65.8%。在小鼠, RIG-1启动子区域同样存在一个CpG岛, 只是其在启动子上位置相对于鸭较靠后, 说明鸭和小鼠RIG-1基因的转录调控可能相近[9]。据报道, 视黄酸的刺激可以诱导细胞RIG-1基因的表达, 在人RIG-1启动子发现RXR和RAR转录因子结合位点并证明这些结合位点对RIG-1基因的表达具有调控作用[10], 本研究发现鸭RIG-1启动子上也存在着大量的RXR转录因子结合位点; 此外, 鸭RIG-1启动子区域也发现存在IRF-1转录因子结合位点, 该转录因子被证明可以促进人体RIG-1基因的表达[11]; 同时鸭RIG-1启动子上预测发现存在Pax-2转录因子结合位点, 该转录因子被证明可以抑制小鼠RIG-1的表达[9], 进一步说明哺乳动物和禽类可能存在一致性, 但在小鼠和人上却没有探讨其他的转录因子对RIG-1基因表达的调控作用。
为进一步探讨RIG-1基因与预测转录因子之间可能存在的调控关系, 本实验测定了3个免疫器官中RIG-1与其转录因子在4个发育时期的mRNA的相对表达量并进行双向聚类分析。结果发现, 只有法氏囊中RIG-1与所有的转录因子的mRNA的表达量的表达趋势具有高度的一致性, 这可能与RIG-1在法氏囊中的相对表达水平最高有关 (图 4)。法氏囊作为禽类特有的中枢免疫器官, 是B淋巴细胞最早发生的场所[15-16]。本实验所选用时期属于鸭胚胎期和孵化后第1天, 此时法氏囊快速发育并在1日龄时其结构较为完整[17], 然后在出壳前后B细胞才开始大量从法氏囊迁移到胸腺、脾脏等淋巴器官[13, 18], 并且RIG-1发挥作用主要是在先天免疫反应中, 所以推测在选择的时间点上法氏囊结构较为完善并可能发挥免疫功能, RIG-1在法氏囊中有较高表达而存在被其他转录因子调控的可能。综上所述, 转录因子IRF-1、RXR-α-like、AP1、NF-κB、IL6可能作为RIG-1的转录调控因子调控RIG-1基因的表达。除此之外, 聚类热图显示, 3个免疫器官中的NF-κB与IRF-1基因始终与RIG-1聚类在一起, 有较为相似的表达模式。SU等[11]在人体上的研究表明, IRF-1蛋白可以结合在RIG-1启动子的IRF-1结合位点上诱导RIG-1基因的表达, 说明在鸭上IRF-1可能也是RIG-1的转录调控因子之一。然而, 在RLRs信号通路中, RIG-1通过引起NF-κB通路的活化而导致炎症细胞因子和I型干扰素的表达[2], 所以这可能是RIG-1与NF-κB具有相同的表达模式的原因之一, 因此, NF-κB是否可以作为转录因子调控RIG-1的表达需要进一步的实验验证。
4 结语本研究克隆得到鸭RIG-1启动子序列4 372 bp。鸭RIG-1启动子存在典型的TATA-box、CAAT-box调控元件, 有IRF-1、RXR、RAR、AP1、NF-κB、SP1、IL6及Pax-2等多个转录因子结合位点。RIG-1在鸭胚胎免疫器官中表达呈动态性, 具有不同的表达模式。只有法氏囊中RIG-1与转录因子IRF-1、RXR、AP1、NF-κB、IL6的mRNA的表达量具有相似的表达模式, 而在法氏囊、脾脏和胸腺中的RIG-1与转录因子IRF-1、NF-κB的mRNA的表达量的表达模式均较为相似且被聚类在一起。
| [1] |
IRETON R C, GALE JR M. RIG-1 like receptors in antiviral immunity and therapeutic applications.
Viruses, 2011 (3):906–919. |
| [2] |
陈聪, 姜北, 万瑛.模式识别受体视黄酸诱导基因-Ⅰ样受体及信号通路研究进展.
免疫学杂志,2010 :636–638.
CHENG C, JIANG B, WAN Y. Progress in the properties and signal transduction pathway of retinoic acid inducible geneⅠ like receptors. Immunological Journal, 2010 :636–638. (in Chinese with English abstract) |
| [3] |
崔映宇.维甲酸诱导基因Ⅰ研究进展.
生物化学与生物物理进展,2008,35 :380–386.
CUI Y Y. Research progress of retinoic acid induced genesⅠ. Progress in Biochemistry and Biophysics, 2008,35 :380–386. (in Chinese with English abstract) DOI: 10.3321/j.issn:1000-3282.2008.04.004. |
| [4] |
TAKEUCHI O, AKIRA S. Mda5/RIG-1 and virus recognition.
Current Opinion in Immunology, 2008,20 :17–22. DOI: 10.1016/j.coi.2008.01.002. |
| [5] |
KATO H, TAKEUCHI O, SATO S, et al. Differential roles of mda5 and RIG-1 helicases in the recognition of RNA viruses.
Nature, 2006,441 :101–105. DOI: 10.1038/nature04734. |
| [6] |
KARPALA A J, STEWART C, MCKAY J, et al. Characterization of chicken mda5 activity: regulation of IFN-β in the absence of RIG-1 functionality.
The Journal of Immunology, 2011,186 :5397–5405. DOI: 10.4049/jimmunol.1003712. |
| [7] |
BARBER M R, ALDRIDGE J R, WEBSTER R G, et al. Association of RIG-1 with innate immunity of ducks to influenza.
Proceedings of the National Academy of Sciences, 2010,107 :5913–5918. DOI: 10.1073/pnas.1001755107. |
| [8] |
SUN Y, DING N, DING S S, et al. Goose RIG-1 functions in innate immunity against newcastle disease virus infections.
Molecular Immunology, 2013,53 :321–327. DOI: 10.1016/j.molimm.2012.08.022. |
| [9] |
YUAN S S, YEH Y T, Lee E Y. Pax-2 interacts with rb and reverses its repression on the promoter of RIG-1, a Robo member.
Biochemical and Biophysical Research Communications, 2002,296 :1019–1025. DOI: 10.1016/S0006-291X(02)02032-6. |
| [10] |
JIANG S Y, WU M S, CHEN L M, et al. Identification and characterization of the retinoic acid response elements in the human RIG-1 gene promoter.
Biochemical and Biophysical Research Communications, 2005,331 :630–639. DOI: 10.1016/j.bbrc.2005.03.214. |
| [11] |
SU Z Z, SARKAR D, EMDAD L, et al. Central role of interferon regulatory factor-1 (IRF-1) in controlling retinoic acid inducible gene-Ⅰ (RIG-1) expression.
Journal of Cellular Physiology, 2007,213 :502–510. DOI: 10.1002/(ISSN)1097-4652. |
| [12] |
CAMURRI L, MAMBETISAEVA E, SUNDARESAN V. RIG-1 a new member of Robo family genes exhibits distinct pattern of expression during mouse development.
Gene Expression Patterns, 2004,4 :99–103. DOI: 10.1016/S1567-133X(03)00142-X. |
| [13] | MUSTONEN L, ALINIKULA J, LASSILA O, et al. Bursa of Fabricius. Encyclopedia of Life Sciences. New York: Academic Press , 2010 . |
| [14] |
黄玉, 杨波, 迟小华, 等.真核生物启动子的研究及应用.
生物技术通讯,2010 :275–279.
HUANG Y, YANG B, CHI X H, et al. Investigation and application of promoters of eukaryotic organism. Litters in Biotechnology, 2010 :275–279. (in Chinese with English abstract) |
| [15] |
GLICK B, CHANG T S, JAAP R G. The bursa of Fabricius and antibody production.
Poultry Science, 1956,35 :224–225. DOI: 10.3382/ps.0350224. |
| [16] |
BRAND A, GILMOUR D G, GOLDSTEIN G. Lymphocyte-differentiating hormone of bursa of Fabricius.
Science, 1976,193 :319–321. DOI: 10.1126/science.180600. |
| [17] |
王平, 曹焯, 樊启昶, 等.北京鸭 (Peking duck) 腔上囊的研究Ⅰ, 北京鸭腔上囊淋巴上皮滤泡的发生.
北京大学学报 (自然科学版),1984 (2):7.
WANG P, CAO Z, FAN Q X, et al. Research of Peking duck brusa of Fabricius Ⅰ: the lymphoid follicle epithelium of peking duck brusa of Fabricius. Acta Scientiarum Naturalium Universitatis of Pekinensis, 1984 (2):7. (in Chinese with English abstract) |
| [18] |
高守华, 于士广, 张红卫.手术去法氏囊对鸡盲肠扁桃体发育的影响.
动物学报,1997 :60–64.
GAO S Y, YU S G, ZHANG H W. Surgery to division Bursa of Fabricius has a impact on development of chicken caecum tonsil. Acta Zoologica Sinica, 1997 :60–64. (in Chinese with English abstract) |
 2017, Vol. 43
2017, Vol. 43