| 亚洲柑橘木虱带菌率的周年变化动态 |
2. 浙江省柑桔研究所, 浙江 黄岩 318020;
3. 台州市植物保护检疫站,浙江 椒江 318000
2. Citrus Research Institute of Zhejiang Province, Huangyan 318020, Zhejiang, China;
3. Plant Protect and Quarantine Station of Taizhou City, Jiaojiang 318000, Zhejiang, China
Las bacterium content of HLB-infected citrus trees was detected via the qPCR technology. The detection was carried out on a monthly basis throughout the whole year at the Huangyan district of Zhejiang Province. The results showed that the content of Las bacterium for HLB-infected citrus tree varied dramatically with time in a year. The highest value for the content of Las bacterium was observed in December, followed by November, but no significant difference (P > 0.05) was found between these two months. This was the case with the other months, whose values were lower (P < 0.05) than those detected in December and November.
Apart from the detection for the content of Las bacterium, the Las-holding ratio of Asian citrus psyllid (Diaphorina citri) captured from HLB-infected citrus tree was also detected. The highest ratio was found in December, which was not significantly different from that in January, but significantly higher than those detected in other months at P=0.05 level. Meanwhile, the pathogen quantity of Asian citrus psyllid showed that the average content of Las bacterium was highest during the period from December to the following January. This indicated that the Las-holding ratio of Asian citrus psyllid was directly affected by the content of Las bacterium for HLB-infected citrus trees. That is, the higher the ratio of Asian citrus psyllid, the more readily the spread of citrus HLB disease. Given that the spread of citrus HLB disease reached to peak in December and January, winter and spring would be the crucial period of controlling Asian citrus psyllid in order to prevent HLB disease.
柑橘黄龙病 (Huanglongbing, HLB) 是柑橘上危害最严重的病害, 属于一种柑橘韧皮部杆菌引起的柑橘病害。HLB病原被认为是一种限于韧皮部筛管细胞内的革兰阴性细菌[1], 中国目前仅发现该菌亚洲种“Candidatus Liberibacter asiaticus”(Las)[2]。其主要症状为柑橘叶片斑驳、叶脉革质化、果实畸形及不完全转色、味苦、严重的直至落果, 最后导致树势衰败至叶片完全黄花、落叶、橘树全株死亡。迄今为止, 柑橘黄龙病除澳大利亚和地中海周围国家外均有发生, 主要的传播途径还是通过亚洲柑橘木虱——一种昆虫媒介。亚洲柑橘木虱可以从带菌的芸香科植物包括其他观赏性芸香科寄主携菌并传播到健康的橘树。另外,利用嫁接枝条进行品种改良的手段因接穗带菌也是造成Las菌蔓延的一个重要途径。
亚洲柑橘木虱 (Diaphorina citri Kuwayama, 又称Asian citrus psyllid) 属昆虫纲、有翅亚纲、半 (同) 翅目、胸喙类、木虱亚目, 是柑橘新梢期主要害虫。XU等[3]报道亚洲柑橘木虱大龄若虫获得黄龙病病原菌的能力较强, 一般4~5龄的若虫和成虫一样具有传播Las菌能力, 而1~3龄若虫则不会传播。感染Las菌的雌性木虱很少经卵巢传菌到下一代[4], 携带Las菌的雄性木虱也不能通过交配过程将Las菌传导到雌性木虱体内[5], 因此亚洲柑橘木虱携带的Las菌的来源只有带菌黄龙病树, AMMAR等[6-8]采用聚合酶链式反应 (polymerase chain reaction,PCR) 和荧光原位杂交方法研究Las菌在亚洲柑橘木虱体内的保持及传菌过程, 发现亚洲柑橘木虱摄入Las菌后, 通过消化道壁传递到其他组织, 如血淋巴、唾液腺等, 然后在取食过程中将Las菌随唾液分泌物传递到寄主植物上;研究还表明, 在感染Las菌的亚洲柑橘木虱大部分器官组织中都能检出Las菌, 包括唾液腺、血淋巴、滤腔、中肠组织、脂肪体、肌肉组织、卵巢等。
亚洲柑橘木虱虫口密度与柑橘树新芽抽出有关, 由于亚洲柑橘木虱只在嫩芽产卵, 若虫在植株幼嫩组织发育, 因此在北美, 亚洲柑橘木虱一般在晚春和仲夏大量发生, 只要环境因素适合和幼嫩组织存在亚洲柑橘木虱往往会爆发[9]。亚洲柑橘木虱成虫具有一定的耐寒性, 所有3个虫态均能耐受短时间的冰冻天气, 大部分成虫和若虫能在-6 ℃低温下存活数小时, 大部分卵在-8 ℃低温下存活数小时, 所以轻度的冰冻事件不会造成亚洲柑橘木虱成虫死亡, 但由于其造成嫩芽死亡才会导致亚洲柑橘木虱幼虫大量死亡[10]。一般在柑橘萌芽期和冬季防治可以大大降低亚洲柑橘木虱的虫口密度, 集中密集地采用化学防治亚洲柑橘木虱是目前公认的防御柑橘黄龙病的主要手段, 杀虫剂一般选用吡虫啉、甲氰菊酯、毒死蜱、噻虫嗪等[11], 但在美国佛罗里达已发现亚洲柑橘木虱对一些化学农药产生了抗药性[12]。在中国, 根据亚洲柑橘木虱发生流行规律, 生产上化学防治偏重在柑橘萌芽期的春季、夏季和秋季进行, 主要防治目标是降低亚洲柑橘木虱的虫口密度。
亚洲柑橘木虱成虫喜食感染黄龙病的植株, 但在其摄食黄龙病感染的植株汁液后更喜食未感染黄龙病的植株, 从而造成了黄龙病的快速传播[13]。亚洲柑橘木虱成虫在病树上取食0.5~1 h即可获得病菌[3], 但通过PCR技术检测亚洲柑橘木虱成虫在病树上取食后的带菌率, 取食35 d后只有40%的成虫带Las菌[14], CEN等[15]报道柑橘黄龙病发病的程度不会影响亚洲柑橘木虱的取食能力, 但可以影响获菌的速度, 带菌的若虫一旦羽化即可传菌[3], 亚洲柑橘木虱一旦携有Las菌将终生带菌, 且发育加快、繁殖能力提高[14]。实际上, 亚洲柑橘木虱通过摄食柑橘幼嫩组织的汁液而带菌, 柑橘植株带菌量高低往往是亚洲柑橘木虱传菌效率的主要因素。
目前, 柑橘黄龙病广泛采用聚合酶链式反应 (PCR), 依靠对韧皮部杆菌的16S rRNA基因通过特异性引物扩增进行验证, 但Las菌在柑橘不同组织分布不同且含量较低, 病原菌含量随着时间而波动, 甚至出现在几个月及数年后的感染和未感染之间的变动[16]。正是由于Las菌在柑橘病株中含量低、分布不均匀[17], 使得更灵敏的巢式PCR (nested-PCR) 或可定量的实时PCR (real-time quantitative PCR) 病菌检测技术也应运而生[18-19]。
本研究通过定量的荧光定量PCR技术, 对感染Las菌柑橘植株周年Las带菌量进行分析, 并分析田间采集的亚洲柑橘木虱带菌比例和带菌量, 从黄龙病防治角度提出亚洲柑橘木虱防治关键时期。
1 材料与方法 1.1 柑橘黄龙病树叶片采集在浙江省台州市黄岩区澄江街道山头舟村选定一处果园, 该区域属平原橘区, 土壤pH值为4.75, 筑土墩栽培方式, 排水沟南北走向, 种植密度为675株/hm2, 取8株感染黄龙病的柑橘树, 品种为本地早蜜橘, 树龄为30年, 树高219~266 cm, 橘树基部嫁接口上方直径为18.15~30.25 cm, 因高接换种而感染上柑橘黄龙病。黄龙病树经田间典型症状和PCR手段确诊, 选定后进行编号, 用挂牌标记。于2015年4月中旬在选定病树的东、南、西、北4个方位各选取1个枝条, 挂上小标签, 在每个枝条取老熟叶片2张, 每株橘树共8张叶片为1个样本。以后每月中旬以同样方法在同一枝条的相同部位取样, 进行荧光定量PCR检测, 直到2016年3月结束, 共12个月。检测不同时间柑橘Las带菌量的变化情况。
1.2 亚洲柑橘木虱成虫的采集样品采自浙江省台州市黄岩区院桥镇唐家桥村确定400 m2感染黄龙病的温州蜜柑病果园, 树龄23年, 种植橘树48株, 病株率91.7%。在果园内选东、南、西、北、中不同方位橘树各2株, 共10株, 于2015年5月至2016年4月的每月下旬采集亚洲柑橘木虱成虫, 在每株感染黄龙病的橘树上各捕捉亚洲柑橘木虱成虫3头, 合计30头, 设3个重复, 进行荧光定量PCR检测, 检测亚洲柑橘木虱携带Las菌的比例和Las带菌量。
1.3 Las菌荧光定量PCR检测方法 1.3.1 样品DNA提取柑橘叶片:挑取4~5片待测叶片, 剪取其叶片中脉 (约0.5 g), 剪成1~2 mm的小段, 经冷冻干燥后, 在离心管中加入钢珠, 用研磨仪将其磨碎, 用CTAB法提取总DNA, 并在微量紫外分光光度计中测量各样品DNA质量浓度, 将其调到50 ng/μL, 置于-20 ℃冰箱备用。
亚洲柑橘木虱:将1头木虱成虫置于微量离心管中, 加入70 μL DNA提取缓冲液后, 在冰浴中用塑料研磨棒研碎组织, 用CTAB法提取总DNA, 并在微量紫外分光光度计中测量各样品DNA质量浓度, 将其调到50 ng/μL, 置于-20 ℃冰箱备用。
1.3.2 实时荧光定量PCR检测引物和探针序列参见文献[20], 由大连宝生物工程有限公司 (Takara) 合成。PCR反应体系为20 μL, 其中Premix Ex Taq 10 μL, 250 nmol/L的上下游引物各1 μL, 150 nmol/L探针1 μL, 稀释好的DNA模板1 μL, 无菌水6 μL。反应在Bio-rad CFX96TM PCR仪上进行。扩增程序为95 ℃,2 min;95 ℃,10 s;58 ℃,30 s,共40个循环。每个样品3次重复, 每次扩增分别设1个阳性对照和1个阴性对照。
1.4 数据分析CT(C代表cycle, T代表threshold, CT值的含义是:每个反应管内的荧光信号到达设定的阈值时所经历的循环数) 值取3次定量PCR检测的结果平均值, Las带菌量 (每克叶片中脉中的细菌拷贝数):35.50×108×10(CT-19.3)/-3.169 2, 结果用DPS V7.05软件的Duncan's新复极差法分析。
2 结果与分析 2.1 柑橘树周年Las带菌量变化通过对8株感染黄龙病橘树1年的Las带菌量分析, 黄龙病树携带Las菌量变化较大, 从0~1.00×1010/g之间, 这表明柑橘树的病原菌菌量随着时间而波动, 甚至出现在1年内的几个月及数年后的感染和未感染之间的变动。从图 1可以看出, 11至12月份间, 3至4月份间和8至9月份间均有1次Las菌高峰期, 8株病树检测数据的平均值显示, 12月份最高为1.59×109/g, 而5月份最低为3.72×106/g, 总体上看, 11至12月份Las带菌量相对最高, 而4至7月份相对最低, 其他月份居中。经差异显著性分析, 在P=0.05水平下, 12月份Las带菌量与11月份无显著性差异, 但显著高于其他月份, 而其他各月份间无显著差异。
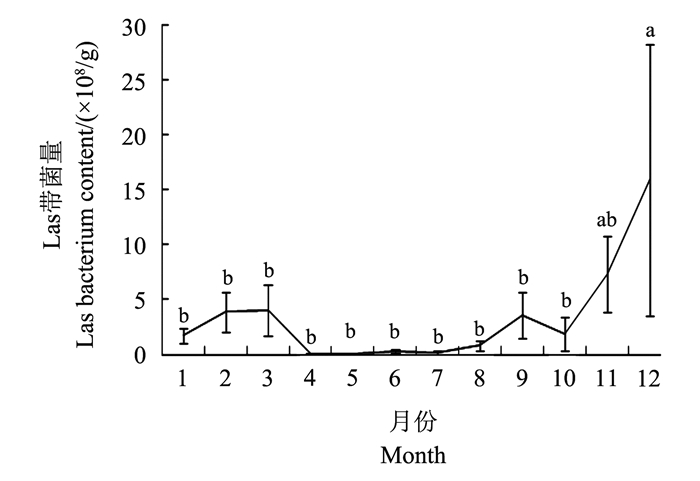 |
| 图上不同小写字母表示在P < 0.05水平差异有统计学意义。 Different lowercase letters indicate statistically significant differences at the 0.05 probability level. 图1 不同月份黄龙病树Las平均带菌量 Fig. 1 Average Las bacterium of HLB tree in different months |
通过1年内对单头亚洲柑橘木虱Las菌的检测, 以10头为1组, 检测阳性比例, 按照3次重复计算平均值, 将平均值与月份作图 (图 2), 其中12月份亚洲柑橘木虱带Las菌比例最高为63.33%, 其次为1月份的50%, 其余各月份均低于50%, 在P=0.05水平下, 12月份亚洲柑橘木虱带Las菌比例显著高于除1月份以外的其他各月份;在P=0.01水平下, 12月份亚洲柑橘木虱带Las菌比例极显著高于3月份和5至11月份的亚洲柑橘木虱带菌率。
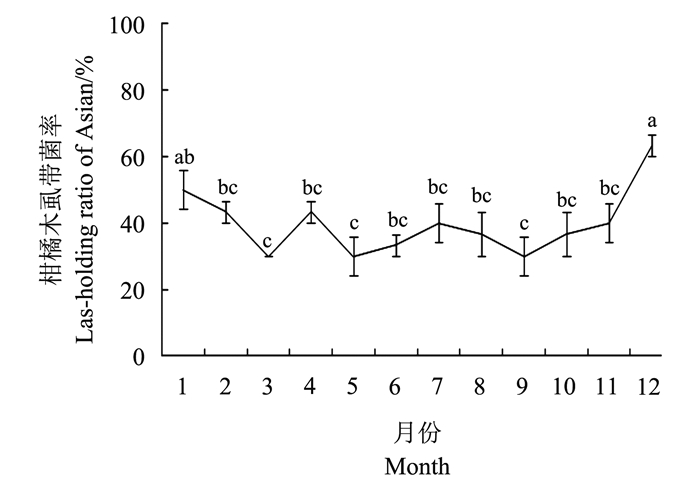 |
| 图上不同小写字母表示在P < 0.05水平差异有统计学意义。 Different lowercase letters indicate statistically significant differences at the 0.05 probability level. 图2 不同月份亚洲柑橘木虱带菌率 Fig. 2 Las-holding ratio of Asian citrus psyllid in different months |
在每月采集到的所有亚洲柑橘木虱中, 对检测到携带Las菌的亚洲柑橘木虱进行分析, 其带菌量按照月份统计见图 3。结果表明:亚洲柑橘木虱体内Las带菌量为12月至翌年1月份之间最高, 将所有数据分成3组, 平均值进行差异分析, 在P=0.05水平下, 其中12月份携LAS菌亚洲柑橘木虱带菌量显著高于除1月份之外的其他月份。
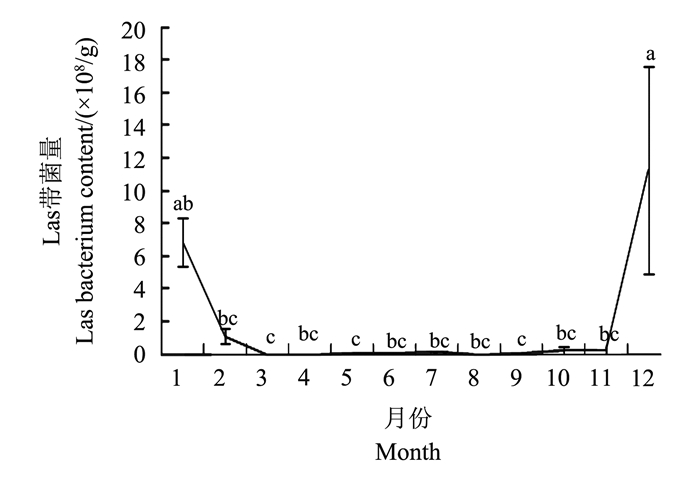 |
| 图上不同小写字母表示在P < 0.05水平差异有统计学意义。 Different lowercase letters indicate statistically significant differences at the 0.05 probability level. 图3 不同月份带菌亚洲柑橘木虱Las平均带菌量 Fig. 3 Average Las bacterium of the Las-holding Asian citrus psyllid in different months |
将所有亚洲柑橘木虱携带Las带菌量总和与每月采集的所有30头亚洲柑橘木虱进行平均值分析, 得到的结果是12月至翌年1月份平均带菌量最高, 明显高于1年之中的其他月份 (图 4)。
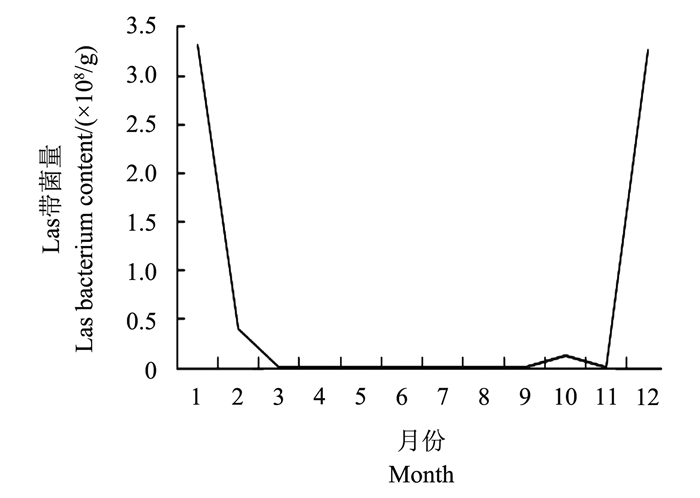 |
| 图4 不同月份亚洲柑橘木虱Las平均带菌量 Fig. 4 Average Las bacterium of the Asian citrus psyllid in different months |
从试验结果看, 感染黄龙病的橘树1年之中, 其Las带菌量有明显的变化, 以11至12月份达到最高, 虽然不同橘树之间有差异, 但总体上趋势明显;同时, 亚洲柑橘木虱携带Las菌的比例和带菌量也表现为12月至翌年1月份之间最高。胡浩[21]在广西柳州的一处橘园对感染黄龙病的老熟叶片采用定量PCR手段检测, 其中10至12月份CT值最低, 而3至5月份的CT值最高, 表明10至12月份Las带菌量最高, 而3至5月份Las带菌量最低。对采集浙江丽水的亚洲柑橘木虱Las带菌量进行周年监测, 虽然该研究缺2至4月份的数据, 可是其结果也显示1月份亚洲柑橘木虱携带Las菌量最高, 与本研究结果一致;但其结果中12月份最低, 与本检测不一致。本试验结果显示橘树Las带菌量越高, 则亚洲柑橘木虱获菌比例和带菌量也越高, 这也与CEN等[15]报道寄主柑橘树黄龙病发病的程度可以影响亚洲柑橘木虱获菌的速度一致。而1月份采集的亚洲柑橘木虱为越冬代成虫, 其携带Las菌的比例较高可能与其进入1月份后取食量下降, Las带菌量与上年12月的带菌量有关, 随着进入2月份, 亚洲柑橘木虱的带菌比例持续下降, 而在4月份带菌比例有一个小高峰,这可能与感染黄龙病的柑橘树3至4月份间和8至9月份间均有1次Las带菌量高峰期有关。PELZ-STELINSKI等[4]报道亚洲柑橘木虱携带Las菌后取食未感染黄龙病的健康橘树约25 d后, 亚洲柑橘木虱Las带菌比例从100%降低至小于10%, 他们认为亚洲柑橘木虱在健康橘树上饲养后其携带柑橘Las菌量在体内随着时间会下降。因此, 也可以解释由于在1至10月份黄龙病橘树带黄龙病菌含量较低, 从而导致2至11月份间亚洲柑橘木虱带菌比例和其携带Las菌量较低。
3 讨论许多节肢动物的传菌能力研究表明, 寄主的病原菌量直接影响其摄入的细菌菌量和随后的传菌能力, 也就是节肢动物的传菌能力与寄主病原菌的菌量和其摄入食物量相关[22-23]。亚洲柑橘木虱在103/mL浓度及1 mL摄入量下, 仅有38%的亚洲柑橘木虱获得Las菌, 也许部分未检测出Las菌是由于样品中病原菌的模板数量太少而导致无法通过qPCR检出[24]。这说明感染黄龙病的柑橘树Las菌的量直接与亚洲柑橘木虱带菌比例和带菌量相关, 而且本研究结果也表明橘树Las菌量越高的月份亚洲柑橘木虱的带菌率和带菌量也越高, 从而造成带菌亚洲柑橘木虱传播黄龙病能力加强。
在柑橘黄龙病区没有更好的办法使亚洲柑橘木虱不带Las菌及传播该菌, 目前只能采用综合防控的办法即通过挖除减少病树以减少毒源, 复栽健康植株和抗黄龙病的柑橘品种, 并持续监测和控制亚洲柑橘木虱等措施[24]。喷施化学农药仍是防治亚洲柑橘木虱最主要的措施。冬季清园可以消灭越冬成虫, 从而显著减少春季虫口基数, 是全年防治亚洲柑橘木虱最关键的时期。其次为新梢抽发期, 应该在新芽长度0.5~1.0 cm时开始喷药防治, 随着新芽的生长, 相隔5~10 d后再次喷药[25]。
本研究结果显示, 感染黄龙病的橘树由于在11至12月份Las菌量最高, 从而使得亚洲柑橘木虱在12月至翌年1月份带菌比例最高、传菌能力最强。由此可说明, 12月至翌年1月份间是亚洲柑橘木虱的重要防治时间, 该时期如果漏过少量的亚洲柑橘木虱就会造成柑橘黄龙病发生的几率大大增加。这可能是在浙江一些亚洲柑橘木虱虫口密度低的地区柑橘黄龙病同样发生的一个原因。因此, 通过本研究可以认为, 在以防控柑橘黄龙病为目标的亚洲柑橘木虱防治中, 冬季和春季的清园是非常重要的环节, 这对于减少越冬成虫和降低黄龙病传播风险是非常有必要的工作。
| [1] |
GOTTWALD T R, DA GRACA J V, BASSANEZI R B. Citrus Huanglongbing: the pathogen and its impact.
Plant Health Progress, 2007,6 :906. |
| [2] |
丁芳, 洪霓, 钟云, 等.中国柑橘黄龙病病原16SrDNA序列研究.
园艺学报,2008,35 (5):649–654.
DING F, HONG N, ZHONG Y, et al. Studies on 16S rDNA sequence of citrus Huanglongbing bacteria in China. Acta Horticulturae Sinica, 2008,35 (5):649–654. (in Chinese with English abstract) |
| [3] | XU C F, XIA Y H, LI K B, et al. Further study of the transmission of citrus Huanglongbing by a psyllid, Diaphorina citri Kuwayama.//10th Conference of the International Organization of Citrus Virologists. Riverside: CA. 1988:243-248. |
| [4] |
PELZ-STELINSKI K S, BRLANSKY R H, EBERT T A, et al. Transmission parameters for Candidatus Liberibacter asiaticus by Asian citrus psyllid (Hemiptera: Psyllidae).
Journal of Economic Entomology, 2010,103 (5):1531–1541. DOI: 10.1603/EC10123. |
| [5] |
MANN R S, PELZ-STELINSKI K, HERMANN S L, et al. Sexual transmission of a plant pathogenic bacterium, Candidatus Liberibacter asiaticus, between conspecific insect vectors during mating.
PLoS ONE, 2011,6 (12):e29197. DOI: 10.1371/journal.pone.0029197. |
| [6] |
AMMAR E D. Propagative transmission of plant and animal viruses by insects: factors affecting vector specificity and competence.
Advances in Disease Vector Research, 1994,10 :289–331. DOI: 10.1007/978-1-4612-2590-4. |
| [7] |
AMMAR E D, SHATTERS R G, LYNCH C, et al. Detection and relative titer of Candidatus Liberibacter asiaticus in the salivary glands and alimentary canal of Diaphorina citri (Hemiptera: Psyllidae) vector of citrus Huanglongbing disease.
Annals of the Entomological Society of America, 2011,104 (3):526–533. DOI: 10.1603/AN10134. |
| [8] |
AMMAR E D, SHATTERS R G, HALL D G. Localization of Candidatus Liberibacter asiaticus, associated with citrus Huanglongbing disease, in its psyllid vector using fluorescence in situ hybridization.
Journal of Phytopathology, 2011,159 (11/12):726–734. |
| [9] | HALL D G. Biology, history and world status of Diaphorina citri//North American Plant Protection Organization. Proceedings of the International Workshop on Huanglongbing and Asian Citrus Psyllid. 2011:19-23. |
| [10] |
HALL D G, WENNINGER E J, HENTZ M G, et al. Temperature studies with the Asian citrus psyllid, Diaphorina citri: cold hardiness and temperature thresholds for oviposition.
Journal of Insect Science, 2011,11 (1):83. |
| [11] |
HALL D G, RICHARDSON M L, AMMAR E, et al. Asian citrus psyllid, Diaphorina citri, vector of citrus Huanglongbing disease.
Entomologia Experimentalis et Applicata, 2013,146 (2):207–223. DOI: 10.1111/eea.12025. |
| [12] |
TIWARI S, MANN R S, ROGERS M E, et al. Insecticide resistance in field populations of Asian citrus psyllid in Florida.
Pest Management Science, 2011,67 (10):1258–1268. DOI: 10.1002/ps.v67.10. |
| [13] |
MANN R S, ALI J G, HERMANN S L, et al. Induced release of a plant defense volatile "deceptively" attracts insect vectors to plants infected with a bacterial pathogen.
PLoS Pathogens, 2012,8 (3):e1002610. DOI: 10.1371/journal.ppat.1002610. |
| [14] | PELZ-STELINSKI K S, ROGERS M, BRLANSKY R. Vector-pathogen interactions: transmission of Candidatus Liberibacter asiaticus and its effect on Asian citrus psyllid life history//Second Annual Citrus Health Research Forum, 2011. |
| [15] |
CEN Y, YANG C, HOLFORD P, et al. Feeding behaviour of the Asiatic citrus psyllid, Diaphorina citri, on healthy and Huanglongbing-infected citrus.
Entomologia Experimentalis et Applicata, 2012,143 (1):13–22. DOI: 10.1111/eea.2012.143.issue-1. |
| [16] |
AKSENOV A A, PASAMONTES A, PEIRANO D J, et al. Detection of Huanglongbing disease using differential mobility spectrometry.
Analytical Chemistry, 2014,86 (5):2481–2488. DOI: 10.1021/ac403469y. |
| [17] |
TEIXEIRA D C, SAILLARD C, COUTURE C, et al. Distribution and quantification of Candidatus Liberibacter americanus, agent of Huanglongbing disease of citrus in Sao Paulo State, Brasil, in leaves of an affected sweet orange tree as determined by PCR.
Molecular and Cellular Probes, 2008,22 (3):139–150. DOI: 10.1016/j.mcp.2007.12.006. |
| [18] |
胡浩, 殷幼平, 张利平, 等.柑橘黄龙病的常规PCR及荧光定量PCR检测.
中国农业科学,2006,39 (12):2491–2497.
HU H, YIN Y P, ZHANG L P, et al. Detection of citrus Huanglongbing by conventional and two fluorescence quantitative PCR assays. Scientia Agricultura Sinica, 2006,39 (12):2491–2497. (in Chinese with English abstract) DOI: 10.3321/j.issn:0578-1752.2006.12.013. |
| [19] |
廖晓兰, 朱水芳, 赵文军, 等.柑橘黄龙病病原16S rDNA克隆测序及实时荧光PCR检测方法的建立.
农业生物技术学报,2004,12 (1):80–85.
LIAO X L, ZHU S F, ZHAO W J, et al. Cloning and sequencing of citrus Huanglongbing pathogen 16S rDNA and its detection by real-time fluorescent PCR. Journal of Agricultural Biotechnology, 2004,12 (1):80–85. (in Chinese with English abstract) |
| [20] |
LI W B, HARTUNG J S, JOHN S, et al. Quantitative real-time PCR for detection and identification of Candidatus Liberibacter species associated with citrus Huanglongbing.
Journal of Microbiological Methods, 2006,66 (1):104–115. DOI: 10.1016/j.mimet.2005.10.018. |
| [21] | 胡浩.应用荧光定量PCR技术研究亚洲韧皮部杆菌在寄主体内的动态变化及分布. 重庆:重庆大学,2007 :38–47. |
| [22] |
LORD C C, RUTLEDGE C R, TABACHNICK W J. Relationships between host viremia and vector susceptibility for arboviruses.
Journal of Medical Entomology, 2006,43 (3):623–630. DOI: 10.1093/jmedent/43.3.623. |
| [23] |
COLETTAFILHO H D, DAUGHERTY M P, FERREIRA C, et al. Temporal progression of "Candidatus Liberibacter asiaticus" infection in citrus and acquisition efficiency by Diaphorina citri.
Phytopathology, 2014,104 (4):416–421. DOI: 10.1094/PHYTO-06-13-0157-R. |
| [24] |
TABACHNICK W J. Diaphorina citri (Hemiptera: Liviidae) vector competence for the citrus greening pathogen "Candidatus Liberibacter asiaticus".
Journal of Economic Entomology, 2015,108 (3):839–848. DOI: 10.1093/jee/tov038. |
| [25] | AUBERT B. Integrated activities for the control of Huanglongbing-greening and its vector Diaphorina citri Kuwayama in Asia. 1990, Proceedings of the Fourth FAO-UNDP International Asia Pacific Conference on Citrus Rehabilitation. 1990:410. |
 2017, Vol. 43
2017, Vol. 43


