| “三本提”葡萄芽变“11-06-25”的遗传鉴定 |
2. 浙江省长兴县长兴龙湖农业发展有限公司, 浙江 长兴 313100;
3. 湖州市农业经济作物局, 浙江 湖州 313000
2. Changxing Longhu Agricultural Development Co. Ltd., Changxing 313100, Zhejiang, China;
3. Huzhou Agricultural Economic Crop Bureau, Huzhou 313000, Zhejiang, China
Using "Sanbenti", "11-06-25", "Zaoxia Wuhe" and "Summer Black" and four reference varieties including two Vitis vinifera L. cv. "Muscat of Red Alexandria" and "Shien" along with two Euro-American hybrids "Shine-Muscat" and "Kyoho" as materials, an analysis of their genetic relationship by SSR (simple sequence repeat) was carried out. 35 pairs of SSR primers were screened for PCR amplification. By these primers, a total of 135 robust and reproducible bands were generated, of which 124 were polymorphic and the polymorphism frequency was 91.85%. An unweighted pair-group method with arithmetic mean (UPGMA) dendrogram of eight genotypes using NTSYS-pc 2.10e was constructed.
Based on our results, it could be established that "Sanbenti", "11-06-25", "Zaoxia Wuhe" and "Summer Black" showed high similarity. According to the parents and bud sports relation, the genetic similarity coefficient between "Sanbenti" and "11-06-25" is the highest. Although "11-06-25" and "Zaoxia Wuhe" are similar in some biological traits, the DNA band patterns of "11-06-25" and "Zaoxia Wuhe" varied in four loci (VrZAG15, VrZAG64, VMC4A1 and VMC9A2.1), suggesting that they are not identical grape lines. Besides, during preliminary observation, "11-06-25" showed better color than that of "Sanbenti", and it also showed better in fruit quality especially aroma than that of "Zaoxia Wuhe" under the same cultivation condition.
In conclusion, "11-06-25" is a new grape line derived from "Sanbenti". It is very worth popularizing because of its early maturity time and great fruit quality. In addition, we presumed that "Sanbenti" may be a bud sport of "Summer Black".
芽变在果树上普遍存在, 芽变选种是果树育种的重要方法之一。葡萄的种植历史悠久, 种质资源丰富, 品种繁多, 在其推广和传播过程中易产生芽变, 为鉴别变异的真伪, 需要在遗传上进行分析、鉴定。“夏黑”是三倍体无核葡萄, 由日本山梨县果树试验场1968年用“巨峰”和“无核白”杂交所得, 1997年8月获得品种登记[1]。“夏黑”果粒圆形, 果肉硬脆, 鲜食浓甜爽口, 有浓郁草莓香味, 而且果皮厚, 在运输过程中不易因挤压而破裂。它是我国南方近年来继“巨峰”之后的又一主栽品种。现实生产中发现, “夏黑”容易发生芽变, 如上海奥德农庄于2008年在“夏黑”葡萄园中发现特早熟芽变——“早夏无核”, 于2012年9月27日通过品种认定 (沪农品认果树[2012]第003号)。2011年我们在极早熟葡萄选种过程中, 意外发现了被农户称为“三本提”葡萄上的一个优质芽变“11-06-25”(暂定名), 其成熟期比母本提前约2周, 与“早夏无核”相近, “三本提”葡萄的生物学性状与“夏黑”基本相似 (表 1)。
| 表1 “三本提”“11-06-25”“早夏无核”“夏黑”的果实品质性状 Table 1 Fruit quality traits of "Summer Black", "Zaoxia Wuhe", "Sanbenti" and "11-06-25" |
 |
| 点击放大 |
传统品种鉴定常用的方法是根据形态特征进行, 因而会受到很多因素的限制, 比如不同的组织类别、发育阶段的形态特征、栽培条件等因素。DNA分子标记技术的发展, 使葡萄品种鉴定的困难迎刃而解。目前常用于葡萄品种鉴定的分子标记有限制性片段长度多态性、随机扩增片段长度多态性、简单重复序列、扩增片段长度多态性、单核苷酸多态性等[2]。其中简单重复序列 (simple sequence repeat, SSR) 分子标记以其高度的多态性、孟德尔共显性遗传模式 (可以区别纯合显性个体和杂合显性个体)、引物的公开性和易获得性、实验重复性高等优点, 已得到广泛应用[3]。本研究选用35对国际通用的SSR荧光标记引物对8份葡萄试验材料的基因组DNA进行扩增, 并利用毛细管电泳技术对扩增产物进行分离, 从分子水平上研究这些品种 (系) 间的亲缘关系, 以便确定“11-06-25”是否为可遗传的变异, 从而为葡萄遗传育种、种质资源管理及品种保护提供科学依据。
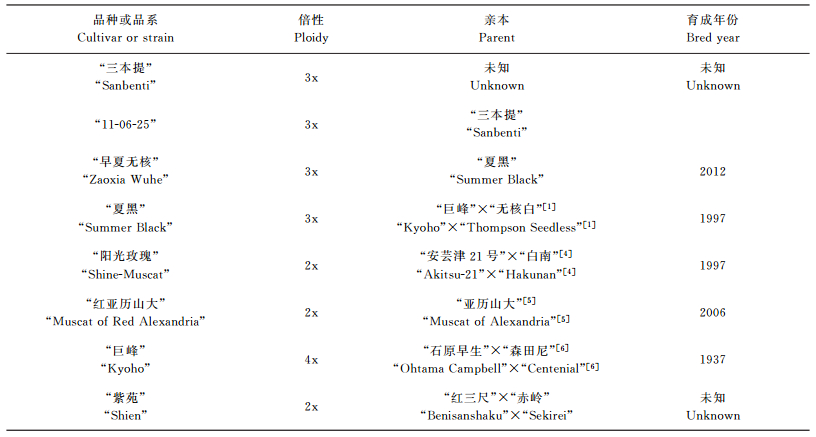
1 材料与方法 1.1 植物材料试验材料共8份, 包括欧亚种葡萄 (Vitis vinifera L.)2份:“红亚历山大”“紫苑”; 欧美杂交种 (V. vinifera L.×V. labrusca L.)6份:“三本提”“11-06-25”“早夏无核”“夏黑”“阳光玫瑰”“巨峰”。其中“三本提”“11-06-25”“早夏无核”“夏黑”的叶片于2015年5月上旬采集自江苏常州某葡萄果园, 它们均栽培于同一环境中, 采用相同的栽培措施, 并在盛花后1~3 d内用相同质量浓度的50 mg/L GA3和5 mg/L N-(2-氯-4-吡啶基)-N′-苯基脲作为植物生长调节剂来处理花穗。“阳光玫瑰”“红亚历山大”“巨峰”“紫苑”的叶片采集自浙江杭州经济葡萄园。样品基本信息见表 2。幼嫩叶片采下后立即使用液氮冷冻保存直至运回实验室提取基因组DNA。
| 表2 试验材料信息 Table 2 Information of accessions studied in this research |
 |
| 点击放大 |
采用改良的CTAB法提取植物叶片组织的基因组DNA[7], 其中使用CTAB (cetyltrimethyl ammonium bromide, 十六烷基三甲基溴化铵) 提取DNA之前的步骤参考李金璐等[8]的方法:在研磨好的样品中加入预冷的缓冲液A, 缓冲液A由0.1 mol/L (pH 8.0) Tris·HCl、5 mmol/L EDTA-Na2、0.25 mol/L NaCl和2% PVP (polyvinyl pyrrolidone, 聚乙烯吡咯烷酮) 组成, 混匀后冰浴15 min, 冰浴过程中颠倒混匀2~3次, 然后4 ℃ 12 000 r/min,离心10 min并弃去上清液, 重复冰浴和离心的步骤, 直至上清液不黏稠后再加入CTAB进行下一步的提取。最后用标准DNA作为标记对基因组DNA进行1%琼脂糖凝胶电泳检测确定其质量和数量, 再将DNA的质量浓度稀释到30 ng/μL备用。
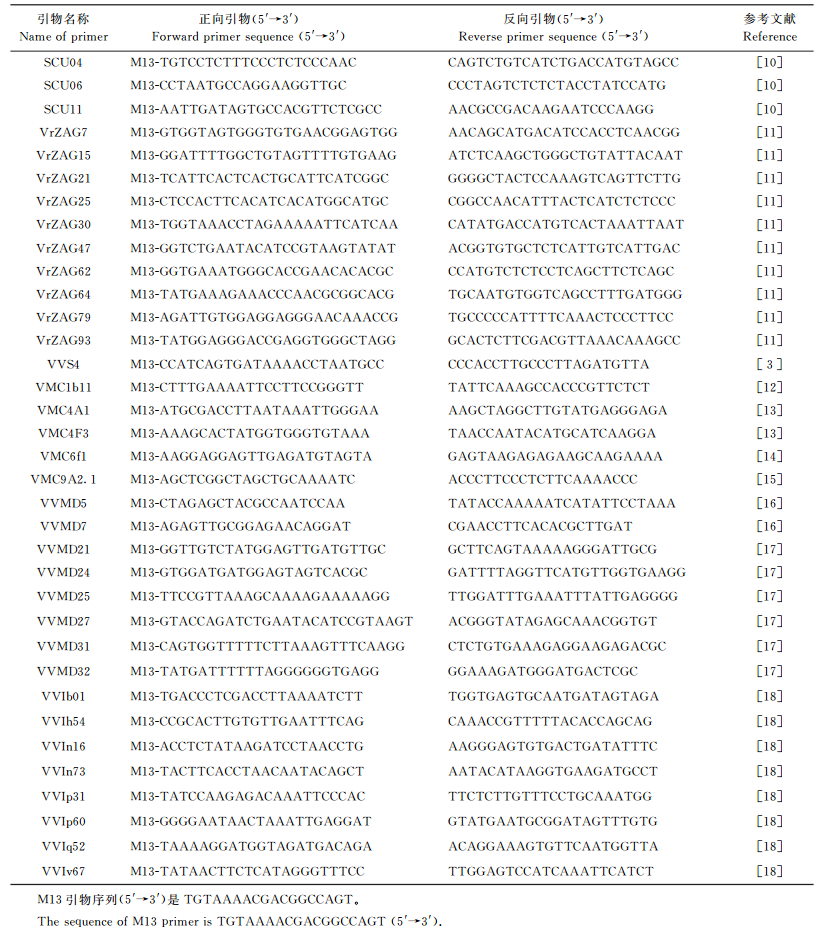
1.3 引物选择与PCR扩增选用在品种鉴定或亲缘关系研究中常用的SSR引物35对 (表 3)。采用TP-M13-SSR荧光标记的方法检测PCR产物的有无及条带大小[9]。用3条引物进行PCR扩增。第1条引物是在普通的SSR引物的正向引物5′端加上M13序列, 成为TP-M13引物; 第2条引物为普通的SSR反向引物; 第3条引物是5′端带有荧光标记的M13引物, 分别标识4种颜色, FAM (蓝)、HEX (绿)、NED (黄) 和PET (红), 由美国ABI公司合成。TP-M13-SSR引物由上海华津生物科技有限公司合成。
| 表3 SSR引物序列信息 Table 3 Information of SSR primer sequences |
 |
| 点击放大 |
PCR反应体系:10×PCR缓冲液 (含Mg2+)2 μL, 2.5 mmol/L dNTPs 2 μL, 5 U/μL rTaq酶0.2 μL, 10 pmol/L TP-M13正向引物0.1 μL, 10 pmol/L反向引物0.5 μL, 带有荧光标记的M13引物0.4 μL, 30 ng/μL模板DNA 2 μL, ddH2O 20 μL。使用艾本德中国有限公司 (Eppendorf) 的PCR仪进行扩增。扩增程序如下:94 ℃预变性5 min; 94 ℃变性30 s, 适温退火45 s, 72 ℃延伸45 s, 循环32次; 94 ℃变性30 s, 53 ℃退火45 s, 72 ℃延伸45 s, 循环8次; 最后72 ℃延伸10 min。
1.4 琼脂糖凝胶电泳及毛细管电泳PCR完成后取PCR产物3 μL用1.5%琼脂糖凝胶电泳检测, 紫外灯下观察扩增效果。取PCR产物3~4 μL进行混样, 再用ABI3700XL全自动基因分析仪进行毛细管电泳检测, 检测工作由生工生物工程 (上海) 股份有限公司完成。
1.5 数据分析所有片段数据由ABI3700XL配套软件GeneMapper ID V3.2自动读取后并输出到Microsoft Excel文件 (含sample file,sample name,panel,size,marker,dye,height) 和PDF文件 (峰型图、片段大小) 中。对35对引物出现的所有片段按大小顺序排列, 每个品种的PCR产物片段大小与其对比, 有该片段大小出现标为1, 否则标为0。为了方便亲缘关系分析, 根据SSR标记产生的二进制数据计算相似系数, 建立相似矩阵, 采用NTSYS-pc V2.10e程序计算遗传距离, 以非加权数据分析法 (UPGMA) 来进行聚类分析, 建立聚类树状图, 分析各自之间的亲缘关系。
2 结果与分析 2.1 样品DNA提取及检测采用改良的CTAB法, 8个供试样品DNA的1%琼脂糖凝胶电泳条带清晰。用英国柏楉 (Biochrom) 有限公司的超微量蛋白核酸分析仪BioDrop μLite检测样品DNA质量浓度及纯度, 结果均符合PCR实验的要求。
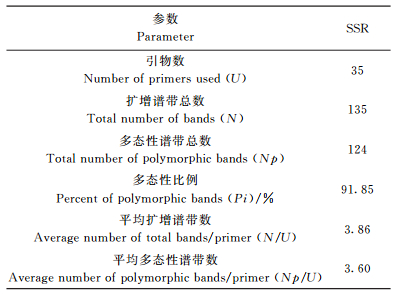
2.2 PCR扩增结果及引物多态性分析PCR产物的琼脂糖凝胶电泳结果显示, 扩增条带较清晰。35对SSR引物的毛细管电泳结果均表现出较高的多态性。8份不同样品中共扩增得到135个等位基因, 平均每对引物可扩增得到3.86个等位基因 (表 4)。其中, 引物VVIv67扩增得到7个条带, 而VVS4扩增仅得到1个条带。扩增产物长度介于90~400 bp, 以150~300 bp的扩增片段居多。在扩增出的所有条带中多态性条带有124个, 多态性百分率为91.85%, 供试样品的相似系数在0.49~0.95之间 (图 2)。可见, SSR标记检测葡萄遗传多样性的效率很高, 也表明葡萄的遗传多样性极为丰富。
| 表4 遗传多样性参数 Table 4 Genetic diversity parameters |
 |
| 点击放大 |
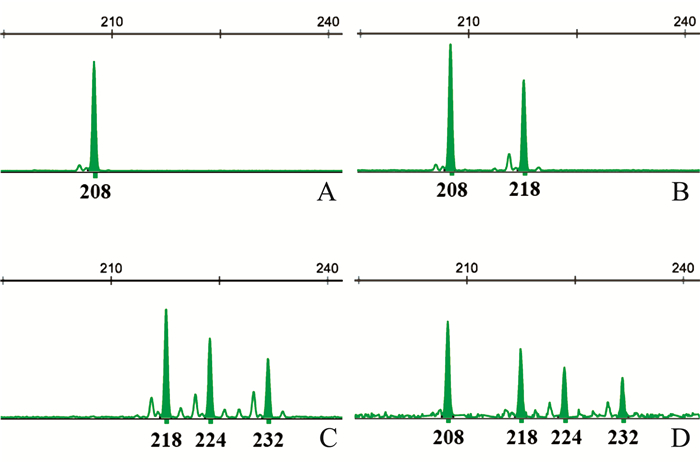 |
| 图1 VrZAG21引物在二倍体 (A、B)、三倍体 (C) 及四倍体 (D) 中的扩增结果 Fig. 1 Electropherograms of VrZAG21 loci in diploid (A, B), triploid (C) and tetraploid (D) cultivars |
 |
| 图2 UPGMA聚类分析 Fig. 2 Dendrogram of UPGMA cluster analysis |
根据毛细管电泳峰图的峰型和每个引物PCR产物片段的大小, 对供试样品的基因型数据进行判读和整理。图 1所示, 二倍体纯合的基因型在毛细管电泳峰图中表现为明显的单峰, 而杂合则表现为双峰; 相应地, 三倍体和四倍体杂合的基因型分别为三峰和四峰。
综合35个位点的SSR数据, 8个葡萄样品的SSR指纹图谱互不相同, 可以为品种鉴别提供依据。“三本提”“11-06-25”“早夏无核”“夏黑”这4个样品在27个位点上表现出完全相同的带型, 在另外8个位点上的带型存在一定的差异 (表 5), 我们可以利用这8个位点的分子信息鉴别“三本提”“11-06-25”“早夏无核”“夏黑”。
| 表5 8对SSR引物在8份葡萄样品中的扩增结果 Table 5 Amplified results of the 8 grape samples by 8 SSR markers |
 |
| 点击放大 |
“三本提”和“11-06-25”仅在VrZAG64和VVMD5这2个位点存在差异; “11-06-25”和“早夏无核”的差异表现在VrZAG15、VrZAG64、VMC4A1和VMC9A2.1的4个位点上; “早夏无核”和“夏黑”在6个位点 (SCU04、VrZAG15、VMC4A1、VMC9A2.1、VVMD7和VVIb01) 存在差异; “夏黑”和“三本提”的差异表现在SCU04、VVMD5、VVMD7和VVIb01的4个位点上。
2.3 亲缘关系分析基于SSR数据计算出试验材料的Dice相似系数, 可获得UPGMA聚类图 (图 2)。从聚类图中可以看出, SSR标记在相似系数0.49处将8个样品清楚地分成2大类。第Ⅰ类包含了“紫苑”“红亚历山大”“阳光玫瑰”3个样品, 第Ⅱ类包含“巨峰”“11-06-25”“三本提”“夏黑”“早夏无核”5个样品。
在第Ⅱ聚类枝中, “巨峰”与其他4个样品的相似系数为0.7, 证实了“巨峰”是“夏黑”的杂交亲本之一; “三本提”与“11-06-25”的相似系数最高0.95, 亲缘关系最近, 符合二者间的芽变关系; “三本提”与“夏黑”的相似系数为0.93;“夏黑”与“早夏无核”的相似系数为0.92。“11-06-25”“三本提”“夏黑”“早夏无核”这4个葡萄样品聚类紧密, 相似系数均大于0.92, 表明四者有着非常近的亲缘关系, 它们之间的分化可能是由无性系变异所引起。
3 讨论芽变 (bud sport) 是体细胞突变的一种, 发生在芽的分生组织细胞中, 当芽萌发长成枝条, 在性状上表现出与原类型不同, 它是果树新品种的重要来源[19]。芽变大多为基因突变产生的, 其遗传物质发生了改变。SSR标记具有高度的多态性, 在品种和品系鉴定中已广泛应用。早在1996年BOWERS,等[16]就已利用此技术论述了4个酿酒葡萄品种可能是同一个栽培品种的体细胞变异。近年来, JAHNKE等[20]也利用SSR标记将“黑比诺”“灰比诺”“白比诺”的克隆系的遗传差异追溯到了它们不同的地理来源; 杜晶晶等[21]为国家葡萄品种资源圃内保存的80份葡萄种质建立了分子身份证; 李慧等[22]揭示了“关口葡萄”的品种来源和分类; 尹玲等[2]成功建立了24个我国近年来新育成葡萄品种的SSR指纹图谱。本研究结果显示SSR标记能有效地鉴别葡萄品种及其芽变品系。明确了“11-06-25”是“三本提”产生的一个芽变, 二者在UPGMA聚类图中的相似系数高达0.95, “11-06-25”改变了35个位点中2个位点的遗传物质。“早夏无核”是“夏黑”产生的一个芽变, 二者的相似系数为0.92, “早夏无核”在35个位点中有6个位点的遗传物质与“夏黑”不同。“11-06-25”与“早夏无核”的生物学性状相似, 但二者的遗传本质存在差异, 即在VrZAG15、VrZAG64、VMC4A1、VMC9A2.1的4个位点上表现出的带型不同, 由此推断“11-06-25”和“早夏无核”是2个不同的葡萄品系。由第Ⅱ聚类枝可知, “三本提”、“11-06-25”、“早夏无核”、“夏黑”与“巨峰”的亲缘关系比较近, 证实了“巨峰”是“夏黑”的亲本之一。本试验也发现, “三本提”与“夏黑”之间存在较近的亲缘关系, 推测“三本提”可能是“夏黑”的一个芽变, 在“夏黑”的推广过程中, 由于“夏黑”是三倍体无核品种, “三倍体”与“三本提”谐音, 在口耳相传时, 某些地方的种植者就将“夏黑”的这个芽变称为“三本提”葡萄。
果树芽变的变异性状多种多样, 有树体比较矮小的短枝型芽变, 有果实的浓红型和大果型芽变, 有果实风味品质的变异, 有果实成熟期、耐贮性的变异, 还有丰产性变异以及适应性、抗逆性等方面的变异。“夏黑”和“三本提”葡萄的成熟期在7月下旬末, “11-06-25”与“早夏无核”成熟期接近 (7月中旬)。本研究在相同栽培条件下的初步结果表明, “11-06-25”除成熟期提前于母本“三本提”外, 在色泽上有明显改善, 与“早夏无核”相近; 但在平均穗质量、可溶性固形物含量和香味方面较“早夏无核”更具优势 (表 1); 特别是具有柠檬味的右旋柠檬烯和具有绿叶清香的青叶醛、己醛在“11-06-25”的果肉中含量比“早夏无核”高; 具有草香并伴有橙花油气息的特征香气物质罗勒烯和具有生酒花香的特征香气物质月桂烯在“三本提”和“早夏无核”的果肉中均没有检测到 (数据未显示)。因此, “三本提”芽变“11-06-25”是一个品质优异的极早熟葡萄品系, 对其进行开发利用可丰富早熟葡萄市场, 具有较高的经济价值。
| [1] |
徐卫东.极早熟三倍体无核葡萄--夏黑.
西北园艺,2003 (6):31.
XU W D. Very early triploid seedless grape: Summer Black. Northwest Horticulture, 2003 (6):31. (in Chinese with English abstract) |
| [2] |
尹玲, 张晨, 向江, 等.我国新育成葡萄品种SSR指纹图谱的建立.
果树学报,2015,32 (3):366–373.
YIN L, ZHANG C, XIANG J, et al. The SSR fingerprinting of grapevine cultivars newly-developed in China. Journal of Fruit Science, 2015,32 (3):366–373. (in Chinese with English abstract) |
| [3] |
THOMAS M R, SCOTT N S. Microsatellite repeats in grapevine reveal DNA polymorphisms when analyzed as sequence-tagged sites (STSs).
Theoretical and Applied Genetics, 1993,86 (8):985–990. |
| [4] |
山田昌彦, 山根弘康, 佐藤明彦, 等.ブドウ新品种'シヤインマスカツト'.
果树研报,2008 (7):21–38.
YAMADA M, YAMANE H, SATO A, et al. New grape cultivar "Shine Muscat". Bulletin of the National Institute of Fruit Tree Science, 2008 (7):21–38. (in Chinese with English abstract) |
| [5] |
王世平, 沈玉良, 张才喜, 等.葡萄新品种"红亚历山大".
果农之友,2008 (7):10.
WANG S P, SHEN Y L, ZHANG C X, et al. New grape cultivar "Muscat of Red Alexandria". Friend of Fruit Growers, 2008 (7):10. (in Chinese with English abstract) |
| [6] |
刘崇怀, 孔庆山, 潘兴.我国鲜食葡萄育种的种质基础与种质创新.
果树学报,2002,19 (4):256–261.
LIU C H, KONG Q S, PAN X. Germplasm background of the grape varieties bred in China and its innovation. Journal of Fruit Science, 2002,19 (4):256–261. (in Chinese with English abstract) |
| [7] |
DOYLE J J, DOYLE J L. A rapid DNA isolation procedure from small quantities of fresh leaf tissues.
Phytochemistry, 1986,19 (1):11–15. |
| [8] |
李金璐, 王硕, 于婧, 等.一种改良的植物DNA提取方法.
植物学报,2013,48 (1):72–78.
LI J L, WANG S, YU J, et al. A modified CTAB protocol for plant DNA extraction. Chinese Bulletin of Botany, 2013,48 (1):72–78. (in Chinese with English abstract) |
| [9] |
SCHUELKE M. An economic method for the fluorescent labeling of PCR fragments.
Nature Biotechnology, 2000,18 (2):233–234. DOI: 10.1038/72708. |
| [10] |
SCOTT K D, EGGLER P, SEATON G, et al. Analysis of SSRs derived from grape ESTs.
Theoretical and Applied Genetics, 2000,100 (5):723–726. DOI: 10.1007/s001220051344. |
| [11] |
SEFC K M, REGNER F, TURETSCHEK E, et al. Identification of microsatellite sequences in Vitis riparia and their applicability for genotyping of different Vitis species.
Genome, 1999,42 (3):367–373. DOI: 10.1139/gen-42-3-367. |
| [12] |
BOZ Y, BAKIR M, ÇELIKKOL B P, et al. Genetic characterization of grape (Vitis vinifera L.) germplasm from Southeast Anatolia by SSR markers.
Vitis, 2011,50 (3):99–106. |
| [13] |
GASPERO G D, PETERLUNGER E, TESTOLIN R, et al. Conservation of microsatellite loci within the genus Vitis.
Theoretical and Applied Genetics, 2000,101 (1/2):301–308. |
| [14] |
DOULATI-BANEH H, MOHAMMADI S A, LABRA M. Genetic structure and diversity analysis in Vitis vinifera L. cultivars from Iran using SSR markers.
Scientia Horticulturae, 2013,160 :29–36. DOI: 10.1016/j.scienta.2013.05.029. |
| [15] |
方连玉, 王军, 许雷.15份葡萄种质遗传多样性的SSR分析.
分子植物育种,2010,8 (3):511–515.
FANG L Y, WANG J, XU L. Genetic diversity of 15 grape germplasms revealed by SSR markers. Molecular Plant Breeding, 2010,8 (3):511–515. (in Chinese with English abstract) |
| [16] |
BOWERS J E, DANGL G S, VIGNANI R, et al. Isolation and characterization of new polymorphic simple sequence repeat loci in grape (Vitis vinifera L.).
Genome, 1996,39 (4):628–633. DOI: 10.1139/g96-080. |
| [17] |
BOWERS J E, DANGL G S, MEREDITH C P. Development and characterization of additional microsatellite DNA markers for grape.
American Journal of Enology and Viticulture, 1999,50 (3):243–246. |
| [18] |
MERDINOGLU D, BUTTERLIN G, BEVILACQUA L, et al. Development and characterization of a large set of microsatellite markers in grapevine (Vitis vinifera L.) suitable for multiplex PCR.
Molecular Breeding, 2005,15 (4):349–166. DOI: 10.1007/s11032-004-7651-0. |
| [19] |
伊凯, 闫忠业, 刘志, 等.苹果芽变选种鉴定及应用研究.
果树学报,2006,23 (5):745–749.
YI K, YAN Z Y, LIU Z, et al. Review on identification and utilization of apple sport selection. Journal of Fruit Science, 2006,23 (5):745–749. (in Chinese with English abstract) |
| [20] |
JAHNKE G, MÁJER J, VARGA P, et al. Analysis of clones of Pinots grown in Hungary by SSR markers.
Scientia Horticulturae, 2011,129 (1):32–37. DOI: 10.1016/j.scienta.2011.03.004. |
| [21] |
杜晶晶, 刘国银, 魏军亚, 等.基于SSR标记构建葡萄种质资源分子身份证.
植物研究,2013,33 (2):232–237.
DU J J, LIU G Y, WEI J Y, et al. Establishment of molecular ID for grape germplasm based on SSR markers. Bulletin of Botanical Research, 2013,33 (2):232–237. (in Chinese with English abstract) DOI: 10.7525/j.issn.1673-5102.2013.02.019. |
| [22] |
李慧, 罗正荣, 张青林.基于SSR和IRAP标记的"关口葡萄"亲缘关系分析.
果树学报,2014,31 (6):1040–1046.
LI H, LUO Z R, ZHANG Q L. Genetic relationship analysis of "Guankou-Putao" grape by SSR and IRAP markers. Journal of Fruit Science, 2014,31 (6):1040–1046. (in Chinese with English abstract) |
 2017, Vol. 43
2017, Vol. 43


