


2. 天津中医药大学中药学院,天津 301617
陈乃宏(1961-),男,研究员,博士生导师,研究方向:神经药理学,通信作者,E-mail: chennh@imm.ac.cn
2. School of Chinese Materia Medica, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
缺血性脑卒中约占脑卒中患病人口总数的87%,是由脑部血管堵塞引起的脑组织缺血、缺氧性脑损伤,具有高发病率、高致死率、高致残率等特点,给社会和家庭造成沉重负担[1]。迄今为止,唯一被FDA批准治疗缺血性脑卒中的溶栓药物重组组织型纤溶酶原激活剂(rt-PA)具有治疗时间窗短,易引发出血转化等缺点[2],而在血流恢复后神经系统又会遭受到不同程度的缺血/再灌注(ischemia/reperfusion,I/R)损伤,包括线粒体功能障碍、兴奋性毒性、氧化应激、炎症反应、凋亡、铁死亡[3]等其他病理过程[4]。因此,针对I/R损伤的关键步骤去寻找有效的神经保护剂对缺血性脑卒中的治疗具有重要意义。
近年来许多研究表明,铁死亡参与脑缺血进程中神经细胞的损伤[5]。其主要机制是,在二价铁或酯氧合酶的作用下,催化细胞膜上高表达的不饱和脂肪酸,发生脂质过氧化,从而诱导细胞死亡[6]。具体来说,铁死亡表现出独特的形态特征,如线粒体收缩和线粒体膜密度增加、外部膜破裂、内部膜压缩和完整的细胞核。在分子水平上,表现为铁蓄积式铁离子失衡和细胞内谷胱甘肽(glutathione,GSH)耗竭,以及谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)失活,并伴有脂质过氧化物水平升高,最终导致细胞膜损伤和细胞死亡[7]。在参与调控铁死亡信号通路中,核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)信号通路与铁死亡的发生机制具有高度的相关性。Nrf2入核后促进转录的多个基因在防止铁死亡的发生中起着关键作用,包括胱氨酸/谷氨酸转运蛋白(cystine/glutamate transporter,SLC7A11,xCT)、铁蛋白轻重链,甚至GPX4本身,都是Nrf2的靶基因[8]。表明针对Nrf2的调控为抗缺血性脑卒中铁死亡的重要途径。
人参皂苷Rg1是一种四环三萜类衍生物(Fig 1A),是人参的主要活性成分。最近的许多研究认为它是最有效的抗中风候选药物之一[9-10]。Rg1对实验性急性缺血性卒中有明显疗效,表现为其缩小梗死体积、减轻间质水肿程度和改善神经评分的能力,但是其根本的机制仍然在探索中[11]。前期研究证明,Rg1可以通过促进Nrf2入核,激活含有抗氧化反应元件的基因的转录,增加抗氧化酶的表达,从而减轻I/R后的氧化应激[12]。但其能否上调GPX4蛋白表达,进而减轻缺血性脑卒中引起的神经细胞铁死亡尚未有报道。因此,我们针对Rg1对缺血性脑卒中后神经元铁死亡的影响及其相关机制展开进一步的研究。
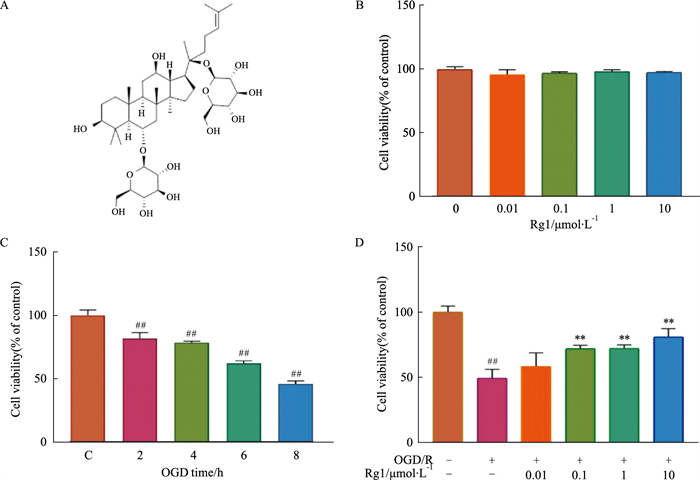
|
| Fig 1 Effect of ginsenoside Rg1 on survival rate of HT22 cells induced by OGD/R (x±s, n=3) A: Chemical structure of Rg1. B: The effect of different concentrations of Rg1 on the activity of HT22 cells. C: The effect of OGD duration on the viability of HT22 cells. D: The effect of different concentrations of Rg1 on the survival rate of HT22 cells treated with OGD/R. **P < 0.01 vs OGD/R group; ##P < 0.01 vs control group. |
SD大鼠,雄性,体质量(260~280) g,购自北京维通利华实验动物技术有限公司(清洁级,合格证编号: SCXK(京)2021-0011),购入后饲养于中国医学科学院药物研究所动物房,室温维持在(26±2)℃,相对湿度(55±5)%,12 h/12 h光照/避光循环,自由摄食与饮水。
1.1.2 细胞株HT22小鼠海马神经元细胞培养于含10% FBS的DMEM完全培养基中,置于37 ℃、5% CO2培养箱中培养,隔天传代,供后续实验使用。
1.1.3 药品与试剂人参皂苷Rg1(上海源叶生物科技有限公司,B21057,纯度HPLC≥98%);ML385(索莱宝,IM1020);Ferrostatin-1(Fer-1)(MACKLIN, F864515);CCK-8(索莱宝,CA1210);Anti-GPX4抗体(Abcam公司,ab125066);Anti-Nrf2抗体(Abcam公司,ab76026);Anti-xCT抗体(ABclonal,A2413);Anti-β-actin抗体(Sigma,A5441);Anti-Rabbit IgG (H+L)抗体(KPL,5450-0010);Anti-Mouse IgG (H+L)抗体(KPL,5450-0011);Goat Anti-Rabbit IgG (H+L)Fluor594(affinity,S0006);GSH/GSSG试剂盒(同仁化学,G263),MDA试剂盒(同仁化学,M496),SOD试剂盒(同仁化学,S311),Fe2+试剂盒(北京普利来基因技术有限公司,E1042)。1.1.4仪器小动物呼吸麻醉机(深圳市瑞沃德生命科技有限公司);MCAO栓线(北京西浓科技有限公司);高速组织研磨仪(康涛科技);ECL发光仪(GE公司,Amersham Imager 680);DYY-7C型垂直板电泳转移装置及蛋白电泳系统电源(北京六一仪器厂);Milli-Q plus超纯水仪(Millipore公司);透射电子显微镜(日本电子株式会社,JEM-1200EX);倒置荧光生物显微镜(重庆澳浦光电技术有限公司,DSY2000X);三气培养箱(Heal Force,HF100);荧光酶标仪(美谷分子仪器有限公司,SpectraMax iD3)。
1.2 方法 1.2.1 动物分组、模型制备及给药将20只SD雄性大鼠随机分为sham组、MCAO组、MCAO+Rg1(40 mg·kg-1)组及MCAO+Fer-1(0.2 mg·kg-1)组,每组各5只。sham组分离CCA、ECA、ICA,不插入线栓,其余与MCAO组相同。MCAO造模90 min后拔栓,同时立即尾静脉注射生理盐水,Rg1或Fer-1。24 h后进行神经行为学检测,随后取材。
1.2.2 神经行为学评分Zea Longa法造模完成后24 h,提鼠尾离开地面约一尺,观察两前肢状况;将大鼠置于地面,观察行走情况。采用5级评分法(0~5分),分数越高说明其神经行为损伤越重。0分:无神经功能缺损症状;1分:不能伸展对侧前爪;2分:身体向对侧转圈;3分:身体向对侧倾倒;4分:意识丧失,不能自发行走;5分:动物死亡。
1.2.3 神经行为学评分Garcia Test造模完成后24 h,通过Garcia Test评价神经功能。Garcia Test是由7个独立测试组成,分别为自发活动、腹部感觉、触须反应、肢体对称性、侧身转向、前肢爬行、攀爬。每个单独测试的表现按0(表现最差)至3(表现最好)的等级评分,以得分(max=21)的总和评价大鼠的神经功能,评分越低,造模越严重[13]。
1.2.4 透射电镜观察神经细胞线粒体大鼠神经功能评分完成后,腹腔注射水合氯醛(400 mg·kg-1)麻醉,心脏灌注PBS冲洗,4%多聚甲醛溶灌流固定,完成后断头取脑,取皮质半暗带组织,修剪成1 mm3大小的组织块,电镜固定液中4 ℃保存过夜。通过分级乙醇系列脱水后,将细胞包埋在树脂中过夜。超薄切片随后用柠檬酸铅染液和醋酸双氧轴染液染色。使用透射电子显微镜收集图像。
1.2.5 Western blot实验大鼠神经功能评分完成后,腹腔注射水合氯醛麻醉,断头取脑,冰上分离皮质半暗带区域,立即于-80 ℃冻存。取出提取皮质或细胞总蛋白,BCA试剂盒定量,SDS-PACE凝胶电泳,10%分离胶分离。转膜,5%BSA封闭2 h,根据目标蛋白分子量裁膜,分别加入对应一抗(GPX4,1 ∶ 5 000;xCT,1 ∶ 2 000;Nrf2,1 ∶ 2 000;β-actin,1 ∶ 10 000),4 ℃过夜。TBST洗膜10 min,重复3次,加入二抗(1 ∶ 5 000),室温孵育2 h,回收二抗,TBST洗膜10 min,重复3次,ECL仪曝光成像。
1.2.6 OGD/R诱导HT22细胞损伤模型及Rg1给药对数生长期细胞以5×103/孔密度接种于96孔板内,正常培养24 h后,更换为Earle's平衡盐溶液并置于三气培养箱(94%N2、5%CO2和1%O2)进行低氧培养,时间为2 h、4 h、6 h和8 h;缺氧完成后更换完全培养基,置于37 ℃,5% CO2培养箱中正常培养24 h。CCK-8法检测细胞活力,根据实验结果确定HT22细胞OGD/R最佳时间。最终确定后续实验中,OGD 8 h后,模型组更换为完全培养基,Rg1组更换为含不同浓度Rg1的完全培养基,正常培养24 h。
1.2.7 CCK-8法检测细胞活力细胞培养结束后将培养板取出,每孔避光加入10 μL CCK-8溶液在培养箱内孵育1.5 h,用酶标仪测定在450 nm处的吸光度,计算细胞活力。
1.2.8 细胞内GSH/GSSG含量检测收集处理后的各组细胞样品,冻融裂解细胞后,8 000×g离心10 min,上清分为两份,分别加入掩蔽剂作为GSSG样品管和ddH2O作为总谷胱甘肽样品管,随后加入工作液在37 ℃培养10 min。用酶标仪在405 nm或415 nm下测定吸光度。根据标注曲线分别计算出总谷胱甘肽和GSSG的浓度。样品中GSH浓度使用以下公式计算:GSH=总谷胱甘肽(GSH+GSSG)-GSSG×2。
1.2.9 细胞内MDA含量检测收集处理后的各组细胞样品,离心后去除上清,加入Antioxidant PBS solution吹打裂解,再加入Lysis Buffer充分涡旋后静置5 min。取10 μL用BCA法进行蛋白质定量。各微管中加入Working solution,涡旋振荡器充分混匀。在95 ℃,反应15 min。冰浴上冷却5 min,10 000×g离心10 min。取上清加至96孔板黑板中。用荧光酶标仪检测检测荧光强度(Ex: 540 nm,Em: 590 nm)。根据MDA的标准曲线计算样品中的MDA浓度,并用蛋白浓度进行校准。
1.2.10 细胞内SOD含量检测冰浴超声破碎HT22细胞(60 W,0.5 s间隔,15 min)后,4 ℃ 10 000×g离心15 min,上清液制成样品溶液。取10 μL样品用于BCA蛋白定量。样品加入WST工作液,酶工作液,混匀。在37℃培养箱中培养20 min。用酶标仪在450 nm处读数。按说明书计算SOD活性。
1.2.11 细胞内Fe2+含量检测HT22细胞加入裂解液,置于摇床裂解2 h。取10 μL样品裂解液用BCA蛋白定量。样品加入高锰酸钾溶液与缓冲液,混匀,60 ℃孵育1 h。冷却至室温,加入铁离子检测剂,混匀,室温孵育30 min。取200 μL于96孔板,在550 nm测定吸光度。绘制标准曲线并计算铁离子浓度。
1.2.12 细胞免疫荧光将生长状态良好的HT22细胞以2×104/孔密度接种在24孔板内的圆形盖玻片上,按上述OGD/R方法造模。完成后弃掉培养液,用冰浴的PBS洗1次,加入适量4%多聚甲醛冰上固定20 min,弃去多聚甲醛,PBS轻轻洗3次。加入0.5% TritonX-100/PBS透化10 min,弃掉Triton,PBS轻轻洗3次。加5% BSA封闭30min,随后加一抗(GPX4,1 ∶ 200),4 ℃孵育过夜。回收一抗,加PBS,放在摇床上慢速摇晃5 min,重复3次,加二抗[Goat Anti-Rabbit IgG (H+L)Fluor594,1 ∶ 200]室温避光孵育2 h。回收二抗,PBS摇床洗3次,每次5 min。用DAPI染色液在室温下孵育10 min染色细胞核,再次用PBS摇床洗3次,每次5 min。取3 μL 90%甘油滴于载玻片上,用镊子夹取盖玻片,反扣于甘油上,指甲油封片,荧光显微镜下观察拍照。
1.2.13 统计学分析所有数据均表示为x±s表示。使用GraphPad Prism 9软件进行统计分析,作图。采用单因素方差分析(One-way ANOVA)比较组间差异。
2 结果 2.1 Rg1可改善HT22细胞OGD/R模型的存活率Rg1结构式如Fig 1A所示,CCK-8检测结果表明,实验浓度范围内的Rg1对正常HT22细胞的存活率均无影响(Fig 1B)。随后我们检测不同氧糖剥夺时间对HT22细胞活力的影响,HT22细胞存活率随OGD时间增加逐渐下降,当OGD 8 h时,细胞存活率为55.07%±0.83%(Fig 1C)。后续研究选择OGD培养8 h,复氧24 h作为HT22细胞的OGD/R造模条件。如Fig 1D所示,加入Rg1后,细胞存活率明显上升。Rg1浓度在0.1~10 μmol·L-1检测范围相较模型组均具有显著性,Rg1浓度为10 μmol·L-1时保护效果最佳,HT22细胞的存活率为81.4%± 5.73%(P < 0.001)。
2.2 Rg1可抑制HT22细胞OGD/R模型引起的铁死亡OGD/R损伤后HT22细胞GSH/GSSG比值显著降低(P < 0.05),而Rg1剂量依赖性地逆转了这一结果,在10 μmol·L-1时效果最佳,上调OGD/R后HT22细胞GSH/GSSG比值(P < 0.001)(Fig 2A);OGD/R损伤后SOD活性明显降低(P < 0.05),Rg1(10 μmol·L-1)能恢复SOD活性(P < 0.01)(Fig 2B);此外,OGD/R后HT22细胞MDA(P < 0.001)和Fe2+(P < 0.01)含量明显上升,Rg1(1,10 μmol·L-1)能明显下调OGD/R损伤后HT22细胞MDA(P < 0.05或P < 0.001)(Fig 2C)和Fe2+
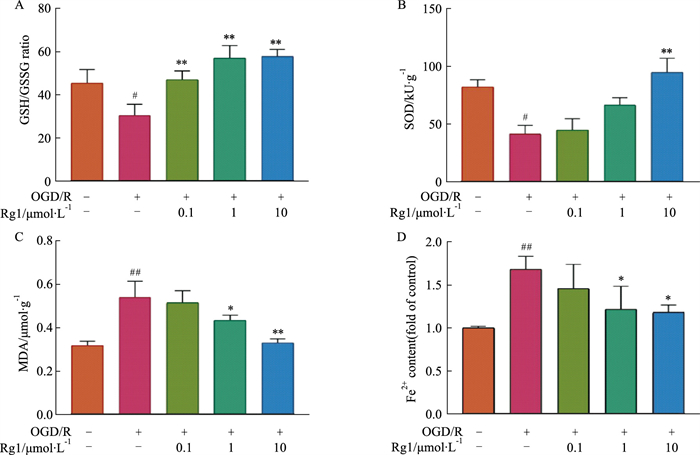
|
| Fig 2 Effect of ginseng Rg1 on content of ferroptosis markers in HT22 cells induced by OGD/R (x±s, n=3~4) A: GSH/GSSG ratio; B: MDA levels; C: SOD activity; D: Fe2+ content. *P < 0.05, **P < 0.01 vs OGD/R group, #P < 0.05, ##P < 0.01 vs control group. |
(P < 0.05)(Fig 2D)的含量。为研究Rg1影响OGD/R后HT22细胞铁死亡的机制,本研究采用Western blot检测了HT22细胞GPX4、xCT蛋白表达情况,结果表明OGD/R能降低HT22细胞GPX4和xCT(Fig 3B)蛋白的表达(P < 0.01),提示OGD/R增加HT22细胞铁死亡敏感性,Rg1给药后,HT22细胞GPX4、xCT蛋白表达均有显著性的提高,且在10 μmol·L-1浓度时效果最佳(P < 0.01)。说明Rg1能显著逆转OGD/R导致的HT22细胞铁死亡敏感性增强。为了进一步验证Rg1降低OGD/R诱导HT22细胞铁死亡敏感性的作用,我们采用免疫荧光观察GPX4蛋白表达的变化。结果表明OGD/R处理后HT22细胞GPX4蛋白荧光信号明显变弱,而随着Rg1剂量增高,GPX4信号增强(Fig 3C),这与Western blot结果一致。
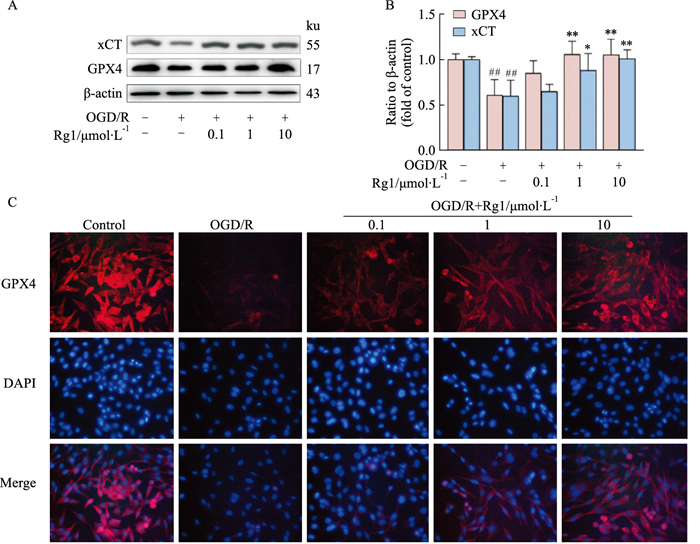
|
| Fig 3 Effect of ginsenoside Rg1 on content of ferroptosis-related proteins in HT22 cells induced by OGD/R A: Western blot; B: GPX4 and xCT protein levels(x±s, n=4); C: HT22 cells were then immunostained using antipodean y specific for GPX4, nucleus used with DAPI (blue) images were acquired using a fluorescence microscope. Scale bar, 20 μm. *P < 0.05, **P < 0.01 vs OGD/R group; ##P < 0.01 vs control group. |
Nrf2是GPX4和xCT的上游转录因子,为研究Rg1是否能上调Nrf2含量,采用Western blot检测Rg1给药后Nrf2蛋白水平的变化,结果表明Rg1给药后HT22细胞Nrf2蛋白表达明显上调(Fig 4B),且在10 μmol·L-1浓度时效果最佳(P < 0.01)。为了验证Nrf2在Rg1抑制OGD/R处理HT22细胞铁死亡中的作用,加入小分子抑制剂ML385,其可抑制Nrf2与DNA结合结构域结合。结果表明,加入ML385(10 μmol·L-1)后,Rg1(10 μmol·L-1)对OGD/R后HT22细胞存活率(Fig 4C)以及GPX4和xCT(Fig 4E)蛋白的上调作用均被抑制,提示Rg1通过促进Nrf2/xCT/GPX4通路,减少OGD/R后HT22细胞铁死亡。
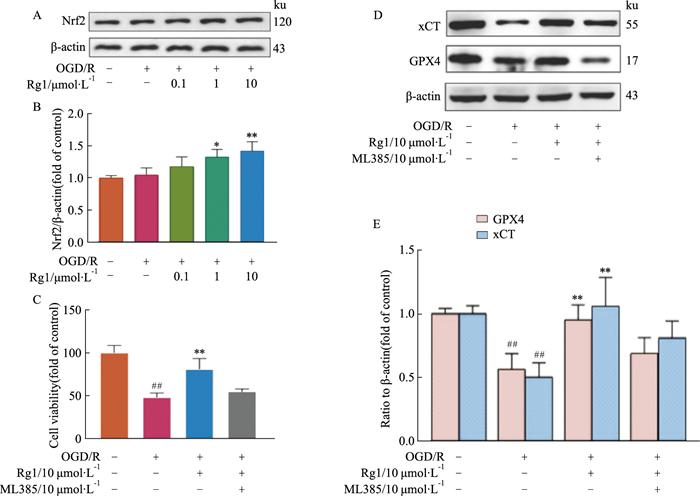
|
| Fig 4 Effect of Nrf2 on inhibitory effect of Rg1 on ferroptosis in HT22 cells after OGD/R (x±s, n=3~4) |
我们采用大鼠MCAO模型验证Rg1在体水平对脑卒中的保护作用,实验设计如Fig 5所示。MCAO模型缺血1.5 h,再灌注24 h后,采用Zea Longa法以及Garcia Test对大鼠进行神经行为学评分。结果显示与sham组相比,MCAO组大鼠Zea Longa和Garcia Test(Tab 1)评分差异均有显著性(P < 0.001),而在Rg1(40 mg·kg-1)或Fer-1(0.2mg·kg-1)给药后神经行为学评分均有明显的改善。
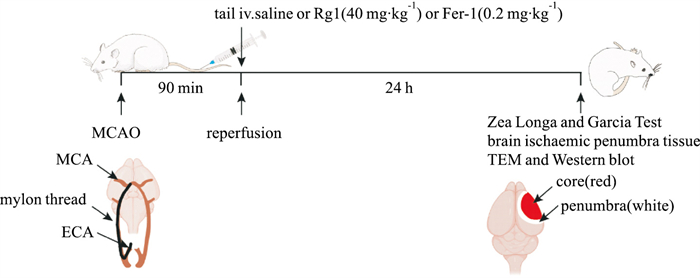
|
| Fig 5 Schematic diagram of MCAO modeling, administration and sampling in rats |
| Group | Zea Longa | Garcia Test |
| Sham | 0.00±0.00 | 18.75±0.96 |
| MCAO | 2.75±0.50## | 8.5±2.08## |
| MCAO+Rg1 | 1.75±0.50* | 12.25±2.22* |
| MCAO+Fer-1 | 1.50±0.58** | 12.75±1.71* |
| F | 24.80 | 21.98 |
| P | < 0.000 1 | < 0.000 1 |
| *P < 0.05, **P < 0.01 vs MCAO; ##P < 0.01 vs sham. | ||
为了检测Rg1对MCAO大鼠皮质神经细胞铁死亡的影响,我们取缺血半暗带附近组织,采用透射电子显微镜观察各组细胞线粒体微结构。结果显示,sham组大鼠皮层神经细胞状态良好,胞质分布均匀,线粒体形态正常。与sham组相比,MACO组大鼠细胞电镜下出现线粒体外膜破裂、线粒体皱缩、嵴减少、膜致密等铁死亡典型特征;MCAO+Rg1组和铁死亡抑制剂MCAO+Fer-1组神经细胞线粒体外膜均未见破裂,收缩明显逆转,且线粒体嵴未见严重损伤(Fig 6)。
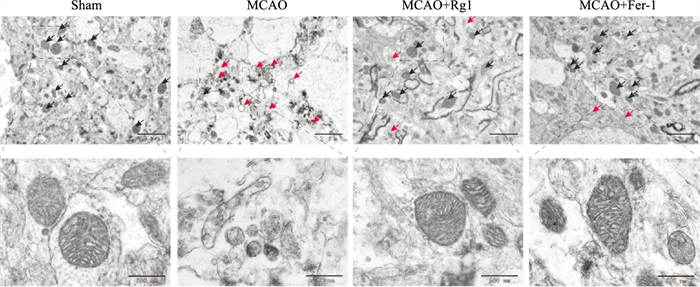
|
| Fig 6 Effect of ginsenoside Rg1 on morphological changes of neuron mitochondria in MCAO rats The red arrows indicated the outer mitochondrial membrane of neurons was ruptured and the mitochondrial cristae decreased or disappeared. The black arrows indicated the normal mitochondria. Bar=2 μm or 500 nm. |
Western blot实验进一步检测Rg1对MCAO模型中铁死亡相关蛋白的影响,结果显示,与sham组相比,MCAO组大鼠皮质脑组织内铁死亡负调节蛋白GPX4(P < 0.05)和xCT(P < 0.05)(Fig 7B)水平明显降低;与MCAO组相比,MCAO+Rg1组大鼠皮质脑组织GPX4蛋白表达增加(P < 0.05)、xCT蛋白表达明显增加(P < 0.01),MCAO+Fer-1组GPX4(P < 0.05)蛋白以及xCT(P < 0.01)蛋白表达也明显上升。Rg1处理组对铁死亡相关蛋白的上调效果与铁死亡抑制剂Fer-1组相当,动物水平上验证Rg1具有改善卒中后神经元铁死亡的作用。
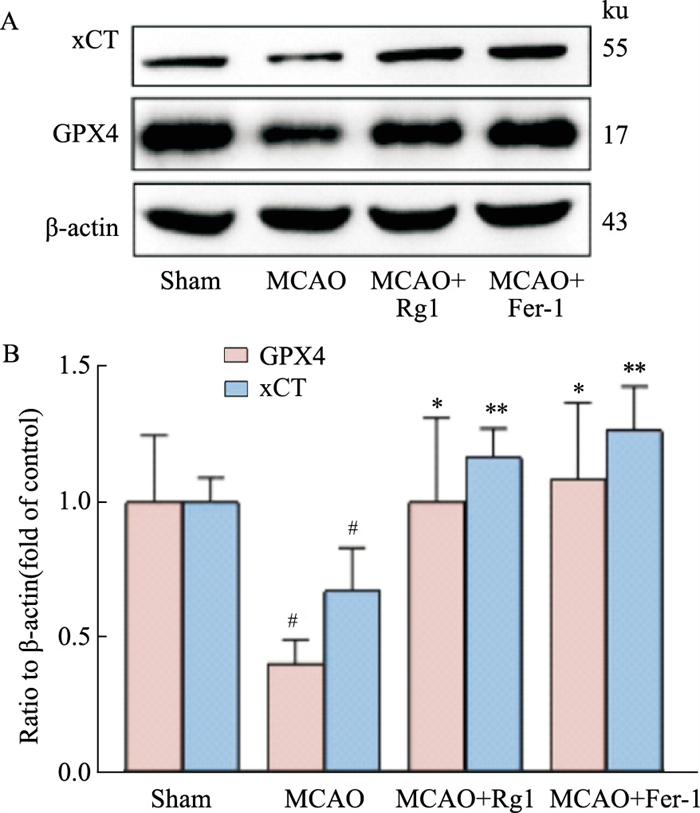
|
| Fig 7 Effect of ginsenoside Rg1 on ferroptosis-related proteins in cortical tissue of MCAO rats A: Western blot. B: GPX4 and xCT protein levels(x±s, n=3). *P < 0.05, **P < 0.01 vs MCAO group; #P < 0.05 vs Sham group. |
人参和三七在临床治疗缺血性脑卒中的复方和中成药中占比巨大[14],人参皂苷Rg1为二者共有的主要活性成分,是通心络胶囊、血栓心宁片等中成药的共同有效成分,具有广阔的应用开发前景[15-16]。现代药理研究表明,人参皂苷Rg1可改善动物局灶性脑缺血引起的神经损伤、脑梗死体积和血脑屏障通透性,其主要机制是通过抑制氧化应激和神经炎症触发的细胞凋亡与坏死程序[11]。既往研究报道,神经元死亡的主要原因是坏死、凋亡、自噬、焦亡等,但这些机制均不能完全解释缺血性脑卒中引起的脑损伤,铁死亡作为一种新型的细胞死亡方式,被证实参与脑卒中损伤的生理病理过程[5]。在实验性中风动物模型中,铁螯合剂、Liproxstatin-1、Ferrostatin-1等铁死亡抑制剂均能有效的减少缺血性卒中后的再灌注损伤来改善神经预后[17]。提示抑制神经细胞铁死亡可能成为治疗缺血性脑卒中的有效手段。而Rg1对缺血性脑卒中的保护作用是否与抑制细胞铁死亡有关还未见报道,因此,本实验对Rg1影响缺血性脑卒中后神经细胞铁死亡的作用进行研究。
OGD/R模型是模拟体内缺血/缺氧/再灌注情况较理想的模型,HT22细胞是小鼠神经元细胞系,体外研究谷氨酸毒性诱导铁死亡的良好模型,因此本实验采用OGD/R诱导HT22细胞模拟体内缺血再灌注的情况,研究Rg1对缺血性脑卒中神经元的保护作用[18]。结果表明在OGD 8 h/R 24 h时,HT22细胞存活率明显降低,而10、1和0.1 μmol·L-1的Rg1均能提高OGD/R后细胞存活率,并随着Rg1浓度的增加而升高,所以后续研究选择10、1和0.1 μmol·L-1作为Rg1的高,中和低剂量浓度。实验发现OGD/R损伤后HT22细胞GSH/GSSG比值明显降低,SOD活性减弱,而Rg1改变了这一结果,上调了OGD/R后HT22细胞GSH/GSSG比值,恢复了SOD活性。此外,OGD/R后HT22细胞内MDA与Fe2+明显升高,Rg1降低了MDA和Fe2+的水平,提示Rg1降低了OGD/R后HT22细胞铁死亡的相关指标,减少了细胞铁死亡。GPX4是细胞铁死亡的核心负调控蛋白,GPX4能降解小分子过氧化物和某些脂质过氧化物,抑制脂质过氧化。GPX4表达下调则会对铁死亡更敏感;相反,若上调GPX4的表达,则会产生对铁死亡的耐受[3]。xCT蛋白负责摄入胱氨酸,参与GSH的合成,GSH又是GPX4降解脂质过氧化物的底物,起到抗氧化和抵抗铁死亡的作用(Fig 8)。实验发现OGD/R能降低HT22细胞GPX4和xCT蛋白的表达,进一步说明OGD/R会诱导HT22细胞铁死亡。Rg1给药能恢复HT22细胞GPX4和xCT蛋白表达。说明Rg1能明显降低OGD/R损伤后HT22细胞铁死亡的敏感性。Nrf2能促进GPX4和xCT基因的转录。实验发现Rg1能促进OGD/R后HT22细胞Nrf2的表达。在加入抑制Nrf2与DNA结合的小分子抑制剂ML385后,Rg1提高OGD/R后HT22细胞存活率,上调GPX4和xCT蛋白表达的作用被抵消,提示Rg1可能通过促进Nrf2/GPX4/xCT通路,减少OGD/R后HT22细胞铁死亡。
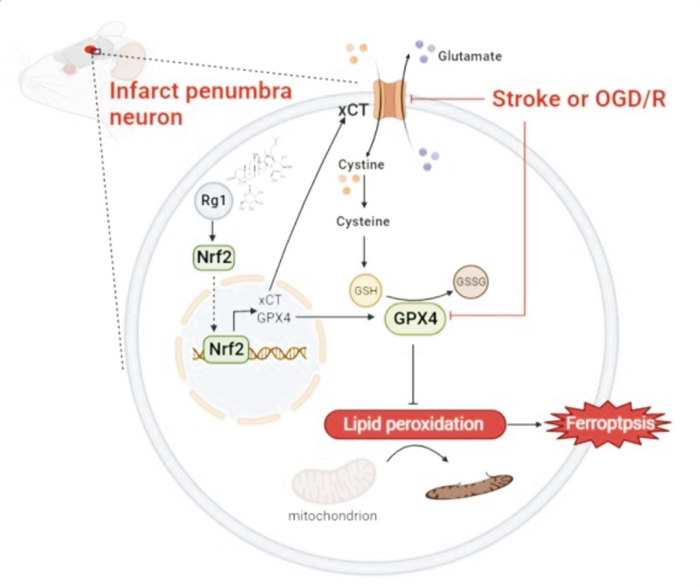
|
| Fig 8 Schematic diagram of protective mechanism of Rg1 on neuronal ferroptosis induced by MCAO or OGD/R Ischemia causes cellular lipid peroxide accumulation, which led to cell ferroptosis. Ginsenoside Rg1 could promote the expression of Nrf2, up-regulate the expression of GPX4 and xCT protein, reduce the level of lipid peroxide, and inhibit the occurrence of ferroptosis after ischemia. Ginsenoside Rg1 inhibited the ferroptosis of ischemic stroke neurons by promoting Nrf2/xCT/GPX4 pathway. |
此外,我们前期研究还发现,Rg1可降低MCAO大鼠皮质神经元靶向Nrf2的miR-144含量,增强Nrf2的转录活性,但其是否能上调GPX4和xCT蛋白的表达尚未可知[12]。在本实验中,Rg1能上调MCAO大鼠皮质脑组织GPX4和xCT蛋白的表达,缓解神经元线粒体形态损伤,并改善MCAO后大鼠神经功能。提示Rg1可能通过促进Nrf2/xCT/GPX4通路抑制MCAO大鼠神经元铁死亡。
综上,人参皂苷Rg1可通过促进Nrf2/xCT/GPX4通路抑制缺血性脑卒中神经元铁死亡(Fig 8)。本课题研究进一步阐明并完善人参皂苷Rg1治疗缺血性脑卒中的相关作用机理,为以抑制铁死亡作为缺血性脑卒中的治疗手段以及为Rg1治疗缺血性脑卒中的开发应用提供了理论参考和实验依据。
| [1] |
Virani S S, Alonso A, Aparicio H J, et al. Heart disease and stroke statistics-2021 Update: a report from the american heart association[J]. Circulation, 2021, 143(8): e254-743. |
| [2] |
Hacke W, Kaste M, Bluhmki E, et al. Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke[J]. N Engl J Med, 2008, 359(13): 1317-29. doi:10.1056/NEJMoa0804656 |
| [3] |
Alim I, Caulfield J T, Chen Y, et al. Selenium drives a transcriptional adaptive program to block ferroptosis and treat stroke[J]. Cell, 2019, 177(5): 1262-79. doi:10.1016/j.cell.2019.03.032 |
| [4] |
Datta A, Sarmah D, Mounica L, et al. Cell death pathways in ischemic stroke and targeted pharmacotherapy[J]. Transl Stroke Res, 2020, 11(6): 1185-202. doi:10.1007/s12975-020-00806-z |
| [5] |
Zhang Y, Lu X, Tai B, et al. Ferroptosis and its multifaceted roles in cerebral stroke[J]. Front Cell Neurosci, 2021, 15: 615372. doi:10.3389/fncel.2021.615372 |
| [6] |
Jiang X, Stockwell B R, Conrad M. Ferroptosis: mechanisms, biology and role in disease[J]. Nat Rev Mol Cell Biol, 2021, 22(4): 266-82. doi:10.1038/s41580-020-00324-8 |
| [7] |
Tang D, Chen X, Kang R, et al. Ferroptosis: molecular mechanisms and health implications[J]. Cell Res, 2021, 31(2): 107-25. doi:10.1038/s41422-020-00441-1 |
| [8] |
Anandhan A, Dodson M, Schmidlin C J, et al. Breakdown of an ironclad defense system: the critical role of NRF2 in mediating ferroptosis[J]. Cell Chem Biol, 2020, 27(4): 436-47. doi:10.1016/j.chembiol.2020.03.011 |
| [9] |
Lin M, Sun W, Gong W, et al. Ginsenoside Rg1 protects against transient focal cerebral ischemic injury and suppresses its systemic metabolic changes in cerabral injury rats[J]. Acta Pharm Sin B, 2015, 5(3): 277-84. doi:10.1016/j.apsb.2015.02.001 |
| [10] |
Sun Y, Yang Y, Liu S, et al. New therapeutic approaches to and mechanisms of Ginsenoside Rg1 against neurological diseases[J]. Cells, 2022, 11(16): 25-9. |
| [11] |
Xie W, Zhou P, Sun Y, et al. Protective effects and target network analysis of Ginsenoside Rg1 in cerebral ischemia and reperfusion injury: a comprehensive overview of experimental studies[J]. Cells, 2018, 7(12): 270. doi:10.3390/cells7120270 |
| [12] |
Chu S F, Zhang Z, Zhou X, et al. Ginsenoside Rg1 protects against ischemic/reperfusion-induced neuronal injury through miR-144/Nrf2/ARE pathway[J]. Acta Pharmacol Sin, 2019, 40(1): 13-25. doi:10.1038/s41401-018-0154-z |
| [13] |
Liu P, Yu X, Dai X, et al. Scalp acupuncture attenuates brain damage after intracerebral hemorrhage through enhanced mitophagy and reduced apoptosis in rats[J]. Front Aging Neurosci, 2021, 13: 718631. doi:10.3389/fnagi.2021.718631 |
| [14] |
李霖, 付姝菲, 华声瑜, 等. 含人参或三七中成药治疗缺血性中风临床应用[J]. 时珍国医国药, 2016, 27(11): 2789-92. Li L, Fu S F, Hua S Y, et al. Study on the application of Chinese patent medicine contained ginseng and Panax notoginseng for ischemic stroke[J]. Lishizhen Med Mat Res, 2016, 27(11): 2789-92. |
| [15] |
麻玉成, 张梦帆, 张运克. 益气活血类方药防治缺血性脑卒中的作用机制研究进展[J]. 中华中医药学刊, 2022, 40(4): 34-42. Ma Y C, Zhang M F, Zhang Y K. Research progress on mechanism of replenishing qi and activating blood circulation traditional Chinese medicine and compound prescriptions in prevention and treatment of ischemic stroke[J]. China J Trad Chin Med Pharm, 2022, 40(4): 34-42. |
| [16] |
明磊. 血栓心脉宁片药效物质基础研究[D] : 长春: 吉林大学, 2012. Ming L. Study on effective substances in Xueshuan Xinmaining Tablet[D]. Changchun: Jilin Univ, 2012. |
| [17] |
Jin Y, Zhuang Y, Liu M, et al. Inhibiting ferroptosis: a novel approach for stroke therapeutics[J]. Drug Discov Today, 2021, 26(4): 916-30. doi:10.1016/j.drudis.2020.12.020 |
| [18] |
门运政, 胡淼, 刘刚, 等. 右美托咪定通过调控Nrf2减轻HT22细胞缺氧/复氧引起的铁死亡[J]. 中国药理学通报, 2022, 28(10): 1480-6. Men Y Z, Hu M, Liu G, et al. Dexmedetomidine attenuates ferroptosis through regulation of Nrf2 on HT22 cells with hypoxia/reoxygenation[J]. Chin Pharmacol Bull, 2022, 28(10): 1480-6. |

