


2. 毕节市市场监督管理局检验检测中心,贵州 毕节 551700
李威(1998-),男,硕士,研究方向:肿瘤药理学,通信作者,E-mail:1778069795@qq.com
 ,
HUANG Yong1,
ZHAO Huan-huan1,
YANG Lin-sen1,
LIU Yong-bin1,
WANG Cheng-cheng1
,
HUANG Yong1,
ZHAO Huan-huan1,
YANG Lin-sen1,
LIU Yong-bin1,
WANG Cheng-cheng1
 ,
LI Wei2
,
LI Wei2

2. Inspection and Testing Center of Bijie Market Supervision Administration, Bijie Guizhou 551700, China
据全球癌症数据统计显示,宫颈癌是最常见的女性生殖系统恶性肿瘤[1]。高危型人乳头瘤病毒(high-risk human papillomavirus,HR-HPV)感染是女性宫颈部位产生癌细胞的主要诱因[2],临床诊断发现,99%的宫颈癌患者体内能检测到HPV的存在[3]。近年来,HPV疫苗虽逐步普及,但接种率仍然有限,并且不适用于处于疾病高发期的45岁以上女性。因此,在许多发展中国家,宫颈癌发病率仍呈现上升趋势[1]。最新统计数据显示,全球每年宫颈癌新发病例高达57万例,死亡约31.1万例。我国宫颈癌每年新发病例高达11万例,死亡约6万例[1]。
在HR-HPV阳性宫颈癌细胞中,由HPV编码的原癌蛋白E6可与UBE3A基因编码的泛素蛋白连接酶E6AP形成复合物[4],共同介导抑癌蛋白p53的泛素化修饰,并通过26S蛋白酶体途径使其降解[5]。由于p53蛋白被过度降解,导致其蛋白水平降低,抑癌功能受损,引起肿瘤细胞凋亡减少,增殖失控,引起宫颈癌的发生发展[6]。此外,有研究表明,宫颈癌多呈现E6AP活性的增高[7]。因此,通过抑制E6AP介导的泛素化降解来维持p53蛋白水平应是靶向抗癌研究的有效途径。
氯化两面针碱(nitidine chloride,NC)系来源于传统中药两面针根部的苯骈菲啶类化合物[8]。NC在治疗包括肿瘤在内的多种疾病中均体现出较大的价值,因此受到国内外研究人员的关注[9]。NC最初因具有止痛、消炎、抗寄生虫、抗氧化、抗菌等药理活性而被发现[10-11],随着其抗肿瘤活性及机制的深入研究,逐渐被证实具有明显的抑制肝癌[12]、卵巢癌[13]、前列腺癌[14]、口腔癌[15]等癌细胞增殖的作用。目前,关于NC在宫颈癌治疗中的作用及机制报道较少。本研究发现,NC可抑制E6AP与p53的相互作用,降低p53泛素化修饰水平,延缓p53降解速度,上调p53蛋白表达水平,恢复其抑癌功能,发挥抗宫颈癌作用。
1 材料与方法 1.1 材料 1.1.1 试剂和抗体NC(B20783)购自上海源叶生物科技有限公司;DMEM培养基(10-013-CVRC)为美国CORNING公司产品;胎牛血清(10270106)、青霉素/链霉素(15070063)及胰蛋白酶(25200072)均购自美国Gibco公司;从美国Proteintech公司购得GAPDH单克隆抗体(60004-1-Ig);从美国Cell Signaling Technology公司获得PARP(9532)、caspase-3(9662s)、caspase-8(9746s)、caspase-9(9508s)、Bax(2772s)及Bcl-2(15071s)抗体;E6AP(sc-166689)、p53(sc-126)、Ubiquitin(Ub,sc-8017)及normal mouse IgG(sc-2025)抗体来源于美国Santa cruz biotechnology公司;放线菌酮(Cycloheximide,CHX,S7418)购自美国Selleck公司;Cell Counting Kit-8(CCK-8,c0040)来自上海Beyotime Biotechnology公司;从南京Vazyme公司购得TUNEL FITC Apoptosis Detection Kit(A111-03);Protease Inhibitor Cocktail(K1007)来自美国APExBIO公司。
1.1.2 细胞系与细胞培养人宫颈癌HeLa及SiHa细胞系均来源于中国科学院上海生命科学研究院细胞资源中心。细胞培养基使用添加了10%胎牛血清及1%青霉素/链霉素的DMEM培养基,将细胞置于培养条件为37 ℃和5% CO2的培养箱中进行培养。
1.2 方法 1.2.1 CCK-8实验通过CCK-8实验测定NC对HeLa及SiHa细胞的毒性作用。将细胞接种于96孔板中,密度为3×107 cells/L,每孔100 μL细胞悬液。次日,细胞贴壁后去除上清,并向培养板中加入含一定浓度NC的培养基,在37 ℃下孵育12 h、24 h或48 h。随后加入CCK-8溶液,继续孵育1 h后,使用酶标仪(Bio-Rad Laboratories, CA, USA)在波长450 nm处检测吸光度值。用药物处理组与对照组的活细胞百分比值表示细胞存活率,其计算公式为:细胞存活率/%=(A处理组-A空白组)/A对照组-A空白组)×100 %。
1.2.2 克隆形成实验采用克隆形成实验探究NC对HeLa和SiHa细胞的生长抑制作用。细胞以1×106 cells/L的密度接种于6孔细胞培养板中,每孔1 mL细胞悬液。待细胞贴壁后,加入含NC的培养基,处理细胞12 h,去除含药培养基,加入新鲜培养基继续培养。每2~3 d更换一次培养基,持续培养14 d。每天观察细胞生长状态,当对照组的细胞集落数量≥100时,去除培养基,并用PBS轻柔洗涤细胞2次。使用4%的多聚甲醛固定细胞,每孔1 mL。于室温静置15 min后,吸去多聚甲醛,并用PBS小心洗涤细胞2次,每次静置5 min。每孔加入1 mL 5%的结晶紫染色液,于室温下静置染色15 min。吸去染液,并用蒸馏水洗去多余染液,洗涤3~5次,观察并记录各组细胞克隆数。
1.2.3 TUNEL分析重悬细胞后,将细胞密度调整为1×108 L-1,向共聚焦培养皿中加入细胞悬液,每皿1 mL。待细胞贴壁后,用含NC的培养基处理细胞12 h。随后,根据试剂盒说明书操作步骤进行TUNEL分析,并使用激光共聚焦显微镜(Olympus Corporation)进行观察并拍照。
1.2.4 Western blot分析蛋白质样品经SDS-PAGE电泳分离,并转移至PVDF膜(美国Millipore公司)上。使用5 %的脱脂牛奶于室温下封闭PVDF膜1 h。后将其用一抗孵育2 h,再用二抗孵育1 h。使用化学发光系统(上海天能科技有限公司)检测蛋白表达水平。
1.2.5 免疫共沉淀实验细胞经含药培养基和对应溶剂处理12 h后,将其浸入含Protease Inhibitor Cocktail的IP裂解液中,4 ℃条件下裂解细胞15 min。将细胞轻轻刮下,收集于1.5 mL微量离心管中,将离心管置于冰上,使用超声破碎仪进行细胞破碎,随后使用冷冻离心机于4 ℃条件下离心10 min,转速为14 000 r·min-1。加入p53抗体,将样本置于4 ℃下慢速旋转,孵育过夜。加入protein G agarose继续慢速旋转6~8 h,随后洗涤3次。使用SDS-PAGE蛋白上样缓冲液制备蛋白样品,并置于金属浴中,95 ℃加热10 min,最后进行Western blot分析。
1.2.6 泛素化实验细胞经含药培养基和对应溶剂处理12 h后,将其浸入含Protease Inhibitor Cocktail的RIPA裂解液中,4 ℃条件下裂解细胞15 min。将细胞集于1.5 mL微量离心管中,使用超声破碎仪于低温下进行细胞破碎,随后使用冷冻离心机于4 ℃条件下离心10 min,转速为14 000 r·min-1。加入p53抗体,并在4 ℃环境下低速旋转孵育过夜,加入protein G agarose继续慢速旋转6~8 h,随后洗涤3次。使用SDS-PAGE蛋白上样缓冲液制备蛋白样品,并置于金属浴中,95 ℃加热10 min,最后进行Western blot分析。
1.2.7 蛋白稳定性实验细胞经含有NC的培养基处理12 h,弃去含药培养基,加入120 mg·L-1 CHX溶液,分别处理细胞0、15、30、45、60 min后收集样本,提取各组细胞总蛋白,随后进行Western blot分析。
1.2.8 统计学分析应用GraphPad Prism 8软件对数据进行统计学分析,数据以x±s表示,采用单因素方差分析进行组间比较。
2 结果 2.1 NC对宫颈癌细胞的生长抑制作用以HeLa(HPV 18阳性)和SiHa(HPV 16阳性)细胞为对象,分别用不同浓度的NC处理细胞12、24或48 h,采用CCK-8法检测NC的细胞毒性作用并计算半数抑制浓度(inhibitory concentration 50,IC50)值。结果显示,NC可呈剂量依赖地发挥对HeLa和SiHa细胞的毒性作用,且随作用时间延长,IC50值逐渐降低(Fig 1A)。NC在HeLa细胞中作用12、24、48 h时,IC50值分别为(8.86±0.52)、(3.58±0.06)、(1.97±0.034) μmol·L-1;在SiHa细胞作用12、24、48 h时,IC50值分别为(8.50±0.26)、(4.42±0.065)、(1.67±0.07) μmol·L-1。
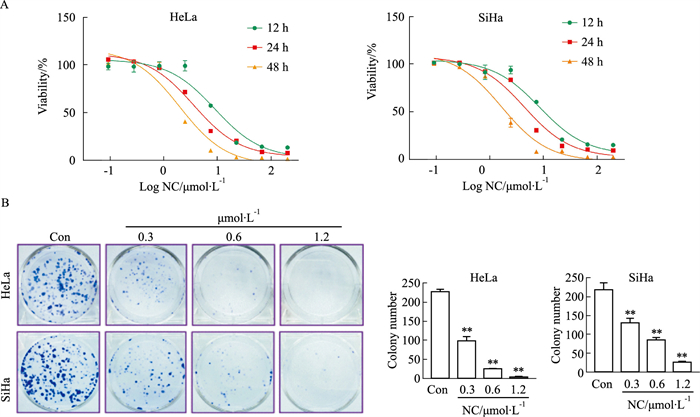
|
| Fig 1 The inhibitory effect of NC on cervical cancer cells and colony formation (x±s, n=3) A: HeLa and SiHa cells were treated with NC (0.1-200 μmol·L-1) for 12, 24 and 48 h, respectively. Cell viability was determined by CCK-8 assay; B: HeLa and SiHa cells were treated with NC (0.3, 0.6, 1.2 μmol·L-1) for 12 h. Cells were fixed in 4% paraformaldehyde after 14 days, and stained with 0.1% crystal violet. **P < 0.01 vs control group. |
为进一步验证NC对宫颈癌细胞增殖的抑制活性,采用克隆形成实验探究了NC对HeLa和SiHa细胞的生长抑制作用。结果显示,细胞经NC处理后,其克隆数量明显减少(P < 0.01),且这种抑制作用随NC剂量的增加而明显加强,具有较好的剂量依赖关系(Fig 1B)。以上结果表明,NC可抑制HR-HPV阳性宫颈癌细胞增殖,表现出明显的抗肿瘤作用。
2.2 NC对宫颈癌细胞凋亡的诱导作用为确定NC是否通过凋亡途径发挥抗宫颈癌作用,本研究采用TUNEL法检测了NC对宫颈癌细胞凋亡的影响。结果表明,经NC处理的细胞,TUNEL-FITC阳性比例较对照组明显增大,即凋亡细胞增多,说明NC可诱导宫颈癌细胞凋亡(Fig 2)。此外,为进一步明确NC对宫颈癌细胞的凋亡诱导作用及细胞凋亡途径,本研究使用Western blot法检测了两种宫颈癌细胞中凋亡相关蛋白的表达水平。如Fig 3所示,与对照组相比,NC处理组caspase-3、caspase-8、caspase-9及PARP蛋白的全长形式明显减少,切割形式明显增加。Bcl-2家族成员Bax及Bcl-2参与细胞凋亡调控,其中Bax是促凋亡蛋白,而Bcl-2则是抗凋亡蛋白。本研究发现,NC可明显升高Bax/Bcl-2的比值(Fig 3)。以上结果表明,NC可诱导促凋亡蛋白表达,抑制抗凋亡蛋白表达,通过内源性和外源性两条凋亡相关通路,介导HR-HPV阳性宫颈癌细胞发生凋亡。
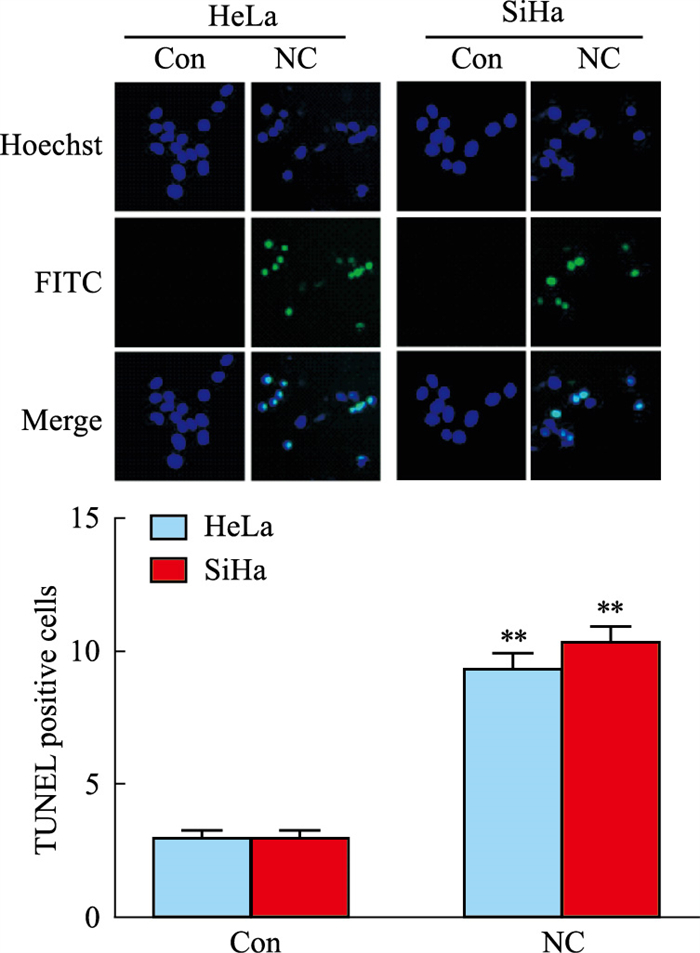
|
| Fig 2 Apoptosis of cervical cancer cells induced by NC (x±s, n=3) HeLa and SiHa cells were treated with NC for 12 h and detected by fluorescence microscopy using a TUNEL FITC Apoptosis Detection Kit. TUNEL-stained cells were in green, and Hoechst-stained nuclei in blue. **P < 0.01 vs control group. |
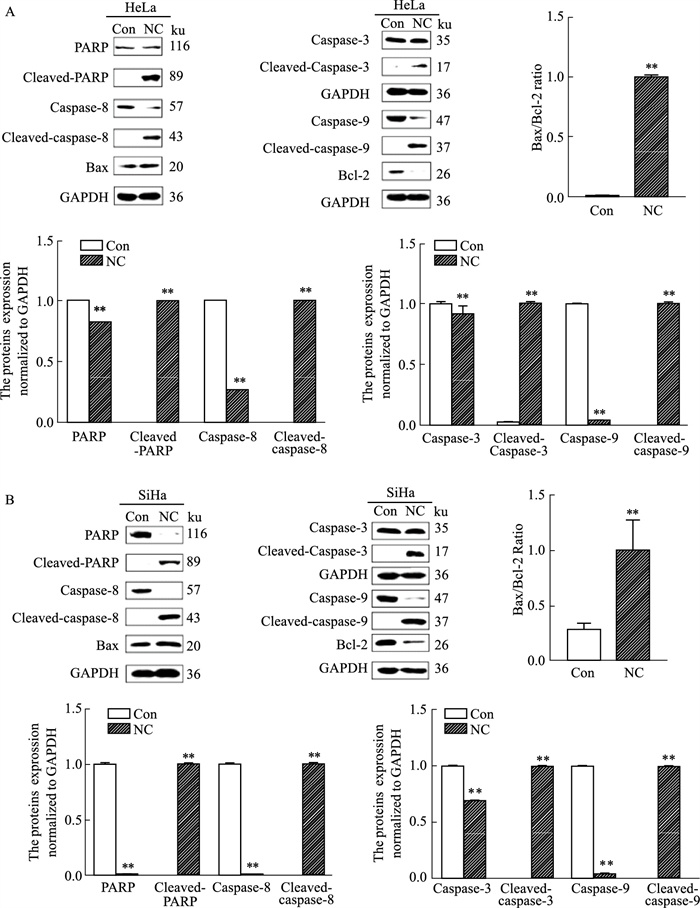
|
| Fig 3 Effect of NC on apoptosis-related protein in cervical cancer cells (x±s, n=3) Western blot was used to detect PARP, caspase-3, caspase-8, caspase-9 (pro and cleaved) and Bax, Bcl-2 expression levels in (A)HeLa and (B)SiHa cells after NC treatment. **P < 0.01 vs control group. |
为进一步探究NC对宫颈癌细胞抑制作用的具体机制,本研究对NC作用下HeLa及SiHa细胞中E6AP蛋白表达水平进行了检测。结果如Fig 4A所示,NC可明显降低EA6P的蛋白水平。HR-HPV阳性宫颈癌细胞中,E6AP与HPV编码的原癌蛋白E6结合,形成E6/E6AP异源二聚体,并与p53相互作用,从而介导p53蛋白泛素化降解,已被证实是宫颈癌发生、发展的关键机制。为探究NC对E6AP与p53的相互作用情况的影响,本研究采用免疫共沉淀实验,通过免疫沉淀p53蛋白,检测与之共同沉淀的E6AP蛋白水平。结果显示,NC明显降低了HeLa和SiHa细胞中与p53结合的E6AP蛋白水平(Fig 4B)。此外,经NC处理后,与E6AP相结合的p53蛋白水平同样下调(Fig 4C),以上结果表明,NC阻碍了E6AP与p53结合,抑制二者的相互作用。
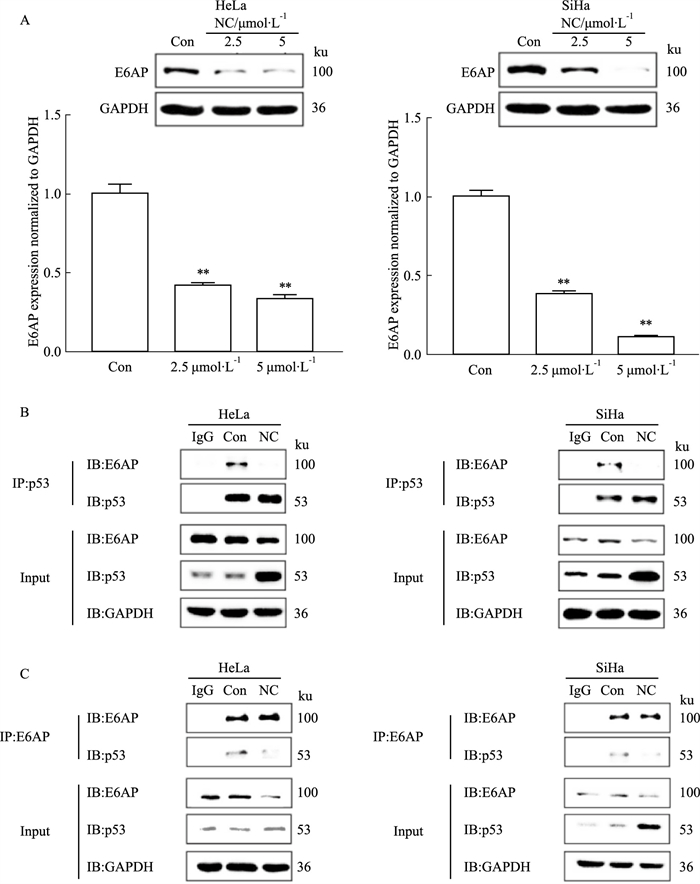
|
| Fig 4 NC inhibited E6AP expression and interactions between E6AP and p53 (x±s, n=3) A: HeLa and SiHa cells were treated with NC for 12 h were detect E6AP expression by Western blot and (B-C) test the interactions between E6AP and p53 by Coimmunoprecipitation experiments. **P < 0.01 vs control group. |
基于在HR-HPV阳性宫颈癌细胞中,E6AP与p53相互作用,介导其泛素化修饰,而NC可下调E6AP蛋白表达水平,并且抑制其与p53相互作用。因此,本研究进一步检测了经NC处理后,细胞中p53蛋白的泛素化修饰水平。结果显示,NC明显抑制了HeLa和SiHa细胞中p53蛋白的泛素化修饰水平(Fig 5)。
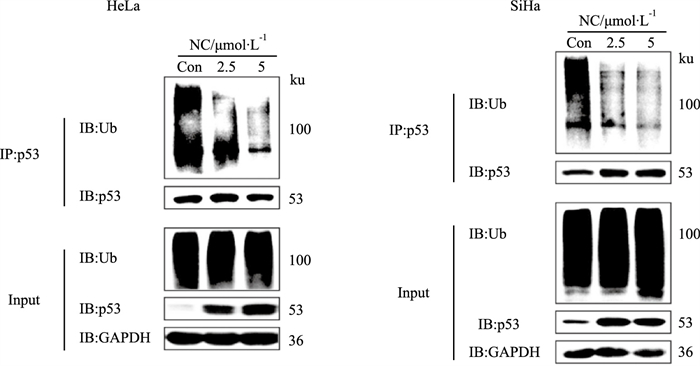
|
| Fig 5 Effect of NC on ubiquitination of p53 in cervical cancer cells (x±s, n=3) HeLa and SiHa cells were treated with NC (2.5, 5 μmol·L-1) for 12 h and the ubiquitination of endogenous p53 was tested by Coimmunoprecipitation experiments. |
在HR-HPV阳性宫颈癌中,p53多为野生型,但由于E6AP介导其泛素化修饰,导致p53蛋白的过度降解,使p53蛋白表达水平降低,进而抑制其发挥抗癌功能。那么,NC对p53泛素化修饰的抑制作用最终应表现为促进p53蛋白稳定性,延缓其降解,增加其蛋白水平的作用。因此,本研究进一步探究了NC是否可减缓HeLa及SiHa细胞中p53蛋白的降解速度。CHX是一种应用广泛的蛋白合成抑制剂,可阻断细胞蛋白质合成,通过CHX阻断细胞内p53蛋白合成后,采用Western blot法检测各组细胞中p53蛋白的降解情况。结果显示,在HeLa和SiHa细胞中,经NC处理后,p53蛋白降解速度较对照组明显减慢(Fig 6A)。这表明NC可促进p53稳定,延缓其降解。此外,本研究进一步检测了NC作用后,HeLa和SiHa细胞细胞中p53蛋白表达情况。结果显示,NC处理组p53蛋白表达水平明显上调(Fig 6B)。这也与NC对p53下游蛋白Bax及Bcl-2的调控作用趋势相一致。上述结果表明,NC可抑制HR-HPV阳性宫颈癌细胞HeLa及SiHa中E6AP介导的p53蛋白泛素化修饰,延缓其降解,促进其稳定,从而增加其蛋白表达水平。
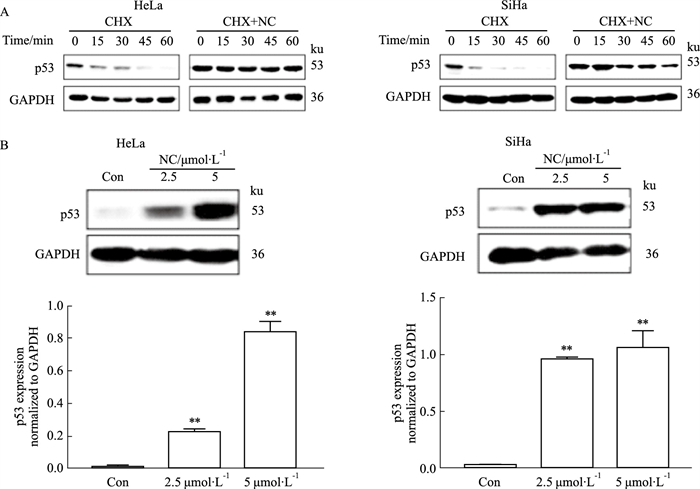
|
| Fig 6 NC promoted stability of p53 protein in cervical cancer cells (x±s, n=3) A: The degradation of p53 was analyzed in HeLa and SiHa cells by Western blot after treated with NC; B: The protein level of p53 was analyzed in HeLa and SiHa cells by Western blot after treated with NC. **P < 0.01 vs Control group. |
宫颈癌是一种高发病率、高死亡率的女性恶性肿瘤,且患病人数仍呈现逐年增长的趋势。尽管HPV疫苗的研发和使用及宫颈癌筛查均取得较大进展,但已感染者和未被疫苗有效覆盖的人群仍面临着巨大风险。目前,手术、放疗及化疗是临床治疗中的标准诊疗方案,但存在创伤大、易复发或转移、易发生耐药等缺点。因此,急需开发对宫颈癌针对性强、疗效好、毒副作用小的靶向药物。
肿瘤的发生与细胞信号传导、激素调节及转录调控的失调密切相关。此外,原癌基因和抑癌基因发生功能性突变也是导致肿瘤形成的重要原因。这些失调与突变会导致DNA复制失控,端粒酶发挥作用,进而引起细胞恶性增殖,促进肿瘤发生。TP53作为最重要的抑癌基因之一,其结构突变及功能缺失是许多肿瘤发生、发展的重要原因。由TP53基因编码的p53蛋白是一种抑癌蛋白,参与了包括DNA修复、细胞凋亡及细胞周期阻滞等重要生命活动[16]。p53分为野生型和突变型,在p53野生型的肿瘤细胞中,其主要通过小鼠双微体2(murine double minute 2,MDM2)所介导的泛素蛋白酶体途径(ubiquitin proteasome pathway,UPS)进行降解。然而,在HR-HPV阳性的宫颈癌细胞中,MDM2功能受到抑制,E6AP与E6蛋白形成异源二聚体,进一步募集p53,与之形成复合物,并通过UPS促使p53降解[16]。因此,寻找可阻断E6AP所介导的p53泛素化降解的药物对宫颈癌的治疗具有重要意义。
NC是一种从两面针根部提取得到的具有明确生物活性的苄基四氢异喹啉类化合物,是两面针中研究最为深入和广泛的生物碱之一。据报道,NC对多种肿瘤均有明显的抑制作用。已被报道的抗肿瘤作用机制有:抑制细胞周期相关蛋白表达,诱导细胞周期阻滞。NC还可通过调控JAK/STAT3、PI3K/AKT/mTOR等经典信号通路及线粒体途径,从而发挥诱导细胞凋亡的作用[17]。此外,NC可调控蛋白激酶信号通路,进而抑制肿瘤细胞的侵袭、转移。值得注意的是,NC可通过上调p53蛋白表达,并激活其下游信号通路发挥抗肿瘤活性[18]。然而,NC究竟是通过增多p53合成还是抑制p53降解发挥上调p53蛋白水平的作用目前尚不清楚。此外,目前关于NC的抗宫颈癌作用及具体机制报道较少。
本研究通过CCK-8及克隆形成实验发现传统中药两面针的活性成分NC对HR-HPV阳性宫颈癌细胞具有明显的毒性作用,可呈时间和剂量依赖性抑制HR-HPV阳性宫颈癌细胞增殖(Fig 1)。此外,TUNEL实验结果表明,经NC处理后,宫颈癌细胞凋亡水平增加(Fig 2)。通过检测凋亡相关蛋白表达情况,结果与TUNEL实验结果一致,NC可明显诱导HR-HPV阳性宫颈癌细胞凋亡的发生(Fig 3)。上述结果均表明,NC具有抗HR-HPV阳性宫颈癌的作用。
在HR-HPV阳性宫颈癌细胞中,p53蛋白泛素化降解主要由泛素蛋白连接酶E6AP所介导,且在细胞中E6AP蛋白表达水平异常升高。本研究发现,NC可明显抑制宫颈癌细胞中E6AP蛋白表达(Fig 4A)。E6AP与p53相互作用,通过泛素化途径致其降解,导致其抑癌功能受到抑制。免疫共沉淀实验结果表明,NC可抑制E6AP与p53相互作用(Fig 4B-C)。同时,泛素化实验结果显示,NC可降低p53蛋白泛素化修饰水平,且该抑制作用具有较好的剂量依赖性(Fig 5)。综上结果,NC可抑制E6AP蛋白表达,降低与p53结合的E6AP蛋白水平,进而降低p53泛素化修饰水平。为进一步确定NC是否可抑制p53的降解,恢复p53蛋白水平,本研究检测了NC对p53蛋白降解速度及表达水平的影响。蛋白稳定性实验和Western blot实验结果显示,NC处理后,两种宫颈癌细胞中p53蛋白的降解速度明显减慢(Fig 6A),p53蛋白表达水平明显升高(Fig 6B)。
综上所述,本研究首次发现并证实了NC可抑制宫颈癌细胞E6AP蛋白表达,并抑制其与p53相互作用,削弱其介导的p53蛋白泛素化修饰程度,抑制p53蛋白降解,增加p53蛋白表达水平,从而恢复p53蛋白的抑癌功能,发挥明显的抗宫颈癌作用。这可为进一步探索NC用于宫颈癌治疗提供实验基础和理论依据,对其临床应用具有参考价值。
| [1] |
Sung H, Ferlay J, Siegel R, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-49. doi:10.3322/caac.21660 |
| [2] |
Colín-Ferreyra M, Domínguez-García M, Mendieta-Zerón H, et al. Genotyping of human papillomavirus in cervical squamous intraepithelial lesions in Mexican women[J]. Jpn J Infect Dis, 2020, 73(2): 157-60. doi:10.7883/yoken.JJID.2019.289 |
| [3] |
Wang R, Pan W, Jin L, et al. Human papillomavirus vaccine against cervical cancer: Opportunity and challenge[J]. Cancer Lett, 2020, 471: 88-102. doi:10.1016/j.canlet.2019.11.039 |
| [4] |
Osei-Amponsa V, Walters K. Proteasome substrate receptors and their therapeutic potential[J]. Trends Biochem Sci, 2022, 47(11): 950-64. doi:10.1016/j.tibs.2022.06.006 |
| [5] |
Vats A, Skrabar N, Del Sal G, et al. Loss of the E6AP ubiquitin ligase induces p53-dependent phosphorylation of human papillomavirus 18 e6 in cells derived from cervical cancer[J]. J Virol, 2022, 96(6): e0150321. doi:10.1128/jvi.01503-21 |
| [6] |
Chen J. Signaling pathways in HPV-associated cancers and therapeutic implications[J]. Rev Med Virol, 2015, 24-53. |
| [7] |
Mortensen F, Schneider D, Barbic T, et al. Role of ubiquitin and the HPV E6 oncoprotein in E6AP-mediated ubiquitination[J]. Proc Natl Acad Sci USA, 2015, 112(32): 9872-7. doi:10.1073/pnas.1505923112 |
| [8] |
Li W, Yin H, Bardelang D, et al. Supramolecular formulation of nitidine chloride can alleviate its hepatotoxicity and improve its anticancer activity[J]. Food Chem Toxicol, 2017, 109: 923-9. doi:10.1016/j.fct.2017.02.022 |
| [9] |
Liao Y, Li C, Lin C, et al. Traditional Chinese medicine as adjunctive therapy improves the long-term survival of lung cancer patients[J]. J Cancer Res Clin Oncol, 2017, 143(12): 2425-35. doi:10.1007/s00432-017-2491-6 |
| [10] |
Yang N, Yue R, Ma J, et al. Nitidine chloride exerts anti-inflammatory action by targeting Topoisomerase Ⅰ and enhancing IL-10 production[J]. Pharmacol Res, 2019, 148: 104368. doi:10.1016/j.phrs.2019.104368 |
| [11] |
Yang X, Jiang B, Jing Q, et al. Nitidine chloride induces S phase cell cycle arrest and mitochondria-dependent apoptosis in HaCaT cells and ameliorates skin lesions in psoriasis-like mouse models[J]. Eur J Pharmacol, 2019, 863: 172680. doi:10.1016/j.ejphar.2019.172680 |
| [12] |
Lin J, Shen A, Chen H, et al. Nitidine chloride inhibits hepatic cancer growth via modulation of multiple signaling pathways[J]. BMC cancer, 2014, 14: 729. doi:10.1186/1471-2407-14-729 |
| [13] |
Chen S, Yang L, Feng J. Nitidine chloride inhibits proliferation and induces apoptosis in ovarian cancer cells by activating the Fas signalling pathway[J]. J Pharm Pharmacol, 2018, 70(6): 778-86. doi:10.1111/jphp.12901 |
| [14] |
Shi Y, Cao T, Sun Y, et al. Nitidine Chloride inhibits cell proliferation and invasion via downregulation of YAP expression in prostate cancer cells[J]. Am J Transl Res, 2019, 11(2): 709-20. |
| [15] |
Kim L, Khadka S, Shin J, et al. Nitidine chloride acts as an apoptosis inducer in human oral cancer cells and a nude mouse xenograft model via inhibition of STAT3[J]. Oncotarget, 2017, 8(53): 91306-15. doi:10.18632/oncotarget.20444 |
| [16] |
商廿颍, 赵春阳, 彭英. 靶向E3泛素连接酶的药物研究进展[J]. 中国药理学通报, 2021, 37(6): 749-55. Shang N Y, Zhao C Y, Peng Y. Progress of drugs targeting E3 ubiquitin ligase[J]. Chin Pharmacol Bull, 2021, 37(6): 749-55. |
| [17] |
Peña-Blanco A, García-Sáez A. Bax, Bak and beyond-mitochondrial performance in apoptosis[J]. FEBS J, 2018, 285(3): 416-31. doi:10.1111/febs.14186 |
| [18] |
Ou X, Lu Y, Liao L, et al. Nitidine chloride induces apoptosis in human hepatocellular carcinoma cells through a pathway involving p53, p21, Bax and Bcl-2[J]. Oncol Rep, 2015, 33(3): 1264-74. doi:10.3892/or.2014.3688 |