

单磷酸腺苷活化的蛋白激酶(AMP-activated protein kinase,AMPK)是一种丝氨酸/苏氨酸激酶,在真核细胞中普遍表达。它是一种重要的能量传感器,可以感知细胞的能量状态,在调节全身细胞能量的稳态中具有重要作用。AMPK在葡萄糖剥夺、缺氧或局部缺血等能量应激条件下因细胞内AMP/ADP比值的升高而被磷酸化和激活,促进ATP合成并抑制ATP的分解代谢来维持细胞和全身能量代谢平衡。能量平衡失调被认为是一个影响人类疾病的重要驱动因素。因此,AMPK在维持能量稳态中的核心作用使其成为预防和治疗代谢性疾病的一个关键靶点[1]。铁死亡是一种新定义的铁依赖性细胞死亡,其标志是铁代谢失衡,特点是铁依赖性活性氧(reactive oxygen species,ROS)的产生和脂质过氧化。铁死亡与多种疾病的病理生理过程有关,如癌症、脑卒中、缺血/再灌注损伤、肾变性等。近年来诸多研究表明,AMPK的激活在各种炎症、缺血/再灌注和氧化应激性疾病的改善中起着至关重要的作用,基础AMPK活性高的细胞对铁死亡具有可抗性,而AMPK失活可使这些细胞对铁死亡变得敏感,激活AMPK相关信号通路是调控铁死亡的重要途径[2]。本文主要综述AMPK调控铁死亡的相关信号通路,以期为相关药物和疾病治疗靶点的寻找提供参考。
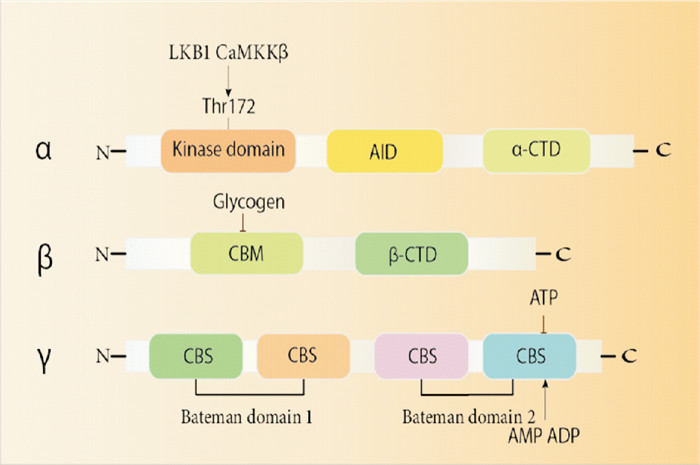
1 AMPK结构及表达位置AMPK是由1个催化亚基(α)和2个调节亚基(β和γ)组成的异三聚体复合物。在哺乳动物中,有2种不同的α、β亚型和3种不同的γ亚型,α、β和γ亚基的主要功能分别是催化、调节和连接。α亚基由激酶结构域、自身抑制剂结构域(AID)和α-亚基羧基末端结构域(α-CTD)组成,包含催化结构域和激活环中的Thr172,其被上游激酶磷酸化以激活。β亚基由β-CTD和CBM组成,通过β-CTD充当α和γ亚基之间的桥梁,这有助于AMPK靶向寻找位点。γ亚基N端结构域长度不同,含有4个串联的胱硫醚β合成酶(CBS)重复序列,形成2个Bateman结构域[3]。Bateman结构域是AMP/ATP结合和变构调控的位点,具体见Fig 1。大脑主要包含α1、α2、β1、γ1和γ2亚基,心脏和肝脏主要含有α1、α2、γ1和γ2亚基,肺和肾主要含有α1、γ1和γ2亚基,骨骼肌主要含有α2、β2、γ1、γ2和γ3亚基[4]。由于AMPK各亚基表达表达在不同的细胞类型中,因此由其介导的相关信号通路和相关疾病的激活位点各有不同。
|
| Fig 1 The AMPK subunit structure |
能量应激扰乱细胞稳态并诱导细胞死亡,铁死亡是一个需要能量的过程,而能量应激介导的AMPK激活可以调控铁死亡。AMPK与铁死亡有关的一个关键靶点是乙酰辅酶A羧化酶(Acetyl-CoA carboxylase1,ACC1),其抑制导致游离脂肪酸减少,这些脂肪酸在整合到细胞膜之前特别容易被过氧化[5]。此外,由于ACC1抑制促进脂肪酸氧化,这导致可氧化脂肪酸水平的进一步降低。脂肪酸合成和分解的这种组合效应提高了谷胱甘肽(glutathione,GSH)水平,这对于防止铁死亡很重要。除了前面描述的AMPK的作用外,AMPK激活还导致蛋白质合成的减少,蛋白质合成抑制剂已经被证明可以降低细胞内GSH的水平从而抑制铁死亡[6]。因此,AMPK介导的蛋白质合成减少也可能抑制铁死亡而发挥保护作用。AMPK激活还能促进线粒体增殖,而线粒体功能障碍是铁死亡及年龄相关的神经退行性疾病的关键特征[3],这是AMPK激活可能有助于预防铁死亡的另一种方式。AMPK激活剂(AICAR,A769662)可以保护细胞免受铁死亡的影响,而AMPK敲除则会大大降低A769662的保护作用[1]。有研究证实,AMPK的药理激活剂5-氨基咪唑-4-甲酰胺核苷酸(AICAR)可显著阻断铁死亡和相关的脂质过氧化,与此相反,AMPKα1和α2亚基的双敲除则显著提高了铁死亡和脂质过氧化物积累的敏感性[7]。可见AMPK与铁死亡之间的关系错综复杂。笔者将在下文着重讨论AMPK调控铁死亡的相关信号通路,见Tab 1。
| Initiating factor | Inhibit/Activate | Intermediate pathway 1 | Inhibit/Activate | Intermediate pathway 2 | Inhibit/Induce | Result |
| AMPK | Activate | PGC1α | Activate | NRF2 | Inhibit | |
| Activate | GSK3β | Activate | NRF2 | Inhibit | ||
| Inhibit | mTOR | Activate | ULK1 | Induce | ||
| Inhibit | mTOR | Inhibit | SLC7A11 | Induce | ||
| Inhibit | JAK2/STAT3 | Activate | P53/GPX4 | Induce | ||
| Ferroptosis | ||||||
| Inhibit | SREBP1/SCD1 | Induce | ||||
| Activate | BECN1/SLC7A11 | Inhibit | Xc- | Induce | ||
| SIRT3 | Activate | Inhibit | mTOR | Induce | ||
| ROS | Activate | Inhibit | mTOR | Induce | ||
| ROS | Activate | AMPK | Activate | SCD1 | Inhibit | |
| LKB1 | Activate | Inhibit | ACC1 | Inhibit | ||
| PP2A | Activate | Inhibit | EEF2 | Induce |
核因子NF-E2相关因子(nuclear factor erythroid2-related factor 2,NRF2)被认为是抗氧化反应的主要调节因子,当细胞受到ROS刺激时,NRF2改变其分子构象,从细胞质转位到细胞核,继而促进下游血红素氧合酶-1(heme oxygenase-1,HO-1)、溶质载体家族7成员11(recombinant solute carrier family 7,SLC7A11)和谷胱甘肽过氧化物酶4(glutathione peroxidase,GPX4)转录,这些蛋白在抗氧化和抑制铁死亡中发挥重要作用[8]。
AMPK-PGC1α-NRF2信号通路:过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1,PGC-1α)的磷酸化是AMPK信号通路激活的关键指标,也是连接AMPK和NRF2信号通路的桥梁[9]。NRF2在减轻神经退行性疾病的脂质过氧化和铁死亡中发挥了重要作用,并受AMPK-PGC1α信号通路调控。作为细胞内能量状态的调节剂,AMPK和PGC1α在脑损伤后均异常活跃。Gao等[10]发现,在缺血性脑卒中后AMPK-PGC1α通路激活能保护线粒体的生物合成和功能,而该通路的抑制会加重脑缺血/再灌注损伤,这与激活AMPK-PGC1α-NRF2信号通路抑制铁死亡相关。
AMPK-GSK3β-NRF2信号通路:糖原合成酶激酶3β(glycogen synthase kinase-3β,GSK3β)是AMPK的下游分子,AMPK可以通过诱导GSK3β的磷酸化促进NRF2的核转录,而AMPK-GSK3β-NRF2信号转导是铁死亡的重要调节途径[2]。铁死亡被认为是心肌缺血/再灌注(MIR)损伤的重要原因,Wang等[11]研究证实,增加AMPK和GSK3β的磷酸化,促进NRF2的核转录,增强HO-1、SLC7A11和GPX4的表达能显著抑制心肌细胞铁死亡,从而减轻MIR损伤。Lu等[12]通过制备MIR损伤动物模型也得出同样结论。
3.2 AMPK-mTOR相关信号通路哺乳动物雷帕霉素靶(mammalian target of rapamycin,mTOR)是雷帕霉素激酶的机制靶点,调节细胞生长和自噬。已知AMPK-mTOR信号通路与铁死亡密切相关,作为能量分子的传感器,AMPK正向抑制铁死亡和灭活mTOR以响应能量代谢[13]。
SIRT3-AMPK-mTOR信号通路:去乙酰化酶(sirtuin 3,SIRT3)对AMPK的磷酸化有正向调节作用,与维持细胞氧化还原稳态有关。Han等[14]通过研究观察到在铁死亡诱导物作用下,滋养细胞SIRT3蛋白表达显著升高。SIRT3缺失会抑制AMPK-mTOR通路的激活,增强GPX4的表达,从而抑制铁死亡。这提示SIRT3上调能通过促进AMPK-mTOR途径并降低GPX4水平诱导细胞铁死亡。
AMPK-mTOR-ULK1信号通路:ULK1是酵母蛋白Atg1的同源物,有研究表明它参与铁死亡的诱导。Bao等[15]发现双酚a(bisphenol A,BPA)激活AMPK-mTOR-ULK1信号通路诱导了铁死亡,表现为细胞内铁沉积增加,脂质过氧化和细胞死亡,而且利用典型的铁死亡抑制剂ferrostatin-1和去铁胺可以从根本上减少细胞死亡。为证明这一结果的真实性,他们敲除AMPK,mTOR和ULK1,发现显著减轻了BPA诱导的铁死亡。这些结果表明,AMPK-mTOR-ULK1信号通路参与了铁死亡的调节。同时,Guo等[13]也通过研究验证了大蒜素可以在体内通过激活AMPK,抑制mTOR来诱导铁死亡。
ROS-AMPK-mTOR信号通路:据报道,花杉黄酮(AF)具有抗肿瘤能力。Sun等[16]研究AF在子宫内膜癌(KLE)中的作用及其机制。结果发现经AF处理后KLE细胞ROS和AMPK表达增加,而mTOR表达降低且呈浓度依赖性。提出AF通过激活ROS-AMPK-mTOR途径促进铁死亡,抑制了KLE细胞增殖。
AMPK-MTOR-SLC7A11信号通路:苯并吡喃衍生物2-亚氨基-6-甲氧基-2H-铬烯-3-碳硫代酰胺(IMCA)能通过AMPK-mTOR途径下调SLC7A11的表达而诱导铁死亡。Zhang等[17]证实了IMCA能诱导细胞AMPK磷酸化,抑制mTOR去磷酸化,并同时下调SLC7A11的表达,降低半胱氨酸和GSH含量,最终导致ROS积累和铁死亡。因此,IMCA诱导的铁死亡与AMPK-mTOR通路有关。
3.3 AMPK-JAK2/STAT3-P53-GPX4信号通路近年来,Janus激酶(JAK)信号转导和转录激活因子(signal transducer and activator of transcription,STAT)途径被发现并作为与细胞因子密切相关的细胞内信号转导途径。JAK2/STAT3是JAK/STAT的一个重要亚型,参与细胞增殖、分化、凋亡和免疫调节等多种生物学过程,与许多癌症的增殖、迁移、转移和恶病质有关[18]。在Li等[19]的研究中,他们发现能量应激通过激活AMPK显著增强了GPX4依赖性铁死亡。并发现通过上调p53(已知的一种人体抑癌基因)的表达以及在转录水平上抑制GPX4的表达,能促进AMPK介导的GPX4依赖性铁死亡。而JAK2/STAT3信号通路失活能上调p53的表达,从而参与铁死亡这一过程。总之,能量应激介导的AMPK激活后通过JAK2/STAT3-P53信号通路促进了铁死亡发生。
3.4 ROS-AMPK-SCD1信号通路在以往的研究中,TP53诱导的糖酵解和凋亡调节因子(TP53-induced glycolysis and apoptosis regulator,TIGAR)显示出较强的抗氧化作用,并能显著降低细胞内ROS水平[20]。Liu等[21]进一步研究提出,TIGAR是对抗铁死亡的潜在关键驱动因素,他们发现TIGAR通过灭活AMPK介导的硬脂酰辅酶A去饱和酶1(stearyl coenzyme A dehydrogenase-1,SCD1)上调来控制氧化还原信号,从而诱导细胞铁死亡。因此,他们提出TIGAR可能通过抑制ROS的产生影响铁死亡。这些结果提示TIGAR能通过ROS-AMPK-SCD1信号通路来抑制细胞铁死亡。
3.5 LKB1-AMPK-ACC1信号通路Li等[7]的研究表明,AMPK能调节铁死亡的敏感性,通过抑制脂肪酸合成限速酶ACC1在能量不足的情况下负向调节脂肪酸合成。除此,他们观察到铁死亡在小鼠胚胎成纤维细胞(mouse embryonic fibroblasts,MEFs)中诱导了ACC1的强烈磷酸化,而在AMPK敲除模型中则不能诱导ACC1磷酸化,这提示在铁死亡过程中AMPK抑制了ACC1的磷酸化。本研究同时证实了在铁死亡的诱导下,AMPK被上游肝激酶B1(liver kinase B1,LKB1)激活,通过抑制ACC1和脂质生物合成所需的其他可能底物的磷酸化来抑制细胞脂质合成,从而保护细胞免受铁死亡。总之,LKB1-AMPK能通过抑制ACC1磷酸化负调控铁死亡。
3.6 AMPK-SREBP1/SCD1信号通路Zhao等[22]观察到,富含乳酸的肿瘤细胞对常见的铁死亡诱导剂所致的损伤具有强抵抗力,单羧酸转运体1(monocarboxylate transporter 1,MCT1)介导的乳酸摄取可促进癌细胞ATP的产生,并使AMPK失活,导致固醇调节元件结合蛋白1(sterol regulatory element binding protein-1,SREBP-1)和下游SCD1上调,从而促进抗铁死亡单不饱和脂肪酸的产生。该团队还证实肿瘤细胞中乳酸抑制受体HCAR1/MCT1的缺失会导致p-AMPK上调和下游SREBP1、SCD1下调,从而促进铁死亡发生。这说明SREBP1/SCD1参与了AMPK调控铁死亡的途径。
3.7 PP2A-AMPK-EEF2相关信号通路Zhong等[23]发现,芬戈莫特(FTY720)能通过PP2A-AMPK途径诱导铁死亡。众所周知,GPX4和SLC7A11的失活和耗竭抑制了半胱氨酸代谢,导致脂质过氧化升高和铁死亡[24],即GPX4和SLC7A11的表达减少代表了铁死亡发生。他们发现蛋白磷酸酶2A(protein phosphatase 2A,PP2A)抑制剂LB-100和AMPK激活剂AICAR能逆转FTY720下调的GPX4和SLC7A11表达,因此他们认为PP2A抑制剂或AMPK激活剂抑制PP2A-AMPK通路能抑制FTY720诱导的铁死亡。真核延伸因子2激酶(eukaryotic elongation factor 2 kinases,EEF2K)是Ca2+/CaM依赖性蛋白激酶,通过磷酸化其唯一已知底物EEF2来调节蛋白质合成[25]。本研究也发现FTY720可通过激活PP2A,从而去磷酸化AMPK,进一步降低EEF2的磷酸化,诱导细胞铁死亡。
3.8 AMPK-BECN1-SLC7A11-Xc-信号通路System Xc-是细胞膜上的一种胱氨酸/谷氨酸逆向转运蛋白,在调控细胞铁死亡过程中发挥关键作用,也是BECN1(一种特异性的自噬基因)自噬的关键分子。Song等[26]发现,BECN1通过与其核心组分SLC7A11结合,直接阻断System Xc-的活性,从而促进铁死亡。AMPK介导的BECN1在Ser90/93/96位点的磷酸化是BECN1-SLC7A11复合物形成和脂质过氧化所必需的。因此,BECN1磷酸化缺陷能逆转BECN1诱导的脂质过氧化和铁死亡。总之,他们定义了一个由AMPK-BECN1-SLC7A11介导的调节信号通路,这一通路通过直接阻断System Xc-活性来调控铁死亡。
4 AMPK调控铁死亡相关信号通路在疾病中的应用AMPK处于能量应激的十字路口,不仅参与了铁死亡的调控,也参与了多种疾病的发生发展过程。Huang等[27]表明,葛根素通过激活AMPK-PGC1α-NRF2信号通路能减轻蛛网膜下腔出血大鼠模型的铁死亡,从而改善大鼠神经行为损伤。Bao等[15]证实,抑制AMPK-mTOR-ULK1轴激活能明显抑制铁死亡,保护肾小管上皮细胞,改善肾功能。Wang等[11]发现,右美托咪啶通过AMPK/GSK-3β信号途径激活NRF2能显著降低心肌细胞Fe2+积累和脂质过氧化,改善心功能。Zhou等[28]表明,葛根素能调节AMPK表达,抑制大鼠铁死亡,对脓毒症所致的心肌损伤有保护作用。Lu等[12]经研究证实,激活AMPK-GSK3B-NRF2信号通路并上调GPX4对心肌缺血/再灌注损伤具有保护作用。Wang等[29]提出,萝卜硫素能通过激活AMPK-NRF2途径抑制铁死亡,从而预防或延缓糖尿病心肌病发生。Guo等[13]表明,大蒜素可通过激活AMPK-mTOR介导的铁死亡,诱导食管鳞状癌细胞死亡,控制疾病进程。Zhang等[17]发现,苯并吡喃衍生物2-亚氨基-6-甲氧基-2H-铬烯-3-碳硫代酰胺(IMCA)能通过AMPK-mTOR途径诱导癌细胞铁死亡,最终抑制结直肠癌细胞的生存能力。Han[14]团队表明激活AMPK-mTOR途径能诱导铁死亡,预防妊娠期糖尿病。Sun等[16]证实,花杉黄酮通过激活ROS-AMPK-mTOR通路能抑制子宫内膜癌细胞的活力和增殖,促进癌细胞凋亡和铁死亡,从而延缓疾病进展。Zhong等[23]发现,FTY720能通过激活蛋白磷酸酶2A(PP2A)-AMPK途径诱导铁死亡,延长多发性骨髓瘤患者生命。上述研究均表明,AMPK和铁死亡参与了脑血管疾病、心血管疾病、呼吸系统疾病、消化系统疾病、泌尿系统疾病、血液病、肿瘤等多种疾病的发生过程,而通过药物或物理手段干预AMPK调控铁死亡的相关通路防治疾病是未来研究的一大趋势和热点。
5 小结自20世纪80年代研究以来,致力于AMPK研究的热情就不断高涨。各种研究结果先后证实了AMPK能抑制氧化应激、细胞凋亡、线粒体功能障碍、谷氨酸兴奋性毒性和神经炎症,促进自噬和组织修复,维持代谢稳态[30]等。自铁死亡这一概念问世后,AMPK与铁死亡的调控机制便成为诸多学者的研究焦点。本文整理AMPK调控铁死亡的相关信号通路主要有:AMPK-PGC1α-NRF2;AMPK-GSK3β-NRF2;SIRT3-AMPK-mTOR;AMPK-mTOR-ULK1;ROS-AMPK-mTOR;AMPK-MTOR-SLC7A1;AMPK-JAK2/STAT3-P53-GPX4;ROS-AMPK-SCD1;LKB1-AMPK-ACC1;AMPK-SREBP1-SCD1;PP2A-AMPK-EEF2;AMPK-BECN1-SLC7A11。其中被激活后能够抑制铁死亡进程的是AMPK-PGC1α-NRF2、AMPK-GSK3β-NRF2、ROS-AMPK-SCD1和LKB1-AMPK-ACC1信号通路。而SIRT3- AMPK-mTOR、AMPK-mTOR-ULK1、ROS-AMPK-mTOR、AMPK-MTOR-SLC7A1、AMPK-JAK2/STAT3-P53-GPX4、AMPK-SREBP1-SCD1、PP2A-AMPK-EEF2和AMPK-BECN1-SLC7A11信号通路一旦被激活,若不加以阻断则会诱导铁死亡,引起或阻止相关疾病发生。所以了解这些通路的具体途径,明确调控相关通路最终达到的效果,对药物的研发及治疗手段的实施具有重要指导意义。
对于AMPK相关通路激活最终抑制还是诱导铁死亡学界众说纷纭,未深入研究的学者甚至上升到AMPK直接对铁死亡的作用,忽略了通路转接过程,所以读者经常可以看到AMPK能抑制铁死亡,或AMPK能诱导铁死亡等说法,殊不知这就是断章取义的结果。机体是一个完整的系统,任何指令的下达和实现都依赖于一整套完整的神经电生理和分子通路传导,而AMPK作为能量应激分子通路的交叉点,其上下游连接的结构不同,最终所起的作用自然存在差异。所以今后若想探讨AMPK在铁死亡及相关疾病中作用,需溯本求源,追踪具体通路,应用严谨的实验方案方可得出令人信服的结论,才能正确指导临床,助力药物研究。除此之外,铁死亡究竟对哪些疾病有益,又对哪些疾病有害;针对具体疾病需抑制铁死亡还是诱导铁死亡;AMPK的每一条通路在如何调控铁死亡,具体疾病又与AMPK的那一条通路相关,该阻断还是促进这条通路发挥作用,以及AMPK调控铁死亡相关信号通路的靶向药物研发都将成为未来研究热点。本文对AMPK调控铁死亡相关信号通路的梳理有一定局限,一方面,人体结构十分复杂,相关蛋白及信号通路丰富繁杂,铁死亡作为一种新型的细胞死亡方式,学者们对AMPK调控铁死亡的相关信号通路研究还有待完善;另一方面,不排除笔者在查阅文献过程中遗漏相关内容,未在本篇中进行介绍。后期笔者将继续深入挖掘相关文献,进一步明确和完善AMPK调控铁死亡的信号通路,深入探讨铁死亡的发生以及在具体疾病中的机制与应用,为相关药物研发和疾病治疗提供思路。
| [1] |
Carling D. AMPK signalling in health and disease[J]. Curr Opin Cell Biol, 2017, 45: 31-7. doi:10.1016/j.ceb.2017.01.005 |
| [2] |
Lee H, Zandkarimi F, Zhang Y, et al. Energy-stress-mediated AMPK activation inhibits ferroptosis[J]. Nat Cell Biol, 2020, 22(2): 225-34. doi:10.1038/s41556-020-0461-8 |
| [3] |
Herzig S, Shaw R J. AMPK: guardian of metabolism and mitochondrial homeostasis[J]. Nat Rev Mol Cell Biol, 2018, 19(2): 121-35. doi:10.1038/nrm.2017.95 |
| [4] |
Jiang S, Li T, Ji T, et al. AMPK: Potential therapeutic target for ischemic stroke[J]. Theranostics, 2018, 8(16): 4535-51. doi:10.7150/thno.25674 |
| [5] |
Currais A, Huang L, Goldberg J, et al. Elevating acetyl-CoA levels reduces aspects ofbrain aging[J]. Elife, 2019, 8: e47866. doi:10.7554/eLife.47866 |
| [6] |
Lewerenz J, Ates G, Methner A, et al. Oxytosis/Ferroptosis-(Re-) emergingroles for oxidative stress-dependent non-apoptotic cell death in diseases of the central nervous system[J]. Front Neurosci, 2018, 12: 214. doi:10.3389/fnins.2018.00214 |
| [7] |
Li C, Dong X, Du W, et al. LKB1-AMPK axis negatively regulates ferroptosis by inhibiting fatty acid synthesis[J]. Signal Transduct Target Ther, 2020, 5(1): 187. doi:10.1038/s41392-020-00297-2 |
| [8] |
Dodson M, Castro-Portuguez R, Zhang D D. NRF2 plays a critical role in mitigating lipid peroxidation and ferroptosis[J]. Redox Biol, 2019, 23: 101107. doi:10.1016/j.redox.2019.101107 |
| [9] |
Gureev A P, Shaforostova E A, Popov V N. Regulation of mitochondrial biogenesis as a way for active longevity: interaction between the Nrf2 and PGC-1α signaling pathways[J]. Front Genet, 2019, 10: 435. doi:10.3389/fgene.2019.00435 |
| [10] |
Gao J, Qian T, Wang W. CTRP3 activates the AMPK/SIRT1-PGC-1α pathway to protect mitochondrial biogenesis and functions in cerebral ischemic stroke[J]. Neurochem Res, 2020, 45(12): 3045-58. doi:10.1007/s11064-020-03152-6 |
| [11] |
Wang Z, Yao M, Jiang L, et al. Dexmedetomidine attenuates myocardial ischemia/reperfusion-induced ferroptosis via AMPK/GSK-3β/Nrf2 axis[J]. Biomed Pharmacother, 2022, 154: 113572. doi:10.1016/j.biopha.2022.113572 |
| [12] |
Lu H, Xiao H, Dai M, et al. Britanin relieves ferroptosis-mediated myocardial ischaemia/reperfusion damage by upregulating GPX4 through activation of AMPK/GSK3β/Nrf2 signalling[J]. Pharm Biol, 2022, 60(1): 38-45. doi:10.1080/13880209.2021.2007269 |
| [13] |
Guo Z, Zhang Y. Allicin promotes autophagy and ferroptosis in esophageal squamouscell carcinoma by activating AMPK/mTOR signaling[J]. Heliyon, 2022, 8(10): e11005. |
| [14] |
Han D, Jiang L, Gu X, et al. SIRT3 deficiency is resistant to autophagy-dependent ferroptosis by inhibiting the AMPK/mTOR pathway and promoting GPX4 levels[J]. J CellPhysiol, 2020, 235(11): 8839-51. |
| [15] |
Bao L, Zhao C, Feng L, et al. Ferritinophagy is involved in Bisphenol A-induced ferroptosis of renal tubular epithelial cells through the activation of the AMPK-mTOR-ULK1 pathway[J]. Food Chem Toxicol, 2022, 163: 112909. doi:10.1016/j.fct.2022.112909 |
| [16] |
Sun Q, Zhen P, Li D, et al. Amentoflavone promotes ferroptosis byregulating reactiveoxygen species (ROS) /5'AMP-activated protein kinase (AMPK)/mammaliantarget of rapamycin (mTOR) to inhibit the malignant progressionof endometrial carcinomacells[J]. Bioengineered, 2022, 13(5): 13269-79. doi:10.1080/21655979.2022.2079256 |
| [17] |
Zhang L, Liu W, Liu F, et al. IMCA induces ferroptosis mediated by slc7a11 through the ampk/mtor pathway in colorectal cancer[J]. Oxid Med Cell Longev, 2020, 2020: 1675613. |
| [18] |
Shen H, Guo M, Wang L, et al. MUC16 facilitates cervical cancer progression via JAK2/STAT3 phosphorylation-mediated cyclooxygenase-2 expression[J]. Genes Genomics, 2020, 42(2): 127-33. doi:10.1007/s13258-019-00885-9 |
| [19] |
Li Y, Zhang Y, Qiu Q, et al. Energy-Stress-Mediated AMPK activation promotes gpx4-dependent ferroptosis through the jak2/stat3/p53 axis in renal cancer[J]. Oxid Med Cell Longev, 2022, 2022: 2353115. |
| [20] |
Tang J, Chen L, Qin Z H, et al. Structure, regulation, and biological functions of TIGAR and its role in diseases[J]. Acta Pharmacol Sin, 2021, 42(10): 1547-55. doi:10.1038/s41401-020-00588-y |
| [21] |
Liu M Y, Li H M, Wang X Y, et al. TIGAR drives colorectal cancer ferroptosis resistance through ROS/AMPK/SCD1 pathway[J]. Free Radic Biol Med, 2022, 182: 219-31. doi:10.1016/j.freeradbiomed.2022.03.002 |
| [22] |
Zhao Y, Li M, Yao X, et al. HCAR1/MCT1 regulates tumor ferroptosis through the Lactate-mediated AMPK-SCD1 activity and its therapeutic implications[J]. Cell Rep, 2020, 33(10): 108487. doi:10.1016/j.celrep.2020.108487 |
| [23] |
Zhong Y, Tian F, Ma H, et al. FTY720 induces ferroptosis and autophagy via PP2A/AMPK pathway in multiple myeloma cells[J]. Life Sci, 2020, 260: 118077. doi:10.1016/j.lfs.2020.118077 |
| [24] |
Hassannia B, Vandenabeele P, Vanden Berghe T. Targeting ferroptosis to iron out cancer[J]. Cancer Cell, 2019, 35(6): 830-9. doi:10.1016/j.ccell.2019.04.002 |
| [25] |
肖敏, 王根柱, 戚欣, 等. eEF2K对MDA-MB-231细胞增殖的影响与初步机制研究[J]. 中国药理学通报, 2018, 34(8): 1061-5. Xiao M, Wang G Z, Qi X, et al. Study on the effect of EF2K on the proliferation of MDA-MB-231 cells and its preliminary mechanism[J]. Chin Pharmacol Bull, 2018, 34(8): 1061-5. doi:10.3969/j.issn.1001-1978.2018.08.007 |
| [26] |
Song X, Zhu S, Chen P, et al. AMPK-Mediated BECN1 phosphorylation promotes ferroptosis by directly blocking system Xc- activity[J]. Curr Biol, 2018, 28(15): 2388-99. doi:10.1016/j.cub.2018.05.094 |
| [27] |
Huang Y, Wu H, Hu Y, et al. Puerarin attenuates oxidative stress and ferroptosis via AMPK/PGC1α/Nrf2 pathway after subarachnoid hemorrhage in rats[J]. Antioxidants (Basel), 2022, 11(7): 1259. doi:10.3390/antiox11071259 |
| [28] |
Zhou B, Zhang J, Chen Y, et al. Puerarin protects against sepsis-induced myocardial injury through AMPK-mediated ferroptosis signaling[J]. Aging (Albany NY), 2022, 14(8): 3617-32. |
| [29] |
Wang X, Chen X, Zhou W, et al. Ferroptosis is essential for diabetic cardiomyopathy and is prevented by sulforaphane via AMPK/NRF2 pathways[J]. Acta Pharm Sin B, 2022, 12(2): 708-22. doi:10.1016/j.apsb.2021.10.005 |
| [30] |
Trefts E, Shaw R J. AMPK: Restoring metabolic homeostasis over space and time[J]. MolCell, 2021, 81(18): 3677-90. |

