


2. 湖北中医药大学老年医学研究所,湖北 武汉 430065
 ,
ZHU Qi-hang1,
MAIHELIYA·Aisikaer1,
JU Xin-hui1,
LEI Shi-dong1,
WANG Hao-tian1,
WANG Ping2
,
ZHU Qi-hang1,
MAIHELIYA·Aisikaer1,
JU Xin-hui1,
LEI Shi-dong1,
WANG Hao-tian1,
WANG Ping2

2. Institute of Geriatrics, Hubei University of Chinese Medicine, Wuhan 430065, China
阿尔茨海默病(Alzheimer's disease,AD)为临床上常见的痴呆类疾病,且以进行性认知功能衰退为主要临床表现。随着人口老年化的加速,中国AD的患病率也日益增加,研究显示,当前中国AD患者已突破1 000万人,同时与AD相关的开支也迅速飙升,有研究预测2030年中国用于AD的总开支将超过9 000亿美元[1-2]。目前,被批准用于抗AD的药物仍以作用神经递质为基础,然而这些药物难以逆转AD的病理进程[3]。传统中医药在抗AD方面积累了丰富的临床经验,并已建起防治AD的理法方药体系。因此,从中药复方或单味中药中开发出更为高效的抗AD药物具有可行性。
线粒体为细胞最主要的细胞器之一,具有提供能量ATP和钙稳态等作用。然而,衰老的加速,线粒体功能也随之减退。相当多的研究已证实,线粒体功能障碍为AD的重要病理特征之一,一些研究发现,线粒体功能障碍甚至早于老年斑沉积和神经原纤维缠结[4-5]。因此,靶向线粒体功能被一些研究视为抗AD的有效策略。AMPK/SIRT1/PGC-1α (adenosine 5'-monophosphate(AMP)-activated protein kinase /silent information regulator 1 /peroxisome-proliferator-activated receptor γ coactivator-1α)信号通路与线粒体功能关系密切,为改善线粒体功能的关键途径。研究证实,激活AMPK/SIRT1/PGC-1α信号通路可改善AD认知障碍、神经元和突触损伤[6-7]。
酸枣仁汤(SZRD)出自张仲景《金匮要略》,具有滋阴养血安神益智之功。本课题组前期研究发现,SZRD低、高剂量均具有良好的抗AD作用,并证实其可通过激活JAK2/STAT3 (Janus kinase 2 /signal transducer and activator of transcription 3)信号通路和PI3K/AKT/GSK-3β (phosphatidylinositol 3 kinase /protein kinase B /glycogen synthase kinase-3β)信号通路改善APP/PS1小鼠的神经炎症、神经元和突触损伤[8-10]。但SZRD成份复杂,其抗AD的分子机制仍有待于深入挖掘。本实验将以前期研究为基础,拟研究SZRD对AMPK/SIRT1/PGC-1α信号通路的作用,从而初步阐明SZRD改善AD线粒体功能障碍的作用机制。
1 材料与方法 1.1 实验动物5月龄APP/PS1痴呆小鼠30只,同品系和同月龄C57BL/6JNju野生型小鼠10只,均为SPF级,购自北京华阜康生物科技股份有限公司,实验动物许可证号:SCXK(京)2014-0004。动物饲养于湖北中医药大学老年医学研究所,适宜温度、湿度饲养,自由饮水、饮食。
1.2 实验药品及试剂参考[8-10]本课题组前期研究,确定复方酸枣仁汤的药物及剂量,即含炒酸枣仁30 g、茯苓6 g、川芎6 g、知母9 g、炙甘草3 g。所有酸枣仁汤中药饮片均从湖北中医药大学附属医院购买。纯水煎煮药物,分别将低、高剂量组浓缩成生药浓度为0.75、1.5 kg·L-1的溶液,置4 ℃保存备用。4%多聚甲醛溶液(批号:G1101)、电镜固定液(批号:G1102),DAB显色试剂盒(批号:G1212),购自武汉赛维尔生物科技有限公司;硫黄素染色液(批号:T8320),ATP检测试剂盒(批号:BC0305),ROS(批号:CA1410),购自北京索莱宝科技有限公司;抗体Aβ(批号:ab201060)、AMPKα(批号:ab32047)、p-AMPKα-ThrK172(批号:ab133448),购自Abcam公司;抗体SIRT1(批号:A0230)、PGC-1α(批号:A12348)、NRF1(批号:A5547)、NRF2(批号:A0674)、TFAM(批号:A13552)、β-actin(批号:AC026),购自武汉ABclonal公司。
1.3 实验仪器Morris水迷宫(ZH-Morris,安徽正华生物仪器设备有限公司);组织切片机(RM2016,Leica);正置光学显微镜(Nikon Eclipse E100,Nikon);正置荧光显微镜(Nikon Eclipse C1,Nikon);超薄切片机(Leica UC7,Leica);透射电子显微镜(HT7800,hitachi);酶标仪(RT-6100,雷杜生命科技有限公司);凝胶成像仪(GelDoc XR,Bio-Rad)。
1.4 方法 1.4.1 动物分组及给药将APP/PS1小鼠随机分为模型组(APP/PS1组)、酸枣仁汤低剂量组(L-SZRD组)和酸枣仁汤高剂量组(H-SZRD组),同品系C57BL/6JNju小鼠设为对照组(WT组),每组10只。参考[10-12]前期给药剂量,L-SZRD组和H-SZRD组分别按照12.96、25.92 g·kg-1的剂量灌胃酸枣仁汤水煎液,WT组和APP/PS1组则灌胃等体积的纯水。4组连续灌胃30 d,每日1次。
1.4.2 Morris水迷宫实验参考本课题组前期方法进行Morris水迷宫实验[8-10]。简言之,定位航行实验前连续进行5 d的学习记忆训练,每次训练60 s,每天4次,若小鼠在60 s内未找到平台,则将小鼠引导至平台停留15 s。休息1 d,进行定位航行实验,行为追踪系统将记录小鼠的逃避潜伏期。撤离平台,进行空间探查实验,行为追踪系统将记录小鼠的穿越平台次数,并分析小鼠在目标象限的游泳时间。
1.4.3 样本采集每组随机选取3只小鼠,麻醉后断头取脑,将脑组织分为两等分,一部分置4%多聚甲醛溶液,另一部分置电镜固定液。将剩余小鼠以相同方式处死,剥离颅骨,取出脑组织,低温分离海马组织,置-80 ℃保存备检。
1.4.4 硫黄素染色用石蜡包埋多聚甲醛溶液中的脑组织。切取5 μm厚度切片,常规脱蜡。PBS洗片,硫黄素染液室温避光孵育10 min,滴加DAPI染液。PBS洗涤、封片。荧光显微镜下观察切片,拍照,用ImageJ软件分析海马区老年斑的数量和面积。
1.4.5 免疫组化染色取石蜡包埋的脑组织,5 μm厚切片。脱蜡,抗原修复15 min。PBS洗片,依次置3%双氧水和3%胎牛血清室温避光孵育25 min和30 min。洗涤切片,滴加一抗Aβ(1 ∶ 200),4 ℃孵育过夜。滴加二抗(1 ∶ 200),室温孵育1 h。洗涤切片,滴加DAB显色液,梯度乙醇和二甲苯脱水,封片。正置光学显微镜下观察切片,拍照,用ImageJ软件分析Aβ相关的斑块数量和面积。
1.4.6 透射电镜从电镜固定液中取出脑组织,分离海马,并修剪成1 mm×1 mm×1 mm的组织块;将海马组织置1%锇酸处理2 h,梯度递增乙醇和丙酮脱水海马组织;丙酮和812包埋剂渗透包埋海马组织,置60 ℃烤箱聚合48 h;聚合后,将海马组织置超薄切片机切片,厚度为80 nm;将切片置2%醋酸铀溶液染色8 min,70%乙醇和超纯水洗片,置2.6%枸橼酸铅溶液染色8 min。洗片,透射电子显微镜下采集图像,观察线粒体的超微结构。
1.4.7 海马中ATP、ROS的检测取新鲜海马组织,加入PBS,置研磨仪匀浆,低温离心,收集上清液,按照试剂盒说明书检测海马中ATP、ROS的表达水平。
1.4.8 Western blot检测取适量海马组织,加入RIAP裂解液。研磨组织,低温离心,收集上清液,BCA蛋白试剂盒检测蛋白浓度。蛋白变性,自然冷却后置-20 ℃保存备检。制备SDS-PAGE凝胶,上样,电泳转印至PVDF膜。加入稀释后的一抗AMPKα(1 ∶ 1 000)、p-AMPKα-ThrK172(1 ∶ 1 000)、SIRT1(1 ∶ 1 000)、PGC-1α(1 ∶ 1 000)、NRF1(1 ∶ 1 000)、NRF2(1 ∶ 1 000)、TFAM(1 ∶ 1 000)、β-actin(1 ∶ 1 000),置4 ℃孵育过夜;洗膜,将膜置稀释后的二抗(1 ∶ 10 000),室温孵育30 min;ECL显色液处理5 min,凝胶成像仪曝光条带,用ImageJ软件分析蛋白条带的灰度值。
1.4.9 统计分析采用SPSS 24.0软件进行统计分析,实验数据以x±s表示。组间比较采用单因素方差分析。使用GraphPad Prism 9.0软件和Adobe Illustrator 2021软件绘图和组图。
2 结果 2.1 SZRD改善APP/PS1小鼠学习记忆能力如Fig 1A-C所示,训练期的前3 d,各组小鼠逃避潜伏期变化不明显,且差异没有统计学学意义(P>0.05)。从d 4开始,APP/PS1组小鼠的逃避潜伏期明显高于WT组(P < 0.01),而L-SZRD和H-SZRD则减少了APP/PS1小鼠的平台潜伏期(P < 0.05或P < 0.01),这说明APP/PS1小鼠有明显的学习能力损伤且SZRD低、高剂量组可改善APP/PS1小鼠的学习能力。Fig 1D-F显示,APP/PS1组小鼠的穿越平台次数和目标象限驻留时间较WT组明显减少(P < 0.01),而L-SZRD组和H-SZRD组小鼠的穿越平台次数和目标象限驻留时间较APP/PS1组增加(P < 0.05或P < 0.01),这说明SZRD低、高剂量组可改善APP/PS1小鼠的记忆能力。水迷宫实验结果显示,SZRD可改善APP/PS1小鼠学习记忆能力。
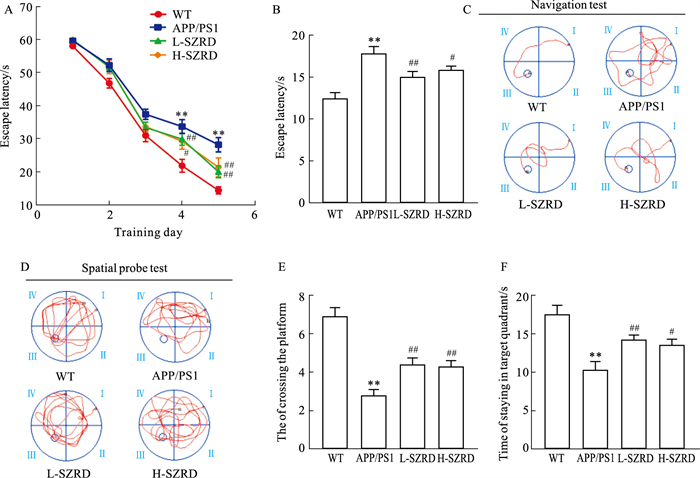
|
| Fig 1 SZRD ameliorated cognitive impairment of APP/PS1 mice in Morris water maze test (x±s,n=10) A: Line graph of mouse escape latency during the 5-day continuous training period; B: Escape latency of navigation test; C. Representative swimming trajectories of mice in navigation test; D. Representative swimming trajectories of mice in spatial probe test; E. Times of crossing the platform; F. Time of staying in target quadrant. **P < 0.01 vs WT group; #P < 0.05, ##P < 0.01 vs APP/PS1group. |
老年斑沉积为AD的重要病理表现,为证明SZRD是否具有抑制老年斑沉积的作用,本研究利用硫黄素染色标记了小鼠海马区的老年斑。Fig 2A-C显示,APP/PS1组小鼠海马区老年斑的数量和面积较WT组明显增加(P < 0.01),而L-SZRD和H-SZRD则减少了APP/PS1小鼠海马区老年斑的数量和面积(P < 0.05或P < 0.01),这说明SZRD具有缓解AD老年斑沉积的作用。Aβ为老年斑沉积的关键蛋白,为进一步研究SZRD抑制AD老年斑沉积的作用,本研究还利用免疫组化对Aβ进行标记。Fig 2D-F显示,APP/PS1组小鼠海马区Aβ标记的老年斑数量和面积较WT组明显增加(P < 0.01),而L-SZRD和H-SZRD则逆转了上述现象(P < 0.05或P < 0.01)。上述结果表明,SZRD可以通过抑制Aβ的表达,从而缓解AD老年斑沉积。
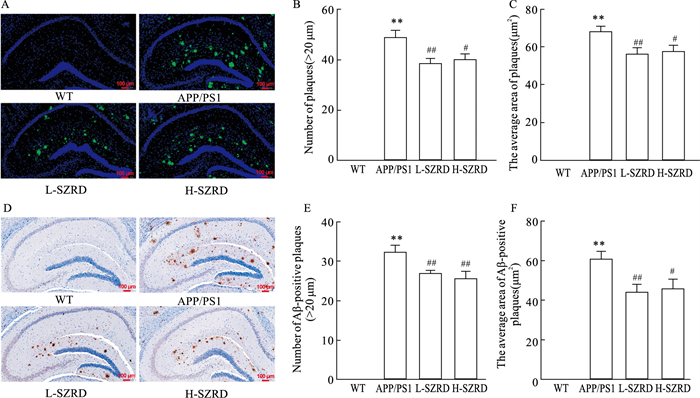
|
| Fig 2 SZRD alleviated plaque deposition in hippocampus via inhibiting Aβ expression (x±s,n=3) A.Representative images of Thioflavin T staining in the hippocampus of each group (×100; scan bar, 100 μm); B. Number of plaques in Thioflavin T staining; C. The average area of plaques in Thioflavin T staining; D. Representative images of Aβ's immunohistochemical staining in the hippocampus of each group (original magnification, ×100; scan bar, 100 μm); E. Number of Aβ-labelled plaques; F. The average area of Aβ-labelled plaques. **P < 0.01 vs WT group; #P < 0.05, ##P < 0.01 vs APP/PS1 group. |
线粒体功能障碍涉及线粒体结构损伤、ATP减少和ROS增加。本研究首先利用透射电镜观察了海马区线粒体的超微结构。Fig 3A显示,与WT组比较,APP/PS1组小鼠海马区有线粒体肿胀、线粒体嵴断裂和线粒体膜破裂的表现,而L-SZRD组和H-SZRD组小鼠海马区线粒体损伤较APP/PS1减轻。此外,我们还利用试剂盒检测了海马中ATP和ROS的表达水平。Fig 3B-C显示,与WT组比较,APP/ PS1组小鼠海马中ATP含量减少、ROS表达增加(P < 0.01),而L-SZRD和H-SZRD则逆转了上述现象(P < 0.05或P < 0.01)。上述实验结果证实,SZRD可改善AD小鼠线粒体功能障碍。
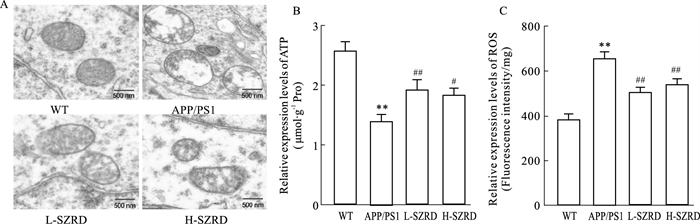
|
|
Fig 3 SZRD alleviated mitochondrial dysfunction of APP/PS1 mice (x±s,n=3 or 7)
A: Representative images of transmission electron microscope in the hippocampus of each group (original magnification, ×10 000; scan bar, 500 nm); B: Relative expression level of ATP in the hippocampus of each group; C: Relative expression level of ROS in the hippocampus of each group. **P < 0.01 vs WT group; #P < 0.05, ##P < 0.01 vs APP/PS1 group. |
如Fig 4所示,与WT组比较,APP/PS1组小鼠海马中p-AMPKα-ThrK172、SIRT1的表达水平明显减少(P < 0.01)。与APP/PS1组比较,L-SZRD组和H-SZRD组小鼠海马中p-AMPKα-ThrK172、SIRT1的表达水平增加(P < 0.05或P < 0.01)。此外,各组小鼠海马中AMPKα的表达变化不明显,且差异没有统计学意义(P>0.05)。
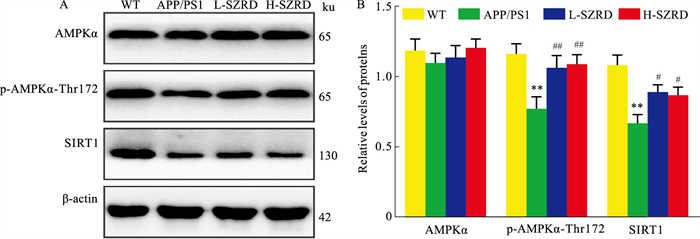
|
| Fig 4 Effects of SZRD on protein expression levels of AMPKα,p-AMPKα-ThrK172 and SIRT1 in hippocampus (x±s,n=4) A: Original Western blot bands of AMPKα, p-AMPKα-ThrK172 and SIRT1 in the hippocampus of each group; B: Relative expression levels of AMPKα, p-AMPKα-ThrK172 and SIRT1 in the hippocampus of each group. **P < 0.01 vs WT group; #P < 0.05, ##P < 0.01 vs APP/PS1 group. |
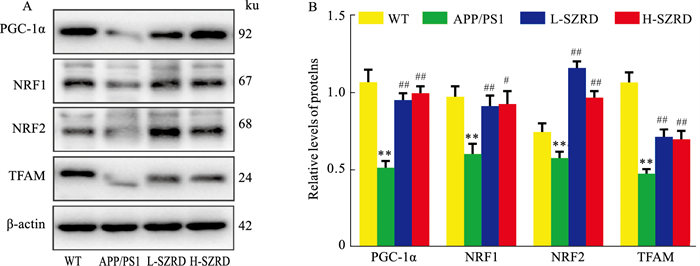
如Fig 5所示,与WT组比较,APP/PS1组小鼠海马中PGC-1α、NRF1、NRF2、TFAM的表达水平明显减少(P < 0.01)。与APP/PS1组比较,L-SZRD组和H-SZRD组小鼠海马中PGC-1α、NRF1、NRF2、TFAM的表达水平增加(P < 0.05或P < 0.01)。
|
| Fig 5 Effects of SZRD on protein expression levels of PGC-1α,NRF1,NRF2 and TFAM in hippocampus (x±s,n=4) A: Original Western blot bands of PGC-1α, NRF1, NRF2 and TFAM in the hippocampus of each group; B: Relative expression levels of PGC-1α, NRF1, NRF2 and TFAM in the hippocampus of each group. **P < 0.01 vs WT group; #P < 0.05, ##P < 0.01 vs APP/PS1 group. |
SZRD原为主治“虚劳虚烦不得眠”的经典方,但我们前期研究证实,SZRD对AD模型及睡眠剥夺模型的认知损伤均具有一定的疗效[8-11]。近年来[12-14],一些研究也发现,SZRD中酸枣仁皂苷A、芒果苷、斯皮诺素等成分对AD具有一定的疗效,并证实其可通过抑制神经炎症、改善线粒体自噬、缓解Aβ毒性等途径改善AD认知功能和病理损伤。尽管SZRD已显示出一定的抗AD作用,但其分子机制仍有待于进一步研究。为此,本实验首先应用Morris水迷宫实验评估了SZRD对AD小鼠认知损伤的作用,结果发现SZRD低、高剂量组可减少小鼠的逃避潜伏期,并增加小鼠的穿越平台次数和目标象限驻留时间。这些结果与前期研究结果一致,均证实SZRD可缓解APP/PS1小鼠的认知损伤[8-10]。
老年斑为AD的重要病理特征,其中Aβ沉积为其形成的关键[15]。为进一步研究SZRD改善认知损伤的分子机制,本研究利用硫黄素染色标记了海马区的老年斑。硫黄素染色证实,SZRD低、高剂量组可缓解AD小鼠海马区老年斑。此外,我们还利用Aβ的免疫组化标记了小鼠海马区的老年斑。结果证实,SZRD具有抑制Aβ沉积的作用。上述结果表明,SZRD可通过抑制Aβ的表达改善AD老年斑沉积。
线粒体功能障碍具有线粒体形态损伤、ATP减少和ROS增加等特征,其形成主要与Aβ的神经毒性有关[16]。为验证SZRD是否具有改善AD线粒体功能障碍的作用,本研究首先利用透射电镜观察了小鼠海马区线粒体的超微结构。透射电镜显示,SZRD低、高剂量组可改善AD小鼠海马区线粒体肿胀、线粒体嵴断裂。海马中ATP和ROS检测结果也显示,SZRD低、高剂量组可增加小鼠海马中ATP含量,并能减少ROS的表达水平。这些结果暗示,SZRD可改善AD小鼠线粒体功能障碍。
为进一步研究SZRD改善AD线粒体功能障碍的分子机制,本研究还利用Western blot检测了AMPK/SIRT1/PGC-1α信号通路中的关键分子。PGC-1α为调节线粒体功能的关键因子,其上游还受AMPK和SIRT1调节,研究证实AMPKα在Thr172位点磷酸化可激活下游SIRT1,活化的SIRT1则会进一步激活PGC-1α[6-7]。本研究也发现,SZRD低、高剂量组可增加小鼠海马p-AMPKα-ThrK172、SIRT1的表达。这说明SZRD可激活AD小鼠海马中AMPK/SIRT1信号通路。线粒体功能还受NRF1、NRF2、TFAM的调节,研究证实PGC-1α活化后可促使下游NRF1、NRF2、TFAM的激活,活化的TFAM可促使线粒体DNA的转录和翻译,从而改善线粒体功能[17-18]。本研究也发现,SZRD低、高剂量组可增加小鼠海马NRF1、NRF2、TFAM的表达。上述实验结果表明,SZRD可通过激活AMPK/SIRT1/PGC-1α信号通路改善AD线粒体功能障碍。
综合上述实验结果,SZRD具有改善AD认知损伤、老年斑沉积和线粒体功能障碍的作用,其机制可能与其激活AMPK/SIRT1/PGC-1α信号通路有关。本研究再次证实了SZRD抗AD的潜力,为深入研究SZRD的滋阴养血安神益智和抗AD作用提供了重要参考。
| [1] |
Jia L, Du Y, Chu L, et al. Prevalence, risk factors, and management of dementia and mild cognitive impairment in adults aged 60 years or older in China: A cross-sectional study[J]. Lancet Public Health, 2020, 5(12): 661-71. doi:10.1016/S2468-2667(20)30185-7 |
| [2] |
Jia J, Wei C, Chen S, et al. The cost of Alzheimer's disease in China and re-estimation of costs worldwide[J]. Alzheimers Dement, 2018, 14(4): 483-91. doi:10.1016/j.jalz.2017.12.006 |
| [3] |
Kang Y J, Diep Y N, Tran M, et al. Therapeutic targeting strategies for early-to late-staged Alzheimer's disease[J]. Int J Mol Sci, 2020, 21(24): 9591. doi:10.3390/ijms21249591 |
| [4] |
Ke J, Tian Q, Xu Q, et al. Mitochondrial dysfunction: A potential target for Alzheimer's disease intervention and treatment[J]. Drug Discov Today, 2021, 26(8): 1991-2002. doi:10.1016/j.drudis.2021.04.025 |
| [5] |
Perez Ortiz J M, Swerdlow R H. Mitochondrial dysfunction in Alzheimer's disease: Role in pathogenesis and novel therapeutic opportunities[J]. Br J Pharmacol, 2019, 176(18): 3489-507. doi:10.1111/bph.14585 |
| [6] |
牛芬溪, 谢硕, 刘悦, 等. 能量合成障碍在阿尔茨海默病发病中的作用[J]. 中国药理学通报, 2021, 37(8): 1042-6. Niu F X, Xie S, Liu Y, et al. Role of energy synthesis disorders in pathogenesis of Alzheimer's disease[J]. Chin Pharm Bull, 2021, 37(8): 1042-6. |
| [7] |
Yin Z, Gao D, Du K, et al. Rhein ameliorates cognitive impairment in an APP/PS1 transgenic mouse model of Alzheimer's disease by relieving oxidative stress through activating the SIRT1/PGC-1α pathway[J]. Oxid Med Cell Longev, 2022, 2022: 2524832. |
| [8] |
Long Q H, Wu Y G, He L L, et al. Suan-Zao-Ren decoction ameliorates synaptic plasticity through inhibition of the Aβ deposition and JAK2/STAT3 signaling pathway in AD model of APP/PS1 transgenic mice[J]. Chin Med, 2021, 16(1): 14. doi:10.1186/s13020-021-00425-2 |
| [9] |
龙清华, 赵宾宾, 丁莉, 等. 基于PI3K/AKT/GSK-3β信号通路探讨酸枣仁汤对APP/PS1双转基因痴呆小鼠海马神经元突触损伤的改善作用[J]. 中华中医药杂志, 2020, 35(5): 2546-51. Long Q H, Zhao B B, Ding L, et al. Suan-Zao-Ren decoction ameliorates synaptic plasticity through regulating PI3K/AKT/GSK-3β signaling pathway in APP/PS1 double transgenic dementia mice[J]. Chin J Tradit Chin Med Pharm, 2020, 35(5): 2546-51. |
| [10] |
龙清华, 丁莉, 赵宾宾, 等. 酸枣仁汤通过抑制APP/PS1双转基因小鼠海马神经炎症发挥神经保护作用[J]. 中国实验方剂学杂志, 2019, 25(20): 1-6. Long Q H, Ding L, Zhao B B, et al. Suan-Zao-Ren decoction exerts neuroprotective effect by inhibiting hippocampal neuroinflammation of APP/PS1 double transgenic mice[J]. Chin J Exp Formulas, 2019, 25(20): 1-6. |
| [11] |
郭帆, 吴东南, 刘玲, 等. 酸枣仁汤防治睡眠剥夺性大鼠学习记忆功能变化及其对NLRP3通路的影响[J]. 中国实验方剂学杂志, 2021, 27(2): 22-7. Guo F, Wu D N, Liu L, et al. Suan-Zao-Ren decoction ameliorates the learning and memory of sleep-deprived rats by inhibiting NLRP3 pathway[J]. Chin J Exp Formulas, 2021, 27(2): 22-7. |
| [12] |
Zhang M, Qian C, Zheng Z G, et al. Jujuboside A promotes Aβ clearance and ameliorates cognitive deficiency in Alzheimer's disease through activating AXL/HSP90/PPARγ pathway[J]. Theranostics, 2018, 8(15): 4262-78. doi:10.7150/thno.26164 |
| [13] |
Cai M, Jung I, Kwon H, et al. Spinosin attenuates Alzheimer's disease-associated synaptic dysfunction via regulation of plasmin activity[J]. Biomol Ther (Seoul), 2020, 28(2): 131-6. doi:10.4062/biomolther.2019.076 |
| [14] |
Ahuja A, Tyagi P K, Tyagi S, et al. Potential of Pueraria tuberosa (Willd.) DC. to rescue cognitive decline associated with BACE1 protein of Alzheimer's disease on drosophila model: an integrated molecular modeling and in vivo approach[J]. Int J Biol Macromol, 2021, 179: 586-600. doi:10.1016/j.ijbiomac.2021.03.032 |
| [15] |
Guo T, Zhang D, Zeng Y, et al. Molecular and cellular mechanisms underlying the pathogenesis of Alzheimer's disease[J]. Mol Neurodegener, 2020, 15(1): 40. |
| [16] |
Rey F, Ottolenghi S, Zuccotti G V, et al. Mitochondrial dysfunctions in neurodegenerative diseases: role in disease pathogenesis, strategies for analysis and therapeutic prospects[J]. Neural Regen Res, 2022, 17(4): 754-8. |
| [17] |
Hou Y, Zhao W, Yu H, et al. Biochanin A alleviates cognitive impairment and hippocampal mitochondrial damage in ovariectomized APP/PS1 mice[J]. Phytomedicine, 2022, 100: 154056. |
| [18] |
Singulani M P, Pereira C P M, Ferreira A F F, et al. Impairment of PGC-1α-mediated mitochondrial biogenesis precedes mitochondrial dysfunction and Alzheimer's pathology in the 3xTg mouse model of Alzheimer's disease[J]. Exp Gerontol, 2020, 133: 110882. |