

2. 省部共建组分中药国家重点实验室,天津 301617
2. State Key Laboratory of Component-based Chinese Medicine, Tianjin 301617, China
心肌梗塞(myocardial infarction,MI)是冠状动脉急性、持续性缺血缺氧所引起的心肌坏死,临床上可表现为剧烈而持久的胸骨后疼痛[1]。通常还伴随着心律失常、休克、心力衰竭等情况,严重威胁到患者的生命安全[2]。作为临床常见的心血管疾病之一,MI具有发病急、死亡率高、并发症多等特点,美国每年大约会有150万新增MI患者,近年来,中国MI患病率也呈明显上升趋势,每年新发患者至少50万。因此,MI一直是心血管领域临床和基础研究的重点疾病,受到广泛关注。
枳实薤白桂枝汤(Zhishi Xiebai Guizhi Decoction,ZXGD)出自东汉著名医学家张仲景编著的《金匮要略》,由枳实、薤白、桂枝、厚朴、瓜蒌五味药组成,具有祛痰散结、通阳下气之功效,主治胸阳不振,痰气互结于胸所致胸痹,有效缓解心肌梗死及损伤症状。现代药理学研究表明[3-6],ZXGD中所包含的枳实、桂枝、厚朴等中药具有抗炎、抗血小板聚集、抗凝血、增加耐缺氧能力、降脂、改善循环等药理作用,在临床上主要用于治疗心脏疾病、消化系统疾病、呼吸系统疾病及一些代谢疾病[7]。已有研究表明,ZXGD能够辅助其他药物治疗MI,起到改善MI临床症状,增强心功能,保护心肌细胞等作用[8]。本研究基于网络药理学对ZXGD治疗MI的有效成分、活性靶点、潜在机制进行探讨,以期为ZXGD治疗MI的体内机制研究和临床应用提供科学依据。
1 资料与方法 1.1 数据库及分析平台本研究所使用的数据库及分析平台有中药系统药理学数据库与分析平台(TCMSP)、SwissTargetPrediction以及GeneCards、OMIM、DisGeNET、UniProt、DAVID等。
1.2 ZXGD中有效成分筛选及靶点预测通过中药系统药理学数据库与分析平台(TCMSP)(https://old.tcmsp-e.com/index.php)对ZXGD(枳实、薤白、桂枝、厚朴、瓜蒌)中各药物有效成分进行初步筛选,限定筛选条件(TCMSP:DL≥0.18,OB≥30%),并对筛选有效成分进行靶点预测,利用UniProt蛋白质数据库(https://www.uniprot.org/)将筛选出来的靶蛋白名进行标准化。
1.3 MI疾病靶点的获取以“Myocardial infarction”“MI”作为关键词,检索并筛选GeneCards数据库(https://www.genecards.org/)、人类孟德尔遗传综合数据库(online mendelian inheritance in man,OMIM)(https://www.omim.org/)、DisGeNET数据库(https://www.disgenet.org//)获取MI疾病靶点。
1.4 基于STRING的PPI相互作用网络构建将ZXGD以及MI靶点进行取交集,借助STRING(功能性蛋白质关联网络)数据库(https://string-db.org/)对得到的交集靶点进行分析,得到交集靶点的蛋白质-蛋白质相互作用网络(Protein-Protein Interaction Networks, PPI),将从STRING分析得到的TSV文件导入Cytoscape3.7.2软件中构建交集靶点间的PPI网络,将交集基因中的关键基因可视化。
1.5 建立ZXGD “成分-疾病-靶点”网络将ZXGD成分、靶点、MI靶点之间的联系利用Cytoscape软件构建“成分-疾病-靶点”网络,使ZXGD中的有效成分与相关靶点与疾病靶点之间的联系可视化。
1.6 交集靶点的GO功能富集分析与KEGG通路富集分析将得到的交集靶点上传至DAVID数据库中进行分析,获得交集靶点的BP、CC、MF以及KEGG通路等的关键信息。并利用微生信云平台将数据结果可视化,富集分析结果采用气泡图展现。其中,不同颜色节点代表不同类型富集结果,而其大小与明显程度正相关。
1.7 ZXGD治疗MI小鼠的实验研究ZXGD颗粒剂参照《金匮要略》记载方组成,按照枳实12 g,厚朴12 g,薤白9 g,桂枝6 g,瓜蒌12 g的比例配制颗粒剂(华润三九医药股份有限公司)。实验动物选择的是ICR雄性小鼠,SPF级,60只,体质量(20~22) g,动物许可证编号:SCXK(京)2016-0006,由北京维通利华生物科技有限公司提供。采用标准饲料进行喂养,相对湿度40%~60%,适应性饲养1周后进行实验。实验分为假手术组、模型组、ZXGD低、中、高剂量组。ZXGD按照颗粒计重剂量分别为0.663 g·kg-1(低剂量,临床等效剂量),1.326 g·kg-1(中剂量),2.652 g·kg-1(高剂量)。实验ICR小鼠经2%异氟烷气体诱导麻醉,打开胸腔,找到心脏冠状动脉左前降支(LAD)并用缝合线结扎。迅速将心脏送回胸腔,清理胸腔,并缝合伤口。手术后次日开始给药,给药组每日灌胃给药1次,持续14 d。给药14 d后,各组小鼠使用超高频高分辨率小动物超声影像系统(Vevo 2100)进行超声心动图检测。检测指标包括:射血分数(ejection fraction; EF, %),缩短分数(fractional shortening; FS, %),室间隔厚度(interventricular septum; IVS, mm),左心室内径(left ventricular inner diameter; LVID, mm),左心室容量(left ventricular volume; LV Vol, μL),速度时间积分(velocity time integral; VTI, mm),流出道峰速(AV peak velocity; Peak Vel, mm·s-1),流出道峰压(AV peak pressure; peak Grad, mmHg),流出道平均速度(mean Vel, mm·s-1),流出道平均流速压差(mean Grad, mmHg)。
1.8 血清生化检测给药结束后,采集血样进行血清生化分析。将非分离的血液在3 500 r·min-1(10 min,4 ℃)下离心,收集上清液。用全自动血液生化分析仪(HITACHI7020;日立,东京,日本)检测血清生化参数,按标准程序测定肌酸激酶(creatine kinase,CK)。
1.9 ZXGD对MI小鼠心脏组织蛋白免疫印迹分析取梗死区周围心肌组织,使用裂解液裂解心肌组织,离心取上清提取总蛋白,采用BCA蛋白浓度测定试剂盒测定样品蛋白浓度。将处理好的蛋白样品上样进行电泳,蛋白转移到PVDF膜上,转膜完毕将PVDF膜置于5%脱脂奶粉中封闭2 h,一抗4 ℃孵育过夜。1×TBST洗膜3次,每次10 min,二抗孵育2 h,洗膜,显色。使用Image Lab软件分析目标蛋白的灰度值。蛋白免疫印迹法检测各组IL-1β、IL-6、IL-10、TNF-α的蛋白表达和活化水平。
1.10 统计分析采用单因素方差分析方法进行组间比较,两两比较用t检验,均以x±s表示。数据分析采用Prism软件6.0进行。
2 结果 2.1 ZXGD中有效成分筛选和靶标预测结果利用TCMSP和SwissTargetPrediction数据库对ZXGD中各药物进行筛选共得到51个有效成分和234个潜在靶点。收集到枳实(ZS)有效成分18个,薤白(XB)11个,桂枝(GZ)7个,厚朴(HP)4个,瓜蒌(GL)11个,其中2个共有成分,分别为枳实和薤白共有成分柚皮素,桂枝和薤白共有成分β-谷甾醇(Tab 1)。
| Mol ID | Molecule name | OB | DL | Source |
| MOL013277 | Isosinensetin | 51.15 | 0.44 | ZS |
| MOL013279 | 5, 7, 4'-Trimethylapigenin | 39.83 | 0.3 | ZS |
| MOL013428 | isosakuranetin-7-rutinoside | 41.24 | 0.72 | ZS |
| MOL013430 | Prangenin | 43.6 | 0.29 | ZS |
| MOL013435 | poncimarin | 63.62 | 0.35 | ZS |
| MOL013436 | isoponcimarin | 63.28 | 0.31 | ZS |
| MOL013437 | 6-Methoxy aurapten | 31.24 | 0.3 | ZS |
| MOL013440 | citrusin B | 40.8 | 0.71 | ZS |
| MOL001798 | neohesperidin_qt | 71.17 | 0.27 | ZS |
| MOL001803 | Sinensetin | 50.56 | 0.45 | ZS |
| MOL001941 | Ammidin | 34.55 | 0.22 | ZS |
| MOL002914 | Eriodyctiol(flavanone) | 41.35 | 0.24 | ZS |
| MOL004328 | naringenin | 59.29 | 0.21 | ZS |
| MOL005100 | 5, 7-dihydroxy-2-(3-hydroxy-4-methoxyphenyl)chroman-4-one | 47.74 | 0.27 | ZS |
| MOL005828 | nobiletin | 61.67 | 0.52 | ZS |
| MOL005849 | didymin | 38.55 | 0.24 | ZS |
| MOL000006 | luteolin | 36.16 | 0.25 | ZS |
| MOL007879 | Tetramethoxyluteolin | 43.68 | 0.37 | ZS |
| MOL001973 | Sitosteryl acetate | 40.39 | 0.85 | XB |
| MOL002341 | Hesperetin | 70.31 | 0.27 | XB |
| MOL000332 | n-coumaroyltyramine | 85.63 | 0.2 | XB |
| MOL000358 | beta-sitosterol | 36.91 | 0.75 | XB |
| MOL004328 | naringenin | 59.29 | 0.21 | XB |
| MOL000483 | (Z)-3-(4-hydroxy-3-methoxy-phenyl)-N-[2-(4-hydroxyphenyl)ethyl]acrylamide | 118.35 | 0.26 | XB |
| MOL000631 | coumaroyltyramine | 112.9 | 0.2 | XB |
| MOL007640 | macrostemonoside e_qt | 35.26 | 0.87 | XB |
| MOL007650 | PGA(sup 1) | 43.98 | 0.25 | XB |
| MOL007651 | Prostaglandin B1 | 40.21 | 0.25 | XB |
| MOL000098 | quercetin | 46.43 | 0.28 | XB |
| MOL001736 | (-)-taxifolin | 60.51 | 0.27 | GZ |
| MOL000358 | beta-sitosterol | 36.91 | 0.75 | GZ |
| MOL000359 | sitosterol | 36.91 | 0.75 | GZ |
| MOL000492 | (+)-catechin | 54.83 | 0.24 | GZ |
| MOL000073 | ent-Epicatechin | 48.96 | 0.24 | GZ |
| MOL004576 | taxifolin | 57.84 | 0.27 | GZ |
| MOL011169 | Peroxyergosterol | 44.39 | 0.82 | GZ |
| MOL005970 | Eucalyptol | 60.62 | 0.32 | HP |
| MOL005980 | Neohesperidin | 57.44 | 0.27 | HP |
| MOL000210 | Magnolol | 69.19 | 0.15 | HP |
| MOL005955 | Honokiol | 60.67 | 0.15 | HP |
| MOL001494 | Mandenol | 42 | 0.19 | GL |
| MOL002881 | Diosmetin | 31.14 | 0.27 | GL |
| MOL004355 | Spinasterol | 42.98 | 0.76 | GL |
| MOL005530 | Hydroxygenkwanin | 36.47 | 0.27 | GL |
| MOL006756 | Schottenol | 37.42 | 0.75 | GL |
| MOL007165 | 10α-cucurbita-5, 24-diene-3β-ol | 44.02 | 0.74 | GL |
| MOL007171 | 5-dehydrokarounidiol | 30.23 | 0.77 | GL |
| MOL007172 | 7-oxo-dihydrokaro-unidiol | 36.85 | 0.75 | GL |
| MOL007175 | karounidiol 3-o-benzoate | 43.99 | 0.5 | GL |
| MOL007179 | Linolenic acid ethyl ester | 46.1 | 0.2 | GL |
| MOL007180 | vitamin-e | 32.29 | 0.7 | GL |
通过以“myocardial infarction”“MI”作为关键词检索GeneCards、OMIM、DisGeNET疾病数据库筛选MI靶点,检出与MI相关的靶点分别为324个、34个、166个,删除检索结果中重复靶点后共纳入524个与MI发生发展相关的靶点。
2.3 ZXGD与心肌梗塞取交集靶点将ZXGD与MI靶点的基因导入韦恩图在线制作工具中,得到了75个共同靶点(Fig 1A),包括PTGS1、PTGS2、HIF-1α、VEGFA、IL-1β、IL-6、TNF-α、CCL2等靶点,即ZXGD作用于MI的靶点。
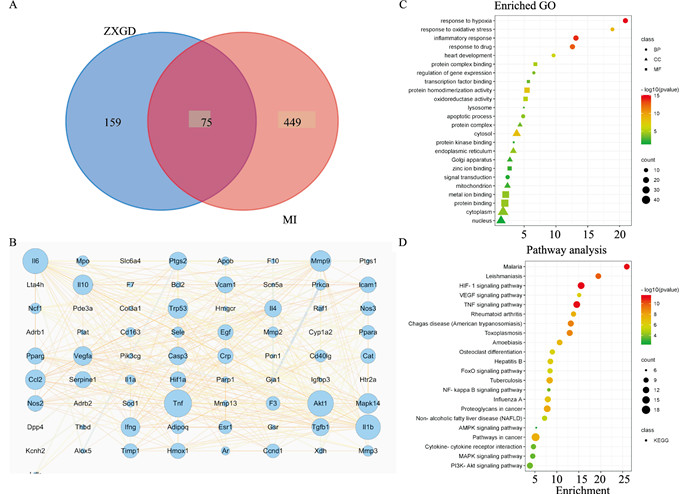
|
| Fig 1 Intersection target Venn diagram, PPI network diagram, GO enrichment and KEGG pathway enrichment A: Venn diagram of the intersection target of ZXGD and MI; B: PPI network diagram of Cytoscape intersection target; C: GO enrichment analysis bubble diagram; D. KEGG pathway enrichment analysis bubble diagram |
对药物靶点和疾病靶点取交集,借助STRING(功能性蛋白质关联网络)数据库对得到的交集靶点进行分析,得到交集靶点的蛋白质-蛋白质相互作用网络,将从STRING分析得到的TSV文件导入Cytoscape3.7.2软件中构建交集靶点间的调控网络,将交集基因中的关键基因可视化(Fig 1B)。节点的面积代表其度值,面积越大说明该节点越重要,从Fig 1B中可以看出ZXGD作用于MI的关键靶点包括TNF-α、IL-1β、IL-6、HIF1α、VEGFA、IL-10等。
2.5 GO功能富集分析结果利用DAVID 6.8对75个共同靶点进行GO功能富集分析,共得到GO条目535个,其中生物过程(BP)条目427个、分子功能(MF)条目70个、细胞组成(CC)条目38个,筛选出其中与心肌梗塞相关的条目利用生物信息在线作图网站微生信(http://www.bioinformatics.com.cn/)对其结果进行可视化分析。GO功能富集分析结果显示,BP主要涉及缺氧的反应、炎症反应、对氧化应激的反应、心脏发育、凋亡过程等方面;MF主要涉及蛋白质复合物结合、NF-κB结合等方面;CC主要涉及核质,线粒体,胞质溶胶,细胞外基质复合物等方面(Fig 1C)。
2.6 KEGG通路富集分析结果利用DAVID 6.8对75个核心靶点进行KEGG通路富集分析,共得到KEGG条目100个,KEGG通路富集结果见Fig 1D。KEGG通路富集分析结果显示,ZXGD治疗MI的通路主要涉及TNF信号通路、HIF-1信号通路、NF-κB信号通路、AMPK信号通路、PI3K-Akt信号通路等。
2.7 ZXGD“成分-疾病-靶点”网络的构建将ZXGD复方成分、成分靶标、疾病、疾病靶标通过Cytoscape软件进行网络构建,得到ZXGD的“成分-疾病-靶点”网络(Fig 2)。从化合物角度分析,与靶点相互作用排名前5位的化合物分别是MOL000098(槲皮素)、MOL004328(柚皮素)、MOL000358(β-谷甾醇)、MOL000006(木犀草素)、MOL013277(异橙黄酮),分别属于中药薤白、枳实的化学成分。从靶点角度分析,PTGS1、PTGS2、TNF、IL-10、IL-6等靶点与化学成分和MI的关联度更为密切。Cytoscape网络结果表明,各基因靶点之间关系复杂,“一对多”即1个靶点作用于多个靶标、“多对一”即多个靶点作用于1个靶标,体现ZXGD治疗MI“多成分、多靶点”的特点。

|
| Fig 2 "Ingredient-disease-target" network of ZXGD |
我们使用Vevo2100超高分辨率小动物超声实时成像仪进行左心室功能检测,包括IVS、LVID、EF、FS、LV Vol。如Fig 3所示,MI明显降低了IVS、EF、FS指标,同时明显升高了LVID、LV Vol指标。与Model组相比,ZXGD中剂量组使IVS、EF、FS明显升高了33.83%、38.28%、32.94%,LVID、LV Vol明显降低17.67%、37.26%。

|
| Fig 3 Effects of ZXGD on left ventricular function of MI mice (x±s, n=6) A: Ultrasonography of left ventricular cardiac function; B: EF, FS, IVS, LVID, LV Vol. *P < 0.05, **P < 0.01 vs Sham group; #P < 0.05, ##P < 0.01 vs Model group. |
ZXGD高剂量组使IVS、EF、FS明显升高35.54%、30.22%、24.36%。同时,LVID、LV Vol明显降低17.98%、37.37%。
2.8.2 ZXGD对MI小鼠左心室流出道和二尖瓣血流的影响我们使用Vevo2100超高分辨率小动物超声实时成像仪进行左室流出道功能检测,包括VTI、Mean Vel、Mean Grad、Peak Vel、Peak Grad。如Fig 4所示,MI明显降低VTI、Mean Vel、Mean Grad、Peak Vel、Peak Grad水平,ZXGD高剂量组使VTI、Mean Vel、Mean Grad、Peak Vel、Peak Grad明显升高了113.83%、124.11%、129.96%、88.22%、115.29%。

|
| Fig 4 Effects of ZXGD on left ventricular outflow tract of MI mice (x±s, n=6) A: Ultrasonography of left ventricular outflow tract flow; B: Mean Vel, Mean Grad, Peak Vel, Peak Grad, and VTI left ventricular outflow tract function indexes. **P < 0.01 vs Sham group; #P < 0.05, ##P < 0.01 vs Model group. |
心肌细胞膜在MI过程中受损,作为MI指标之一的肌酸激酶(CK)从心肌组织渗入血液。如Fig 5所示,与Sham组相比,Model组血清CK含量明显升高145.55% (P < 0.05)。与Model组相比,ZXGD低、中、高剂量组CK水平明显降低67.53%、68.48%、77.66% (P < 0.01)。

|
| Fig 5 Effects of ZXGD on serum creatine kinase of MI mice (x±s, n=6) Creatine kinase serum biochemical results. *P < 0.05 vs Sham group; ##P < 0.01 vs Model group. |
结果表明,经低、中、高剂量ZXGD给药的动物组织内IL-1β、IL-6、TNF-α的表达明显降低,IL-10的表达明显升高,见Fig 6。如Fig 6A-B所示,与假手术组相比,模型组小鼠心肌组织中IL-1β、IL-6、TNF-α蛋白的表达水平分别明显升高61.81%(P < 0.01)、28.35%(P < 0.01)、43.52%(P < 0.05);IL-10蛋白的表达水平明显降低20.90%(P < 0.05);此外,ZXGD低、中、高剂量组与模型组相比,IL-1β蛋白水平分别明显降低了37.65%(P < 0.01)、41.16%(P < 0.01)、56.63%(P < 0.001);IL-6蛋白水平分别明显降低了16.96%、19.91%(P < 0.05)、20.56%(P < 0.05);TNF-α蛋白水平分别明显降低了27.15%(P < 0.05)、40.86%(P < 0.01)、49.87%(P < 0.01);IL-10蛋白水平分别明显升高了16.93%(P < 0.05)、23.96%(P < 0.05)、25.45%(P < 0.01)。

|
| Fig 6 Effects of ZXGD on expression of inflammation-related proteins in myocardial tissue of MI mice (x±s, n=3) A: The expressions of IL-1β, TNF-α, IL-10 and IL-6 were detected by Western blot; B: IL-1β, TNF-α, IL-10 and IL-6 proteins were drawn using Image and GraphPad software Expression histogram. *P < 0.05 vs Sham group; #P < 0.05, ##P < 0.01 vs Model group. |
目前,MI仍然是心脏临床重点关注疾病,其在临床上常常表现出循环功能障碍、长时间胸骨后的剧烈疼痛、心功能衰竭、心律失常、白细胞计数升高、血清中心肌损伤标记酶水平的升高,以及心电图(ECG)的进行性演变[9],这些都属于MI的临床证据。MI的治疗措施主要包括手术治疗和药物治疗,手术治疗主要有经皮冠状动脉介入治疗和冠状动脉旁路移植术两种方法。药物治疗在临床上主要使用血管紧张素转化酶抑制剂(ACEI)与血管紧张素受体拮抗剂(ARB)、β受体阻滞剂、硝酸酯类药物以及一些溶栓药物[10]。此外,一些中成药在MI的预防和治疗上也起到了非常重要的作用,例如复方丹参滴丸、丹红注射液、芪参益气滴丸、养心康片以及ZXGD等。已有研究表明,ZXGD能够改善MI的临床症状,改善患者的LVEF(左心室舒张末内径)、LVDD(左心室射血分数)、IVST(舒张期间隔厚度)等心功能指标水平,进而增强心功能,保护心肌细胞[8, 11],但其内在机制尚不明确。本次研究基于网络药理学、蛋白富集分析以及实验验证的方法来对ZXGD治疗MI的作用和机制进行研究,希望能够为其临床应用提供一定的科学依据。
本研究首先通过网络药理学方法检索药物、疾病靶点,并对药物靶点和疾病靶点取交集,得到ZXGD可能作用于MI的包括TNF-α、IL-1β、IL-6、HIF1α、VEGFA、IL-10等关键靶点。关键靶点中的IL-6、IL-10、IL-1β、TNF-α是典型的炎症因子,炎症被认为是MI后的关键和危险参与者,在MI的急性期和恢复过程中起着双向调节作用。MI急性期的过度炎症会加重心肌损伤、心室重构和心功能不全[12]等心脏损伤,而适度炎症的后续发展可以为心脏恢复奠定良好的基础。因此,有效的抗炎治疗可能会有助于MI后的心功能恢复[13]。肿瘤坏死因子α(TNF-α)在关键靶点中占据重要节点,它主要由巨噬细胞分泌,可以诱导某些肿瘤细胞系的细胞死亡。它是通过直接作用或刺激IL-1分泌引起发烧的有效热原,与恶病质的诱导有关。它还可以通过与IL-1β和IL-6协同诱导VEGF的产生,在血管生成中发挥作用[14]。此外,TNF-α还可以调节心脏收缩力和外周阻力,这是心脏功能的两个最重要的血液动力学决定因素。因此,这些炎症因子可能对心肌功能的恢复至关重要。这些炎症因子在关键靶点中占据重要位置或许表明ZXGD可以通过改善炎症反应来对MI进行治疗。本研究中我们通过体外免疫印迹实验也证实了ZXGD能够明显降低MI小鼠心肌组织中的IL-1β、TNF-α、IL-6的表达水平(P < 0.05),以及提高IL-10的表达水平(P < 0.05),减轻心肌炎性反应从而保护心肌功能。
关键靶点中的缺氧诱导因子1-α(HIF-1α)也可能是ZXGD作用的重要靶标。HIF-1α广泛参与血管生成、血管舒缩控制、葡萄糖和能量代谢、红细胞生成、细胞增殖和活力等诸多细胞功能事件。有研究表明[15],在大鼠MI模型中,HIF-1α过表达的外泌体有效改善受损的血管生成能力、迁移功能和缺氧损伤的HUVEC的增殖。同时,HIF-1α通过促进新血管形成和抑制纤维化来保护心脏功能,促进梗塞心脏的修复[16]。还有研究表明,一种新黄酮类化合物latifolin可以通过调节HIF-1α/NF-κB/IL-6信号通路抑制心肌炎症来预防心肌梗死[17]。本研究因一些原因未能通过HIF-1α来进行实验验证,希望在后续研究中能够从HIF-1α继续展开ZXGD对MI的探讨。KEGG通路富集中的PI3K-Akt信号转导通路在涉及血小板-基质相互作用和血小板聚集的止血和血栓形成过程中在血小板活化中起着重要作用[18]。这说明ZXGD的心肌保护作用可能是通过多靶点联合作用来实现的。
综上所述,本研究采用网络药理学方法揭示了ZXGD治疗MI的关键靶点及作用通路,其主要药理成分有槲皮素、柚皮素、β-谷甾醇、木犀草素等,体内实验验证了ZXGD对MI的治疗作用,免疫印迹发现ZXGD作用于IL-6、IL-10、IL-1β、TNF-α等关键靶点,调节炎症反应,保护心肌功能,发挥抗MI作用,为ZXGD的临床应用提供参考。
| [1] |
刘璐, 刘瑞, 郭鹏. 心肌梗塞的发生发展与药物治疗[J]. 世界最新医学信息文摘, 2019, 19(6): 77-8. Liu L, Liu R, Guo P. Occurrence and development of myocardial infarction and drug therapy[J]. World Latest Med Inform, 2019, 19(6): 77-8. |
| [2] |
赵庆丽. 心肌梗塞的超声诊断分析[J]. 临床医药文献电子杂志, 2018, 5(47): 108-11. Zhao Q L. Ultrasonic diagnosis of myocardial infarction[J]. J Clin Med Literature, 2018, 5(47): 108-11. |
| [3] |
冯利, 庄安琪, 李轶维, 等. 基于网络药理学和体外研究探究瓜蒌薤白半夏汤治疗动脉粥样硬化的机制[J]. 中国药理学通报, 2022, 38(6): 904-12. Feng L, Zhuang A Q, Li Y W, et al. Mechanism of Gualou Xiebai Banxia decoction in the treatment of atherosclerosis based on network pharmacology and in vitro study[J]. Chin Pharmacol Bull, 2022, 38(6): 904-12. |
| [4] |
梁璐. 桂枝的药理作用分析及其临床应用研究[J]. 中国医药指南, 2016, 14(25): 190-1. Liang L. Study on the pharmacological action and clinical application of ramulus cinnamomi[J]. Guide Chin Med, 2016, 14(25): 190-1. |
| [5] |
谭珍媛, 邓家刚, 张彤, 等. 中药厚朴现代药理研究进展[J]. 中国实验方剂学杂志, 2020, 26(22): 228-34. Tan Z Y, Deng J G, Zhang T, et al. Advances in modern pharmacological research of magnolia officinalis[J]. Chin J Exp Tradit Med Form, 2020, 26(22): 228-34. |
| [6] |
李陈雪, 杨玉赫, 冷德生, 等. 枳壳化学成分及药理作用研究进展[J]. 辽宁中医药大学学报, 2019, 21(2): 158-61. Li C X, Yang Y H, Leng D S, et al. Research progress on chemical constituents and pharmacological effects of fructus aurantii[J]. J Liaoning Univ Tradit Chin Med, 2019, 21(2): 158-61. |
| [7] |
郭澜, 袁鑫, 王美峤, 等. 枳实薤白桂枝汤应用研究进展[J]. 河北中医, 2019, 41(6): 942-6. Guo L, Yuan X, Wang M Z, et al. Research progress on the application of Zhishi Xiebai Guizhi decoction[J]. Hebei Tradit Chin Med, 2019, 41(6): 942-6. |
| [8] |
张晖, 沈妍丽. 枳实薤白桂枝汤联合曲美他嗪片治疗急性心肌梗死患者的疗效观察[J]. 中医药信息, 2019, 36(2): 60-4. Zhang H, Shen Y L. Curative effect of Zhishi Xiebai Guizhi Decoction combined with trimetazidine tablets on patients with acute myocardial infarction[J]. Inform tradi Chin med, 2019, 36(2): 60-4. |
| [9] |
何艳萍, 胡晶华. 心肌梗死心电图的新进展[J]. 心脏杂志, 2014, 26(1): 115-6. He Y P, Hu J H. New progress in electrocardiogram of myocardial infarction[J]. Heart J, 2014, 26(1): 115-6. |
| [10] |
覃世坚. 急性心肌梗塞药物溶栓治疗进展[J]. 右江民族医学院学报, 2005(6): 901-3. Tan S J. Advance in thrombolytic therapy for acute myocardial infarction[J]. J Youjiang Med Univ Nation, 2005(6): 901-3. |
| [11] |
孙玉涛. 枳实薤白桂枝汤联合阿托伐他汀对急性心肌梗死患者心功能、血脂水平及hs-CRP的影响[J]. 国医论坛, 2018, 33(3): 40-1. Sun Y T. Effect of Zhishi Xiebai Guizhi Decoction combined with atorvastatin on cardiac function in patients with acute myocardial infarction blood lipid level and hs-CRP[J]. Chin Med Forum, 2018, 33(3): 40-1. |
| [12] |
Wang X, Guo Z, Ding Z, et al. Inflammation, autophagy, and apoptosis after myocardial infarction[J]. J Am Heart Assoc, 2018, 7(9): e008024. |
| [13] |
Dai Y, Song J, Li W, et al. RhoE Fine-Tunes inflammatory response in myocardial infarction[J]. Circulation, 2019, 139(9): 1185-98. |
| [14] |
Nakahara H, Song J, Sugimoto M, et al. Anti-interleukin-6 receptor antibody therapy reduces vascular endothelial growth factor production in rheumatoid arthritis[J]. Arthritis Rheum, 2003, 48(6): 1521-9. |
| [15] |
Sun J, Shen H, Shao L, et al. HIF-1alpha overexpression in mesenchymal stem cell-derived exosomes mediates cardioprotection in myocardial infarction by enhanced angiogenesis[J]. Stem Cell Res Ther, 2020, 11(1): 373. |
| [16] |
Du Y, Ge Y, Xu Z, et al. Hypoxia-Inducible factor 1 alpha (HIF-1alpha)/vascular endothelial growth factor (VEGF) pathway participates in angiogenesis of myocardial infarction in muscone-treated mice: Preliminary study[J]. Med Sci Monit, 2018, 24: 8870-7. |
| [17] |
Lai X X, Zhang N, Chen L Y, et al. Latifolin protects against myocardial infarction by alleviating myocardial inflammatory via the HIF-1alpha/NF-kappaB/IL-6 pathway[J]. Pharm Biol, 2020, 58(1): 1156-66. |
| [18] |
Chen Z, Li T, Kareem K, et al. The role of PI3K/Akt signaling pathway in non-physiological shear stress-induced platelet activation[J]. Artif Organs, 2019, 43(9): 897-908. |

