


2. 湖南省中医药研究院附属医院,湖南 长沙 410006;
3. 湖南中医药大学中西结合学院,湖南 长沙 410208;
4. 湖南中医药大学中医学院,湖南 长沙 410208
 ,
TIAN Xue-fei3,
GAO Wen-hui4,
TAN Xiao-ning2,
YU Shu-xian1,
JIAN Hui-ying1,
LI Ke-xin2,
ZHANG Zhen2,
ZENG Pu-hua1
,
TIAN Xue-fei3,
GAO Wen-hui4,
TAN Xiao-ning2,
YU Shu-xian1,
JIAN Hui-ying1,
LI Ke-xin2,
ZHANG Zhen2,
ZENG Pu-hua1

2. Affiliated Hospital of Hunan Academy of Traditional Chinese Medicine, Changsha 410006, China;
3. College of Integrated Traditional Chinese and Western Medicine, Hunan University of Chinese Medicine, Changsha 410208, China;
4. College of Traditional Chinese Medicine, Hunan University of Traditional Chinese Medicine, Changsha 410208, China
肝癌是全球最常见且恶性程度最高的肿瘤之一,具有发病隐匿、复发率高等特点[1]。目前现代医学治疗方法主要有手术切除、肝动脉栓塞化疗术、射频消融术及放化疗等。而中医药以整体观为基础,采用个体化辩证施治进行治疗,可减轻不良反应,延长患者生存期,提高生活质量。
近年来,能量代谢正成为当前肿瘤研究热点,肿瘤细胞通过代谢途径的改变维持其能量代谢和生物合成平衡,与增殖生长和侵袭转移关系密切[2]。线粒体通过产生活性氧和调控细胞代谢参与维护机体内环境的稳定,是细胞能量代谢、物质合成的调控中心。此外,线粒体介导的机体内源性凋亡对抑制肝癌细胞增殖、分化及迁移具有重要作用[3]。已有研究表明,中医药能通过介导线粒体防治肝癌[4]。但如何更好地利用中医药低毒性、多靶点、多环节优势介导线粒体凋亡途抑制肝癌的发生发展研究较少,也是临床中急需解决的关键问题。
固脾消积饮(Gupi Xiaoji Decoction,GPXJY)为国医大师潘敏求团队应用30年临床经验方,该方能对症肝癌患者临床出现的肝郁脾虚和瘀毒内结证的症状,具有稳定瘤体,调节免疫等作用[5]。前期实验研究已表明,该方能影响肝癌细胞自噬和凋亡从而介导能量代谢,但对能量代谢的关键靶区线粒体的功能和结构的作用从未探索。本研究采用流式、荧光、透射电镜等技术预探索GPXJY对线粒体结构和功能的影响,从而为临床改善肝癌的治疗及相关基础研究提供理论指导。
1 材料与方法 1.1 材料 1.1.1 细胞株人肝癌细胞HepG2为湖南省中医药研究院附属医院中心实验室惠赠。
1.1.2 实验动物SPF级SD大鼠10只,♂(180~220)g,购于湖南斯莱克景达实验动物有限公司(合格证号SCXK(湘)2019-0004)所有动物实验均符合中国伦理委员会有关动物研究指导原则,实验动物饲养在避光、通风环境中,实验温度(22±2)℃,相对湿度45%~50%,自由饮水摄食,适应性喂养7 d后,用于制备含药血清。
1.1.3 实验药品及试剂GPXJY内含白参、黄芪、半枝莲、重楼、醋莪术、甘草(药材购于湖南省中医药研究院附属医院);Deme高糖培养基(批号:WH0021K261)购自Procell公司;小牛血清(批号:20201118)购自CELL-BOX公司;CCK8试剂盒(批号:K1018)购于APExBIO公司;增强型线粒体膜电位检测试剂盒(JC-1)(批号:C2003S)购于上海碧云天生物技术有限公司;抗体BAX(批号:E-AB-10049)、Bcl-2(批号:E-AB-22004)、caspase-3(批号:E-AB-22115)、cleaved-caspase-3(批号:E-AB-30004)、cytochrome-c(批号:E-AB-40271)均购于Elabscience公司;PVDF膜(0.45 μm)(货号:IPVH00010)购自Millipore公司。三磷酸腺苷(adenosine triphosphate,ATP)ELISA检测试剂盒(批号:S0026)购自上海碧云天生物技术有限公司。
1.1.4 主要仪器流式细胞仪(DxFLEX)购自美国Beckman Coulter有限公司;超低温低速离心机(Multifuge XIR)购自德国ThermoFisher公司;酶标仪(EIX808U)购自美国BioTek公司;高内涵成像分析系统(Operetta CLS)购自美国PerkinElmer公司;倒置荧光显微镜(XDS-600C)购自日本奥林巴斯公司;透射电子显微镜(HT7800)购自日本HITACHI公司。
1.2 方法 1.2.1 GPXJY含药血清的制备白参10 g、黄芪30 g、半枝莲30 g、重楼15 g、醋莪术15 g、甘草5 g,饮片8倍量水浸泡30 min,文火煎煮2 h提取2次,合并两次滤液,药物浓缩至100 mL含生药1.8 kg·L-1GPXJY水提液。将SD大鼠随机分为GPXJY组(灌胃GPXJY水提液27 g生药·kg-1·d-1)及空白组(灌胃等体积生理盐水),每组5只。每天灌胃1次,连续灌胃6 d,d 7灌胃后1 h后乙醚麻醉,腹主动脉取血,静置1 h后,3 000 r·min-1离心15 min,分离血清,56 ℃灭活30 min,为含药血清,-80 ℃保存。
1.2.2 实验细胞培养及分组HepG2用10%胎牛血清的完全培养基培养,置于37 ℃,5%CO2培养箱培养,取对数生长期细胞进行实验。本实验Mito-Tracker Green荧光染色设2组(对照组(Control),固脾消积饮血清组(GPXJY)外,其它实验细胞共设4组:对照组(Control);空白血清组(Blank);固脾消积饮血清组(GPXJY);顺铂组(Positive)。每组设置6~10个复孔。GPXJY用10%固脾消积饮含药血清培养基,顺铂组浓度为20 mg·L-1。
1.2.3 CCK-8法检测细胞增殖取对数生长期细胞接种于96孔板,贴壁后分别加入浓度分别为5%、8%、10%、15%、20%、40%的GPXJY,干预24 h,每孔加入10 μL CCK-8检测试剂继续培养2 h,用酶标仪检测每孔450 nm处的吸光度(OD)。并计算不同浓度药物对细胞的增殖率,
1.2.4 Mito-Tracker Green荧光染色检测肝癌细胞HepG2线粒体形态结构取12孔板并将HepG2细胞分为2组,药物干预细胞24 h后,PBS清洗3次,加入Mito-Tracker Green染色液,培养箱孵育15 min,PBS清洗3次,激光共聚焦显微镜下观察并拍照。若两组细胞有显著变化则继续实验。
1.2.5 荧光检测肝癌细胞HepG2线粒体膜电位变化4组细胞药物干预24 h后,去除上清液,PBS洗涤2次后,加入1 mL JC-1染色工作液,充分混匀。细胞培养箱中37 ℃孵育20 min,用JC-1缓冲液洗涤2次,加入培养液,在荧光显微镜下观拍照。
1.2.6 ATP含量测定按照试剂盒说明书要求,每组细胞药物干预后取上清液,用酶标仪450 nm波长下测定吸光度值,通过标准曲线计算样品中指标浓度。
1.2.7 流式细胞仪检测肝癌细胞HepG2线粒体膜电位4组细胞药物干预24 h后,消化各组细胞悬液1 mL(含1×106细胞),以冷PBS洗涤,600×g 4 ℃离心3~4 min后加入100 uL PBS液悬浮细胞,加入JC-1染色工作液,37 ℃孵育20 min,600×g 4 ℃离心3~4 min,加入JC-1缓冲液,沉淀细胞,去除缓冲液,重复3次,最后一次用JC-1缓冲液重悬后,用流式细胞仪检测细胞线粒体膜电位。
1.2.8 透射电镜检测肝癌细胞HepG2线粒体的变化4组细胞药物干预24 h后,加入2.5%的常温戊二醛固定液。常温固定5 min,刮下细胞,离心2 min,加新的电镜固定液,悬浮细胞。放于4 ℃冰箱中固定30 min后,固定脱水切片,在透射电镜下观察线粒体并拍照。
1.2.9 高内涵(high content screening,HCS)检测肝癌细胞HepG2的caspase-3、cleaved-caspase-3、cytochrome-c、Bcl-2、Bax蛋白表达量取黑色96孔板接种细胞,4组加入相应药物,干预24 h。4%多聚甲醛固定30 min,弃液,PBS洗5 min×3次。Trition-100处理15 min,提前冷藏PBS洗3次。5%BSA封闭30 min。分别加入(1 ∶100)兔抗小鼠caspase-3、cleaved-caspase-3、cytochrome-c、Bcl-2、Bax一抗稀释液避光4 ℃过夜孵育,冷PBS洗3次,加入(1 ∶200)FITC标记的山羊抗兔二抗稀释液避光37 ℃30 min孵育,加入DAPI染核,避光室温20 min孵育,每孔加入50 μL PBS,于高内涵成像分析系统上进行荧光检测并拍照。
1.2.10 统计学方法实验数据采用SPSS 26.0统计软件进行分析。计量资料以x±s表示,多组间比较采用单因素方差分析。
2 结果 2.1 GPCJY对HepG2的增殖影响CCK-8法检测结果显示与不同浓度的GPXJY对HepG2细胞均有一定的抑制作用,且抑制作用与药物的浓度存在明显依赖性(Fig 1)。
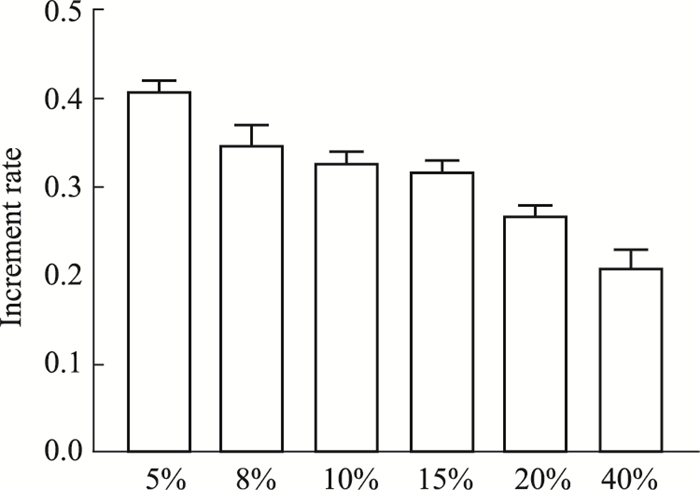
|
| Fig 1 Increment rate of Gupi Xiaoji Decoction medicated serum interfering with HepG2 |
Mito-Tracker Green染色结果显示GPXJY组与对照组相比,线粒体数量减少,荧光强度减弱,差异具有统计学意义(P < 0.01)。结果表明GPXJY干预后,对HepG2细胞线粒体有损伤作用(Fig 2)。
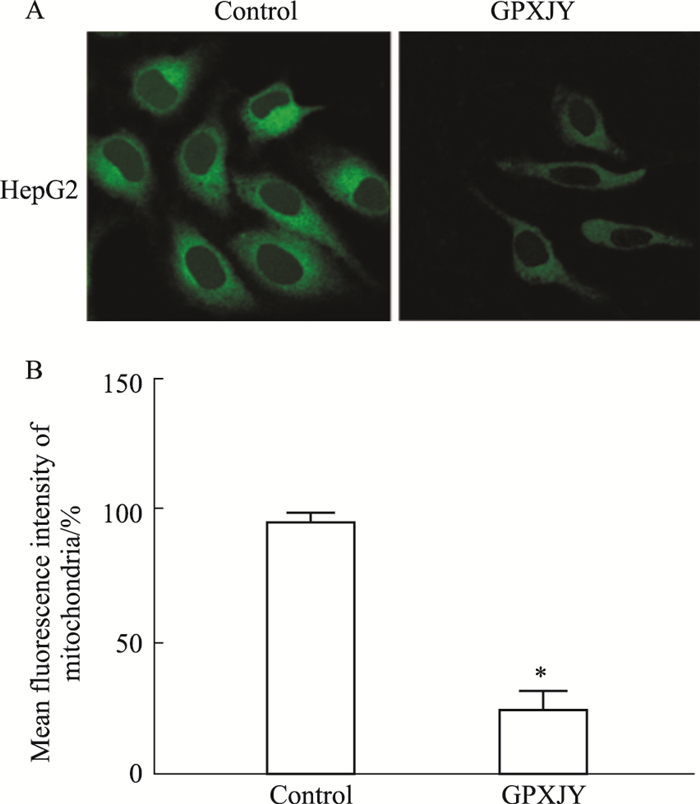
|
| Fig 2 Effect of Gupi Xiaoji Decoction on mitochondria of HepG2 cells (×1000)(x±s,n=6) A:Image of Mitochondrial staining; B:Average fluorescence intensity of mitochondria; *P < 0.05 vs Control group |
结果显示,GPXJY含药血清组和顺铂组细胞上清液ATP含量减少。由此可见GPXJY对能降低肝癌细胞ATP的释放,且具有显著统计学意义(Fig 3)。
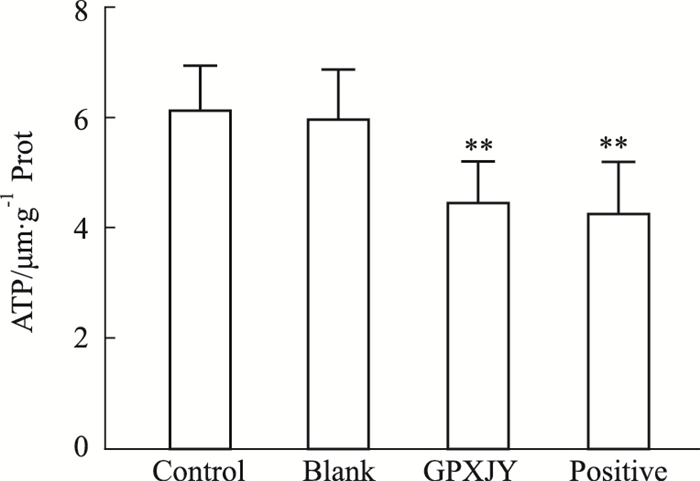
|
| Fig 3 ATP content of cells in each group(x±s,n=6) **P < 0.01 vs Control |
荧光结果表明,对照组与空白血清组的红色荧光较多,表明其线粒体膜电位较高。相反,GPXJY血清组和顺铂组的绿色荧光较多,细胞贴壁能力不强,可见线粒体电位降低。从流式结果可以看出,与对照组比较,GPXJY和顺铂血清组线粒体膜电位依次下降,差异均具有统计学意义(Fig 4)。
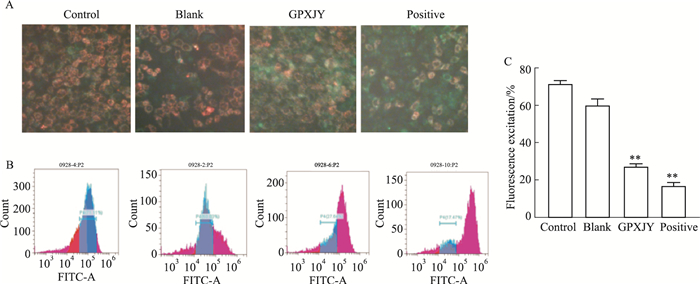
|
| Fig 4 Mitochondrial membrane potential in each group(×200)(x±s,n=6) A:Mitochondrial membrane potential of cells in each group; B:Flow cytometric membrane potential diagram of mitochondria in each group; C:Fluorescence expression of mitochondrial membrane potential in each group.**P < 0.01 vs Control |
实验结果图片中箭头所指为线粒体及其对应的放大结构。电镜结果表明,对照组和空白血清组的线粒体饱满、规整。与对照组相比,GPXJY和顺铂组线粒体肿胀,有线粒体空泡,嵴样结构错乱并消失,线粒体固缩等结构。由此可见,GPXJY能对HepG2细胞的线粒体结构产生影响(Fig 5)。
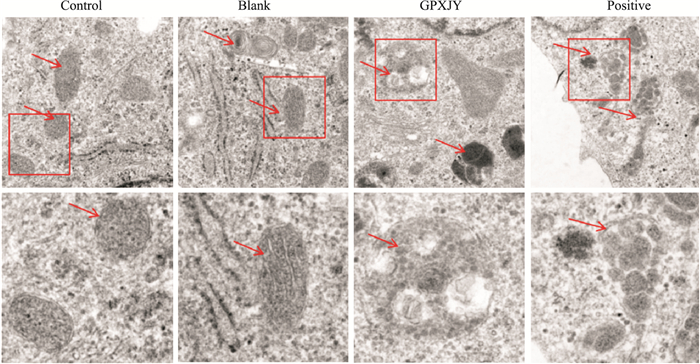
|
| Fig 5 Morphology of mitochondria in different treatment groups observed by transmission electron microscope |
与对照组比较,Blank组蛋白荧光强度值均无明显差异(P>0.05),而顺铂组、GPXJY含药血清组的HepG2细胞内Bcl-2平均荧光强度值明显降低(P < 0.01、P < 0.05),凋亡促进蛋白Bax、cytochrome-c、caspase-3、cleaved-caspase-3平均荧光强度值明显增加(P < 0.01、P < 0.05),研究表明GPXJY含药血清和顺铂组能显著调控抑凋亡与促凋亡蛋白表达水平(Fig 6)。
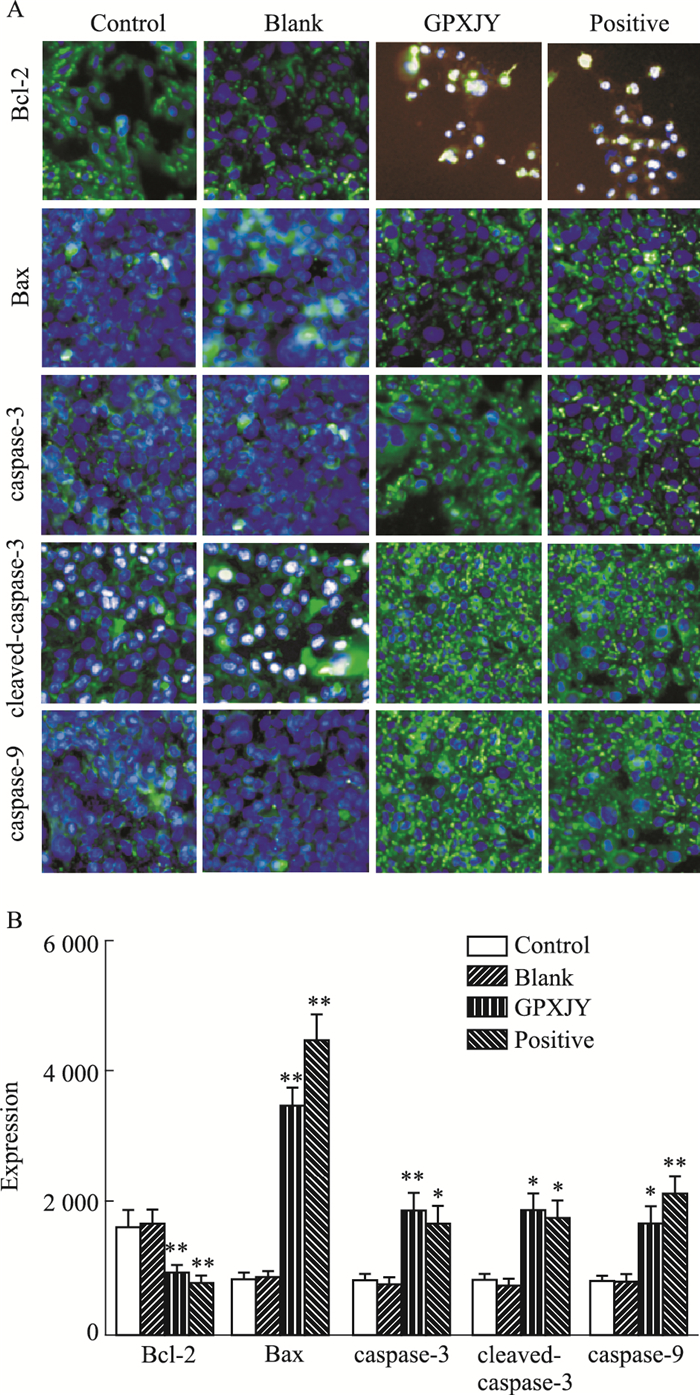
|
| Fig 6 Expression of Bcl-2,Bax,caspase-3,cleaved-caspase-3,cytochrome-c in each group(x±s,n=6) A:HCS of caspase-3,cleaved-caspase-3,cytochrome-c,Bcl-2 and Bax in cells of each group; B:Expression of caspase-3,cleaved-caspase-3,cytochrome-c,bcl-2 and Bax in each group. *P < 0.05,**P < 0.01 vs Control |
肝癌与其它肿瘤相比易复发转移且侵袭性高,其恶性程度高与线粒体紊乱有关。研究表明,在肝癌发生发展中线粒体发挥重要作用,线粒体能量产生、合成、代谢、动力学、凋亡调控等均与肝癌相关[6]。本实验CCK-8法检测结果显示,GPXJY能抑制HepG2的细胞生长并与浓度存在明显依赖性。线粒体的融合和分裂情况判断,肝癌细胞的线粒体结构完整,数目较多,而GPXJY组线粒体数目减少并发生分裂。由此可以判断GPXJY对HepG2发生线粒体介导的凋亡。由此可见,GPXJY能阻碍HepG2线粒体的功能。
线粒体是为细胞生存提供能量,为机体进行能量代谢的主要场所。其结构和功能状态决定了细胞能量代谢及供应效率[7]。线粒体结构变化主要是由于其分裂、融合引起的形态、数目和大小的改变,线粒体内膜上线粒体呼吸链提供了细胞生存所需绝大部分能量,其活性及ATP含量是反映线粒体氧化合成功能的重要指标[8]。线粒体功能的改变是靶向肝癌细胞凋亡的重要信号途径,导致线粒体途径凋亡因子释放的线粒体事件称为线粒体外膜通透性,主要由Bcl-2家族蛋白控制。此外,线粒体在呼吸氧化过程中,将所产生的能量以电化学势能储存于线粒体内膜,在内膜两侧造成质子及其他离子浓度的不对称分布而形成线粒体膜电位(mitochondrial membrane potential,MMP)。正常的MMP是维持线粒体进行氧化磷酸化、产生三磷酸腺苷的先决条件,MMP的稳定有利于维持细胞的正常生理功能。研究发现,GPXJY干预后,HepG2线粒体的结构中发生空泡,嵴样结构错乱并消失,固缩等对线粒体结构损伤的效应。同时发现该方能降低MMP,降低ATP含量,可见,GPXJY能破坏HepG2线粒体结构和功能。
近年来线粒体介导的凋亡途径成为了防治肝癌的研究热点。肝癌细胞中的线粒体一方面通过选择性的吞噬功能障碍的线粒体,维持线粒体稳态,达到肝癌细胞内的能量平衡及内环境的稳定[9-10];另一方面,线粒体能通过凋亡途径调节肝癌细胞的增殖迁移,其机制可能是外界刺激导致线粒体外膜通透化后,释放细胞色素C(cytochrome,Cyt C)触发凋亡,导致Bax相关通路激活,凋亡相关因子如caspase-3、cleaved-caspase-3、Bcl-2、Bax发生变化,诱导细胞发生级联性凋亡从而拮抗肝癌[9, 11]。本实验验证GPXJY对HepG2细胞内Bcl-2平均荧光强度值明显降低,促进蛋白Bax、cytochrome-c、caspase-3、cleaved-caspase-3平均荧光强度值增加。由此可见,GPXJY能通过影响线粒体凋亡途径而破坏肝癌细胞的能量代谢,从而影响肝癌细胞的增殖。
综上所述,GPXJY可通过破坏肝癌细胞线粒体的结构,削弱线粒体功能而抑制肝癌细胞的增殖。后续考虑考察GPXJY对线粒体相关功能信号及能量代谢相关靶点探讨其它相关基因蛋白的调控机制及药效物质基础,并结合原位肝癌动物模型,进一步探讨GPXJY对肝癌细胞抑制生长作用机制,为肝癌的临床用药提供理论价值。
| [1] |
Llovet J M, Zucman-Rossi J, Pikarsky E, et al. Hepatocellular carcinoma[J]. Nat Rev Dis Primers, 2016, 2: 16018. doi:10.1038/nrdp.2016.18 |
| [2] |
Yao X, Li W, Fang D, et al. Emerging roles of energy metabolism in ferroptosis regulation of tumor cells[J]. Adv Sci (Weinh), 2021, 8(22): e2100997. doi:10.1002/advs.202100997 |
| [3] |
Jin T, Wang C, Tian Y, et al. Mitochondrial metabolic reprogramming: An important player in liver cancer progression[J]. Cancer Lett, 2020, 470: 197-203. doi:10.1016/j.canlet.2019.11.029 |
| [4] |
李振, 王科, 王凯强, 俞科贤. 中药介导线粒体防治肝癌的研究进展[J]. 中草药, 2022, 53(2): 575-89. Li Z, Wang K, Wang K Q, Yu K X. Research progress of traditional Chinese medicine mediated mitochondrial prevention and treatment of liver cancer[J]. Chin Tradit Herbal Drugs, 2022, 53(2): 575-89. |
| [5] |
王亚琪, 曾普华, 郜文辉. 益气化瘀解毒方联合索拉非尼对人肝癌索拉非尼耐药细胞移植瘤及缺氧诱导因子1α与血管拟态表达的影响[J]. 陕西中医, 2020, 41(2): 143-6. Wang Y Q, Zeng P H, Gao W H. Effects of Yiqi Huayu Jiedu recipe combined with sorafenib on transplanted human hepatoma sorafenib resistant cells and hypoxia inducible factor 1 α And vascular mimicry expression[J]. Shaanxi Tradit Chin Med, 2020, 41(2): 143-6. doi:10.3969/j.issn.1000-7369.2020.02.002 |
| [6] |
汪洁, 金晓锋, 叶孟. 线粒体在肝癌进展及治疗中的作用[J]. 生命的化学, 2021, 41(11): 2352-60. Wang J, Jin X F, Ye M. The role of mitochondria in the progression and treatment of liver cancer[J]. Chem Life, 2021, 41(11): 2352-60. |
| [7] |
邵江娟, 金春, 彭珣, 等. 线粒体溶质载体蛋白SLC25A26诱导肝癌细胞衰老作用及分子机制[J]. 中国药理学通报, 2021, 37(2): 220-6. Shao J J, Jin C, Peng X, et al. Mitochondrial solute carrier protein SLC25A26 induces senescence of hepatoma cells and its molecular mechanism[J]. Chin Pharmacol Bull, 2021, 37(2): 220-6. doi:10.3969/j.issn.1001-1978.2021.02.014 |
| [8] |
Krysztofiak A, Szymonowicz K, Hlouschek J, et al. Metabolism of cancer cells commonly responds to irradiation by a transient early mitochondrial shutdown[J]. iScience, 2021, 24(11): 103366. doi:10.1016/j.isci.2021.103366 |
| [9] |
Moreno-Sánchez R, Rodríguez-Enríquez S, Marín-Hernández A, Saavedra E. Energy metabolism in tumor cells[J]. FEBS J, 2007, 274(6): 1393-418. |
| [10] |
Jones C L, Inguva A, Jordan C T. Targeting energy metabolism in cancer stem cells: Progress and challenges in leukemia and solid tumors[J]. Cell Stem Cell, 2021, 28(3): 378-93. |
| [11] |
Chang C W, Lo J F, Wang X W. Roles of mitochondria in liver cancer stem cells[J]. Differentiation, 2019, 107: 35-41. |