


2. 山东第一医科大学(山东省医学科学院)药学院,山东 泰安 271016;
3. 山东第一医科大学(山东省医学科学院)基础医学院,山东 泰安 271016
刘亚平(1998-),男,硕士生,研究方向:心血管药理,共同第一作者,E-mail:1624202596@qq.com。
文今福(1965-),女,博士,教授,硕士生导师,研究方向:心血管药理,通信作者,E-mail: jfwen@sdfmu.edu.cn
2. School of Pharmacy, Shandong First Medical University & Shandong Academy of Medical Sciences, Taian, Shandong 271016, China;
3. College of Basic Medical Sciences, Shandong First Medical University & Shandong Academy of Medical Sciences, Taian, Shandong 271016, China
心血管疾病(cardiovascular diseases,CVD)仍是威胁人类生命安全的一个危险疾病,而不良的膳食结构则是心血管疾病的主要危险因素。长期的高脂饮食会增加身体中的脂肪含量, 从而增加血液中的游离脂肪酸(free fatty acids,FFA)水平。棕榈酸(palmitic acid,PA)是血液循环中含量最丰富的FFA之一,其在血液中的累积可导致细胞脂毒性,最终诱导内皮功能障碍甚至细胞死亡[1]。
CVD发展过程中最重要的因素是血管内皮细胞的功能及结构是否完整,而一氧化氮(nitric oxide,NO)在调节内皮功能动态平衡中起关键作用[2-3]。NO主要来源于内皮,具有多种血管保护作用。PA可减少血管内皮NO的释放,并能抑制Akt和内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的磷酸化激活[4]。此外,PA诱导的ROS可促使内皮细胞发生凋亡,ROS的过量产生还能破坏氧化系统和抗氧化系统之间的平衡[5]。因此,减轻氧化应激可以成为治疗高脂饮食所致血管内皮损伤的一种策略。
氧化苦参碱(oxymatrine,OMT)是一种天然生物碱,具有广泛的药理作用和生物活性,包括抗菌、抗病毒、抗氧化、抗肿瘤等作用[6]。OMT抑制促炎介质的释放,从而对高糖损伤的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)具有保护作用[7]。最近研究表明[8],OMT通过Akt-eNOS-NO信号通路抑制Hcy诱导的HUVECs细胞凋亡。然而,OMT对PA致血管内皮细胞损伤的作用尚不清楚。因此,本研究选用体外培养的HUVECs作为研究对象,旨在探讨OMT对PA诱导的内皮细胞损伤的保护作用及其潜在机制。
1 材料与方法 1.1 材料 1.1.1 细胞株HUVECs细胞购自于江苏凯基生物技术有限公司。
1.1.2 药物与试剂OMT(纯度>98%)购自西安嘉天生物科技有限公司;PA(货号:slcd8134)购于Sigma公司;DMEM培养基(货号:AG29643096)购自HyClone公司;胎牛血清购于杭州四季青公司;MTT(货号:TOX1)、二甲基亚砜(DMSO, 货号:D2650)均购自美国Sigma公司;Wortmannin(WT,货号:1232/5)购自英国Tocris公司;LDH试剂盒、SOD试剂盒、GSH-PX试剂盒、MDA试剂盒、NO试剂盒(货号分别为:A020-1-2、A001-1-1、A005-1-1、A003-1-2、A012-1-2)均购自南京建成生物科技有限公司;Annexin V-FITC细胞凋亡检测试剂盒(货号: C1067S)、ROS检测试剂盒(货号:S0033S)均购自碧云天生物公司;一抗抗体Akt、p-Akt、eNOS、p-eNOS、bax、bcl-2、caspase-3、β-actin(货号分别为:4691S、4060T、32027S、4223S、2772T、4060S、14220T、4970S)均购自美国CST公司;二抗兔抗IgG(货号:ZB-2301)、二抗鼠抗IgG(货号:ZB-2305)均购于北京中杉生物技术公司。
1.1.3 仪器流式细胞仪(美国BD公司);电泳仪(伯乐,Bio Rad);Infinite F 200型多功能酶标仪(瑞士Tecan公司);超净工作台(苏州净化设备公司);XPS-1 B型倒置显微镜(重庆电光仪器有限公司)。
1.2 方法 1.2.1 细胞培养将从液氮中取出的细胞在DMEM高糖培养基(包括10% FBS、1%青链霉素)、5%CO2、37 ℃培养箱中培养。取第3~8代细胞供实验用。
1.2.2 分组与药物干预细胞存活率和LDH指标检测实验中,将HUVECs细胞分为7组:正常对照组(control组)、PA组(0.5 mmol·L-1,模型组)、PA+OMT组(0.1、0.3、0.6 μmol·L-1,干预组)、WT+PA+OMT(0.6 μmol·L-1)组、WT(0.1 μmol·L-1)组。其他指标检测实验中,将HUVECs细胞分为5组: control组、PA组、PA+OMT(0.1、0.3、0.6 μmol·L-1)组。待细胞长到80%密度后吸出培养基,模型组只加入PA,干预组用相应浓度OMT提前预处理4 h后再加入PA,control组加入相同体积的培养基,细胞继续培养24 h,收集样品备用。
1.2.3 MTT检测细胞存活率细胞以每孔3 000个的密度接种于96孔板中,各组细胞加药处理24 h后,弃掉旧培养基,每孔加入0.5 g·L-1的MTT 100 μL,4 h后弃上清,每孔加DMSO 150 μL,振摇10 min结晶溶解,用多功能酶标仪在490 nm波长测定OD值,并计算细胞存活率。
1.2.4 Annexin V-FITC/PI双染检测细胞凋亡细胞以每孔5×104个的密度接种于6孔板中,细胞贴壁24 h后弃旧培养基,按分组加药处理细胞后于孵箱中继续培养24 h后弃旧培养液,使用PBS清洗两次,用不含EDTA的胰酶消化细胞,转移至流式管离心收集细胞。按照Annexin V-FITC/PI凋亡检测试剂盒说明书操作,用流式细胞仪检测细胞凋亡并进行数据处理。
1.2.5 DCHF-DA染色检测细胞内ROS生成细胞以每孔5×104个的密度接种于6孔板细胞中,按照DCHF-DA试剂盒说明书操作,用ELISA法检测细胞内ROS水平。
1.2.6 MDA、SOD、LDH、GSH-PX、NO含量测定收集细胞培养液,根据检测试剂盒使用明书进行实验操作,用ELISA法检测细胞培养液中MDA、SOD、LDH、GSH-PX和NO水平。
1.2.7 Western blot检测相关蛋白表达各组细胞处理后用预冷的PBS缓冲液冲洗3次,用含1 mmol·L-1 PMSF的RIPA细胞裂解液提取细胞总蛋白,BCA蛋白定量试剂盒测定蛋白浓度。每孔加入15 μL的蛋白样品进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),分离并转移至PVDF膜上,BSA封闭液封闭2 h。加入一抗(1 ∶1 000)于4 ℃孵育过夜,加入辣根过氧化物酶偶联的二抗(1 ∶5 000),室温孵育1.5 h,增强化学发光法(ECL)暗室显影。利用Image-Pro Plus 6.0软件分析条带灰度值。
1.2.8 统计学分析所有实验结果数据均采用x±s表示,采用GraphPad Prism 7软件对实验结果进行统计学处理。多组间比较采用单因素方差分析,两组间比较采用t检验。
2 结果 2.1 OMT对PA处理的HUVECs细胞存活率的影响为了评估OMT对PA损伤的HUVECs细胞存活率的影响,使用MTT法检测细胞存活率。选用不同浓度的OMT(0.1、0.3、0.6、1、3、10、30、300 μmol·L-1)处理细胞,结果显示OMT对细胞存活率无影响(Fig 1A)。选用不同浓度的PA(0.1、0.25、0.5、0.75、1、1.5 mmol·L-1)处理细胞,结果显示PA呈剂量依赖性地降低细胞存活率(Fig 1B)。根据PA对细胞存活率的检测结果,选取0.5 mmol·L-1作为后续实验的损伤浓度。与对照组相比,PA组明显降低细胞存活率,而OMT干预组则浓度依赖性地提高细胞存活率,但此作用明显被WT所抑制(Fig 1C)。此外,LDH是膜损伤的重要标志物,因此使用ELISA法检测细胞培养液中LDH水平。如Fig 1D所示,PA显著提高细胞培养液中LDH水平,而OMT则抑制PA诱导的LDH水平上调,此作用也明显被WT所抑制。这些结果表明,OMT可以改善PA诱导的血管内皮细胞损伤。
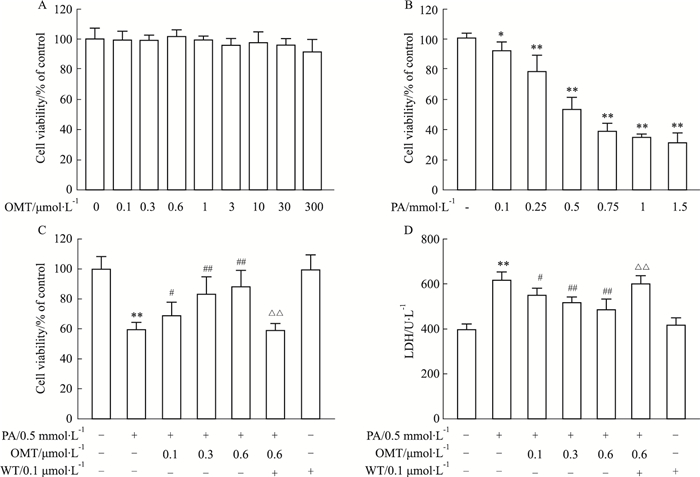
|
| Fig 1 Effect of OMT on HUVECs injury in response to PA(x±s, n=6) A: MTT assay showed cell viability after 24 h treatment with OMT (0~300 μmol·L-1); B: MTT assay showed cell viability after 24 h treatment with PA (0~1.5 mmol·L-1); C: Cells were incubated for 4 h with the indicated concentrations of OMT (0.1, 0.3, 0.6 μmol·L-1) and then stimulated with PA (0.5 mmol·L-1) for 24 h, WT(0.1 μmol·L-1) was added into the culture medium 1 h before pretreated with OMT. Cell viability was measured by MTT assay; D: The level of LDH in cell culture medium was measured by ELISA. *P < 0.05, **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs PA group; △△P < 0.01 vs OMT(0.6 μmol·L-1)+PA group |
为了确认OMT是否能减少PA诱导的HUVECs细胞凋亡,采用Annexin V-FITC/PI双染的流式细胞术分析。与对照组相比,PA组细胞凋亡率明显增加。与PA组相比,OMT干预组呈剂量依赖性地下调细胞凋亡率(Fig 2)。同时,Western blot法检测细胞凋亡标志物bcl-2、bax以及caspase-3的蛋白表达。如Fig 3所示,OMT有效抑制PA诱导的HUVECs细胞bcl-2/bax比值下调和caspase-3蛋白表达升高。这些结果表明,OMT改善PA诱导的血管内皮细胞凋亡。
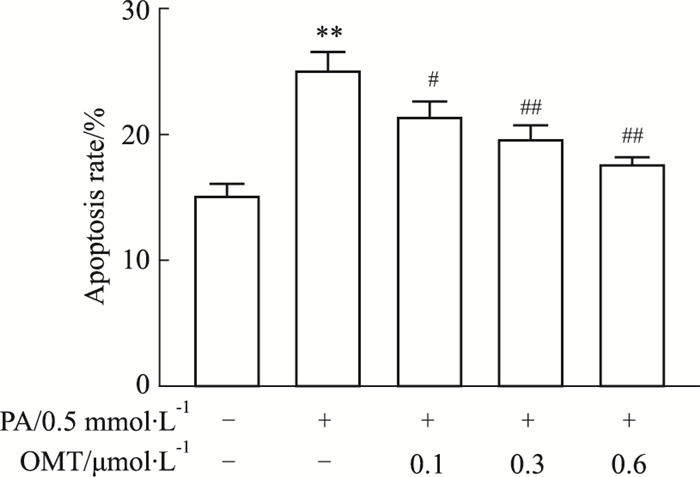
|
| Fig 2 Effect of OMT on PA-induced apoptosis in HUVECs(x±s, n=3) The apoptotic rate was detected by flow cytometry. **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs PA group |
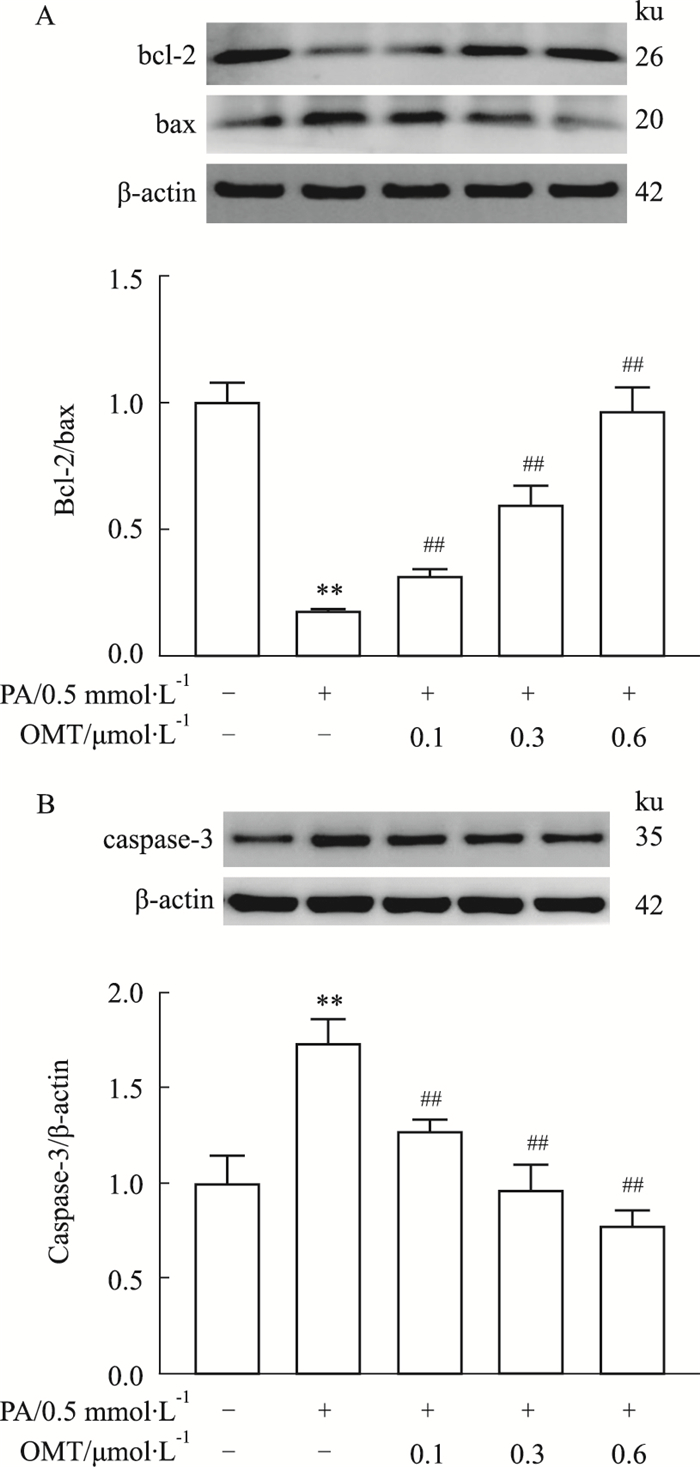
|
| Fig 3 Effect of OMT on protein expression of bcl-2, bax and caspase-3 in HUVECs subjected to PA(x±s, n=3) Western blot analysis of protein expression of bcl-2, bax(A) and caspase-3(B)in HUVECs. **P < 0.01 vs control group; ##P < 0.01 vs PA group. |
为了明确OMT对HUVECs细胞的保护作用是否与氧化应激有关,采用DCFH-DA染色进行细胞内ROS的检测。与对照组比较,PA组明显增加细胞内ROS水平,而OMT干预组剂量依赖性地降低其水平(Fig 4)。此外,ELISA法检测氧化应激相关指标。如Fig 5所示,在细胞培养液中,与对照组相比,PA组明显上调MDA水平并下调SOD和GSH-PX水平,而OMT干预组则剂量依赖性地逆转上述变化。这些结果表明,OMT减弱PA诱导的血管内皮细胞氧化应激损伤。

|
| Fig 4 Effect of OMT on PA-induced ROS production in HUVECs (x±s, n=3) Intracellular ROS level was detected by flow cytometry. a: Control; b: PA (0.5 mmol·L-1); c: OMT (0.1 μmol·L-1)+PA; d: OMT (0.3 μmol·L-1)+PA; e: OMT (0.6 μmol·L-1)+PA. **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs PA group |
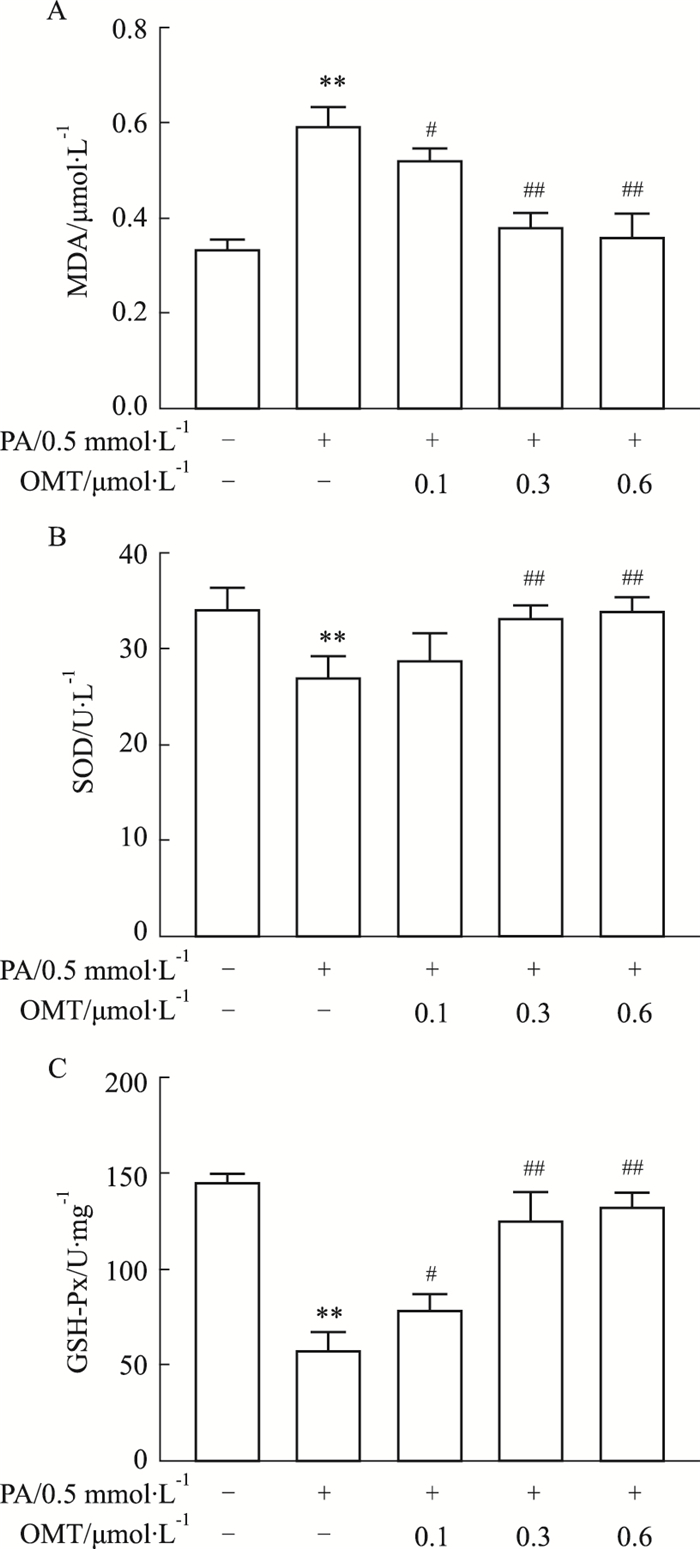
|
| Fig 5 Effect of OMT on PA-induced oxidative stress in HUVECs(x±s, n=3) The levels of MDA(A),SOD(B)and GSH-Px(C)in cell culture medium were measured by ELISA. **P < 0.01 vs control group;#P < 0.05,##P < 0.01vs PA group. |
为了探究OMT对PA诱导的血管内皮细胞损伤的保护作用机制,采用Western blot法检测NO信号相关蛋白表达。与对照组比较,PA组明显降低HUVECs细胞中Akt和eNOS的磷酸化蛋白水平,而OMT组则剂量依赖性地上调Akt和eNOS的磷酸化蛋白表达(Fig 6A,B)。由于Akt和eNOS的磷酸化蛋白表达升高可促进内皮细胞NO分泌,因此采用ELISA法对细胞培养液中NO水平进行检测。如Fig 6C所示,PA组显著降低细胞培养液中NO水平,而OMT干预组则逆转这一变化。结果表明,OMT通过激活Akt-eNOS-NO信号通路减轻PA诱导的血管内皮细胞损伤。
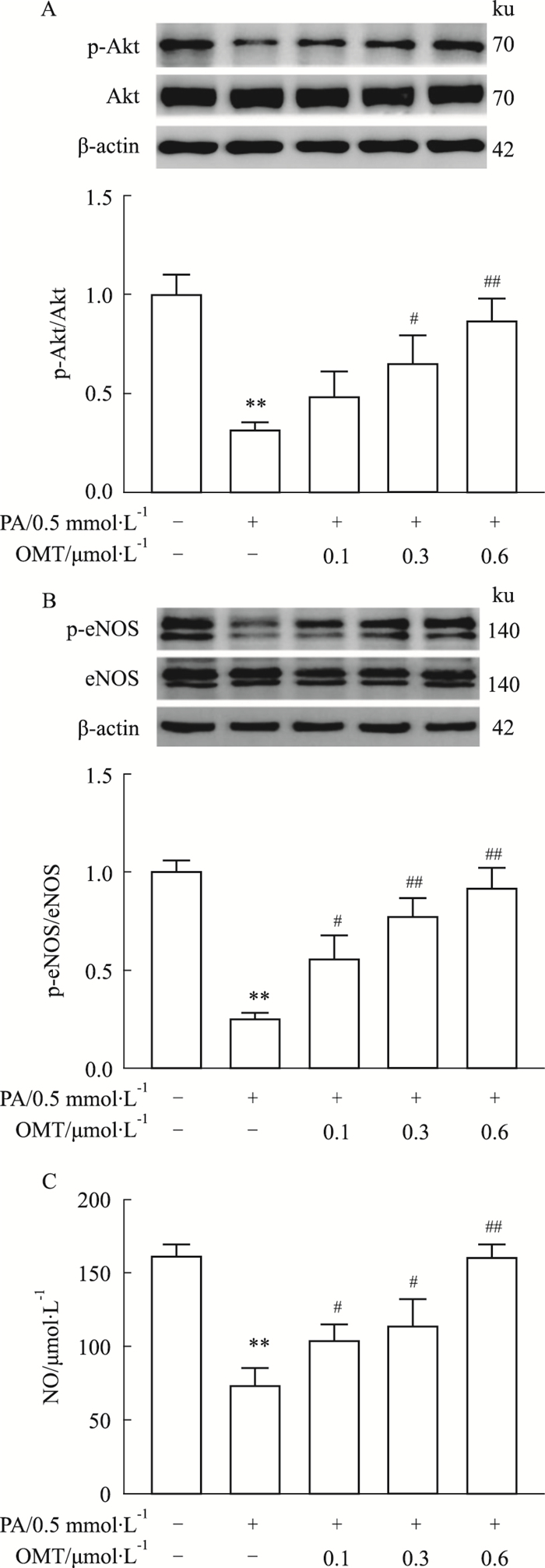
|
| Fig 6 Effect of OMT on PA-induced endothelial Akt-eNOS-NO signaling pathways(x±s, n=3) The protein phosphorylation levels of Akt(A)and eNOS(B) were detected by Western blot; The level of NO(C)in cell culture medium was measured by ELISA. **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs PA group. |
CVD的防治一直备受医学界的关注,而血管内皮损伤是造成CVD的病理基础[9]。研究表明[10],FFA对骨骼肌的胰岛素敏感性和内皮依赖性血管扩张造成损伤,而高脂增加血浆FFA水平会造成血管内皮损伤,进而导致血管并发症。PA是一种含16个碳的长链饱和脂肪酸,是最丰富的膳食脂肪酸,也是血浆中最常见的游离脂肪酸之一。本研究采用PA诱导的HUVECs细胞损伤模型,探讨OMT通过Akt-eNOS-NO信号通路改善PA诱导的HUVECs细胞损伤的作用。
脂毒性对血管内皮细胞具有损伤作用[10-11]。用PA处理HUVECs细胞后发现细胞存活率受到明显抑制,这与文献报道相符。LDH是一种存在于胞质中稳定的酶,是细胞受损或死亡的一个重要标志物。研究结果显示,PA诱导HUVECs细胞LDH水平的升高,而OMT则逆转此变化,表明OMT对PA诱导的细胞损伤具有保护作用。此外,用Akt抑制剂WT对细胞进行预处理后,显著抑制OMT升高HUVECs细胞存活率和降低LDH的效应,提示OMT对PA诱导的内皮损伤的保护作用与Akt信号通路的激活有关。
血浆中脂质的增加会引起氧化应激,并进一步触发血管内皮功能障碍和细胞凋亡[10-11]。PA诱导的细胞损伤主要是由于ROS生成增加和抗氧化酶受损[12]。正常生理条件下,ROS是重要的信号分子,当ROS的产生超过抗氧化能力时,就会发生氧化应激。研究发现,PA诱导HUVECs细胞产生大量ROS,而OMT则有效清除PA所产生的过量ROS,说明OMT能改善血管内皮细胞在高脂条件下所产生的氧化应激损伤。MDA是膜脂质过氧化的重要产物之一,是评价膜损伤程度的常用指标。许多抗氧化酶和非酶分子参与抵消ROS效应。线粒体产生的ROS的主要形式是超氧阴离子,而抗氧化酶SOD能将其转化为过氧化氢,随后可被GSH-PX转化为水[13]。通过测定抗氧化酶系统SOD与GSH-PX的活性,以及脂质过氧化物MDA的含量,发现OMT减弱PA诱导的MDA水平升高以及SOD和GSH-PX活性降低。表明OMT减弱脂质的过氧化,增强抗氧化酶活性,从而能改善细胞内的氧化应激状态。
血管内皮细胞中,线粒体不仅是ATP的主要来源,也是产生ROS的细胞器[14],ROS是诱导凋亡的主要因素之一。Bcl-2家族分子接收和传递凋亡信号,负责凋亡上游的调控,主要通过线粒体途径来调控凋亡[15]。Bcl-2具有代表性的抗凋亡作用,大多位于线粒体外膜上,可调节线粒体外膜通透性。Bax是与bcl-2有拮抗作用的一种蛋白质,能够促进细胞凋亡。Bcl-2/bax比值是线粒体信号通路中的一个重要指标。研究结果显示,用PA刺激HUVECs细胞时,产生大量的ROS,而ROS的产生影响bcl-2和bax的表达,使bcl-2/bax比值降低,继而引起下游caspase级联反应中的caspase-3效应蛋白的表达,从而诱导细胞发生凋亡,但这种作用被OMT所阻断。提示OMT抑制PA诱导的内皮细胞线粒体依赖性凋亡。
血管内皮细胞是一种氧化还原敏感组织,对血管稳态的维持起着核心作用[8, 11]。NO是维持血管内环境稳定的重要信号分子,具有调节多种生命活动的作用,受eNOS催化前体L-精氨酸生成,并由Akt的激活触发[16]。血管内皮功能障碍的一个主要原因是NO的生物利用度降低,可能的原因是NO的合成减少,或者与氧化自由基的反应增加NO的分解有关[17-18]。研究发现,PA抑制HUVECs细胞中Akt和eNOS的磷酸化蛋白表达以及NO水平,而OMT的干预则逆转此种改变。提示OMT对PA诱导的血管内皮损伤的保护作用是通过Akt-eNOS-NO信号通路来实现的。
综上,OMT对PA诱导的血管内皮细胞损伤具有保护作用,其机制与Akt-eNOS-NO信号通路的激活有关。这些发现为OMT对血管内皮细胞损伤的干预提供科学依据。
| [1] |
仲美楠, 李玉子. 棕榈酸在心血管疾病中的研究进展[J]. 吉林医学, 2018, 39(5): 963-6. Zhong M N, Li Y Z. Research progress of palmitic acid in cardiovascular diseases[J]. Jilin Med J, 2018, 39(5): 963-6. |
| [2] |
Joshi M, Kotha S R, Malireddy S, et al. Conundrum of pathogenesis of diabetic cardiomyopathy: Role of vascular endothelial dysfunction, reactive oxygen species, and mitochondria[J]. Mol Cell Biochem, 2014, 386(1-2): 233-49. doi:10.1007/s11010-013-1861-x |
| [3] |
Jin S N, Wen J F, Li X, et al. The mechanism of vasorelaxation induced by ethanol extract of Sophora flavescens in rat aorta[J]. J Ethnopharmacol, 2011, 137(1): 547-52. doi:10.1016/j.jep.2011.06.013 |
| [4] |
Li C Y, Wang L X, Dong S S, et al. Phlorizin exerts direct protective effects on palmitic acid (PA)-Induced endothelial dysfunction by activating the PI3K/AKT/eNOS signaling pathway and increasing the levels of nitric oxide (NO)[J]. Med Sci Monit Basic Res, 2018, 24: 1-9. doi:10.12659/MSMBR.907775 |
| [5] |
Lu Y, Chen Y, Li R, et al. Protective effects of Danzhi jiangtang capsule on vascular endothelial damages induced by high-fat diet and palmitic acid[J]. Biomed Pharmacother, 2018, 107: 1631-40. doi:10.1016/j.biopha.2018.08.129 |
| [6] |
高佩佩, 王珍, 刘静, 等. 氧化苦参碱的药代动力学、毒理学及药理作用[J]. 中国药理学通报, 2019, 35(7): 898-902. Gao P P, Wang Z, Liu J, et al. The pharmacokinetics, toxicology and pharmacology of oxymatrine[J]. Chin Pharmacol Bull, 2019, 35(7): 898-902. |
| [7] |
Yi Y, Shen Y, Wu Q, et al. Protective effects of oxymatrine on vascular endothelial cells from high-Glucose-induced cytotoxicity by inhibiting the expression of A2B receptor[J]. Cell Physiol Biochem, 2018, 45(2): 558-71. doi:10.1159/000487033 |
| [8] |
Wu B, Yue H, Zhou G H, et al. Protective effects of oxymatrine on homocysteine-induced endothelial injury: Involvement of mitochondria-dependent apoptosis and Akt-eNOS-NO signaling pathways[J]. Eur J Pharmacol, 2019, 864: 172717. doi:10.1016/j.ejphar.2019.172717 |
| [9] |
Charles S, Raj V, Arokiaraj J, et al. Caveolin1/protein arginine methyltransferase1/sirtuin1 axis as a potential target against endothelial dysfunction[J]. Pharmacol Res, 2017, 119: 1-11. doi:10.1016/j.phrs.2017.01.022 |
| [10] |
Artwohl M, Roden M, Waldhäusl W, et al. Free fatty acids trigger apoptosis and inhibit cell cycle progression in human vascular endothelial cells[J]. FASEB J, 2004, 18(1): 146-8. doi:10.1096/fj.03-0301fje |
| [11] |
Kim J A, Montagnani M, Chandrasekran S, et al. Role of lipotoxicity in endothelial dysfunction[J]. Heart Fail Clin, 2012, 8(4): 589-607. doi:10.1016/j.hfc.2012.06.012 |
| [12] |
Ku C W, Ho T J, Huang C Y, et al. Cordycepin attenuates palmitic acid-induced inflammation and apoptosis of vascular endothelial cells through mediating PI3K/Akt/eNOS signaling pathway[J]. Am J Chin Med, 2021, 49(7): 1703-22. doi:10.1142/S0192415X21500804 |
| [13] |
Liu W, Baker S S, Baker R D, et al. Antioxidant mechanisms in nonalcoholic fatty liver disease[J]. Curr Drug Targets, 2015, 16(12): 1301-14. doi:10.2174/1389450116666150427155342 |
| [14] |
Sun J, Huang X, Niu C, et al. aFGF alleviates diabetic endothelial dysfunction by decreasing oxidative stress via Wnt/β-catenin-mediated upregulation of HXK2[J]. Redox Biol, 2021, 39: 101811. doi:10.1016/j.redox.2020.101811 |
| [15] |
胡善明, 王亚楠, 许正茂, 等. Bcl-2家族分子在细胞凋亡中的作用研究进展[J]. 动物医学进展, 2021, 42(10): 85-9. Hu S M, Wang Y N, Xu Z M, et al. Progress on bcl-2 family molecular function in apoptosis[J]. Prog Vet Med, 2021, 42(10): 85-9. |
| [16] |
Lovren F, Pan Y, Shukla P C, et al. Visfatin activates eNOS via Akt and MAP kinases and improves endothelial cell function and angiogenesis in vitro and in vivo: Translational implications for atherosclerosis[J]. Am J Physiol Endocrinol Metab, 2009, 296(6): E1440-9. doi:10.1152/ajpendo.90780.2008 |
| [17] |
Clapp B R, Hingorani A D, Kharbanda R K, et al. Inflammation-induced endothelial dysfunction involves reduced nitric oxide bioavailability and increased oxidant stress[J]. Cardiovasc Res, 2004, 64(1): 172-8. doi:10.1016/j.cardiores.2004.06.020 |
| [18] |
Ning W H, Zhao K. Propionyl-L-carnitine induces eNOS activation and nitric oxide synthesis in endothelial cells via PI3 and Akt kinases[J]. Vascul Pharmacol, 2013, 59(3-4): 76-82. doi:10.1016/j.vph.2013.07.001 |

