

2. 中国科学院西北高原生物研究所藏药研究重点实验室,青海 西宁 810001
2. Key Laboratory of Tibetan Medicine Research, Northwest Institute of Plateau Biology, Chinese Academy of Sciences, Xining 810001, China
肝脏作为体内代谢的中心站,涉及很多氧化还原过程,其旺盛的代谢活动必然会伴随肝细胞中活性氧(reactive oxygen species,ROS)的大量生成[1]。ROS过量积累,在体内形成氧化应激(oxidative stress,OS),进而影响肝细胞中酶类及其受体的功能,干扰肝脏的氧化-还原稳态,造成肝细胞线粒体结构和功能破坏,肝细胞发生凋亡或坏死[2]。氧化应激被认为是导致衰老和多种疾病的重要因素[3],因此,人们一直致力于从药用植物及其次生代谢产物中发现某些能通过改变氧化应激从而发挥保肝护肝的活性物质。胡芦巴碱(trigonelline, TRG)为传统中药胡芦巴的主要活性成分之一,具有抗氧化[4]、保肝[5]等药用价值。
Ilavenil等发现TRG可通过改善H2O2诱导的H9C2细胞的抗氧化活性,调节细胞凋亡和抗凋亡途径,从而保护H9C2细胞免受H2O2诱导的细胞坏死和凋亡的影响。TRG还可通过调节细胞凋亡(Caspase-3和Caspase-9)和抗凋亡(Bcl-2和Bcl-XL)途径来抑制细胞凋亡。另外,还将槲皮素作为阳性对照药,发现TRG抗氧化作用效果与槲皮素相当。槲皮素是自然界的一种黄酮类化合物,具有很强的生物活性,可通过减少氧化应激发挥抗氧化药理作用。表明TRG通过激活抗凋亡途径,对氧化应激介导的细胞凋亡有明显的保护作用[6]。Zhang等[7]在非酒精性脂肪肝(NAFLD)大鼠模型试验研究中发现了相似的结论。然而,国内几乎未见对TRG抗氧化活性的研究,国外的研究也甚少,目前还缺乏对TRG抗氧化作用机制的系统研究。因此本研究以TRG标准品为受试物,化学结构如Fig 1所示。外源性H2O2处理可以增加细胞内ROS的水平,引起细胞氧化损伤,是一种常见的氧化损伤模型的诱导剂。本研究以L02肝细胞为研究对象,探讨TRG的抗氧化活性及其对H2O2诱导的L02肝细胞氧化损伤的保护作用,并探讨其分子机制,旨在为TRG的抗氧化药理作用研究提供一定的参考价值。

|
| Fig 1 The chemical structures of trigonelline |
TRG标准品(批号:MUST-19083003,纯度≥99.94%)购自成都曼斯特生物科技有限公司。RPMI 1640培养基(批号:2044181)购自Biological Industries公司;胎牛血清(批号:21100701)购自浙江天杭生物技术股份有限公司;磷酸盐缓冲液(PBS,批号:20210630)、MTT(批号:715F0525)购自北京索莱宝科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD,20211202)、谷胱甘肽(glutathione,GSH,20211202)、乳酸脱氢酶(lactic dehydrogenase,LDH,批号:20210622)等检测试剂盒购自南京建成生物工程研究所;丙二醛(malondialdehyde,MDA,073120201016)和过氧化氢酶(catalase,CAT,081420200918)检测试剂盒、蛋白浓度测定试剂盒(批号:072721210907)等购自碧云天生物技术有限公司;c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK1/2)、核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)、血红素加氧酶1(heme oxygenase 1,HO-1)、B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl2)、B淋巴细胞瘤基因-2相关X蛋白(BCL2-associated X,Bax)、半胱氨酸天冬氨酸蛋白酶3(Caspase 3)等抗体(Cell Signaling Technology公司);兔二抗(武汉爱博泰克生物科技有限公司);30% H2O2(批号:20190302)购自国药集团化学试剂有限公司。
1.2 仪器二氧化碳培养箱(Memmert ICP500,德国);酶标仪(BioTek Synergy Epoch 2,美国);倒置显微镜(Leica DMi1,德国);高速冷冻离心机(Eppendorf 5430R,德国);Tanon 5200化学发光成像系统(上海天能科技有限公司);电泳仪(Tetra Cell,美国伯乐公司);PL303电子天平(梅特勒-托利多仪器有限公司);冷冻干燥机(LGJ-10,北京四环科学仪器厂有限公司);Eppendorf minispan离心机(Eppendorf,德国)。
1.3 L02细胞株及细胞培养L02人正常肝细胞购自中国科学院上海细胞所,在含10%胎牛血清、1%青链霉素的RPMI 1640培养基、37 ℃、5% CO2细胞培养箱中培养L02细胞24 h。
1.4 TRG对L02细胞毒副作用的检测取对数生长期L02细胞,密度控制为5×107 L-1,接种于96孔板中培养24 h。用含0~200 μmol·L-1 TRG替换原有培养基,继续培养12 h,MTT法[13]检测490 nm波长处的吸光值(A)。并计算细胞存活率。
细胞存活率/%= A处理组/A空白组×100%
1.5 H2O2诱导细胞氧化损伤模型的建立将L02细胞接种于96孔培养板。用无血清培养基将H2O2配成0~1 000 μmol·L-1等10个不同浓度,作用12 h后,同“1.3.2”MTT检测方法并计算细胞存活率,确定H2O2的最佳造模浓度。
1.6 胡芦巴碱对H2O2损伤后L02细胞存活率的影响将L02细胞接种于96孔培养板。实验分为对照组(Con)、H2O2组和H2O2+TRG组。处理12 h后,同“1.3.2”MTT检测方法并计算细胞存活率。
1.7 细胞内LDH、MDA、GSH、SOD和CAT的测定取对数期L02细胞,密度控制为5×107 L-1,接种于6孔板,24 h后细胞完全贴壁。按“1.3.4”分组处理12 h后,分别按照各个说明书进行操作,检测细胞内LDH泄漏量,SOD和CAT的活性以及GSH和MDA的含量。
1.8 Western blot检测相关蛋白的表达同“1.3.5”的方法培养细胞。L02细胞加不同浓度的TRG处理与H2O2共同孵育12 h,抽提蛋白后定量并做变性处理,SDS-PAGE检测β-actin、JNK、p-JNK、ERK1/2、p-ERK1/2、Bcl-2、Bax、cleaved Caspase 3、Caspase 3、Nrf2和HO-1等抗体的表达水平。
1.9 数据处理运用Graphpad prism 8.0软件对数据进行分析及作图。数据用x±s表述。各组均数之间采用One-way ANOVA比较,两两比较用t检验。
2 结果 2.1 TRG对L02细胞活力的影响TRG以不同浓度作用L02细胞12 h后,在3.125~200 μmol·L-1时对L02细胞无毒副作用,在浓度大于25 μmol·L-1时L02细胞活力开始稍有下降(Fig 2A)。因此,后续实验选取浓度为25 μmol·L-1。
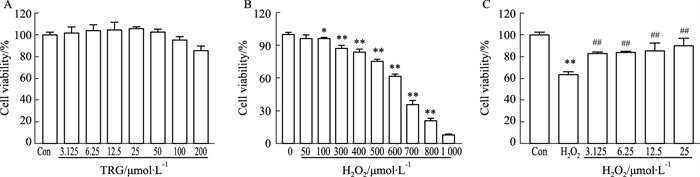
|
| Fig 2 Effect of TRG and H2O2 on cell viability of L02 cells (x±s, n=6) A: L02 cells were treated with TRG (0, 3.125, 6.25, 12.5, 25, 50, 100 and 200 μmol·L-1) for 12 h, and cell viability was determined by MTT assay; B: L02 cells were treated with H2O2 (0, 50, 100, 300, 400, 500, 600, 700, 800 and 1 000 μmol·L-1) for 12 h, and cell viability was determined by MTT assay; C: The effect of TRG on the survival rate of L02 cells injured by H2O2. *P < 0.05, **P < 0.01 vs Con; ##P < 0.01 vs H2O2 |
选取几个不同浓度的H2O2对L02细胞进行12 h诱导。L02细胞的存活率随着H2O2浓度的增加而显著下降,见Fig 2B。以半数致死量(IC50)为原则,本研究选择H2O2的造模浓度为650 μmol·L-1。
2.3 TRG对H2O2损伤L02细胞活力的影响MTT结果如Fig 2C所示,H2O2组细胞存活率与对照组相比具有显著性差异(P < 0.01);与模型组相比,3.125~25 μmol·L-1浓度下TRG能明显提高H2O2损伤后L02细胞的活力(P < 0.01)。
2.4 TRG对H2O2损伤L02细胞LDH、SOD、GSH、MDA和CAT的影响如图Fig 3A, B所示,与空白组相比,H2O2组的LDH和MDA水平明显升高(P < 0.01)。经TRG处理后,与H2O2组相比,LDH水平随TRG浓度的增大逐渐降低,当TRG浓度>12.5 μmol·L-1时,LDH水平显著下降(P < 0.05,P < 0.01);而低浓度的TRG(6.25 μmol·L-1)就能显著降低MDA(P < 0.01)。如Fig 3C-E,H2O2组的SOD、GSH和CAT水平较空白组相比明显降低(P < 0.01)。TRG处理后,SOD、GSH和CAT活性水平均得到改善。随着TRG浓度的增加,其效果越好。上述结果表明,TRG能够改善H2O2对L02细胞的氧化损伤。

|
| Fig 3 Effects of TRG on antioxidant index in L02 cells induced by H2O2 (x±s, n=3) A: LDH level; B: MDA level; C: SOD level; D: GSH level; E: CAT. **P < 0.01 vs Con, #P < 0.05, ##P < 0.01 vs H2O2. |
Western blot检测经H2O2刺激的L02细胞内Nrf2、HO-1、Bcl2、Bax、cleaved Caspase 3、Caspase 3、JNK、ERK1/2等蛋白的表达水平及其磷酸化表达水平。与对照组相比,H2O2刺激后的L02细胞中Nrf2和HO-1表达受到显著抑制,TRG作用后,随着其浓度的增加,其在不同程度上能促进二者的表达水平,但是在检测浓度范围内,TRG对Nrf2的影响未达到显著水平(Fig 4A, B)。H2O2损伤的L02细胞中cleaved Caspase 3和Bax的表达升高,Caspase 3和Bcl-2被抑制。TRG作用后Caspase 3/cleaved Caspase 3和Bcl-2/Bax比值均有明显上升(Fig 4C,D),与对照组相比有显著性差异(P < 0.01)。此外,H2O2刺激后L02细胞中p-JNK/JNK、p-ERK1/2/ERK1/2比值提升,高浓度的TRG能明显降低p-JNK/JNK、p-ERK1/2/ERK1/2和cleaved Caspase 3/Caspase 3的比值(P < 0.01),且随着TRG浓度逐渐增加,作用越显著(Fig 4E,F)。

|
| Fig 4 Effects of TRG on expression of proteins in L02 cells induced by H2O2 (x±s, n=3) A: Effects of TRG on expression of Nrf2 in L02 cells induced by H2O2; B: Effects of TRG on expression of HO-1 in L02 cells induced by H2O2; C: Effects of TRG on expression of Caspase 3/cleaved Caspase 3 in L02 cells induced by H2O2; D: Effects of TRG on expression of Bcl-2/Bax in L02 cells induced by H2O2; E: Effects of TRG on expression of p-JNK/JNK in L02 cells induced by H2O2; F: Effects of TRG on expression of p-ERK1/2/ERK1/2 in L02 cells induced by H2O2; #P < 0.05, ##P < 0.01 vs H2O2; *P < 0.05, **P < 0.01 vs Con. |
肝细胞具有丰富的线粒体,容易产生氧化损伤的ROS,在各种肝损伤的发病机制中起着重要作用[8]。多种外源性刺激因子如酒精、药物、环境污染物和辐射等均可引起肝细胞氧化应激。H2O2是一种强氧化剂,可通过细胞膜,直接改变细胞内稳态,扰乱信号转导,引起细胞损伤和细胞凋亡。经过H2O2处理的肝细胞可能发生凋亡样延迟性死亡或坏死[9],因此,H2O2被广泛用作肝细胞凋亡的外源性氧化应激介导实验模型[1],可诱导细胞线粒体内ROS的产生。本研究发现,通过构建H2O2诱导L02细胞体外氧化损伤模型,TRG干预后,能显著提高H2O2损伤后L02细胞的存活率,改善在H2O2的刺激下L02细胞中SOD、CAT、GSH等抗氧化物的活性,同时抑制了细胞LDH泄漏和MDA含量的升高,从而发挥保护L02细胞的作用。
细胞凋亡是一种程序性生物过程,伴随着形态学和生化改变,包括细胞收缩、凋亡体形成和Caspase激活等[10]。氧化应激和凋亡过程中的各种事件与ROS的产生、Bcl2家族蛋白的改变以及下游Caspase家族蛋白的激活有重要联系。Bcl-2和Bax蛋白是细胞存活和凋亡的常用指标,前者具抗凋亡活性,而后者具促凋亡活性。当Bax过度表达时,凋亡细胞对死亡信号的反应加剧;另一方面,当Bcl-2过度表达时,与Bax一起抑制细胞凋亡。在本研究中,与H2O2模型组相比,发现经TRG干预H2O2损伤的L02细胞Bax水平有所下调,而Bcl-2水平则显著上调,Bax表达的大量增加可能会激活细胞的凋亡信号,导致细胞死亡,TRG则可以通过与Bax表达相反的方式保护细胞免受氧化应激的损伤。Bax的凋亡还可以通过细胞色素C依赖性复合物激活Caspase 3[11]。Caspase 3是Caspase家族研究最广泛的成员,在细胞凋亡中起关键作用,可被H2O2激活[12-13]。当细胞凋亡发生时,Caspase 3被活化成cleaved Caspase 3,发挥促凋亡的作用。本研究还证明了TRG作用后可以通过上调Caspase 3并下调cleaved Caspase 3的表达来保护L02细胞免受H2O2的伤害。
Nrf2是机体内保持氧化还原平衡的重要因素,在氧化条件下,Nrf2激活了一组抗氧化基因和细胞保护基因,这些基因具有一个共同的抗氧化反应元件(ARE),其中包括HO-1[14]。ROS的大量产生可刺激Nrf2表达,Nrf2的激活会导致抗氧化剂的表达和恢复氧化还原稳态[15],进而激活HO-1的表达。据发现,Nrf2缺陷小鼠更容易受到氧化应激和炎症性疾病的影响[16],因此Nrf2/HO-1通路被认为是氧化应激相关的重要机制之一,并且调控该通路可改善多种因素引起的肝脏损伤[17]。本研究发现,TRG干预后,随着其浓度的增加,能使Nrf2和HO-1活性逐渐增强。上述研究结果表明,TRG可通过提高机体清除氧自由基和抗氧化能力进而有效保护了由H2O2导致的肝细胞损伤。
MAPK通路是一组中枢信号通路,对一系列细胞外刺激做出反应,并参与细胞凋亡、氧化应激、增殖和应激反应等多种细胞过程的重要信号通路[9],并通过连续磷酸化和激活丝氨酸激酶来传递信号,是大多数细胞刺激过程的中枢调节器,当调节失调时会诱发许多疾病[18]。其家族成员ERK和JNK也广泛参与氧化应激所致的肝细胞损伤与凋亡,在受到许多细胞外刺激而激活。本研究显示,在H2O2诱导的L02细胞中,ERK1/2和JNK的磷酸化水平显著增强,而TRG明显抑制了ERK1/2和JNK的磷酸化水平,但没有改变总ERK1/2和JNK蛋白质的激活。这些结果说明,在L02细胞中,JNK和ERK1/2参与此过程,H2O2可能通过激活JNK和ERK1/2的表达而诱导细胞发生凋亡,而TRG具有抑制氧化应激状态下MAPK通路活化的作用。
综上所述,TRG可以提高机体清除氧自由基和抗氧化能力,从而逆转H2O2刺激的肝细胞损伤。同时发现这一作用激活了Nrf2/HO-1信号通路,抑制了MAPK途径,此外TRG还可通过降低L02细胞的cleaved Caspase 3和Bax活性,促进Bcl-2和Caspase 3表达来抑制细胞凋亡,从而起到抗氧化作用,本实验结果为TRG后续的抗氧化药理作用及临床研究提供帮助。本研究仅局限于体外细胞实验,因此,下一步我们将通过动物体内实验验证TRG对机体氧化损伤的保护作用。
| [1] |
Hassan H A. Oxidative stress as a crucial factor in liver associated disorders: Potential therapeutic effect of antioxidants[J]. The Liver, 2018, 121-30. |
| [2] |
Cichoz-Lach H, Michalak A. Oxidative stress as a crucial factor in liver diseases[J]. World J Gastroenterol, 2014, 20(25): 8082-91. doi:10.3748/wjg.v20.i25.8082 |
| [3] |
方琼彤, 吕满霞, 陈彦洁, 等. 氧化应激在鱼藤素致SH-SY5Y细胞神经毒性中的作用[J]. 中国药理学通报, 2020, 36(1): 47-52. Fang Q T, Lyu M X, Chen Y J, et al. Effect of oxidative stress in SH-SY5Y cell injury induced by deguelin[J]. Chin Pharmacol Bull, 2020, 36(1): 47-52. doi:10.3969/j.issn.1001-1978.2020.01.011 |
| [4] |
Gómez-Ruiz J, Leake D S, Ames J M. In vitro antioxidant activity of coffee compounds and their metabolites[J]. J Agr Food Chem, 2007, 55(17): 6962-9. doi:10.1021/jf0710985 |
| [5] |
Mayakrishan T, Nakkala J R, Jeepipalli S P K, et al. Fenugreek seed extract and its phytocompounds-trigonelline and diosgenin arbitrate their hepatoprotective effects through attenuation of endoplasmic reticulum stress and oxidative stress in type 2 diabetic rats[J]. Eur Food Res Technol, 2015, 240(1): 223-32. doi:10.1007/s00217-014-2322-9 |
| [6] |
Ilavenil S, Kim D H, Jeong Y I, et al. Trigonelline protects the cardiocyte from hydrogen peroxide induced apoptosis in H9c2 cells[J]. Aasian Pac J Trop Med, 2015, 8(4): 263-8. doi:10.1016/S1995-7645(14)60328-X |
| [7] |
Zhang D F, Zhang F, Zhang J, et al. Protection effect of trigonelline on liver of rats with non-alcoholic fatty liver diseases[J]. Aasian Pac J Trop Med, 2015, 8(8): 651-4. doi:10.1016/j.apjtm.2015.07.012 |
| [8] |
Wang X, Cui Y J, Qi J, et al. Fucoxanthin exerts cytoprotective effects against hydrogen peroxide-induced oxidative damage in L02 cells[J]. Biomed Res Int, 2018, 2018: 1085073. |
| [9] |
Tian W, Heo S, Kim D W, et al. Ethanol extract of maclura tricuspidata fruit protects SH-SY5Y neuroblastoma cells against H2O2-induced oxidative damage via inhibiting MAPK and NF-κB signaling[J]. Int J Mol Sci, 2021, 22(13): 6946. doi:10.3390/ijms22136946 |
| [10] |
Ziegler, U, Groscurth P. Morphological features of cell death[J]. News Physiol Sci, 2004, 19(3): 124-8. |
| [11] |
Chetsawang B, Putthaprasart C, Phansuwan-Pujito P, et al. Melatonin protects against hydrogen peroxide-induced cell death signaling in SH-SY5Y cultured cells: Involvement of nuclear factor kappa B, Bax and Bcl-2[J]. J Pineal Res, 2006, 41(2): 116-23. doi:10.1111/j.1600-079X.2006.00335.x |
| [12] |
Martin D, Salinas M, Fujita N, et al. Ceramide and reactive oxygen species generated by H2O2 induce caspase-3-independent degradation of Akt/protein kinase B[J]. J Biol Chem, 2002, 277(45): 42943-52. doi:10.1074/jbc.M201070200 |
| [13] |
Zhao X, Fang J, Li S, et al. Artemisinin attenuated hydrogen peroxide (H2O2)-induced oxidative injury in SH-SY5Y and hippocampal neurons via the activation of AMPK pathway[J]. Int J Mol Sci, 2019, 20(11): 2680. doi:10.3390/ijms20112680 |
| [14] |
Innamorato N G, Rojo A I, Garcia-Yague A J, et al. The transcription factor Nrf2 is a therapeutic target against brain inflammation[J]. J Immunol, 2008, 181(1): 680-9. |
| [15] |
Kraft A D, Lee J M, Johnson D A, et al. Neuronal sensitivity to kainic acid is dependent on the Nrf2-mediated actions of the antioxidant response element[J]. J Neurochem, 2006, 98(6): 1852-65. |
| [16] |
Foresti R, Bains S K, Pitchumony T S, et al. Small molecule activators of the Nrf2-HO-1 antioxidant axis modulate heme metabolism and inflammation in BV2 microglia cells[J]. Pharmacol Res, 2013, 76: 132-48. |
| [17] |
曲敬蓉, 张艳艳, 宿宏佳, 等. 黄芪多糖激活Nrf2/HO-1信号通路改善模型大鼠糖尿病性肝损伤[J]. 中国药理学通报, 2020, 36(10): 6. Qu J R, Zhang Y Y, Su H J, et al. Astragalus polysaccharide attenuates hepatic damage by activating Nrf2 /HO-1 pathway in diabetic rats[J]. Chin Pharmacol Bull, 2020, 36(10): 6. |
| [18] |
Seger R, Krebs E G. The MAPK signaling cascade[J]. Faseb J, 1995, 9(9): 726-35. |

