

宫颈癌是在妇科癌症类型占比排名前三的癌症,平均每年有约50万患者被确诊,约占所有新诊断癌症的9%,通常通过子宫切除术、放疗和化疗进行治疗,每年造成约30万人死亡[1]。在全国第3次因病死亡汇总中显示,我国宫颈癌死亡率逐年下降,情况较为乐观[2-3]。发达国家已经组织了疫苗接种和筛查项目[4]。紫杉醇与顺铂联合或紫杉醇、顺铂与贝伐珠单抗联合,仍是治疗的基石[5]。然而,所有这些宫颈癌的临床化疗都显示出有限的有效性,最终肿瘤耐药性会逐渐增强。中药因其低毒性、多靶点的特性,目前为抗肿瘤药物研发的热点[6]。
蛇床子素是天然香豆素类化合物,从蛇床子中提取而来[6]。虽然多数文献报道蛇床子素对大部分肿瘤细胞具有诱导凋亡及自噬的作用,但是蛇床子素诱导肿瘤细胞死亡的机制研究大多聚焦在凋亡方面[7]。自噬在不同类型、不同状态的肿瘤中呈现出的不同的作用机制,调控自噬已成为肿瘤治疗的重要手段。肿瘤细胞对自噬的依赖性是一个日益重要的研究领域[8]。目前针对蛇床子素如何诱导自噬的研究较少,而诱导过程中ROS水平上升,线粒体发生了损伤,也未曾将这一现象与线粒体自噬联系。PINK1/Parkin是与线粒体自噬密切相关的信号通路,且参与ROS的氧化应激。本研究拟观察蛇床子素是否诱导宫颈癌HeLa细胞发生自噬,并判断其自噬类型是否为线粒体自噬,为临床治疗宫颈癌提供新思路。
1 材料与方法 1.1 材料 1.1.1 细胞人宫颈癌HeLa细胞株为桂林医学院生药学重点实验室传代保存。
1.1.2 动物BALB/c裸鼠购于湖南斯莱克景达实验动物有限公司。
1.1.3 药物蛇床子素(纯度99.93%,成都普思生物科技股份有限公司,批号:PS000828)。
1.1.4 主要试剂二甲亚砜(DMSO,美国Amresco公司);DMEM培养基(美国Gibco公司);胎牛血清(美国Clark生物科技公司);3-Methyladenine(3-MA)(美国MedChemExpress公司);PINK1、Parkin、MFN1、抗体(美国Abcam公司);DRP1抗体(南京恩晶生物公司);LC3Ⅰ/Ⅱ抗体(美国CST公司);β-Actin抗体(北京中杉金桥);山羊抗兔、小鼠IgG(美国Santa Cruz公司);MDC试剂盒(美国Thermo Fisher公司);DCFH-DA活性氧染料(美国Sigma公司);JC-1荧光探针(上海碧云天公司)。
1.1.5 主要仪器Galaxy 170S型二氧化碳培养箱(德国Eppendorf公司);A2-4S1级2型生物安全柜(新加坡ESCO公司);超低温冰箱(日本松下公司);电泳槽,转膜槽(美国BIO-RAD公司);流式细胞仪(美国BIO-RAD公司);荧光倒置显微镜(日本Olympus公司)。
1.2 方法 1.2.1 药物的配制蛇床子素用二甲亚砜配制成320 g·L-1的母液备用,使用前用培养基稀释至所需浓度。
1.2.2 细胞培养将人宫颈癌HeLa细胞培养于含10 %FBS的DMEM培养基中,放置于37 ℃含5% CO2的培养箱中培养,待细胞密度达80%~90%时,使用0.25%胰蛋白酶和0.5 mmol·L-1 EDTA的混合液消化传代1次,取对数生长期细胞进行实验。
1.2.3 MTT检测细胞活力将处于对数生长期的HeLa细胞,胰酶消化后,加入适当的培养基制成细胞悬液,利用细胞计数仪计量细胞悬液中的细胞密度。调整细胞密度为5×103个/孔,接种于96孔板中,置于37 ℃,5% CO2培养箱中培养。过夜贴壁后,过夜贴壁后,设置空白对照组(0,即Control,Ctrl),不同浓度蛇床子素处理组(10、20、40、80、160、240、320 mg·L-1),空白对照组加入等体积培养基,每组浓度设6个复孔。经药物处理,置于37 ℃,5% CO2培养箱中分别培养6、12和18 h后,每孔加入20 μL MTT。继续培养4 h后,弃上清,每孔加入150 μL DMSO溶液,用枪吹打使结晶溶解,混匀。在490 nm波长处测吸光度(OD),用以下公式计算HeLa细胞的抑制率:
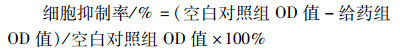
|
将HeLa细胞传代分为正常组与蛇床子素干预组,干预24 h后收集细胞沉淀,使用3%戊二醛溶液固定细胞,经渗透包埋、切片、染色等步骤制备透射电镜样品,将两组细胞样品置于透射电镜观察细胞形态差异。
1.2.5 MDC荧光染色检测自噬体形成将HeLa细胞传代至6孔板中,保持一定密度后待其贴壁加入80 mg·L-1蛇床子素处理。干预24 h后弃去培养基,用PBS洗涤,将提前配置好的MDC试剂按5×10-5 mol·L-1浓度加入六孔板中,室温避光染色15 min后用PBS洗涤,在荧光倒置显微镜下观察荧光。
1.2.6 流式细胞术MDC检测自噬将HeLa细胞传代至7 cm皿中,用80 mg·L-1浓度的蛇床子素分别干预0、6、12、18 h。处理完毕后PBS洗涤,用0.25%胰酶消化至15 mL离心管中离心,再各加入1 mL PBS重悬细胞洗涤,吸去上清液后,细胞沉淀置于1.5 mL Ep管中。各Ep管中加入0.3 mL PBS,然后均加入浓度为5×10-5 mol·L-1 MDC染色,室温避光染色15 min,PBS洗涤重悬,过300目筛上机检测。
1.2.7 流式细胞术JC-1法检测线粒体膜电位将HeLa细胞传代至7 cm皿中,用80 mg·L-1浓度的蛇床子素分别干预0 h、6 h、12 h、18 h。处理完毕后PBS洗涤,用0.25%胰酶消化至15 mL离心管中离心,再各加入1 mL PBS重悬细胞洗涤,吸去上清液后细胞沉淀置于1.5 mL Ep管中。各Ep管中加入0.3 mL PBS,然后均加入浓度为0.5 μmol·L-1的JC-1荧光探针避光染色20 min,PBS洗涤重悬,过300目筛上机检测。
1.2.8 流式细胞术DCFH-DA检测ROS将HeLa细胞传代至7 cm皿中,一组用80 mg·L-1浓度的蛇床子素分别干预0、6、12、18 h;另一组使用3-MA自噬抑制剂预处理。处理完毕后PBS洗涤,用0.25 %胰酶消化至15 mL离心管中离心,再各加入1 mL PBS重悬细胞洗涤,吸去上清液后细胞沉淀置于1.5 mL Ep管中。各Ep管中加入0.3 mL PBS,然后均加入浓度为2×10-6 mol·L-1 ROS探针DCFH-DA,室温避光染色25 min,PBS洗涤重悬,过300目筛上机检测。
1.2.9 建立裸鼠宫颈癌体内移植瘤模型取4周龄的BALB/c裸鼠20只。将对数生长期的细胞用0.25%的胰酶消化,按照4×107个/L的细胞量悬浮于PBS中。在裸鼠右上肢皮下注射0.2 mL细胞悬液,使用游标卡尺测量肿瘤直径,待瘤子长成100 mm3后进行分组。裸鼠分为宫颈癌模型组、蛇床子素低剂量组(75 mg·kg-1·d-1)、蛇床子素高剂量组(150 mg·kg-1·d-1)、顺铂阳性药对照组(5 mg·kg-1·d-1),给药方式为腹腔注射。定时记录体质量、瘤组织大小并观察裸鼠状态。给药21 d后,处死裸鼠,剥离瘤组织称质量。将瘤组织过液氮后放入-80 ℃冰箱保存,以备提取蛋白。
1.2.10 Western blot检测蛋白表达将HeLa细胞传代至7 cm皿中,用80 mg·L-1浓度的蛇床子素分别干预0、6、12、18 h。处理完毕后收集细胞沉淀,加入蛋白裂解液,0~4 ℃裂解30 min,放入高速冷冻离心机离心,4 ℃,12 000 r·min-1离心20 min。将细胞样品与瘤组织样品通过BCA试剂盒进行蛋白定量。配制凝胶进行电泳、转膜,再封闭,敷上相应一抗过夜,二抗孵育后ECL化学发光显色。利用Image Lab软件分析灰度值并进行统计学分析。
1.2.11 统计学方法采用SPSS 18.0版软件进行数据分析,并通过单因素方差分析对数据进行统计学处理,两组间比较用t检验,数据用x±s表示。
2 结果 2.1 蛇床子素对宫颈癌HeLa细胞增殖的抑制作用MTT法检测不同浓度蛇床子素对HeLa细胞活力的影响。Fig 1结果表明,随药物浓度与干预时间的增加,HeLa细胞活力逐渐降低,且呈现浓度与时间依赖性(P < 0.01)。根据MTT结果以及IC50值78.24 mg·L-1,选取蛇床子素浓度为80 mg·L-1分别处理HeLa细胞6、12和18 h进行后续实验。
|
| Fig 1 Inhibition of osthole on proliferation of cervical cancer HeLa cells(x±s, n=6) **P < 0.01 vs Ctrl |
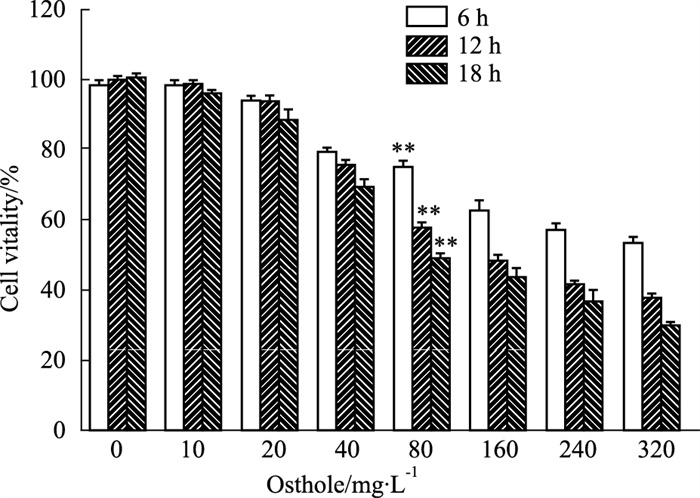
通过透射电镜观察细胞发现,对照组细胞细胞膜完整,细胞器形态正常。蛇床子素干预组则在视野内呈暗色,部分线粒体中空,仅外膜残留;溶酶体异常聚集,呈现多膜样结构;有大量的自噬小体形成。荧光倒置显微镜下观察经MDC染色的两组细胞,对照组荧光较弱,细胞数量较多;蛇床子素干预组则细胞数量较少,且MDC的荧光强度明显增强,这表明有自噬体形成(Fig 2 A~F)。流式细胞术结果显示,随蛇床子素干预时间增加,MDC的荧光强度增强,各组与空白对照组差异有显著性(P < 0.05)(Fig 2G和H)。结果说明,蛇床子素诱导HeLa细胞自噬体产生并引发自噬。
|
| Fig 2 Osthole induced autophagy in HeLa cells with increasing intervention time *P < 0.05, **P < 0.01 vs Ctrl |
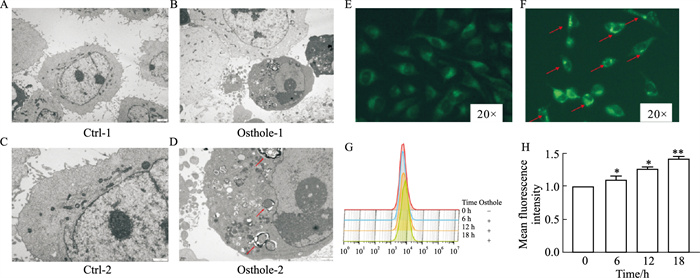
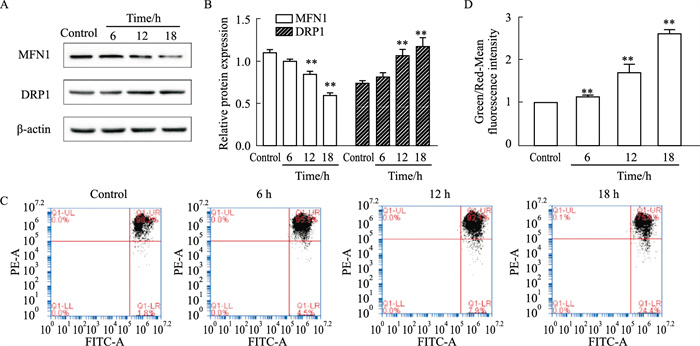
蛇床子素引起HeLa细胞自噬可能与诱导线粒体损伤有关。Western blot结果显示,随蛇床子素干预时间增加,线粒体融合蛋白MFN1表达下调,分裂蛋白DRP1表达上调,这表明线粒体融合程度减少,分裂程度增加,损伤加重。为了进一步说明线粒体损伤情况,我们使用线粒体膜电位检测试剂盒(JC-1)来检测线粒体膜电位变化。JC-1是检测线粒体膜电位变化的理想荧光探针,膜电位较高时,JC-1荧光探针聚集在线粒体基质中,呈红色荧光;膜电位较低时,JC-1以单体存在于胞浆中,产生绿色荧光。流式细胞术结果显示,随蛇床子素干预时间增加,红色荧光减弱,绿色荧光增强,说明线粒体膜电位持续降低,损伤逐步加重。因此,蛇床子素诱导的HeLa细胞自噬与线粒体损伤有关(Fig 3)。
|
| Fig 3 Osthole induced mitochondrial damage in HeLa cells **P < 0.01 vs Ctrl |
蛇床子素促进HeLa细胞自噬的机制与线粒体损伤有关,而线粒体损伤往往伴随ROS水平上升。因此,我们使用流式细胞术检测蛇床子素是否诱导HeLa细胞产生ROS。结果显示,荧光强度与干预时间成正比,且各组与空白对照组差异有显著性(P < 0.01);使用自噬抑制剂3-MA预处理后,蛇床子素诱导的ROS水平升高被逆转,且差异有显著性(P < 0.01)。这一结果表明,蛇床子素诱导HeLa细胞产生ROS,是通过诱导HeLa细胞发生自噬导致线粒体损伤而产生的(Fig 4)。
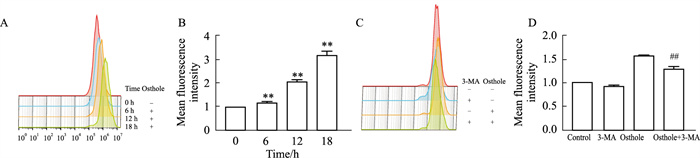
|
| Fig 4 Osthole promoted ROS production in HeLa cells **P < 0.01 vs Ctrl; ##P < 0.01 vs Osthole |
线粒体损伤与线粒体自噬不可分割,因此我们通过检测蛇床子素对线粒体自噬相关因子的影响,来进一步判定蛇床子素诱导HeLa细胞发生的自噬是否为线粒体自噬。Western blot测定线粒体自噬关键因子PINK1、Parkin和LC3Ⅱ/Ⅰ蛋白表达。结果显示,与空白对照组相比,PINK1、Parkin的表达增加,LC3Ⅱ/Ⅰ比值也增加。上述结果表明,蛇床子素诱导HeLa细胞发生线粒体自噬并且与PINK1-Parkin通路有关(Fig 5)。
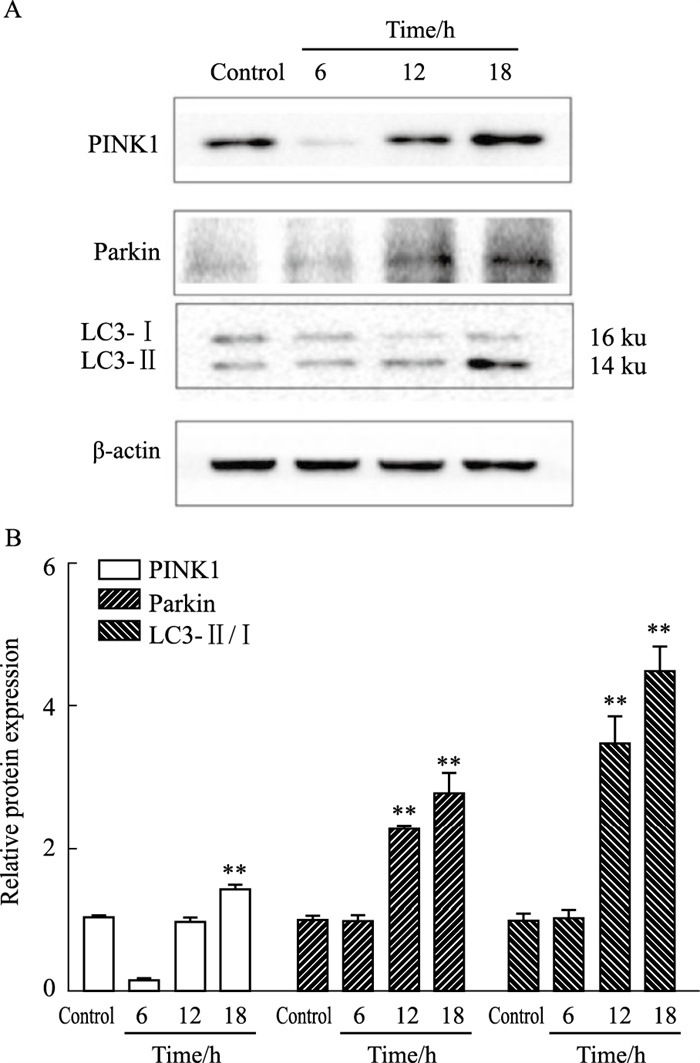
|
| Fig 5 Effects of osthole on expression of PINK1, Parkin and LC3Ⅰ/Ⅱproteins related to mitochondrial autophagy **P < 0.01 vs Ctrl |
上述体外实验结果表明,蛇床子素能够抑制HeLa细胞增殖,并且诱导了线粒体自噬。为了进一步探讨蛇床子素对宫颈癌的作用,建立了裸鼠宫颈癌移植瘤模型,并分为正常对照组、蛇床子素低剂量组、蛇床子素高剂量组和顺铂阳性药组。由肿瘤生长曲线、肿瘤质量和裸鼠外观(Fig 6A-D)可知,对照组与给药组差异有显著性(P < 0.01),蛇床子素能明显抑制裸鼠体内移植瘤的生长。此外,我们检测了裸鼠移植瘤组织中线粒体自噬相关因子的表达,结果表明,蛇床子素给药组中,线粒体自噬关键因子PINK1和Parkin的表达升高,LC3Ⅱ/Ⅰ的比值也升高(Fig 6E和F)。上述结果表明,蛇床子素在裸鼠移植瘤中诱导了线粒体自噬。
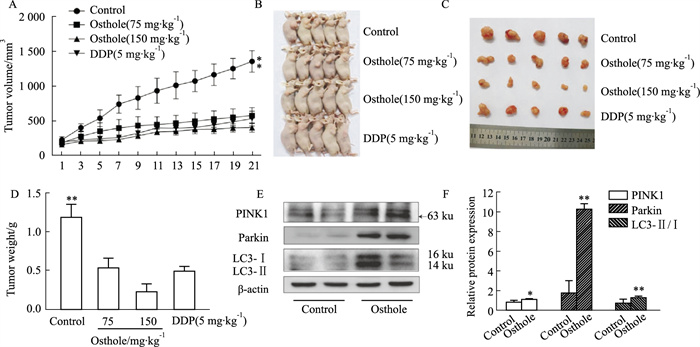
|
| Fig 6 Inhibitory effect of osthole on transplanted cervical cancer *P < 0.05, **P < 0.01 vs Control |
宫颈癌作为最常见的妇科肿瘤,其发病率与死亡率均威胁女性健康[9]。目前使用常规化疗药物治疗癌症有许多弊端,例如毒副作用大,易耐药等。而由于天然药物低毒性,多靶点的特点,使天然药物抗肿瘤活性的研究日渐成为热点。蛇床子素是一种具有抗炎、抗凋亡、抗肿瘤、抗细菌、抗过敏、抗骨质疏松等功效的香豆素衍生物[10],因其明显的抗肿瘤活性引起学术界广泛关注[11-13]。在本研究中我们探讨了蛇床子素对宫颈癌的治疗作用,研究蛇床子素对宫颈癌HeLa细胞的毒性作用。发现蛇床子素对HeLa细胞的增殖与活力具有抑制作用,并呈现时间与浓度依赖性。
自噬诱导可以触发细胞程序性死亡,是一种不依赖胱天蛋白酶的形式,肿瘤细胞脱离药物环境后,会产生受损的细胞器或蛋白质,自噬若超过细胞可承受的范围就会导致肿瘤细胞死亡[14]。自噬在不同类型、不同状态的肿瘤中呈现出的不同的作用机制。一方面,肿瘤细胞处于不利环境中,轻度自噬可以提高肿瘤细胞对应激的耐受能力;另一方面,自噬可以抑制肿瘤生长或转移,甚至成为某些凋亡缺陷肿瘤细胞的死亡途径,是把“双刃剑”,而药物引起的自噬多数是引起死亡。调控自噬已成为肿瘤治疗的重要手段。本研究使用透射电镜观察HeLa细胞空白对照组与蛇床子素给药组。结果显示,蛇床子素能使HeLa细胞产生自噬小体,并使部分细胞器损伤。利用单丹磺酰尸胺(monodansylcadaverine,MDC)染色和流式细胞术检测荧光强度,结果表明蛇床子素能够诱导HeLa细胞自噬,使HeLa细胞发生程序性死亡。
自噬具有多种类型,而线粒体自噬是自噬的主要类型。哺乳动物线粒体中有丝分裂素Mfn1和Mfn2在3个不同的分子复合物中发挥作用,保持线粒体稳态。如果表达下调,线粒体发生自噬受损会促使细胞死亡[15]。在癌症细胞中,受损线粒体会导致ROS的大量产生[16]。Western blot检测线粒体相关蛋白结果显示,蛇床子素使宫颈癌HeLa细胞的线粒体融合蛋白MFN1表达下调,线粒体分裂蛋白DRP1表达上调,提示线粒体动力学发生变化,即应激水平升高,融合程度减少,分裂增多,线粒体发生损伤。JC-1线粒体膜电位结果显示,红色荧光减弱,绿色荧光增强,线粒体膜电位下降。流式细胞术检测结果显示随蛇床子素浓度升高,活性氧ROS水平上升;再使用自噬抑制剂3-MA预处理细胞后,再加入蛇床子素干预,结果显示蛇床子素诱导的ROS上升被逆转,提示抑制自噬后,ROS水平也随之下降。表明蛇床子素使环境内ROS水平上升,诱导了线粒体自噬受损。PINK与Parkin能协同识别损伤的线粒体,此过程中泛素化酶和去泛素化酶对维持Parkin活性及线粒体自噬的效率有重要作用。Parkin泛素化线粒体外膜蛋白会引发线粒体自噬,利用自噬清除目标器官[17],肿瘤细胞随之发生死亡。PINK1/Parkin通路是研究最广泛的线粒体自噬途径[18]。免疫印迹实验结果显示,随加药时间增加,LC3Ⅱ/Ⅰ的比值上升,而LC3Ⅰ到LC3Ⅱ的转化是自噬激活的证明;线粒体自噬相关因子PINK1和Parkin的表达也增加。裸鼠体内宫颈癌移植瘤模型实验结果发现,蛇床子素具有抑制肿瘤生长的作用,LC3Ⅱ/Ⅰ的比值上升,线粒体自噬相关因子PINK1和Parkin的表达增加。以上结果表明,蛇床子素诱导HeLa细胞线粒体损伤后自噬发生,且其诱导的线粒体自噬与PINK1/Parkin信号通路活化有关。
综上所述,本研究的结果表明,蛇床子素对HeLa细胞的增殖有抑制作用,并能够促使细胞死亡,在此诱导过程中使线粒体受损,线粒体自噬发生,其机制与线粒体PINK1 /Parkin信号通路中PINK1和Parkin的活化有关。蛇床子素诱导宫颈癌HeLa细胞自噬可促进肿瘤细胞死亡,或作为辅助药物与其他抗肿瘤药物联用增强疗效,降低耐药性,为治疗宫颈癌提供新思路。但本研究未探明蛇床子素干预HeLa细胞的过程中是否存在其它的死亡形式,仍需进一步探究。
| [1] |
Zhang Y, Zhao Y, Ran Y, e t. Alantolactone exhibits selective antitumor effects in HeLa human cervical cancer cells by inhibiting cell migrati-on and invasion, G2/M cell cycle arrest, mitochondrial mediated apoptosis and targeting NF-κB signalling pathway[J]. J BUON, 2019, 24(6): 2310-5. |
| [2] |
田宜畅, 张颐. 宫颈癌的诊断与治疗进展[J]. 北京医学, 2019, 41(12): 1098-100, 1103. Tian Y C, Zhang Y. Progress in diagnosis and treatment of cervical cancer[J]. Beijing Med J, 2019, 41(12): 1098-100, 1103. doi:10.15932/j.0253-9713.2019.12.011 |
| [3] |
李忠, 赵轶伦, 林振平, 等. 无偿献血动机评价量表的编制与修订[J]. 中国输血杂志, 2017, 30(2): 164-7. Li Z, Zhao Y L, Lin Z P, et al. Compilation and revision of motivation evaluation scale for voluntary blood donation[J]. Chin J Blood Transfus, 2017, 30(2): 164-7. |
| [4] |
Vu M, Yu J, Awolude O A, et al. Cervical cancer worldwide[J]. Curr Probl Cancer, 2018, 42(5): 457-65. doi:10.1016/j.currproblcancer.2018.06.003 |
| [5] |
Gan H, Qi M, Chan C, et al. Digitoxin inhibits HeLa cell growth through the induction of G2/M cell cycle arrest and apoptosis in vitro and in vivo[J]. Int J Oncol, 2020, 57(2): 562-73. doi:10.3892/ijo.2020.5070 |
| [6] |
You L, Feng S, an R, et al. Osthole: A promising lead compound for drug discovery from a Traditional Chinese Medicine (TCM)[J]. Nat Prod Commun, 2009, 4(2): 297-302. |
| [7] |
Lu B, Gong X, Wang Z Q, et al. Shikonin induces glioma cell necroptosisin vitro by ROS overproduction and promoting RIP1/RIP3 necrosomeformation[J]. Acta Pharmacol Sin, 2017, 38(11): 1543-53. doi:10.1038/aps.2017.112 |
| [8] |
Mowers E E, Sharifi M N, Macleod K F. Functions of autophagy in the tumor microenvironment and cancer metastasis[J]. FEBS J, 2018, 285(10): 1751-66. doi:10.1111/febs.14388 |
| [9] |
刘柳, 石正芬, 杨炳. 早期宫颈癌手术治疗研究进展与分析[J]. 四川医学, 2021, 42(10): 1050-4. Liu L, Shi Z F, Yang B. Progress and analysis of surgical treatment of early cervical cancer[J]. Sichuan Med J, 2021, 42(10): 1050-4. |
| [10] |
Zimecki M, Artym J, Cisowski W, et al. Immunomodulatory and anti-inflammatory activity of selected Osthole derivatives[J]. Z Naturforsch C J Biosci, 2009, 64(5-6): 361-8. doi:10.1515/znc-2009-5-610 |
| [11] |
Jiang G, Liu J, Ren B, et al. Anti-tumor effects of Osthole on ovarian cancer cells in vitro[J]. Ethnopharmacol, 2016, 193: 368-76. doi:10.1016/j.jep.2016.08.045 |
| [12] |
Zhu X, Song X, Xie K, et al. Osthole induces apoptosis and suppresses proliferation via the PI3K/Akt pathway in intrahepatic cholangiocarcinoma[J]. Mol Med, 2017, 40(4): 1143-51. |
| [13] |
Xu X, Zhang Y, Qu D, et al. Osthole induces G2/M arrest and apoptosis in lung cancer A549 cells by modulating PI3K/Akt pathway[J]. Exp Clin Cancer Res, 2011, 30(1): 33-40. doi:10.1186/1756-9966-30-33 |
| [14] |
范守仁, 吴淑华, 李扬扬, 等. 结直肠癌中LC3与不同表型肿瘤相关巨噬细胞的相关性及其临床意义[J]. 中国癌症杂志, 2020, 30(11): 849-57. Fan S R, Wu S H, Li Y Y, et al. Correlation between LC3 and different phenotypes of tumor-associated macrophages in colorectal cancer and its clinical significance[J]. Chin Oncol, 2020, 30(11): 849-57. |
| [15] |
Chen H, Detmer SA, Ewald AJ, et al. Mitofusins Mfn1 and Mfn2 coordinately regulate mitochondrial fusion and are essential for embryonic development[J]. Cell Biol, 2003, 160(2): 189-200. |
| [16] |
Florean C, Song S, Dicato M, et al. Redox biology of regulated cell death in cancer: A focus on necroptosis and ferroptosis[J]. Free Radic Biol Med, 2019, 134: 177-89. |
| [17] |
邓婕, 李怡芳, 栗原博, 等. 线粒体损伤与修复在帕金森病中的作用[J]. 中国药理学通报, 2015, 31(7): 906-10. Deng J, Li Y F, Li Y B, et al. The role of mitochondrial damage and repair in PD[J]. Chin Pharmacol Bull, 2015, 31(7): 906-10. |
| [18] |
郎秀娟, 王燕. PINK1/parkin通路调控线粒体自噬机制的研究进展[J]. 微生物与感染, 2018, 13(2): 102-6. Lang X J, Wang Y. Research progress of PINK1/ Parkin pathway regulating mitochondrial autophagy[J]. J Microbes Infect, 2018, 13(2): 102-6. |

