


2. 中南大学湘雅三医院临床药理中心,湖南 长沙 410013
刘世坤(1963-), 男, 博士,教授,研究方向: 心血管药理学,通信作者,E-mail: l8618496@126.com
 ,
FAN Zhi-qiang1,
GONG Hui1,
LIU Rui-jiao1,
SONG Li-ying1,2,
WANG Chun-jiang1,2
,
FAN Zhi-qiang1,
GONG Hui1,
LIU Rui-jiao1,
SONG Li-ying1,2,
WANG Chun-jiang1,2
 ,
LIU Shi-kun1,2
,
LIU Shi-kun1,2

2. Center of Clinical Pharmacology, The Third Xiangya Hospital, Central South University, Changsha 410013, China
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)在成年人群中的发病率达30%,在肥胖和糖尿病人群中达70%~80%[1]。NAFLD的病理过程可从初期的肝内脂肪堆积延续至非酒精性脂肪性肝炎,此时,可观察到明显的肝细胞炎症和死亡,进而肝纤维化、肝硬化及肝细胞癌,其中肝纤维化在决定患者预后方面起重要作用。
肝脏是体内合成脂质的重要组织,不管是血浆中非酯化的游离脂肪酸,还是从头合成的脂肪酸均可在肝脏中用于脂质合成。肝内过量的脂质堆积开启了NAFLD进程。各种病理和生理因素导致肝脏脂肪酸氧化或脂质输出能力较低,或合成能力增强,均造成脂质在肝脏中过度堆积,进而诱导肝细胞氧化应激和炎症等。过氧化物酶体增殖体受体α(peroxisome proliferator-activated receptor alpha,PPARα)是调控脂质代谢的重要转录因子,它和其辅激活因子PGC-1α共同参与脂肪酸摄取、转运、β氧化、脂质合成、酮体生成和脂蛋白与胆固醇代谢等过程。大量研究报道,NAFLD小鼠肝脏中PPARα及其下游靶基因肉毒碱棕榈酰转移酶(carnitine palmitoyltransferase1,CPT1)、脂肪酸结合蛋白(fatty acid-binding protein,FABP1)等蛋白表达和活性明显降低[2],激动PPARα可减少氧化应激以及白细胞介素-6 (interleukin- 6)、肿瘤坏死因子(tumor necrosis factor α)等炎症因子释放,甚至增加脂质自噬(lipophagy)以减少肝脏脂肪堆积,改善NAFLD[3]。PGC-1α也可以通过调控ROS生成,激活PPARα和PPARγ,以保护肝脏免受缺血/再灌注损伤[4]。最新研究发现,溶酶体可调控PPARα,并在脂质代谢以及NAFLD发生发展中起调控作用[5]。使用PPARα激动剂非诺贝特促进溶酶体生物合成调控因子转录因子EB(TFEB)表达,诱导自噬,减少肝脏脂肪堆积[6]。在AML12肝细胞使用溶酶体抑制剂或敲除TFEB可明显抑制过氧化物酶体的合成,特别是抑制PPARα及其辅激活因子PGC-1α的蛋白表达,其下游靶点酰基辅酶A氧化酶1(acox1) 和Cpt1a的基因转录和蛋白表达也明显降低[7]。但溶酶体调控PPARα介导NAFLD的具体机制尚不清楚。
酸性鞘磷脂酶(acid sphingomyelinase,ASMase)是一种广泛存在的细胞溶酶体酶,可水解细胞膜的鞘磷脂(sphingomyelin,SM)生成磷酸胆碱和神经酰胺,形成富含神经酰胺的脂筏介导信号转导。大量研究已证实,ASMase参与血栓形成、细胞死亡、血管钙化平滑肌增殖等多种病理过程,并与NAFLD[8]、糖尿病、心肌梗死等密切相关,但ASMase介导NAFLD的机制尚不清楚。因此,本研究拟在动物实验中观察ASMase是否通过调控PPARα相关通路以促进NAFLD发生发展,这对明确NAFLD发病机制及治疗靶点具体有重要意义。
1 材料与方法 1.1 动物构建基于C57BL/6背景的ASMaseKO小鼠,许可证号:SCXK(苏)2018-0003。为了扩大种群将获得的ASMaseKO小鼠与购自中南大学实验动物中心的野生型(wild type,WT),许可证号:SCXK(湘)2019-0004小鼠进行杂交,获得封闭群,经基因测序后,杂合子(ASMase+/-)以及WT小鼠用于制备本实验NAFLD模型。保障饲料和饮水供应,饲养温度恒定为25 ℃,相对湿度为50%左右,实验过程中关于动物的使用符合中南大学动物伦理委员会的相关规定。
1.2 主要试剂和仪器兔抗鼠ASMase(#3687)、PGC-1α(#2178)、CPT1A (#97361)和GAPDH(#5174)多克隆抗体购自美国Cell Signaling Technology (CST)公司;兔抗鼠PPARα(#ab215270)多克隆抗体购自美国Abcam公司;谷氨酸转氨酶(alanine aminotransferase,ALT,#C009-3-1)、天冬氨酸转氨酶(aspartate aminotransferase,AST,C010-3-1),血清和肝脏组织中甘油三酯(TG,#A110-2-1)、总胆固醇(TC,#A111-2-1)、低密度脂蛋白(LDL-C,#A113-22-1)和高密度脂蛋白(HDL-C,#A112-2-1)等血脂相关试剂盒购自南京建成生物工程研究所;RIPA裂解液(#P0013B)、BCA蛋白浓度测定试剂盒(#P0012S)、超敏ECL化学发光试剂盒(#P0018FM),MnSOD活性检测试剂盒(WST-8法,#S0103),脂质氧化(MDA,#S0131S)检测试剂盒及ATP检测试剂盒(#S0026)均购自碧云天生物技术研究所;其余试剂均为国产分析纯。OneTouch血糖仪购自强生(中国)医疗器材有限公司;Operetta高内涵成像系统购自美国Perkin Elmer公司;BIO-RAD 164-5050电泳仪、IMark酶标仪购自美国BIO-RAD公司;Axio生物显微镜购自德国Carl Zeiss公司。
1.3 方法 1.3.1 NAFLD模型制备及分组从方法2.1动物中选取封闭群6~8周龄雄性杂合子和WT小鼠,共分为4组,分别是野生型正常饮食对照组(WT+Chow,n=3):给予正常基础饲料饲养12周;野生型高脂饮食组(WT+HFD,n=3):给予高脂饲料(猪油10%,蛋黄粉10%,胆固醇1%,胆酸盐0.125%,基础饲料79%,购自广东省实验动物中心)饲养12周;ASMase杂合子正常饮食组(ASMase+/-+Chow,n=6):给予正常基础饲料饲养12周;ASMase杂合子高脂饮食组(ASMase+/-+HFD,n=6):给予高脂饲料饲养12周;每周称量体重,实验结束后收集血清和肝脏组织进行生化测定以及病理检测。
1.3.2 肝功能以及血脂水平测定根据已发表文献[9]中的方法进行实验。反映肝功能的指标ALT、AST和各组小鼠血脂含量包括总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)和低密度脂蛋白(low density lipoprotein,LDL)的测定均参照试剂盒的方法进行。采用固醇氧化酶-过氧化物酶-4-氨基安替比林和酚法(CHOD-PAP法)检测TC,采用甘油磷酸氧化酶-过氧化物酶-4-氨基安替比林和酚法(GPO-PAP法)检测TG,采用磷钨酸镁沉淀法(PTA-Mg2+)和聚乙烯硫酸沉淀法(PVS法)检测LDL,直接法-选择抑制法检测HDL-C。
1.3.3 肝脏脂质含量测定取各组小鼠肝脏30 mg,依照南京建成生物工程研究所提供的试剂盒说明书检测肝脏中TG、TC的含量。
1.3.4 肝脏组织SOD活性和MDA含量测定各组样本经相应处理后,依据碧云天生物技术研究所提供的试剂盒检测说明书检测超氧化物歧化酶(superoxide dismutase,SOD)活性及丙二醛(malondialdehyde,MDA)的含量。
1.3.5 油红染色、苏木精-伊红染色(HE)、Masson染色和天狼星红染色根据已发表文献中的[9]方法进行实验。从甲醛固定液中取出肝脏,先依次放入70%~95%等不同浓度梯度的乙醇中脱水,经二甲笨透明30 min后开始浸蜡、包埋,最后进行厚度3 μm切片。切片经脱蜡至水后,分别进行肝脏组织的油红染色、HE染色、Masson染色和天狼星红染色。肝脏病理组织学改变参照《非酒精性脂肪性肝病与相关代谢紊乱诊疗共识(第二版)》中推荐的美国国立卫生院NASH临床研究网病理工作组指南常规进行的NAFLD活动度积分(NAS)评定和肝纤维化评分,其中脂肪变性(0~3分)、肝小叶炎症(0~3分),气球样变性(0~2分),NAS总分0~8分。同时采用ImageJ软件计算油红染色面积。
1.3.6 ASMase活性测定根据已发表文献[10]中的方法进行实验。采用AmplexTM Red Sphingomyelinase(Thermo Fisher Scientific,美国)试剂盒检测ASMase活性;每组称取50 mg肝组织,加入1 mL含50 mmol·L-1乙酸钠(pH 5.0)的裂解液后进行匀浆,4 ℃,12 000 r·min-1离心30 min,留上清;各取100 μL上清液至96孔板中,以裂解液作为阴性对照,以0.4 kU·L-1鞘磷脂酶溶液作阳性对照。每孔加入10 μL 5 mmol·L-1的鞘磷脂溶液,37 ℃孵育1 h。按说明书制备并加入每孔100 μL工作液,避光孵育30 min后,用酶标仪在530-560 nm内激发,在590 nm处发射波长检测荧光值。
1.3.7 Western blot检测肝脏组织蛋白表达采用Western blot检测各组小鼠肝脏中蛋白表达情况;取小鼠肝脏组织各30 mg,剪碎,加入9倍体积RIPA裂解液,冰上机械匀浆,4 ℃离心12 000 r·min-1,10 min,取上清测蛋白含量;每个样本取30 μg蛋白,经十二烷基硫酸钠-聚丙烯酰氨凝胶(SDS-PAGE)电泳分离蛋白,电转至聚偏氟乙烯膜(PVDF膜)上,脱脂奶粉室温封闭1 h,一抗4 ℃摇晃过夜,加辣根过氧化酶(HRP)标记二抗室温孵育2 h,最后进行ECL化学发光法显色,经凝胶成像系统(Chemi DocTM XRS+system,Bio-RAD)扫描后进行图像数据分析。
1.3.8 统计学分析用Sigmaplot 12.5统计软件进行分析并作图。数据用x±s表示,统计学分析采用方差分析和Newman-Keuls检验比较组间差异。
2 结果 2.1 ASMase+/-小鼠肝脏中ASMase活性明显降低ASMase杂合子(ASMase+/-)小鼠的基因测序结果及野生型对照如Fig 1A所示。为进一步观察高脂饮食的作用,检测了各组小鼠ASMase蛋白表达及活性的变化情况,结果如Fig 1B~D所示,高脂饲养12周明显增加野生型小鼠肝脏中ASMase蛋白表达和活性(Fig 1B, C,P < 0.01)。有趣的是,ASMase+/-+Chow组小鼠肝脏ASMase蛋白表达较WT+Chow组明显增加(P=0.023);ASMase+/-+HFD组小鼠肝脏蛋白表达较WT+HFD组小鼠明显降低(P < 0.01)。在活性变化方面,ASMase+/-+HFD和ASMase+/-+Chow组小鼠肝脏ASMase活性分别较WT+HFD和WT+Chow组明显降低(Fig 1B,P < 0.01),这提示ASMase杂合子在正常饮食状态下,肝脏中存在反馈机制增加ASMase蛋白表达,这种反馈机制在脂代谢紊乱时的影响降低,但是无论正常饮食或高脂饮食下,ASMase杂合子均降低肝脏中ASMase活性。
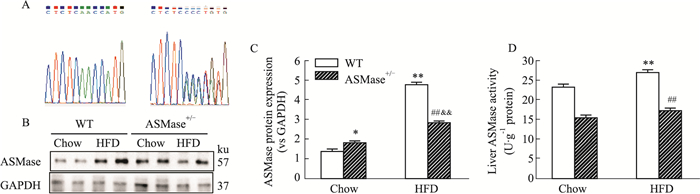
|
| Fig 1 Partial knockout of ASMase significantly dampened ASMase activity in mouse liver A: The diagram of gene sequencing for wild type and heterozygous mice; B, C: ASMase protein levels was detected by Western blot. GAPDH was served as loading control. Data are expressed as x±s of three independent measurements; D: ASMase activity was detected by AmplexTM Red Sphingomyelinase kit. *P < 0.05, **P < 0.01 vs WT+Chow; ##P < 0.01 vs WT+HFD; &&P < 0.01 vs ASMase+/-+Chow. |
肝脏内过度的脂质堆积是NAFLD的重要病理特征,也是导致疾病进展的重要病因。本研究观察了高脂饲养以及ASMase杂合子对小鼠肝脏脂肪堆积以及全身脂质代谢的影响。结果如Fig 2所示,与WT+Chow比较,WT+HFD组小鼠血清中TG水平无明显增加(Fig 2A),但肝脏中TG含量明显增加(Fig 2B,P < 0.01);ASMase+/-小鼠无论在正常或高脂饲养状态下,对血清TG水平均无明显影响;但明显降低肝脏中TG含量(Fig 2B,P < 0.01)。与TG不同的是,与WT+Chow比较,WT+HFD组小鼠血清TC水平明显增加(Fig 2C,P < 0.01),但肝脏中TC水平无明显变化。ASMase+/-小鼠对高脂状态下升高的血清TC水平无影响。
| Group | n | Hepatic steatosis | Intralobular inflammation | Ballooning degeneration | Total score |
| WT+Chow | 3 | 0.12±0.03 | 0.10±0.06 | 0.04±0.00 | 0.25±0.08 |
| WT+HFD | 3 | 2.94±0.12 | 2.03±0.15 | 1.68±0.19 | 6.87±0.42** |
| ASMase+/-+Chow | 6 | 0.10±0.04 | 0.09±0.04 | 0.05±0.01 | 0.23±0.09 |
| ASMase+/-+HFD | 6 | 1.98±0.15 | 1.88±0.23 | 1.03±0.21 | 4.69±0.56# & & |
| Data are presented as x±s. **P < 0.01 vs WT+Chow; #P < 0.05 vs WT+HFD; & & P < 0.01 vs ASMase+/-+Chow. | |||||

|
| Fig 2 Effects of ASMase on lipid metabolism in high-HFD fed mice Biochemical measurement was performed by described as manipulation instructions to detect serum TG (A), TC (C), HDL-c (E), LDL-C (F), SOD activity (I), MDA content (J), GPx activity (K) and LDH-L (L) levels. Liver TG (B) and TC (D) were also detected. (G) Oil red staining was performed to examine lipid accumulation in mouse liver fed by HFD with or without ASMase knockout. Scar bar: 50 μm.The extent of Oil red O staining (area) was measured by Image J software (H). *P < 0.05, **P < 0.01 vs WT+Chow; ##P < 0.01 vs WT+HFD; &P < 0.05, &&P < 0.01 vs ASMase+/-+Chow. |
为了确证上述结果,进一步采用油红染色观察了肝脏形态,发现高脂饲养小鼠肝脏中脂滴明显增多,ASMase+/-小鼠呈现减少的脂滴数量(Fig 2G)。此外,本研究还观察了血清中氧化还原相关指标,如SOD活性、MDA含量和GPx含量等,发现各组差异均无显著性(Fig 2H~J)。以上结果提示高脂饲养12周可导致肝脏中甘油三酯堆积,首先诱发的是高胆固醇血症;抑制ASMase活性一定程度降低高脂饲养诱导的肝脏脂肪堆积。
2.3 ASMase对高脂饲养小鼠肝功能及肝脏形态的影响肝功能异常和肝脏纤维化是中期NAFLD的重要病理表现,也是进行药物干预的重要病理阶段。因此,本部分实验观察了高脂饲养12周以及ASMase杂合子对小鼠肝功能和形态的影响。结果如Fig 3所示,与WT+Chow组比较,WT+HFD组小鼠ALT水平明显升高(Fig 3A,P < 0.05),AST水平无明显变化(Fig 3B)。相似地,与ASMase+/-+Chow组比较,ASMase+/-+HFD组小鼠ALT水平明显升高(Fig 3A,P < 0.05),AST水平无明显变化(Fig 3B);这一结果提示,抑制ASMase活性不能降低高脂饲养12周诱导升高的谷丙转氨酶。
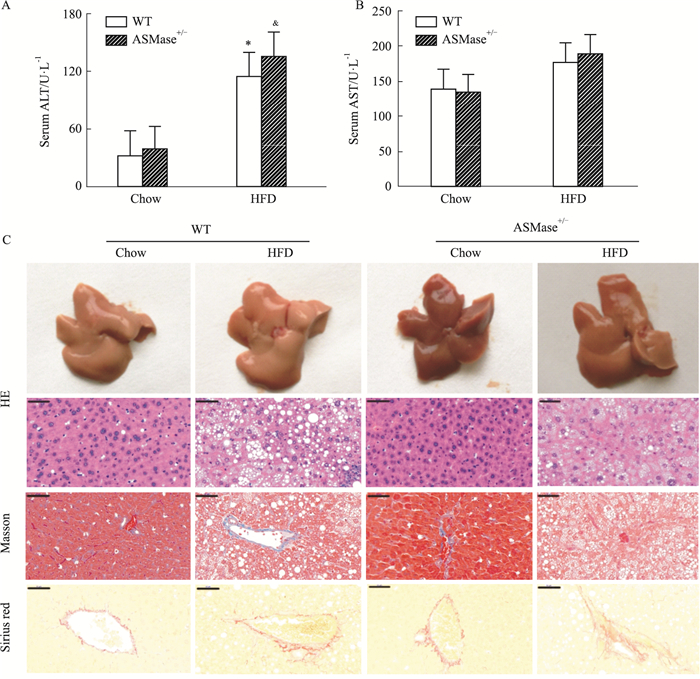
|
| Fig 3 Effects of ASMase on liver function and fibrosis in high-fat fed mice Biochemical measurement was performed by described as manipulation instructions to detect liver function as observed by ALT (A) and AST (B). HE staining was performed to observe liver morphological changes, and Masson and Sirius red staining was performed to detect liver fibrosis (C), Scar bar: 50 μm. *P < 0.05 vs WT+Chow; &P < 0.05 vs ASMase+/-+Chow. |
随后观察了肝脏形态变化。HE染色结果显示,WT+Chow小鼠肝细胞结构完整,肝小叶清晰,未见病理性组织变化,Masson和天狼星红染色结果未显示肝纤维化;WT+HFD小鼠肝细胞出现明显的脂肪变性,空泡样变明显,Masson和天狼星红染色结果显示肝纤维化;ASMase+/-小鼠表现出较轻的肝脏脂肪变性,缩小肝内脂肪堆积导致的空泡体积,但使数量增多;肝纤维化程度减轻。根据以上指标进一步完成NAS评分发现,与WT+Chow组比较,WT+HFD组小鼠NAS评分明显升高;ASMase+/-+HFD组小鼠肝脏的NAS评分较WT+HFD明显降低。综合以上结果,表明ASMase杂合子虽不能有效降低高脂饲养12周导致的肝酶升高,但一定程度减轻了高脂饲养导致的肝脏脂肪变性及结构损伤。
2.4 ASMase对NAFLD小鼠肝脏溶酶体的作用及对PPARα通路的影响CPT1是位于线粒体内膜的介导脂肪酸进入线粒体进行β氧化的限速酶,其表达上调可促进脂肪分解氧化,本研究检测了各组小鼠肝脏中CPT1蛋白表达情况,结果如Fig 4所示,与WT+Chow组比较,WT+HFD组小鼠肝脏组织中CPT1蛋白表达无明显变化(Fig 4A);ASMase+/-小鼠,无论是正常饲养还是高脂饮食饲养状态下,均可明显增加CPT1蛋白表达,表明ASMase抑制了CPT1介导的脂肪酸由胞质向线粒体转移以及后续的β氧化。为验证这一过程是否影响线粒体生物合成,本研究进一步观察了调控线粒体生物合成的重要因子PGC-1α表达变化,发现ASMase+/-小鼠肝脏中PGC-1α的蛋白表达明显上调(Fig 4A,4C)。PGC-1α除了促进线粒体生物合成外,还是PPARα的辅激活因子,PPARα在脂肪酸摄取、转运以及氧化代谢等过程中发挥重要作用,实验结果显示,高脂饲养12周对小鼠肝脏PPARα蛋白表达无明显影响;而ASMase杂合子明显提高PPARα蛋白表达(Fig 4A,4D)。以上结果提示,ASMase抑制脂肪酸氧化,并与线粒体功能以及PPARα-PGC-1α通路有关。
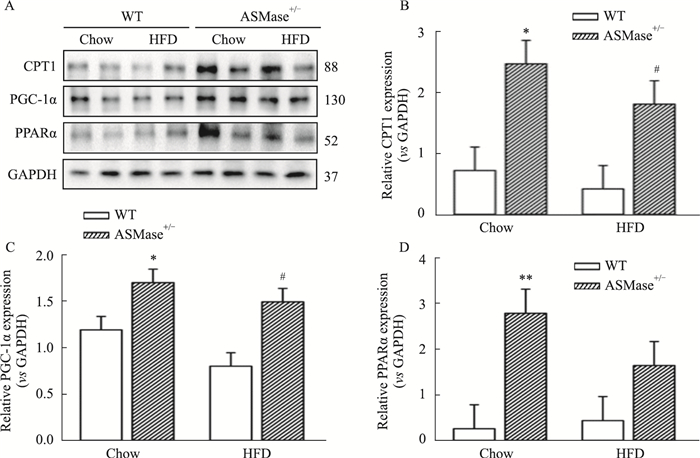
|
| Fig 4 Effects of ASMase on liver lysosomes and PPARα pathway in NAFLD mice A~D: Western blot was performed to detect protein levels of CPT1, PGC-1α and PPARα. GAPDH was served as loading control. Data are expressed as x±s of three independent measurements. *P < 0.05, **P < 0.01 vs WT+Chow; #P < 0.05 vs WT+HFD. |
本研究制备了高脂饲养的NAFLD小鼠模型,并在此基础上观察ASMase对NAFLD的作用。结果发现,高脂饲养12周小鼠出现肝功能异常、肝脏脂肪过度堆积、甚至肝纤维化;与此同时,小鼠肝脏ASMase蛋白表达和活性明显增加,表明ASMase参与NAFLD的发生发展。ASMase杂合子小鼠虽然未明显改善肝功能,但可减少脂肪在肝脏中堆积,并一定程度减轻肝纤维化,这一过程与改善线粒体摄取脂肪以及激活PPARα-PGC-1α通路有关。
本研究发现,高脂饲养12周使小鼠出现高胆固醇血症,此时血清中甘油三酯水平无明显变化。与此不同的是,高脂不仅导致小鼠肝脏中过度的胆固醇堆积,而且导致过度的肝脏甘油三酯堆积,这一发现与最近的一项研究结果相似,Heida等[11]发现,持续激活NF-κB明显增加肝脏组织中脂肪的从头合成(如棕榈酸C16 ∶1、油酸C18 ∶1,是合成TG的重要脂肪酸)和胆固醇的生物合成,但反映在血清指标上,胆固醇的合成增加不仅导致肝脏中胆固醇堆积,还导致血清中胆固醇水平明显升高,但脂质的从头合成增加并未提升血清中甘油三酯水平。还有研究发现,在血清TG正常、高胆固醇血症的母系小鼠子代更易患NAFLD及糖尿病[12],并且这种易感性可能在发育早期就被诱导,这些研究提示了高胆固醇血症与NAFLD之间的重要关系,但具体的分子机制还需更深入的研究。
油红染色结果也确证了肝内脂质过量堆积,从切片中可以看出高脂组小鼠肝脏中脂滴明显增多,且脂滴较大,基本覆盖了所有肝细胞,提示明显的脂肪性肝炎表现。此时反映肝功能的指标ALT水平明显上升,形态学检测也显示高脂导致小鼠肝细胞出现明显的脂肪变性、空泡样变,以及肝纤维化。ASMase杂合子明显降低了高脂饲养时升高的肝脏组织中TG含量。ASMase是SM的水解酶,SM作为细胞膜重要的组成部分,可与胆固醇结合成微结构域介导生理状态下的信号转导,ASMase水解SM,可能影响组织细胞中胆固醇的形式或水平;但ASMase对血清中胆固醇水平没有影响,Koka等[13]也发现,敲除ASMase抑制炎症小体激活可明显改善由高胆固醇血症诱导的动脉内皮增生增厚,但不能改善高脂小鼠的高胆固醇血症,与本研究结果相一致。ASMase杂合子未能明显改善肝功能,但是一定程度减轻了肝纤维化,尽管仍严重于正常对照组。结合观察到的ASMase杂合子减轻了高脂饲养导致的小鼠肝脏脂肪变性,缩小肝内脂肪堆积导致的空泡体积,但使数量增多,提示ASMase敲除小鼠肝脏中脂肪动员可能开始启动。
正常情况下,肝脏中用于合成脂肪的底物60%以上来自脂肪细胞分解产生入血的游离脂肪酸。在NAFLD过程中,过度的脂肪堆积同样由这些分别来自血浆中非酯化脂肪酸以及肝脏从头合成并储存在脂肪酸池中的脂肪酸为底物。脂质的从头合成(de novo lipogenesis,DNL)是导致NAFLD脂肪变性的重要因素,这个过程受诸如SERBP1、LXRα和SCD1等多种转录因子的调控[14]。然而,在研究中发现,尽管在高脂模型中抑制了脂质的从头合成,肝内脂肪堆积仍然发生[15],表明肝内脂质堆积除了受肝脏脂质合成代谢的影响,也受分解代谢的影响。PPARα是调控小鼠肝脏脂肪分解代谢的重要因子,肝脏中PPARα的表达与NASH患者中肝脂肪变性的程度呈负相关。ATGL敲除小鼠通过减少PPARα的DNA结合活性,促进蛋氨酸-胆碱缺乏(MCD)饮食介导的肝脏脂肪变性[16],提示PPARα对NAFLD的发生发展有调控作用。但是,本研究未在高脂饲养的小鼠肝脏中观察到明显降低的PPARα蛋白表达,然而这并不意味着得到了与之前研究相反的结果,最近有研究证实,PPARα作为过氧化物酶体增殖体受体,其表达和活性受过氧化物酶体微环境的直接影响,过氧化物酶体极性在高脂环境下受到损害,并随NAFLD进展而不断降低,此时,PPARα蛋白中有6个氨基酸位点因过量的ONOO-和H2O2而被硝基化和氧化修饰,导致其活性降低,其蛋白表达可能不变[17]。但无论如何,PPARα介导NAFLD的作用不容置疑。尽管未观察到野生型小鼠高脂状态下肝脏中PPARα蛋白表达的变化,但ASMase杂合子小鼠增加了正常饮食和高脂饲养状态下PPARα的蛋白表达,其辅激活因子及下游靶点PGC-1α也明显上调,表明ASMase对PPARα通路具有调控作用,而PPARα可以调控肝脏脂质代谢的中心环节,可以调控FAT/CD36介导的脂肪转运以及脂肪酸结合蛋白(L-FABP)表达,还调控β氧化限速酶,如ACOX1的表达。此外,位于线粒体内外膜的CPT-Ⅰ和CPT-Ⅱ也受PPARα的调控[18],CPT-Ⅰ在肝脏中高表达,作为脂肪酸进入线粒体进行β氧化的关键酶,直接影响脂肪分解代谢,本实验发现,ASMase杂合子小鼠在高脂状态下CPT-ⅠCPT-Ⅰ的蛋白表达明显增加,表明抑制ASMase促进了肝脏组织脂肪分解。
综上所述,ASMase促进肝脂肪变性和肝纤维化。抑制ASMase活性可减少脂肪在肝脏中堆积,并一定程度减轻肝纤维化,这一过程与改善线粒体摄取脂肪以及激活PPARα-PGC-1α通路有关。
| [1] |
Musso G, Cassader M, Gambino R. Non-alcoholic steatohepatitis: emerging molecular targets and therapeutic strategies[J]. Nat Rev Drug Discov, 2016, 15(4): 249-74. doi:10.1038/nrd.2015.3 |
| [2] |
李世英, 汪艳. 抑制线粒体丙酮酸载体通过激活AMPK-ACC通路改善棕榈酸诱导的HepG2细胞脂肪变性[J]. 中国药理学通报, 2020, 36(12): 1679-83. Li S Y, Wang Y. Inhibiting mitochondrial pyruvate carrier improved lipid accumulation in HepG2 cells treated with palmitic acid through activating AMPK-ACC pathway[J]. Chin Pharmacol Bull, 2020, 36(12): 1679-83. doi:10.3969/j.issn.1001-1978.2020.12.010 |
| [3] |
Cai M, Chen Y, Wang Y, et al. Sulfated glucuronomannan hexasaccharide G6S1 enhanced lipolysis and lipophagy via PPARα pathway[J]. Int J Biochem Cell Biol, 2021, 139: 106067. doi:10.1016/j.biocel.2021.106067 |
| [4] |
Wang C, Li Z, Zhao B, et al. PGC-1α protects against hepatic ischemia reperfusion injury by activating PPARα and PPARγ and regulating ROS production[J]. Oxid Med Cell Longev, 2021, 2021: 6677955. |
| [5] |
Song J, Liu Y, Wan J, Zhao G, et al. SIMPLE is an endosomal regulator that protects against non-alcoholic fatty liver disease by targeting the lysosomal degradation of EGFR[J]. Hepatology, 2021, 74(6): 3091-109. doi:10.1002/hep.32075 |
| [6] |
Yoo J, Jeong I-K, Ahn KJ, et al. Fenofibrate, a PPARα agonist, reduces hepatic fat accumulation through the upregulation of TFEB-mediated lipophagy[J]. Metabolism, 2021, 120: 154798. doi:10.1016/j.metabol.2021.154798 |
| [7] |
Tan H W S, Anjum B, Shen H-M, et al. Lysosomal inhibition attenuates peroxisomal gene transcription via suppression of PPARA and PPARGC1A levels[J]. Autophagy, 2019, 15(8): 1455-9. doi:10.1080/15548627.2019.1609847 |
| [8] |
Fucho R, Martínez L, Baulies A, et al. ASMase regulates autophagy and lysosomal membrane permeabilization and its inhibition prevents early stage non-alcoholic steatohepatitis[J]. J Hepatol, 2014, 61(5): 1126-34. doi:10.1016/j.jhep.2014.06.009 |
| [9] |
Li L, Wang H, Yao Y, et al. The sex steroid precursor dehydroepiandrosterone prevents nonalcoholic steatohepatitis by activating the AMPK pathway mediated by GPR30[J]. Redox Biol, 2021, 48: 102187. doi:10.1016/j.redox.2021.102187 |
| [10] |
Opreanu M, Tikhonenko M, Bozack S, et al. The unconventional role of acid sphingomyelinase in regulation of retinal microangiopathy in diabetic human and animal models[J]. Diabetes, 2011, 60(9): 2370-8. doi:10.2337/db10-0550 |
| [11] |
Heida A, Gruben N, Catrysse L, et al. The hepatocyte IKK: NF-κB axis promotes liver steatosis by stimulating de novo lipogenesis and cholesterol synthesis[J]. Mol Metab, 2021, 54: 101349. doi:10.1016/j.molmet.2021.101349 |
| [12] |
Chen H C, Chen Y Z, Wang C H, et al. The nonalcoholic fatty liver disease-like phenotype and lowered serum VLDL are associated with decreased expression and DNA hypermethylation of hepatic ApoB in male offspring of ApoE deficient mothers fed a with Western diet[J]. J Nutr Biochem, 2020, 77: 108319. doi:10.1016/j.jnutbio.2019.108319 |
| [13] |
Koka S, Xia M, Chen Y, et al. Endothelial NLRP3 inflammasome activation and arterial neointima formation associated with acid sphingomyelinase during hypercholesterolemia[J]. Redox Biol, 2017, 13: 336-44. doi:10.1016/j.redox.2017.06.004 |
| [14] |
Xu J, Teran-Garcia M, Park J H Y, et al. Polyunsaturated fatty acids suppress hepatic sterol regulatory element-binding protein-1 expression by accelerating transcript decay[J]. J Biol Chem, 2001, 276(13): 9800-7. doi:10.1074/jbc.M008973200 |
| [15] |
Yoshikawa T, Shimano H, Yahagi N, et al. Polyunsaturated fatty acids suppress sterol regulatory element-binding protein 1c promoter activity by inhibition of liver X receptor (LXR) binding to LXR response elements[J]. J Biol Chem, 2002, 277(3): 1705-11. doi:10.1074/jbc.M105711200 |
| [16] |
Fuchs C D, Radun R, Dixon E D, et al. Hepatocyte‐specific deletion of adipose triglyceride lipase (ATGL/PNPLA2) ameliorates dietary induced steatohepatitis in mice[J]. Hepatology, 2021, 75(1): 125-39. |
| [17] |
Zhou Y, Wu C, Wang X, et al. Exploring the changes of peroxisomal polarity in the liver of mice with nonalcoholic fatty liver disease[J]. Anal Chem, 2021, 93(27): 9609-20. doi:10.1021/acs.analchem.1c01776 |
| [18] |
Pawlak M, Lefebvre P, Staels B. Molecular mechanism of PPARα action and its impact on lipid metabolism, inflammation and fibrosis in non-alcoholic fatty liver disease[J]. J Hepatol, 2015, 62(3): 720-33. doi:10.1016/j.jhep.2014.10.039 |