

2. 安徽医科大学第二附属医院药学部,安徽 合肥 230601
2. Dept of Pharmacology, the Second Hospital of Anhui Medical University, Hefei 230601, China
干扰素(interferon,IFN)是一类由细胞合成和分泌的信号蛋白,具有对抗病毒感染、免疫调节和抗肿瘤活性等多种生物学功能,由3个细胞因子家族组成,与其细胞膜上受体特异性结合后,会激活IFN信号通路,诱导多种IFN刺激基因(IFN-stimulated genes,ISGs)的表达,激活细胞免疫系统,发挥免疫调节作用[1]。
ISGs也称为干扰素诱导的四肽重复蛋白(interferon-induced protein with tetratricopeptide repeats,IFITs),其家族分子包括以下4个成员IFN诱导蛋白四肽重复序列1(interferon-induced protein with tetratricopeptide repeats 1,IFIT1)、IFIT2、IFIT3和IFIT5,其中IFIT1是较早被发现的ISG。IFIT1主要分布细胞质中,生理条件下在多数细胞中表达量较低,但在IFN处理或病毒感染后IFN-JAK-STAT蛋白途径激活,IFIT1蛋白可以被短暂诱导高水平表达[2]。IFN调控IFIT1表达的具体机制是,I型IFN激活细胞膜上IFNAR1和IFNAR2亚基组成的异源二聚体受体,JAK1和TYK2磷酸化,随后募集STAT蛋白,与受体结合的STAT蛋白依次被磷酸化、二聚化。I型IFN与受体结合的反应诱导了3个活性复合体的形成,分别是IRF9与STAT1/STAT2异二聚体结合(ISGF3),IRF9与STAT2同源二聚体结合(STAT2/IRF9),STAT1同源二聚体,随后活性复合体转位到细胞核,启动IFIT1转录。II型IFN激活细胞膜上由两个IFNGR1和两个连接JAK1和JAK2激酶的IFNGR2亚基组成的受体,随后磷酸化STAT1蛋白,STAT1同源二聚体形成并转位到细胞核,启动转录[3]。III型IFN激活细胞膜上连接JAK1和JAK2激酶的IL28Rα与IL-10Rβ亚基组成的受体,随后募集STAT蛋白,IRF9与STAT1/STAT2异二聚体结合(ISGF3),转位到细胞核激活IFIT1表达[4]。综上,调控IFIT1表达水平的IFN-JAK-STAT通路中的重要节点分子可能成为靶向该通路的重要靶点。
研究证实,IFIT1具有广泛的抗病毒活性和抑制炎症的作用,可改善患者临床结局。可见,了解IFIT1抗炎和抗病毒机制对IFIT1成为潜在的治疗靶点具有重要的临床意义。本文就IFIT1的抗炎和抗病毒作用及其相关机制作一综述,以期为相关疾病的治疗提供方向。
1 IFIT1的抗炎作用及相关机制 1.1 IFIT1的抗炎作用IFIT1对于维持宿主体内免疫平衡发挥重要作用,在肺脏、肝脏和肠道等器官中表达水平升高,通常可以抑制炎症,保护机体。病毒感染引起的继发毛细支气管炎和结核杆菌感染的结核病患者体内IFIT1等ISGs表达升高,可以有效减轻肺部炎症,促进机体恢复[5-6]。此外,ISGs的表达可以有效改善肝损伤和炎症性肠道疾病,减轻炎症反应[7-8]。尽管在多种炎症性疾病中发现IFIT1等ISGs在一些疾病发生过程中表达升高,但是阻止疾病进展的确切机制需要进一步临床研究。
IFIT1在自身免疫性疾病中异常升高会损伤机体,加重疾病的发展。在系统性硬化症(systemic sclerosis,SSc)、系统性红斑狼疮(systemic Lupus Erythematosus,SLE)和类风湿性关节炎等多种系统性自身免疫性疾病中内源性DNA损伤水平较高,损伤的DNA可以引起I型IFN途径的激活等异常的免疫反应[9]。目前,多数研究认为损伤的DNA可以激活IFN信号通路和IFIT1等ISGs,这与SSc的发病有关。高水平损伤的DNA激活DNA感受器-STING-IRF3通路诱导IFIT1的异常表达,导致免疫平衡失调,更加容易引起免疫缺陷,以及加重SLE等自身免疫性疾病的病情,在SLE的发病过程中抑制IFIT1的异常表达将有利于改善病情[10]。这些研究结果说明,IFIT1通常具有保护宿主、抑制炎症性疾病继续发展的作用,但是,在自身免疫性疾病中异常表达会损伤宿主体内的免疫平衡,起到一种促进炎症进展的作用。
1.2 抗炎作用相关机制 1.2.1 转录共抑制因子通路目前,对IFIT1抗炎作用确切机制研究较少,IFIT1通常可以通过招募转录共抑制因子通路和JNK-TNF-α信号通路抑制促炎细胞因子的表达发挥抗炎作用。LPS与TLR4受体相结合,可通过TRIF途径激活IRF3,随后诱导IFN和ISGs表达。一项研究采用LPS处理人巨噬细胞,首次发现IFIT1蛋白具有负性调控作用。随后进一步研究发现IFIT1可负调控肿瘤坏死因子α(tumor necrosis factor α,TNF-α)等促炎细胞因子的表达,正调控IFN和多种ISGs的表达,其可能机制是IFIT1促进转录共抑制因子Sin3A-HDAC复合物在ISG位点的有效去除以及促进了IRF3的招募,从而升高了IFN和ISGs表达。IFIT1与Sin3A-HDAC复合物相互作用抑制炎症细胞因子基因位点转录因子的招募,引起TNF-α等促炎细胞因子的表达被抑制[11]。
1.2.2 JNK-TNF-α信号通路在一些炎症模型中JNK-TNFα通路的激活,导致细胞凋亡蛋白的大量释放,常可引起细胞发生损伤凋亡。致死性肝炎以大量肝细胞凋亡为特征,一项使用LPS和肝脏特异性转录抑制剂D-(+)氨基半乳糖诱导小鼠发生致死性肝炎的研究中,发现过表达IFIT1可通过抑制JNK通路的激活而改善细胞凋亡,从而保护细胞,抑制炎症的发生发展。研究结果表明,IFIT1是治疗炎症性肝病的一种新的保护因子[12]。
1.2.3 MAPK信号通路IFIT1可以通过p38 MAPK信号通路降低炎症因子释放,减轻炎症带来的损伤。Kenneth C. Malcolm等[13]收集急性呼吸窘迫综合征患者循环中性粒细胞,发现中性粒细胞中IFIT1高表达时降低p38 MAPK激酶磷酸化、白细胞介素8(IL-8)释放和减轻金黄色葡萄球菌的感染。这表明IFIT1可以通过抑制损伤因素引起的p38 MAPK的激活,进而抑制下游炎症因子信号级联反应,减轻炎症。除此之外,Qiao等[14]认为, IFIT1可以通过多种信号通路抑制NF-KB等多种炎症因子的表达。目前,IFIT1对抗炎症的作用机制尚不明确,仍需进一步研究。
2 IFIT1的抗病毒作用及相关机制 2.1 IFIT1的抗病毒作用病毒感染过程中,会激活细胞体内IFN信号通路以及促进ISGs的表达,短暂强烈的IFN反应驱动免疫效应功能并调节细胞周期和全身代谢[15],从而保护宿主机体免疫平衡。IFIT1具有广泛的抗病毒活性,IFIT1表达升高,可以诱导宿主产生抗病毒或抗炎状态,抑制多种病毒在哺乳动物细胞中的复制和抑制疾病的进展,有利于改善患者疾病[16]。
2.2 IFIT1的抗病毒作用相关机制IFIT1参与抑制病毒复制、翻译等多个过程的抗病毒过程。许多病毒通常携带无帽RNA(5’-三磷酸化,5’-PPP)或不完全封顶RNA,称为CAP 0。高等真核生物含有完全甲基化的5‘末端封顶的细胞mRNA,称为CAP1或CAP 2。DNA、RNA病毒被体内相关模式识别受体如胞质RIG-1样受体、TLR样受体等识别,并触发下游相关信号通路,诱导IFN和IFIT1产生。IFIT1可以优先识别2’-O未甲基化的RNA和5’-PPP RNA病毒,并通过影响相关翻译起始因子如eIF3与特定区域结合,抑制病毒蛋白翻译过程。
2.2.1 IFIT1优先识别2’-O未甲基化的RNA和5’-PPP RNA病毒当2’-O甲基化作用减弱或缺乏2’-O甲基化时,病毒对IFIT1的抗病毒作用更敏感。其机制是IFIT1与缺乏2’-O甲基化的病毒RNA结合如西尼罗河病毒,抑制病毒的复制翻译[17]。此外,IFIT1识别宿主体内的异体病毒5’-PPP RNA,而非自体RNA,阻止了真核细胞翻译起始因子和核糖体的募集,进而抑制入侵病毒的复制翻译[18]。
2.2.2 TLR3调控IFIT1对病毒的识别宿主体内的TLR样受体可以识别病原体相关分子模式,激活IFN信号通路,促进下游IFIT1等ISGs的大量释放以及宿主抗病毒免疫状态的建立。TLR家族成员TLR3样受体可以识别异体病毒RNA,激活NF-κB通路和IFN通路,TLR3诱导的下游TRIF通路刺激IFN的产生,诱导机体对抗病毒入侵。研究发现,IFIT1受TLR3信号诱导并且与其呈浓度和时间依赖关系,表达升高的IFIT1调节体外培养的人肾小球系膜细胞中黑色素瘤分化相关基因5(melanoma differentiation-associated gene5,MDA-5)、维甲酸诱导基因I(retinoic-acid-inducible gene I,RIG-I)、趋化因子CXCL10的表达,对抗病毒感染。此外,TLR3信号在足细胞中也调节IFIT1的表达对抗病毒感染[19]。
2.2.3 RIG-I样解旋酶调控IFIT1对病毒的识别RIG-I样受体(RIG-I like receptors,RLRs)是一类胞质RNA传感器,是一种RNA解旋酶,具有水解ATP的能力。细胞质RNA传感机制可以在病毒感染过程中区分自体和异体RNA,抑制病毒的体内复制必需蛋白的活性。RIG-I和MDA-5蛋白的解旋酶结构是识别自体或异体双链RNA所必需的,病毒感染过程中RIG-I和MDA-5蛋白表达上调,可以激活IFN信号通路和IFIT1等ISGs的表达[20-21]。
2.2.4 病毒对IFIT1的逃逸机制许多病毒已经进化出独特的机制逃避宿主IFIT1的限制作用,对抗机体抗病毒免疫。病毒感染机体后释放某种蛋白,严重急性呼吸综合征冠状病毒2型感染后分泌主要蛋白酶Mpro[22],泰勒氏小鼠脑脊髓炎病毒前导蛋白L蛋白[23]有效抑制IFN信号通路和IFIT1等ISGs的表达,病毒的复制能力增强。此外,病毒也通过上调宿主体内MicroRNAs的产生,抑制宿主体内抗病毒基因的表达。一项研究使用日本脑炎病毒感染细胞株后,发现细胞miR-146a表达增强,JAK-STAT通路受到抑制,机体抗病毒免疫状态减弱,从而病毒发生免疫逃逸[24],而且,病毒也可以诱导宿主IFIT1结构修饰,逃避其抗病毒作用[25]。IFIT1具有广泛的抗病毒作用,其抗病毒机制在多种病毒性疾病中尚需进一步研究。目前,IFIT1可以抑制多数病毒在机体内的复制,部分病毒通过抑制IFN途径,下调IFIT1表达,减弱机体抗病毒免疫。但是,在出现免疫逃逸现象的机体中,给予IFN处理上调IFIT1表达后,病毒复制受到抑制。这说明IFIT1在出现病毒免疫逃逸的机体中上调后,仍具有抑制病毒复制的作用。到目前为止,尽管在IFIT1基因的抗病毒机制上的研究已取得阶段性进展,但如何利用IFIT1基因在病毒性疾病中发挥出最有效的抗病毒效应,以及IFIT1从体内清除病毒的机制,需要进一步研究。
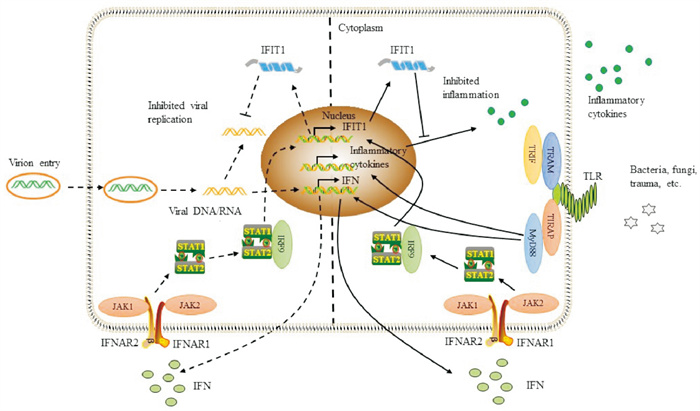
|
| Fig 1 The anti-inflammatory and antiviral effects and related mechanisms of IFIT1 The antiviral mechanism of IFIT1 is that the expression of IFIT1 is highly induced by the activated signaling pathway of IFN after the virus invades the host organism, then IFIT1 plays an antiviral role in inhibiting virus replication. And the anti-inflammatory mechanism of IFIT1 is that the expression of IFIT1 is highly induced by the activated signaling pathway of IFN after the injury factors activate Toll-like receptor, then IFIT1 plays an anti-inflammatory role in inhibiting the expression and release of inflammatory cytokines. |
目前,有研究报道,一些药物可通过作用于IFN途径,诱导以IFIT1为代表的ISGs表达,从而发挥抗病毒、抗炎、抗肿瘤等作用。一些药物可通过诱导IFIT1表达从而发挥抗炎作用,如马齿苋口服给药,有效治疗溃疡性结肠炎[26],鱼油对抗炎症引起的肝损伤[7],毛桃红枣富含酚类提取物改善非酒精性脂肪肝中的氧化应激和炎症反应[27],通过激活Janus激酶-STAT蛋白途径,上调IFIT1表达,增强免疫功能,发挥抗炎作用。
此外,还有一类药物可以诱导IFIT1表达发挥抗病毒作用。蛋白酶抑制剂鲍曼-伯克抑制剂对抗巨噬细胞中艾滋病毒感染[28],茶树油抑制水疱性口炎病毒感染[29],L-亮氨酸缓解传染性胃肠炎病毒感染[30],其机制是IFN信号通路和IFIT1等ISGs表达显著增强。因此,可以进一步开发以IFIT1为靶点的药物,应用于治疗临床炎症性疾病和病毒性疾病。
4 展望综上所述,在多种临床疾病中,IFIT1表达水平升高可以诱导机体发挥抗炎、抗病毒和抗肿瘤等功能,抑制相关疾病进展,改善预后。见Fig 1。因此,通过靶向IFN途径,诱导疾病状态下机体IFIT1表达水平升高,增强机体的免疫功能,或将成为治疗炎症性疾病和病毒感染性疾病的重要手段。由此可见,IFIT1对于炎症性疾病和病毒感染性疾病的预防、诊断、治疗及预后等具有较大潜力,是一种潜在的药物治疗靶点,具有非常广阔的研究前景。
| [1] |
Hopfner K P, Hornung V. Molecular mechanisms and cellular functions of cGAS-STING signalling[J]. Nat Rev Mol Cell Biol, 2020, 21(9): 501-21. doi:10.1038/s41580-020-0244-x |
| [2] |
Tan X F, Chen Q, Hua S H, et al. Roles of interferon induced protein with tetratricopeptide repeats (IFIT) Family in cancer[J]. Curr Med Chem, 2021, 28(25): 5034-47. doi:10.2174/0929867328666210617105209 |
| [3] |
Chen X, Saccon E, Appelberg K S, et al. Type-I interferon signatures in SARS-CoV-2 infected Huh7 cells[J]. Cell Death Discov, 2021, 7(1): 114. doi:10.1038/s41420-021-00487-z |
| [4] |
Majoros A, Platanitis E, Kernbauer-Holzl E, et al. Canonical and non-canonical aspects of JAK-STAT signaling: lessons from interferons for cytokine responses[J]. Front Immunol, 2017, 8: 29. |
| [5] |
Pierangeli A, Viscido A, Bitossi C, et al. Differential interferon gene expression in bronchiolitis caused by respiratory syncytial virus-A genotype ON1[J]. Med Microbiol Immunol, 2020, 209(1): 23-8. doi:10.1007/s00430-019-00633-6 |
| [6] |
Yi F, Hu J, Zhu X, et al. Transcriptional profiling of human peripheral blood mononuclear cells stimulated by mycobacterium tuberculosis PPE57 identifies characteristic genes associated with type I interferon signaling[J]. Front Cell Infect Microbiol, 2021, 11: 716809. doi:10.3389/fcimb.2021.716809 |
| [7] |
Zhang J, Xu X, Zhu H, et al. Dietary fish oil supplementation alters liver gene expressions to protect against LPS-induced liver injury in weanling piglets[J]. Innate Immun, 2019, 25(1): 60-72. doi:10.1177/1753425918821420 |
| [8] |
Labbe C, Boucher G, Foisy S, et al. Genome-wide expression profiling implicates a MAST3-regulated gene set in colonic mucosal inflammation of ulcerative colitis patients[J]. Inflamm Bowel Dis, 2012, 18(6): 1072-80. doi:10.1002/ibd.21887 |
| [9] |
Elsner C, Ponnurangam A, Kazmierski J, et al. Absence of cGAS-mediated type I TFN responses in HIV-1-infected T cells[J]. Proc Natl Acad Sci U S A, 2020, 117(32): 19475-86. doi:10.1073/pnas.2002481117 |
| [10] |
Huijser E, Bodewes IL A, Lourens M S, et al. Hyperresponsive cytosolic DNA-sensing pathway in monocytes from primary Sjogren's syndrome[J]. Rheumatology (Oxford), 2022, keac016. |
| [11] |
John S P, Sun J, Carlson R J, et al. IFIT1 exerts opposing regulatory effects on the inflammatory and interferon gene programs in LPS-Activated human macrophages[J]. Cell Rep, 2018, 25(1): 95-106. doi:10.1016/j.celrep.2018.09.002 |
| [12] |
Chang A, Chen Y, Shen W, et al. Ifit1 protects against lipopolysaccharide and d-galactosamine-induced fatal hepatitis by inhibiting activation of the JNK pathway[J]. J Infect Dis, 2015, 212(9): 1509-20. doi:10.1093/infdis/jiv221 |
| [13] |
Malcolm K C, Kret J E, Young R L, et al. Bacteria-specific neutrophil dysfunction associated with interferon-stimulated gene expression in the acute respiratory distress syndrome[J]. PLoS One, 2011, 6(7): e21958. doi:10.1371/journal.pone.0021958 |
| [14] |
Qiao W, Fan J, Shang X, et al. Bioinformation analysis reveals IFIT1 as potential biomarkers in central nervous system tuberculosis[J]. Infect Drug Resist, 2022, 15: 35-45. doi:10.2147/IDR.S328197 |
| [15] |
Starbaek SMR, Andersen M R, Brogaard L, et al. Innate antiviral responses in porcine nasal mucosal explants inoculated with influenza a virus are comparable with responses in respiratory tissues after viral infection[J]. Immunobiology, 2022, 227(3): 152192. doi:10.1016/j.imbio.2022.152192 |
| [16] |
Dobiezynska A, Miszkiewicz J, Darzynkiewicz Z M, et al. Development of bis-ANS-based modified fluorescence titration assay for IFIT/RNA studies[J]. Biochem Biophys Res Commun, 2020, 533(3): 391-6. doi:10.1016/j.bbrc.2020.09.006 |
| [17] |
Cui D, Espínola E E, Arora K, et al. Two interferon-stimulated response elements cooperatively regulate interferon-stimulated gene expression in west nile virus-infected IFNAR-/- mouse embryo fibroblasts[J]. J Virol, 2021, 95(22): e0104021. doi:10.1128/JVI.01040-21 |
| [18] |
Mears H V, Emmott E, Chaudhry Y, et al. Ifit1 regulates norovirus infection and enhances the interferon response in murine macrophage-like cells[J]. Wellcome Open Res, 2019, 4: 82. doi:10.12688/wellcomeopenres.15223.1 |
| [19] |
Imaizumi T, Aizawa-Yashiro T, Matsumiya T, et al. Interaction between interferon-stimulated gene 56 and melanoma differentiation-associated gene 5 in Toll-like receptor 3 signaling in normal human mesangial cells[J]. Am J Nephrol, 2013, 37(2): 118-25. doi:10.1159/000346415 |
| [20] |
Tirumurugaan K G, Pawar R M, Dhinakar Raj G, et al. RNAseq reveals the contribution of Interferon stimulated genes to the increased host defense and decreased ppr viral replication in cattle[J]. Viruses, 2020, 12(4): 463. doi:10.3390/v12040463 |
| [21] |
Beyer D K, Forero A. Mechanisms of antiviral immune evasion of SARS-CoV-2[J]. J Mol Biol, 2022, 434(6): 167265. doi:10.1016/j.jmb.2021.167265 |
| [22] |
Wu Y, Ma L, Zhuang Z, et al. Main protease of SARS-CoV-2 serves as a bifunctional molecule in restricting type I interferon antiviral signaling[J]. Signal Transduct Target Ther, 2020, 5(1): 221. doi:10.1038/s41392-020-00332-2 |
| [23] |
Buhler M, Runft S, Li D, et al. IFN-beta deficiency results in fatal or demyelinating disease in C57BL/6 mice infected with theiler's murine encephalomyelitis viruses[J]. Front Immunol, 2022, 13: 786940. doi:10.3389/fimmu.2022.786940 |
| [24] |
Sharma N, Verma R, Kumawat K L, et al. Mir-146a suppresses cellular immune response during Japanese encephalitis virus JaOArS982 strain infection in human microglial cells[J]. J Neuroinflammation, 2015, 12: 30. doi:10.1186/s12974-015-0249-0 |
| [25] |
Griffante G, Gugliesi F, Pasquero S, et al. Human cytomegalovirus-induced host protein citrullination is crucial for viral replication[J]. Nat Commun, 2021, 12(1): 3910. doi:10.1038/s41467-021-24178-6 |
| [26] |
周毅, 罗健东, 张根水, 等. 马齿苋对实验性结肠炎大鼠IFN-γ和IL-10的表达影响研究[J]. 中国药理学通报, 2008, 24(8): 1113-4. Zhou Y, Luo J D, Zhang G S, et al. Effect of portulaca oleracea on the expression of IFN-γ and IL-10 of experimental colitis rats[J]. ChinPharmacol Bull, 2008, 24(8): 1113-4. doi:10.3321/j.issn:1001-1978.2008.08.035 |
| [27] |
Wang R, Yao L, Lin X, et al. Exploring the potential mechanism of rhodomyrtus tomentosa (Ait.) hassk fruit phenolic rich extract on ameliorating nonalcoholic fatty liver disease by integration of transcriptomics and metabolomics profiling[J]. Food Res Int, 2022, 151: 110824. doi:10.1016/j.foodres.2021.110824 |
| [28] |
Ma T C, Zhou R H, Wang X, et al. Soybean-derived owman-birk inhibitor (BBI) inhibits HIV replication in macrophages[J]. Sci Rep, 2016, 6: 34752. doi:10.1038/srep34752 |
| [29] |
Shao Q, Huang J, Li J. Intracellular replication inhibitory effects of tea tree oil on vesicular stomatitis virus and anti-inflammatory activities in vero cells[J]. Front Vet Sci, 2021, 8: 759812. doi:10.3389/fvets.2021.759812 |
| [30] |
Du J, Chen D, Yu B, et al. L-Leucine promotes STAT1 and ISGs expression in TGEV-Infected IPEC-J2 cells via mTOR activation[J]. Front Immunol, 2021, 12: 656573. doi:10.3389/fimmu.2021.656573 |

