

2. 中国医药工业研究总院,上海 201210;
3. 上海市食品药品检验研究院,上海 201203
2. China State Institute of Pharmaceutical Industry, Shanghai 201210, China;
3. Shanghai Institute of Food and Drug Control, Shanghai 201203, China
呼吸道细胞每天暴露在各种气体、气溶胶、粉尘颗粒或是药物中,是吸入毒理和药物递送等研究的重点对象[1]。用于科学实验研究的呼吸道细胞类型有很多,如A549(人肺癌细胞)、Calu-3(人肺腺癌细胞)、BEAS-2B (人支气管上皮样细胞)、hAELVi(永生化的人类肺泡上皮细胞)、NCI-H460(人大细胞肺癌细胞)、WI-38(人胚胎肺细胞)等细胞系细胞,还有原代细胞[2]。不同部位的细胞其功能也不相同,用于实验的目的也不尽相同,支气管上皮细胞BEAS-2B用作筛选具有潜在肺毒性或致癌的化学品、纳米金属颗粒等的细胞模型[3]。A549细胞形成的融合单层,具有Ⅱ型肺泡上皮的特征形态,有助于研究肺泡Ⅱ型细胞对肺上皮药物递送机制的代谢和大分子加工[4]。Calu-3细胞作为肺上皮细胞的代表,具有细胞通透性、紧密连接以及蛋白表达的特点[5]。体外-体内相关性研究表明,Calu-3细胞培养模型是预测吸入给药候选药物的潜在模型[6],建议将Calu-3细胞作为筛选呼吸道刺激和空气中化学物质毒性的合适细胞株[7],且Calu-3细胞在气液界面培养时仍可存活数周、屏障能保持完整性、不会过度生长、并且易于培养和维护[8];Grainger等[9]通过比较液体覆盖培养(LCC)和空气液体界面培养(air-liquid interface,ALI)对Calu-3细胞层形态和渗透性的影响得出结论,使用ALI培养的细胞生成的模型在形态学上更能代表气道上皮,细胞呈更明显的柱状上皮、有微绒毛和更多的糖蛋白分泌,细胞的渗透性也强于液体覆盖培养的细胞;Ji等[10]建立了Calu-3细胞模型证实了Calu-3细胞在气液界面培养下的形态和生物电学特征以及蛋白特性的表达,模型中Calu-3细胞上皮表现出明显的分化、紧密连接形成和微绒毛样结构,并产生更多的粘液。因此,本论文主要研究Calu-3细胞模型。
在传统的吸入毒理研究中,大多染毒方式采用浸没式暴露方式,即将受试物溶解在细胞的培养液中进行暴露,随后观察细胞的后续变化,这种暴露方式难以避免受试物与培养基的相互作用,且难以反映实际吸入暴露的情况。随着气液界面培养方式的推行发展出新型暴露系统,可以将气溶胶直接暴露于细胞表面,不仅解决了上述问题,还更接近人体生理实际暴露情况。VITROCELL云系统在烟草吸入毒理、药物递送方向应用较多,云系统和连续流暴露系统区别在于受试物沉降机制和暴露时长,云暴露系统的沉降机制是云沉降,连续流暴露系统的沉降机制是扩散和沉降[11];云暴露系统大多在5 min内完成受试物的暴露,而连续流系统则可以在细胞耐受范围内持续暴露,对比云暴露系统,连续流暴露系统更适用于环境毒理学以及吸入毒理学的研究。本研究采用细胞气液界面培养方式结合VITROCELL连续流暴露系统来进行细胞气液界面暴露实验,此系统可以将受试物以气溶胶的形式均匀且连续地暴露于细胞表面,气溶胶混合物通过VITROCELL喇叭形管口垂直输送到细胞表面(Fig 1),在暴露细胞的小室中气溶胶混合物的流动是平滑的和层状的,很大程度限制了可能会损害细胞的剪切力和潜在的水分损失,保证了湿度,通过VITROCELL体外暴露系统再现人体呼吸道细胞在接触外界时的真实情况,比传统的浸没式暴露更具有说服力。此系统(Fig 1)由3部分组成,形成气溶胶的发生装置、可以定量的稀释系统模块和可以温控的暴露模块,在系统的暴露模块中,有3孔是空气暴露对照组,9孔是实验受试物暴露组,受试物暴露组又可以细分为高中低3个剂量组。暴露时长是评价化合物吸入毒性的1个基本影响因素,本文主要通过洁净空气暴露后细胞的活性和电阻值的考察,确定细胞的单次最长暴露时间,为后续化合物体外吸入毒性评价研究奠定了基础。
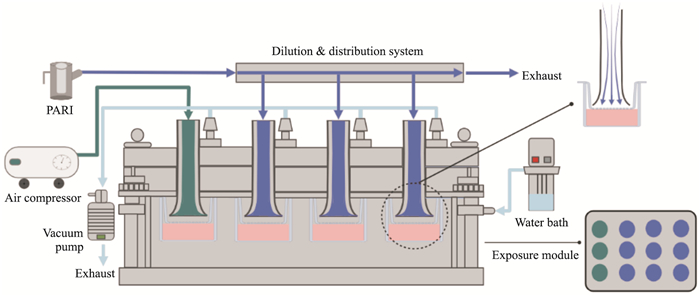
|
| Fig 1 VITROCELL12 in vitro inhalation exposure system The system consists of three modules: a nebulisation generation module, an exposure module and a dilution and distribution system. |
Calu-3细胞株(北纳生物,编号2017033104,通过STR基因型检测,与ATCC数据库完全匹配,实验所用细胞代数均在20代之内)。
1.2 主要仪器Heracell VIOS 160i CO2培养箱(Thermo Scientific公司,德国);BCM-1300A层流超净台(Airtech公司);Vi-cell XR细胞活力测定仪(Beckman counter公司,德国);EVOM 2上皮电阻仪和STX2电极(世界精密仪器公司,美国);VITROCELL® 12/12暴露染毒系统(型号VITROCELL® 12/12 CF,VITROCELL,德国);SpectraMax M5多功能酶标仪(美国Molecular Devices公司);THUNDER Imager 3D Live Cell(德国Leica公司)。
1.3 主要试剂与耗材MEM培养基(批号2192541,Corning);胎牛血清(FBS,批号DBC0520,Hyclone);PBS缓冲液(批号21020007,Corning);青霉素-链霉素(双抗,批号10378016,Thermo);胰蛋白酶-EDTA(批号10165921001,Gibco);CCK-8试剂(日本同仁化学研究所);抗体ZO-1(Cell Signaling Technology,货号:#3195);Anti-Rabbit IgG(Cell Signaling Technology,货号:#4412);牛血清蛋白(BSA,批号abs9157,absin);抗荧光淬灭封片液(批号P0126,Beyotime);DAPI(批号C1006,Beyotime);细胞培养瓶(25 cm2,Corning,美国);Transwell-12孔板(面积为1.12 cm2,孔径为0.4 μm,Corning公司,美国)。
1.4 实验方法 1.4.1 Calu-3细胞ALI培养Calu-3细胞在细胞培养瓶中扩增,培养液为5 mL的完全培养基(MEM,10% FBS,1%双抗),细胞置于37°、5% CO2的培养箱中培养,隔天换1次培养液,细胞在显微镜下观察,当细胞达到90%融合时进行传代。经过传代3次之后将细胞用胰蛋白酶-EDTA消化,使用细胞计数仪计数,加入完全培养基重悬细胞,使细胞的密度约为2×108个·L-1,以每孔500 μL的细胞混悬液接种在Tranwell小室中,底室中加入1 mL完全培养基。显微镜下观察细胞,当细胞在Transwell膜中长满则弃去Transwell小室中的培养基,之后只在底室供给培养液,开始气液界面培养,记作ALI d 0,隔天换1次培养液。
1.4.2 Calu-3细胞电阻值测量在Transwell小室中加入500 μL的培养基,在培养箱中平衡20至30 min,连接电阻仪,在Transwell小室中插入电极头,开始测量、读数,每孔测定3个不同位置,求平均值,减去空白孔的值后,与Transwell膜表面积(1.12 cm2)的乘积即是该孔的跨上皮电阻(trans-epithelium electrical resistant, TEER)[12]。测量完成之后,弃去小室和底室的培养液,用PBS清洗2次,加入新鲜的完全培养液,继续培养。Calu-3细胞ALI培养0~24 d内隔天测1次电阻值,暴露实验在暴露完成24 h后测量电阻值。
1.4.3 免疫荧光标记方法将气液界面培养d 1、4、8、16的Calu-3细胞用PBS清洗细胞3次;加入4%多聚甲醛固定20 min,完成后PBS清洗3次;加入0.2% Triton破膜15 min,结束后PBS清洗3次;加入5% BSA封闭、摇晃1 h,完成后PBS清洗3次;将Transwell滤膜裁剪下来,放在合适容器中,加入按比例稀释好的一抗,4 ℃摇床摇晃过夜;d 2取出滤膜,PBS清洗3次;避光加入按比例稀释好的二抗,摇床孵育2 h,结束后PBS清洗3次;加入DAPI染核10 min,完成后PBS清洗3次;将滤膜放到载玻片上,滴加抗荧光淬灭封片液,盖上盖玻片,制片完成,使用荧光微镜进行观察拍照。
1.4.4 Calu-3细胞吸入暴露在VITROCELL体外暴露系统(Fig 1)中进行洁净空气暴露。提前打开VITROCELL暴露系统的温控和水浴装置,等待升温,达到37 ℃之后,底室各加入3 mL预热的37 ℃ MEM培养液(不含FBS),将ALI d 11的Calu-3细胞放入其中进行洁净空气暴露1、2、3、4、5、6 h,洁净空气流速为5 mL·min-1,与此同时对照组细胞的培养液也换成不含FBS的MEM培养液在培养箱中培养1、2、3、4、5、6 h,第2次暴露实验取ALI 3 d的细胞,第3次暴露实验取ALI- d 16的细胞,随机抽取1至18 d内的细胞。
1.4.5 Calu-3细胞暴露后活性测定在VITROCELL体外暴露系统中暴露1、2、3、4、5、6 h后,将带有Calu-3细胞的Transwell小室回收,培养箱培养24 h后在Transwell小室中加入CCK-8混合液(CCK-8 ∶MEM=1 ∶10)110 μL,培养箱培养1 h,将反应液加入96孔板,每孔110 μL,酶标仪于450 nm处读取吸光度值,细胞活性的计算公式如下:

|
其中,Aexposure为暴露组吸光度值,Acontrol为对照组吸光度值,Ablank为空白孔(无细胞,只有CCK-8和MEM)的吸光度值。
1.5 统计学方法Calu-3细胞暴露后活性和电阻值的测定结果都采用GraphPad Prism 9软件进行计算和作图,结果表示为x±s。多组间比较使用Oneway ANOVA分析,两组间比较采用t检验。
2 结果 2.1 ALI培养的Calu-3细胞 2.1.1 细胞转为ALI培养天数Calu-3细胞从液液培养模式转为气液培养模式的标准是Transwell膜上的细胞长满(Tab 1),细胞需要约(8±1) d的时间从液液培养转为ALI培养(实验天数取整数)。
| No. | Time/d | x | SD |
| 1 | 8 | ||
| 2 | 10 | 8 | 1 |
| 3 | 7 |
Calu-3细胞的电阻值测量结果如Fig 2所示,Calu-3细胞在气液界面培养后的1~18 d内,细胞TEER ≥ 500 Ω·cm2,细胞间紧密连接形成总体稳定,细胞的状态可以用于后续暴露实验。
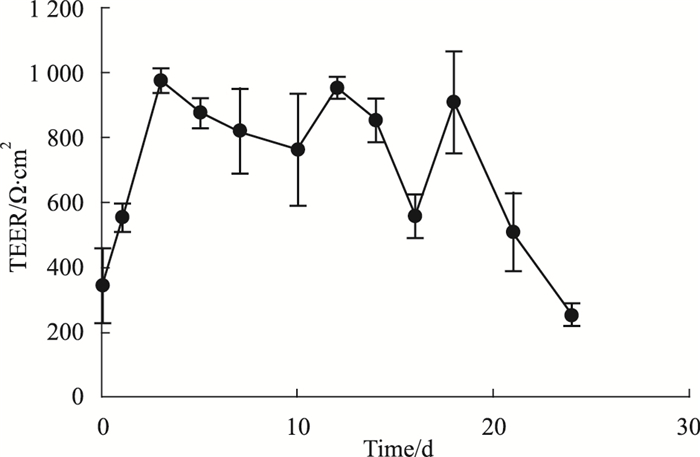
|
| Fig 2 Changes of TEER value of Calu-3 cells with ALI-culture time(x±s, n=3) |
使用ZO-1抗体对气液界面d 1、4、8、16的细胞进行标记,DAPI标记细胞核,结果如Fig 3所示,细胞紧密连接蛋白ZO-1表达明显,细胞排列紧密,且随着培养时间的推移,细胞生长的数量越来越多,细胞逐渐堆积,在气液界面培养1~18 d内细胞间的紧密连接完整且稳定,细胞屏障形成,细胞状态可以用于气液界面暴露。
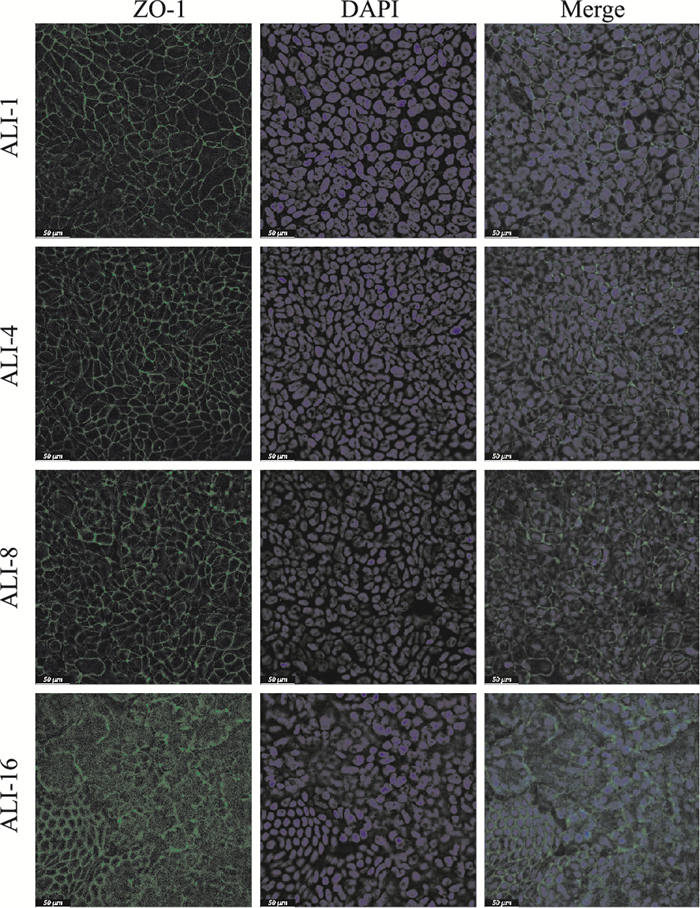
|
| Fig 3 Expression of tight junction protein ZO-1 in Calu-3 cells in different stages of ALI culture(scale bar=50 μm) |
取ALI-3、11、16 d的Calu-3细胞暴露1、2、3、4、5、6 h,暴露结束后培养箱中培养24 h,通过CCK-8方法测定细胞活性,结果如Fig 4所示。洁净空气暴露6 h细胞的活性明显低于培养箱对照组(P < 0.01),其中洁净空气暴露1、3、4、5 h后细胞活性下降但没有统计学差异,洁净空气暴露2 h细胞活性上升。根据暴露后细胞活性结果显示,在连续洁净空气暴露下Calu-3细胞的单次最长暴露时间不宜超过5 h。
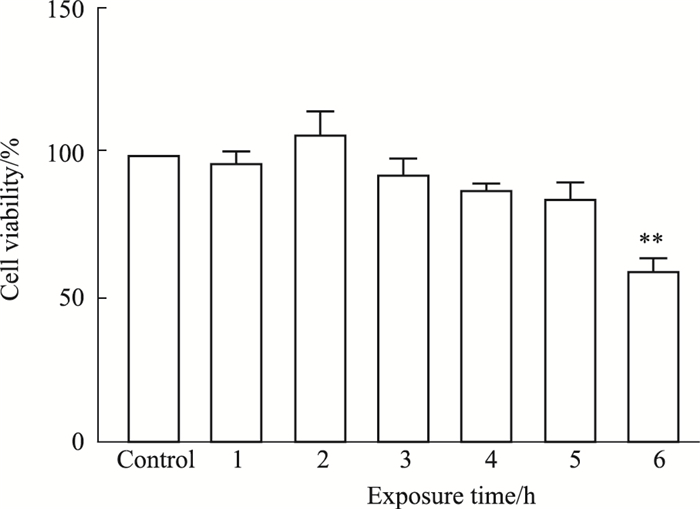
|
| Fig 4 Calu-3 cell viability changes with air exposure time(x±s, n=3) **P < 0.01 vs control |
Calu-3细胞结束暴露之后培养箱培养24 h测定电阻值,测定培养箱对照组的电阻值,每个时间点单独设置对照组,实验结果如Fig 5所示。Calu-3细胞洁净空气暴露之后的电阻值对比培养箱对照组细胞的电阻值均有所下降,且空气暴露4、5、6 h后细胞电阻值对比培养箱对照组细胞有显著性差异(P < 0.05,P < 0.01,P < 0.01)。根据连续洁净空气暴露后Calu-3细胞电阻值结果显示,单次最长暴露时间不宜超过3 h。
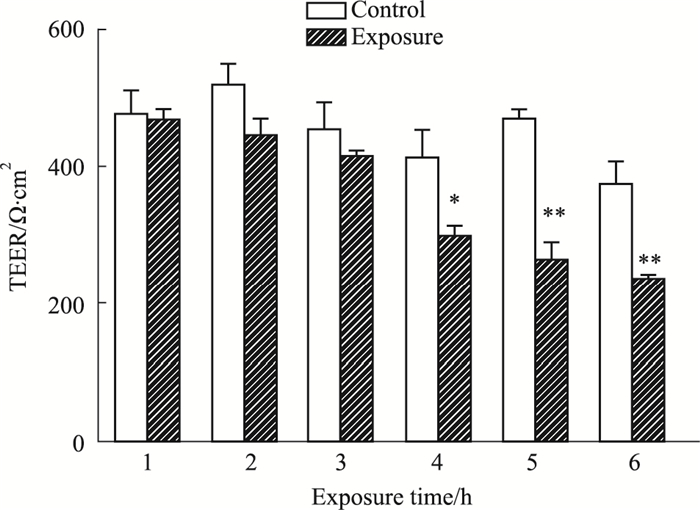
|
| Fig 5 Changes of resistance value of Calu-3 cells with increasing air exposure time(x±s, n=3) *P < 0.05, **P < 0.01 vs control |
成熟的细胞模型以及可控的体外暴露系统可以极大地促进细胞体外暴露实验发展,体外细胞培养不仅解决了动物伦理的问题,使用人源细胞也可以减少种属间的差异,更大程度上的还原了人在暴露时的真实情况,研究结果更具说服力。相应的细胞暴露方式也在进一步发展,从简单的浸没式暴露方式到现在的气液界面暴露,模拟了外界化合物进入人体呼吸道的过程,使得体外吸入毒性评价实验更完善。
TEER是表示Calu-3细胞屏障功能完整性的一个重要指标[13],值越高细胞间的连接越紧密,实验研究证明,当ALI培养的Calu-3细胞的TEER值达到500~800 Ω·cm2时[14],已经形成紧密连接的上皮;紧密连接是粘膜上皮物理屏障的重要结构,紧密连接蛋白ZO-1是其重要组成蛋白之一[15]。本研究采用气液界面培养Calu-3细胞,通过培养期间的细胞电阻值和紧密连接蛋白ZO-1的表达判断细胞屏障是否形成,以确定细胞状态是否可以用于暴露实验,在实验中细胞在气液界面培养1~18 d电阻值稳定且≥ 500 Ω·cm2,紧密连接蛋白ZO-1表达明显,成功培养出具有完整屏障功能的Calu-3细胞模型。成熟的Calu-3细胞模型还可以应用于环境毒理学[16]、肺部药物递送[17]等研究,期待更进一步的探索。
VITROCELL体外暴露系统于体外暴露评价化合物吸入毒性来说,需要解决暴露时长、受试物暴露剂量的准确性、受试物的沉积量和暴露的均一性等一系列问题。本研究将Calu-3细胞仅暴露于洁净空气中,探索细胞在VITROCELL®12连续流暴露系统中的单次最长暴露时间,ALI培养1至18 d的Calu-3细胞可以用于气液界面暴露实验,综合分析Calu-3细胞洁净空气暴露之后的细胞活性和电阻值变化实验结果,Calu-3细胞在VITROCELL®12体外暴露系统中的单次最长暴露时间为3 h。本文后续此系统相关条件的摸索提供了参考条件,具有重要意义,这只是初步的一个探索,此系统在吸入毒理学的应用研究则期待更深入的探索。
| [1] |
Hiemstra P S, Grootaers G, Vanderdoes A M, et al. Human lung epithelial cell cultures for analysis of inhaled toxicants: Lessons learned and future directions[J]. Toxicol In Vitro, 2018, 47: 137-46. doi:10.1016/j.tiv.2017.11.005 |
| [2] |
冀晓丽, 胡玥, 盛云华, 等. 气液界面培养小鼠气管上皮细胞模型构建[J]. 中国药理学通报, 2021, 37(2): 282-8. Ji X L, Hu Y, Sheng Y H, et al. Culture and differentiation of mouse tracheal epithelial cells at air-liquid interface[J]. Chin Pharmacol Bull, 2021, 37(2): 282-8. doi:10.3969/j.issn.1001-1978.2021.02.024 |
| [3] |
Vergaro V, Aldieri E, Fenoglio I, et al. Surface reactivity and in vitro toxicity on human bronchial epithelial cells (BEAS-2B) of nanomaterials intermediates of the production of titania-based composites[J]. Toxicol In Vitro, 2016, 34: 171-8. doi:10.1016/j.tiv.2016.04.003 |
| [4] |
Foster K A, Oster C G, Mayer M M, et al. Characterization of the A549 cell line as a type Ⅱ pulmonary epithelial cell model for drug metabolism[J]. Exp Cell Res, 1998, 243(2): 359-66. doi:10.1006/excr.1998.4172 |
| [5] |
Ong H X, Traini D, Young P M. Pharmaceutical applications of the Calu-3 lung epithelia cell line[J]. Expert Opin Drug Deliv, 2013, 10(9): 1287-302. doi:10.1517/17425247.2013.805743 |
| [6] |
Mathia N R, Timoszyk J, Stetsko P I, et al. Permeability characteristics of Calu-3 human bronchial epithelial cells: In vitro-in vivo correlation to predict lung absorption in rats[J]. J Drug Target, 2002, 10(1): 31-40. doi:10.1080/10611860290007504 |
| [7] |
Jeong M H, Kim H R, Bang I J, et al. In vitro model for predicting acute inhalation toxicity by using a Calu-3 epithelium cytotoxicity assay[J]. J Pharmacol Toxicol Methods, 2019, 98: 106576. doi:10.1016/j.vascn.2019.04.002 |
| [8] |
Braakhuis H M, He R, Vandebriel R J, et al. An air-liquid interface bronchial epithelial model for realistic, repeated inhalation exposure to airborne particles for toxicity testing[J]. J Vis Exp, 2020(159). doi:10.3791/61210 |
| [9] |
Graingrr C I, Greenwell L L, Lockley D J, et al. Culture of Calu-3 cells at the air interface provides a representative model of the airway epithelial barrier[J]. Pharm Res, 2006, 23(7): 1482-90. doi:10.1007/s11095-006-0255-0 |
| [10] |
Ji X, Sheng Y, Guan Y, et al. Evaluation of Calu-3 cell lines as an in vitro model to study the inhalation toxicity of flavoring extracts[J]. Toxicol Mech Methods, 2022, 32(3): 171-9. doi:10.1080/15376516.2021.1977880 |
| [11] |
Zavala J, Greenan R, Krantz Q T, et al. Regulating temperature and relative humidity in air-liquid interface in vitro systems eliminates cytotoxicity resulting from control air exposures[J]. Toxicol Res, 2017, 6(4): 448-59. doi:10.1039/C7TX00109F |
| [12] |
Matilainen L, Toropainen T, Vihola H, et al. In vitro toxicity and permeation of cyclodextrins in Calu-3 cells[J]. J Control Release, 2008, 126(1): 10-6. doi:10.1016/j.jconrel.2007.11.003 |
| [13] |
Foster K A, Avery M L, Yazdanian M, et al. Characterization of the Calu-3 cell line as a tool to screen pulmonary drug delivery[J]. Int J Pharm, 2000, 208(1-2): 1-11. doi:10.1016/S0378-5173(00)00452-X |
| [14] |
Kreft M E, Jerman U D, Lasi E, et al. The characterization of the human cell line Calu-3 under different culture conditions and its use as an optimized in vitro model to investigate bronchial epithelial function[J]. Eur J Pharm Sci, 2015, 69: 1-9. doi:10.1016/j.ejps.2014.12.017 |
| [15] |
李秋霞, 罗茂林, 李茹柳, 等. 紧密连接蛋白ZO-1研究概述[J]. 广州中医药大学学报, 2007, 6: 523-6. Li Q X, Luo M L, Li R L, et al. Overview of research on the tight junction protein ZO-1[J]. J Guangzhou Univ Tradit Chin Med, 2007, 6: 523-6. doi:10.3969/j.issn.1007-3213.2007.06.024 |
| [16] |
He R W, Gerlofs-Nijland M E, Boere J, et al. Comparative toxicity of ultrafine particles around a major airport in human bronchial epithelial (Calu-3) cell model at the air-liquid interface[J]. Toxicol In Vitro, 2020, 68: 104950. doi:10.1016/j.tiv.2020.104950 |
| [17] |
Sibinovska N, Žakelj S, Roškar R, et al. Suitability and functional characterization of two Calu-3 cell models for prediction of drug permeability across the airway epithelial barrier[J]. Int J Pharm, 2020, 585: 119484. doi:10.1016/j.ijpharm.2020.119484 |

