

骨髓抑制是化疗常见的副作用。研究发现,长期使用化疗药物5-氟尿嘧啶(5-fluorouracil,5-FU)可能引起造血干祖细胞受损,进一步发展为长期骨髓抑制,严重影响造血功能[1]。造血干细胞龛是维持造血干细胞自我更新、增殖分化的必要造血微环境,骨内膜龛(endosteal niche)和血管龛(vascular niche)曾是公认的两大最重要的“龛”[2]。近年来,文献报道由于骨内膜附近有大量骨髓内小动脉及血窦分布,骨内膜龛和血管龛之间存在功能上的交联[3]。大量实验证实分布在骨内膜附近血管周围具有成骨成脂双向分化潜能的间充质祖细胞群可分化形成成骨细胞系,是真正维持造血干细胞干性的“龛”——血管周龛(perivasular niche)的重要组成成分,血管周间充质祖细胞群通过分泌细胞生物活性因子如造血因子、信号分子、黏附分子等调控造血[4]。
5-FU广泛应用于固体肿瘤的治疗,尤其是结肠癌和乳腺癌[5-6]。既往研究发现,5-FU对骨髓有毒副作用,可导致骨髓基质细胞氧化损伤[7],但是否损伤血管周间充质祖细胞及其对造血细胞的影响尚不清楚。本实验通过Ⅱ型胶原酶消化小鼠股骨胫骨,分离出表达血管周造血龛关键基因Lepr、Cxcl12、Nestin,以及具有双向分化潜能的间充质祖细胞,旨在探究5-FU对血管周间充质祖细胞的损伤作用及其对造血支持功能的影响,为寻求减轻5-FU化疗后骨髓抑制的精准治疗提供理论依据和实验依据。
1 材料与方法 1.1 动物SPF级8周龄C57BL/6J小鼠,雌雄各半,体质量(20~25) g,重庆市医学实验动物中心购买,合格证号为SCXK (渝) 2012-0001。
1.2 主要药品与试剂当归多糖(陕西慈缘生物技术有限公司,CYC81105);5-FU(美国Sigma公司,F6627-1G);DMEM-F12(美国Gibco公司,C11330500BT);胎牛血清(澳大利亚MRC公司,FSP500);CCK-8试剂盒(日本同仁化学研究所,ab228554);MDA试剂盒(S0131S)、SOD试剂盒(S0103)、BCA法蛋白浓度测定试剂盒(P0012S)、衰老相关β-半乳糖甘酶试剂盒(C0602)均购自碧云天生物技术有限公司;成脂诱导分化培养基(MUBMX-90031)与成骨诱导分化培养基(MUBMX-90021)购自苏州赛业生物科技有限公司;RNAiso试剂(9109)、SYBR green I(RR420L)和逆转录试剂盒(RR047A)购自日本TaKaRa生物技术有限公司。
1.3 方法 1.3.1 细胞培养与分组无菌条件下取小鼠股骨、胫骨并剪碎,用1 g·L-1Ⅱ型胶原酶于37 ℃消化骨碎片30 min,1 500 r·min-1离心消化液得到血管周间充质祖细胞。调整细胞浓度为2.5×108个·L-1接种于35 mm2培养皿中,以含10%胎牛血清的DMEM-F12培养基培养于37 ℃,5% CO2培养箱内。细胞融合率达90%后,用0.25%胰酶消化传代,取第三代细胞进行后续实验。细胞分为两组:对照组,即常规培养;5-FU组,加入0.25 g·L-1 5-FU作用48 h[7]。
建立共培养体系:无菌条件下冲取小鼠双侧股骨、胫骨骨髓,Ficoll密度梯度离心法制备骨髓单核细胞悬液,贴壁培养12 h后,收集悬浮造血细胞,调整细胞浓度为2.5×109个·L-1与血管周间充质祖细胞饲养层共培养24 h。
1.3.2 血管周间充质祖细胞鉴定经上述方法得到血管周间充质祖细胞,体外培养至第3代,提取DNA,配制2%琼脂糖溶液进行凝胶电泳分析。
1.3.3 台盼蓝染色计数分别收集两组造血细胞和血管周间充质祖细胞,用0.4%台盼蓝(1 ∶10)染色2 min,在3 min内完成活细胞计数。
1.3.4 CCK-8法检测血管周间充质祖细胞增殖取第3代血管周间充质祖细胞,以3×103/孔的细胞密度接种在96孔板中,待融合率达90%后,加入0.25 g·L-1 5-FU分别作用24,48,72和96 h,再加入20 μL/孔CCK-8工作液,37 ℃孵育2 h,酶标仪450 nm波长处测定OD值。根据OD值计算细胞存活率,存活率(VR)/%=[(OD实验组-OD空白组)/ (OD对照组-OD空白组)]×100%。
1.3.5 细胞衰老相关SA-β-Gal染色按照试剂盒说明,分别对两组造血细胞和血管周间充质祖细胞进行衰老染色:PBS清洗细胞后,加入染色固定液固定15 min,去除固定液,再次PBS清洗细胞,按说明书配制染色工作液,于37 ℃水浴箱中孵育8 h。光镜下每组随机观察不同视野中至少1 000个细胞,计算染色阳性率。
1.3.6 流式细胞术检测血管周间充质祖细胞凋亡0.25%胰酶分别消化两组血管周间充质祖细胞,PBS清洗并离心收集于1.5 mL EP管中,每管加入0.5 mL PBS重悬细胞,加入5 μL Annexin V-FITC, 4 ℃避光孵育10 min, 用PI复染,流式细胞仪检测细胞凋亡。
1.3.7 氧化指标检测分别收集血管周间充质祖细胞和共培养的造血细胞,细胞裂解液裂解细胞后收集上清液,按照试剂盒说明,分别检测两组细胞中脂质氧化物MDA和超氧化物歧化酶SOD水平。
1.3.8 血管周间充质祖细胞成骨潜能检测血管周间充质祖细胞以2×105/孔的细胞密度接种于6孔板中,5-FU作用48 h后,PBS清洗培养基,加入2 mL成骨诱导培养基,每2 d避光换液,14 d后用4%多聚甲醛固定并进行茜素红染色。观察拍照后,以100 μL/孔异丙醇溶解茜素红染液,酶标仪测定490 nm处吸光度值以便定量分析。
1.3.9 血管周间充质祖细胞成脂潜能检测血管周间充质祖细胞以2×105/孔的细胞密度接种于6孔板中,5-FU作用48 h后,PBS清洗培养基,加入2 mL成脂诱导培养基A液,48 h后更换成脂诱导培养基B液培养24 h,A、B液交替培养20 d后,用4%多聚甲醛固定并进行油红O染色。观察拍照后,以100 μL/孔异丙醇溶解油红O染液,酶标仪测定490 nm处吸光度值以便定量分析。
1.3.10 qRT-PCR检测用TRIzol试剂分别提取两组血管周间充质祖细胞和造血细胞总RNA,按照逆转录试剂盒说明制备cDNA,SYBR II染料法进行荧光定量PCR反应。采用2-ΔΔCT方法定量计算相对表达量,GAPDH作为标准化基因。引物序列见Tab 1。
| Gene | Direction | Primer sequence (5′→3′) | GeneBank accession number | PCR product size/bp |
| Runx2 | Forward | AACAGCAGCAGCAGCAGCAG | NM_001271631.1 | 192 |
| Reverse | GCACCGAGCACAGGAAGTTGG | |||
| Osterix | Forward | GCGGCAAGGTGTATGGCAAGG | XM_006520519.5 | 176 |
| Reverse | GCAGAGCAGGCAGGTGAACTTC | |||
| OPN | Forward | AAGAGCGGTGAGTCTAAGGAGTCC | NM_001204203.1 | 91 |
| Reverse | TGCCCTTTCCGTTGTTGTCCTG | |||
| Ang-1 | Forward | TAACCGGATTCAACATGGGCA | NM_001286062.1 | 101 |
| Reverse | GAGCGTTGGTGTTGTACTGC | |||
| CXCL12 | Forward | TGACGGTAAACCAGTCAGCC | NM_001012477.2 | 129 |
| Reverse | CGTGCAACAATCTGAAGGGC | |||
| G-CSF | Forward | TGCCAACTTTGCCACCACCATC | XM_030245517.2 | 108 |
| Reverse | CGCTGGAAGGCAGAAGTGAAGG | |||
| ICAM1 | Forward | CGGAGGATCACAAACGAAGC | NM_010493.3 | 149 |
| Reverse | CTCTTGCCAGGTCCAGTTCC | |||
| VCAM1 | Forward | GTTGTTCTGACGTGTGCTGC | NM_011693.3 | 129 |
| Reverse | CACAGAGCTCAACACAAGCG | |||
| VLA4 | Forward | TGTCCTACTGGTCCCGACAT | NM_010578.2 | 87 |
| Reverse | CCAAATCAGCAGCAAGGCAA | |||
| LFA1 | Forward | GAAGCTGAGCAGCCTTGTCT | NM_001253873.1 | 102 |
| Reverse | CTTGGAGAGTTCCACGGTCC | |||
| SCF | Forward | CGGGATGGATGTTTTGCCTA | XM_006513315.4 | 188 |
| Reverse | TCTTCGGTGCGTTTTCTTCC |
数据采用SPSS 20.0进行分析。计量资料均用x±s表示,两组数据的比较采用两两比较的独立样本t检验。
2 结果 2.1 血管周间充质祖细胞鉴定琼脂糖凝胶电泳结果显示,体外分离培养细胞Lepr、CXCL12、Nestin基因和成骨相关基因OPN、RUNX2均有高表达,成脂相关基因PPARγ表达较弱,符合血管周间充质祖细胞特征,见Fig 1。
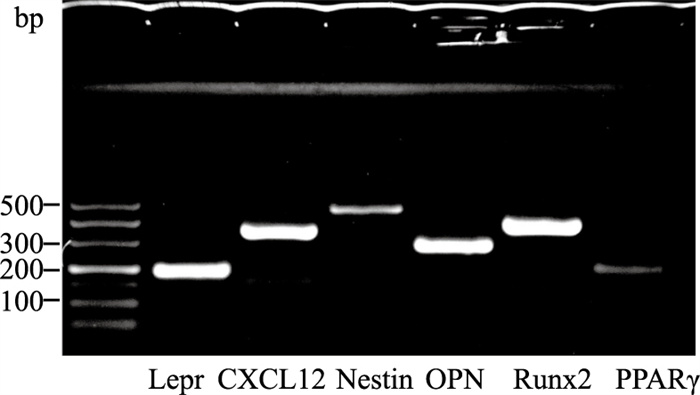
|
| Fig 1 Perivascular hematopoietic niche-related gene expression of perivascular mesenchymal progenitor cells identified by agarose gel electrophoresis |
台盼蓝拒染法计数活细胞,结果显示,5-FU组活细胞数为(0.73±0.06)×106, 明显低于对照组(1.36±0.08)×106,差异具有统计学意义(P < 0.01)(Fig 2A)。以0.25 g·L-1 5-FU作用血管周间充质祖细胞24、48、72、96 h后,采用CCK-8法检测5-FU对血管周间充质祖细胞增殖的影响,结果表明,作用48 h后,5-FU明显抑制细胞增殖(P < 0.01)(Fig 2B)。特异性β-半乳糖苷酶染色后观察细胞形态并计算衰老细胞阳性率,结果显示,5-FU组细胞变圆体积变大,衰老阳性率明显增加(Fig 2C, D)。流式细胞术检测细胞凋亡水平,LR代表早期凋亡细胞,UR代表晚期凋亡细胞,发现5-FU作用后细胞凋亡率明显升高(P < 0.05)(Fig 2E,F)。以上结果提示,5-FU对血管周间充质祖细胞有毒性作用,抑制细胞增殖。
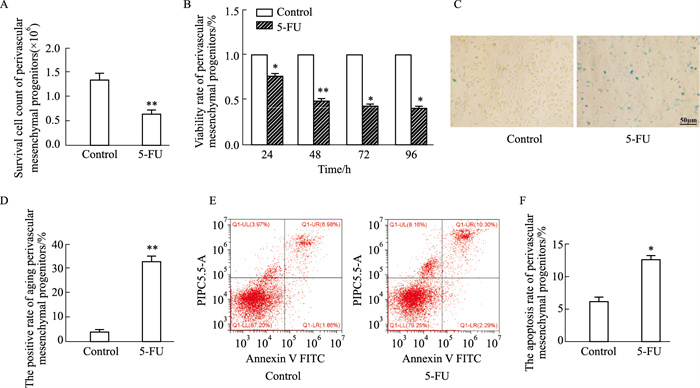
|
| Fig 2 Perivascular mesenchymal progenitor cells apoptosis and premature senescence induced by 5-FU (x±s, n=3) A: The quantitative diagram of the viable perivascular mesenchymal progenitor cells counted by Trypan blue staining; B: Effect of 5-FU on proliferation of perivascular mesenchymal progenitor cells by CCK-8 assay; C: The representative images of senescent perivascular mesenchymal progenitor cells presented by senescence-related SA-β-gal staining. Senescent cells are blue-green stained; D: Positive rate of senescent cells stained by SA-β-Gal; E: Annexin V-FITC/PI double staining was employed to detect cell apoptosis by flow cytometry; F: The apoptotic rate of perivascular mesenchymal progenitor cells. *P < 0.05, **P < 0.01 vs control |
MDA和SOD检测结果显示(Tab 2),5-FU组细胞内脂质氧化物MDA水平明显升高(P < 0.05),而抗氧化酶SOD水平明显降低(P < 0.01),提示5-FU损伤血管周间充质祖细胞抗氧化能力。进一步分别对两组细胞进行成骨成脂诱导分化培养,检测受损血管周间充质祖细胞双向分化潜能的变化。茜素红染色和油红O染色结果显示,5-FU组血管周间充质祖细胞成骨结节明显减少,脂滴数量明显上升;酶标仪检测吸光度值定量分析结果与其趋势一致(Fig 3A-3D)。进一步检测成骨相关基因表达,qRT-PCR结果表明,5-FU处理明显降低血管周间充质祖细胞中Osterix、RUNX2和OPN成骨基因mRNA合成(Fig 4)。以上结果提示,5-FU诱发的氧化损伤可抑制血管周间充质祖细胞成骨分化潜能。
| Group | MDA/mmol·g-1 | SOD/kU·g-1 |
| Control | 1.33±0.17 | 27.49±0.34 |
| 5-FU | 2.54±0.22* | 15.73±0.11** |
| *P < 0.05, **P < 0.01 vs control | ||
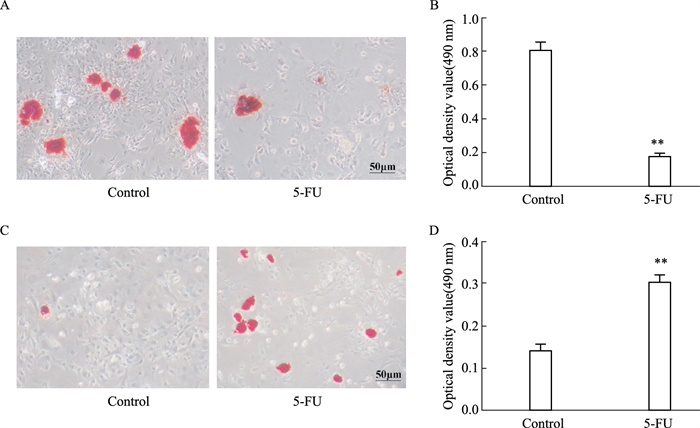
|
| Fig 3 Osteogenic/adipogenic differentiation balance of perivascular mesenchymal progenitor cells destroyed by 5-FU(x±s, n=3) A: The representative image of induced osteogenic differentiation of perivascular mesenchymal progenitors in vitro by alizarin red staining; B: Quantitative analysis of alizarin red staining; C: The representative image of induced adipogenic differentiation in vitro of perivascular mesenchymal progenitors stained by Oil red O; D: Quantitative analysis of Oil red O staining. **P < 0.01 vs control |
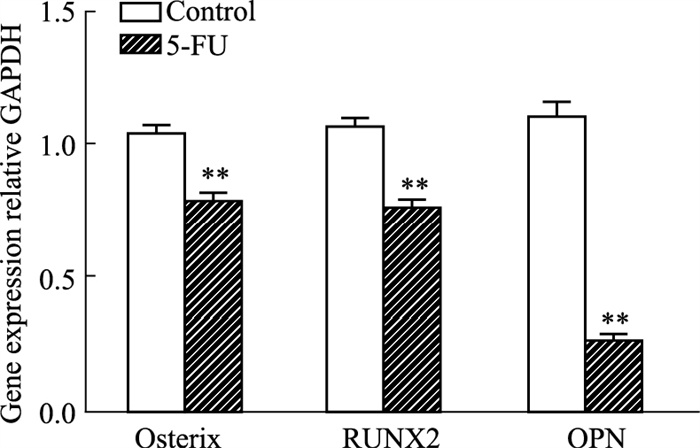
|
| Fig 4 Analysis of mRNA expression of osteogenic related factors in perivascular mesenchymal progenitors (x±s, n=3) **P < 0.01 vs control |
干细胞因子(SCF)、趋化配体12(CXCL12)和粒细胞集落刺激因子(G-CSF)是重要的造血因子,具有促进造血干细胞自我更新以及正向调控造血功能。如Fig 5,5-FU作用后,SCF、CXCL12和G-CSF基因表达明显降低。血管生成素1/酪氨酸激酶2(Ang-1/tie 2),血小板生成素及其受体(TPO/MPL)和Jagged-1/Notch参与维持造血干细胞静止,是造血干细胞龛重要的信号调控分子。黏附分子血管细胞黏附分子/晚期抗原4(VCAM-1/VLA-4)和淋巴细胞功能相关蛋白/细胞间黏附分子1(LFA-1/ICAM-1)促进骨髓基质细胞与造血干/祖细胞相互作用,协助造血干/祖细胞黏附于有利的造血微环境,参与调控造血干/祖细胞增殖分化。实验结果表明,除了Jagged-1/Notch信号分子表达无明显改变,5-FU可明显降低血管周间充质祖细胞和共培养的造血细胞之间信号分子对和黏附分子对基因转录(Fig 6,7)。上述结果提示,5-FU损伤血管周间充质祖细胞,削减骨髓血管周龛支持造血的功能。
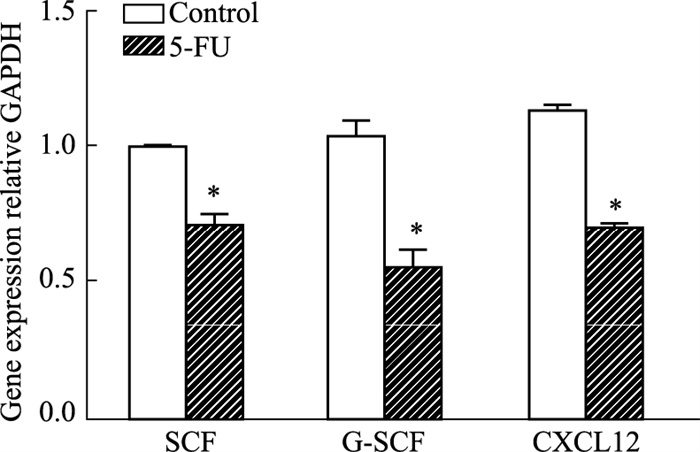
|
| Fig 5 Analysis of mRNA expression of hematopoietic related factors in perivascular mesenchymal progenitors (x±s, n=3) *P < 0.05 vs control |

|
| Fig 6 Analysis of mRNA expression of signal factors between perivascular mesenchymal progenitor cells and hematopoietic cells (x±s, n=3) *P < 0.05, **P < 0.01 vs control |

|
| Fig 7 Analysis of mRNA expression of adhesion molecules between perivascular mesenchymal progenitor cells and hematopoietic cells (x±s, n=3) **P < 0.01 vs control |
在血管周间充质祖细胞饲养层与造血细胞的共培养体系中,台盼蓝活细胞计数结果显示,与5-FU组饲养层共培养的造血细胞数明显减少(Fig 8A)。衰老特异性SA-β-Gal染色结果显示,5-FU共培养组造血细胞衰老阳性率升高(Fig 8B,C),差异具有统计学意义(P < 0.01)。进一步检测造血细胞胞内抗氧化酶SOD和脂质氧化物MDA水平,结果提示,5-FU饲养层削弱共培养造血细胞抗氧化能力(Tab 3)。综上所述,5-FU损伤间充质祖细胞构成的血管周造血龛,受损的造血微环境可能导致造血细胞氧化应激增强,发生应激性衰老。

|
| Fig 8 Injuryed hematopoietic microenvironment caused cytopenia and senescence of co-cultured hematopoietic cells(x±s, n=3) A: The quantitative diagram of the viable co-cultured hematopoietic cells counted by Trypan blue staining; B: The representative images of senescent co-cultured hematopoietic cells presented by senescence-related SA-β-gal staining. Senescent cells are blue-green stained (Scale bar=50 μm); C: Positive rate of senescent cells stained by SA-β-Gal.**P < 0.01 vs control |
| Group | MDA/μmol·mg-1 | SOD/U·mg-1 |
| Control | 1.25±0.14 | 32.88±0.29 |
| 5-FU | 2.12±0.25* | 17.36±0.12** |
| *P < 0.05, **P < 0.01 vs control | ||
化疗药物的细胞毒性、干细胞移植的骨髓排斥反应、细胞黏附介导的耐药是化疗后造血功能障碍的研究热点。造血干细胞储备减少和自我更新缺陷是导致化疗后长期骨髓抑制的主要原因,通常与造血微环境损伤密切相关。研究发现,除了内皮细胞构成的血管龛外,骨髓血窦和小动脉周围的血管周间充质细胞构成的血管周龛起到促进造血干细胞维持,支持造血干/祖细胞活性的主要作用。血管周间充质祖细胞靠近干骺端骨小梁的骨表面,具有成骨和成脂分化潜能,其中成骨分化产生的成骨细胞系可迁移到骨内膜,和新形成的小梁骨一起形成造血干细胞生存的主要微环境[8]。
长期化疗可能损害造血微环境导致骨髓脂肪化。大量研究表明, 在小鼠骨髓不同区域,脂肪细胞数量与造血干细胞数量、活性呈反比;随年龄增长脂肪在人骨髓中堆积,引起骨质疏松、造血微环境功能受损,其机制与氧化应激有关[9]。课题组前期实验结果证实,5-FU导致骨髓基质细胞偏向成脂分化,其机制可能与氧化损伤有关[10]。本研究进一步证实,5-FU削弱骨髓血管周间充质祖细胞抗氧化能力,抑制细胞生长,诱发细胞凋亡和衰老,造血龛成骨/成脂分化潜能失衡。文献表明,成骨分化离不开RUNX2及其下游基因Osterix的表达[11];Stier等[12]通过结合外源性OPN和OPN缺陷小鼠的研究证实OPN对于维持造血干/祖细胞数量和功能的重要性。在本研究中我们发现5-FU处理后血管周围间充质祖细胞形成骨结节减少,并且成骨相关因子RUNX2、osterix和OPN的表达明显降低;相反诱导分化的脂滴形成增加,提示造血龛的骨分化潜能受损。
血管周龛中,血管周间充质祖细胞分泌多种可溶性因子,并通过各种信号分子和黏附分子与造血细胞相互作用,共同调控造血。SCF和CXCL12是调节造血干细胞自我更新和增殖定居的重要细胞因子,主要由血管周围间充质祖细胞,即Nestin+、Lepr+或Prx-1+的CAR细胞(高表达CXCL12的网状细胞)表达[5]。研究发现,基质细胞与造血干细胞间信号分子Ang-1/tie 2, TPO/MPL和Jagged-1/Notch参与造血调控:Ang-1/Tie2信号通路可以使造血干细胞黏附于骨内膜附近,维持造血干细胞的功能[13],造血干细胞表达的Tie2维持造血干细胞处于未分化状态[14];TPO及其受体MPL是造血干细胞和巨核细胞的主要调控因子,造血干细胞中MPL的表达有利于保持造血干细胞长期自我更新的能力[15];Notch途径是维持长期造血干细胞(LT-HSCs)自我更新的重要分子,强化Notch1以及Notch4能够增强造血干细胞的自我更新能力,并抑制分化[16]。有报道表明骨内膜基质成骨细胞系表达黏附分子与造血干细胞表面的对应分子结合调控造血干细胞:ICAM-1和VCAM-1调控造血干细胞增殖;此外,条件性敲除造血细胞的黏附分子VLA-4或VCAM-1, 可以有效地抑制造血干细胞的迁移以及在骨髓腔内的定居[17]。实验结果提示,5-FU诱导血管周间充质祖细胞氧化损伤,削弱其成骨分化潜能,从而下调了重要的造血因子、细胞间信号分子及黏附分子转录,严重损伤血管周龛功能。
高氧造血微环境无疑对造血细胞有损伤作用。为了阐明功能失调的血管周间充质祖细胞对造血细胞的直接调控作用,本研究进一步以血管周间充质祖细胞为饲养层,建立共培养体系,实验证实血管周间充质祖细胞的损伤导致造血细胞数量减少,细胞内活性氧(reactive oxygen species, ROS)清除能力降低,造血细胞中脂氧化物水平升高,并且出现衰老征象。这与课题组前期研究结果一致,5-FU处理后人骨髓间充质干细胞HS-5细胞Cx43缝隙连接蛋白的表达水平降低[6]。
综上所述,5-FU可导致骨髓血管周龛间充质祖细胞氧化应激损伤,成骨/成脂分化失衡,进一步减少造血细胞因子分泌、下调与造血细胞间黏附作用和信号转导,影响血管周龛的造血支持功能,间接引起造血细胞应激性早衰。但造血微环境损伤诱导造血细胞应激性衰老的确切机制尚不清楚,本课题组将在后续工作中进一步探究。
| [1] |
Schepers K, Campbell T B, Passegué E. Normal and leukemic stem cell niches: Insights and therapeutic opportunities[J]. Cell Stem Cell, 2015, 16(3): 254-67. |
| [2] |
Crane G M, Jeffery E, Morrison S J. Adult haematopoietic stem cell niches[J]. Nat Rev Immunol, 2017, 17(9): 573-90. doi:10.1038/nri.2017.53 |
| [3] |
Pinho S, Frenette P S. Haematopoietic stem cell activity and interactions with the niche[J]. Nat Rev Mol Cell Biol, 2019, 20(5): 303-20. doi:10.1038/s41580-019-0103-9 |
| [4] |
Hurwitz S N, Jung S K, Kurre P. Hematopoietic stem and progenitor cell signaling in the niche[J]. Leukemia, 2020, 34(12): 3136-48. doi:10.1038/s41375-020-01062-8 |
| [5] |
Vodenkova S, Buchler T, Cervena K, Veskrnova V. 5-fluorouracil and other fluoropyrimidines in colorectal cancer: Past, present and future[J]. Pharmacol Ther, 2020, 206: 107447. doi:10.1016/j.pharmthera.2019.107447 |
| [6] |
黄燕花, 王鲁妮, 刘泽, 刘凌. 阿司匹林通过抑制β-catenin/EMT信号通路促进5-FU诱导食管癌细胞凋亡[J]. 中国药理学通报, 2020, 36(5): 655-9. Huang Y H, Wang L N, Liu Z, Liu L. Aspirin promates apoptosis of esophageal cancer cells induced by 5-FU through inhibiting β-catenin/EMT signaling pathway[J]. Chin Pharmacol Bull, 2020, 36(5): 655-9. |
| [7] |
肖含先之, 齐嵘嘉, 汪子铃, 等. 5-氟尿嘧啶通过下调Wnt/β-catenin信号通路抑制骨髓基质细胞增殖[J]. 中国细胞生物学学报, 2019, 41(6): 1059-66. Xiao H X Z, Qi R J, Wang Z L. 5-Fluorouracil inhibits proliferation of bone marrow stromal cells via down regulating Wnt/β-catenin signaling pathway[J]. J Mol Cell Biol, 2019, 41(6): 1059-66. |
| [8] |
Zhou B O, Yue R, Murphy M M, et al. Leptin-receptor-expressing mesenchymal stromal cells represent the main source of bone formed by adult bone marrow[J]. Cell Stem Cell, 2014, 15(2): 154-68. |
| [9] |
Ambrosi T H, Scialdone A, Graja A, et al. Adipocyte accumulation in the bone marrow during obesity and aging impairs stem cell-based hematopoietic and bone regeneration[J]. Cell Stem Cell, 2017, 20(6): 771-84.e6. doi:10.1016/j.stem.2017.02.009 |
| [10] |
齐嵘嘉, 肖含先之, 汪子铃, 等. 当归多糖减轻5-氟尿嘧啶对骨髓基质细胞成骨分化的抑制[J]. 中国细胞生物学学报, 2020, 42(3): 435-43. Qi R J, Xiao H X Z, Wang Z L, et al. Angelica sinensis polysaccharides reduced 5-fluorouracil induced inhibition on osteogenic differentiation of bone marrow stromal cells[J]. J Mol Cell Biol, 2020, 42(3): 435-43. |
| [11] |
Komori T. Regulation of proliferation, differentiation and functions of osteoblasts by Runx2[J]. Int J Mol Sci, 2019, 20(7): 1694. doi:10.3390/ijms20071694 |
| [12] |
Stier S, Ko Y, Forkert R, et al. Osteopontin is a hematopoietic stem cell niche component that negatively regulates stem cell pool size[J]. J Exp Med, 2005, 201(11): 1781-91. |
| [13] |
Arai F, Hirao A, Ohmura M, et al. Tie2/angiopoietin-1 signaling regulates hematopoietic stem cell quiescence in the bone marrow niche[J]. Cell, 2004, 118(2): 149-61. |
| [14] |
Moore K A, Lemischka I R. "Tie-ing" down the hematopoietic niche[J]. Cell, 2004, 118(2): 139-40. |
| [15] |
Cui L, Moraga I, Lerbs T, et al. Tuning MPL signaling to influence hematopoietic stem cell differentiation and inhibit essential thrombocythemia progenitors[J]. Proc Natl Acad Sci USA, 2021, 118(2): e2017849118. |
| [16] |
Rho S S, Kobayashi I, Oguri-Nakamura E, et al. Rap1b promotes Notch-signal-mediated hematopoietic stem cell development by enhancing integrin-mediated cell adhesion[J]. Dev Cell, 2019, 49(5): 681-96.e6. |
| [17] |
Chen L, Zhao Q, Wang X L, et al. ZLJ-6, a novel COX/5-LOX inhibitor, attenuates TNF-α-induced endothelial E-selectin, ICAM-1 and VCAM-1 expression and monocyte-endothelial interactions via a COX/5-LOX-independent mechanism[J]. Vascul Pharmacol, 2011, 55(5-6): 135-42. |

