

糖尿病人群易发心肌并发症,主要有冠心病、心肌病、心功能失常等,其中糖尿病心肌病(diabetic cardio myopathy,DCM)发病率较高,心肌纤维化(myocardial fibrosis,MF)是DCM的一种主要病理特征,心肌成纤维细胞(cardiac fibroblast,CFs)是心肌间质的主要细胞,对维持心肌的结构与功能具有十分重要的作用[1]。丹参中含有丰富的丹酚酸物质,丹酚酸B(salvianolic acid B,SalB)是丹酚酸中含量最丰富、生物活性最强的物质。越来越多的证据表明,它对多种器官和组织具有抗纤维化作用,包括肝脏[2]和肾脏[3]等。RhoA/ROCK途径影响着细胞增殖、黏附、迁移、凋亡等生物行为,是重要的调节枢纽之一[4]。在糖尿病心肌中,RhoA表达和活性的增加导致ROCK靶点磷酸化增加,导致肌动蛋白聚合增加,可能与糖尿病心脏功能障碍有关。ROCK蛋白有两种亚型,ROCK1和ROCK2,但二者在调控心肌功能方面有着一定的区别,目前认为,ROCK1参与血管平滑肌增生、心肌肥厚和组织纤维化过程,而ROCK2则更倾向于影响心肌细胞肥大功能。但ROCK1、ROCK2在高糖诱导CFs增殖、转分化及糖尿病心肌纤维化过程中具体作用如何,目前尚不十分明确。因此,本实验基于RhoA/ROCK1信号通路,建立糖尿病大鼠模型以及高糖诱导CFs,探讨SalB对糖尿病大鼠心肌纤维化的作用及其作用机制。
1 材料与方法 1.1 材料 1.1.1 动物、药品与试剂锦州医科大学实验动物中心选购♂Sprague-Dawley大鼠;鼠龄在1~3d之间的大鼠乳鼠,选购标准符合实验要求;链脲佐菌素STZ(sigma公司);SalB(美仑MB6598);ROCK抑制剂Y-27632(APEX BIO公司A3008);DMEM培养基(Hyclone公司);增强型CCK8试剂盒(碧云天生物科技有限公司);α-SMA抗体(博士德公司WL02509);CollagenⅠ抗体(博士德公司WL0088);RhoA抗体(abcam公司ab187027);ROCK1抗体(abcam公司ab134181)、CollagenⅢ(博士德公司WL03186)。
1.1.2 仪器CO2细胞培养箱(日本SANYO公司);酶标仪(奥地利Anthos公司);荧光显微镜(德国Leica公司);电泳系统、化学发光凝胶系统成像仪(美国Bio-Rad公司);高速冷冻离心机(Hitachi公司)。
1.2 方法 1.2.1 糖尿病大鼠模型建立及分组随机选取体质量(250±20)g,健康♂ SD大鼠50只,其中40只尾静脉一次性注射30 mg·kg-1 STZ(由枸橼酸缓冲液提前配置)制备糖尿病大鼠模型。72 h后检测血糖指标(血糖浓度大于16.7 mmol·L-1),尿糖检测呈阳性的大鼠视为模型建立成功。另外10只设为正常对照组(Control),尾静脉注射等量的0.1 mmol·L-1枸橼酸缓冲液。将建模成功的糖尿病大鼠随机分为4组: DM组、DM+SalB低剂量组(80 mg·kg·d-1)、DM+SalB中剂量组(120 mg·kg·d-1)、DM+SalB高剂量组(160 mg·kg·d-1)。SalB组在建模成功后每天进行灌胃给药处理。共饲养12周。
1.2.2 天狼星红染色取左室心肌组织,用新鲜配置的多聚甲醛溶液固定,不同浓度的无水乙醇脱水处理,石蜡包埋,常规石蜡切片脱蜡,天狼星红染色10 min,无水乙醇稍洗后沥干,脱水透明,中性树脂封片,于镜下观察胶原纤维呈红色,拍照保存。
1.2.3 CFs原代培养新生SD大鼠乳鼠,1~3 d,♀♂不拘,75%酒精消毒,用无菌的手术剪刀将心脏快速取出,放于预冷的PBS缓冲液烧杯中清洗干净,再使用眼科剪将心肌组织剪成大约1 mm3的组织碎块,将烧杯中剩余的PBS液体吸去,再加入0.25%的胰蛋白酶消化液,并将组织碎块转移至离心管中进行消化,5 min后将上清吸去。继续加入胰酶消化液并放入细胞培养箱中8 min,摇晃使组织碎块充分的消化,静置后,将离心管中的上清液吸出,并置于装有新鲜配置的含10%胎牛血清的DMEM培养液(完全培养基)的离心管中终止消化,重复消化数次直至组织碎块消失。消化好的上清液合并后,1 200 r·min-1离心5 min,吸除上清液,再加入完全培养基,将细胞沉淀轻轻吹散,混悬均匀后接种于培养瓶中差速贴壁1 h,更换完全培养基继续培养。待细胞培养贴至融合时,进行消化传代处理,后续实验使用2~4代细胞。
1.2.4 检测细胞活力将CFs细胞接种到96孔板,加入完全培养基贴壁培养1 d后,更换无血清培养基,使CFs处在同步生长状态。将CFs分为6组,每组设5复孔:正常组(Control组),高糖组(HG组,25 mmol·L-1葡萄糖),高渗透压对照组(MG组,19.5 mmol·L-1甘露醇+5.5 mmol·L-1葡萄糖),不同浓度SalB组(12.5 μmol·L-1、25 μmol·L-1、50 μmol·L-1)预处理1 h,高糖诱导24 h,观测CFs的活力情况,确定SalB最佳给药浓度。CCK-8试剂盒检测各分组的吸光度OD值。
1.2.5 细胞分组及药物处理① Control组(5.5 mmol·L-1葡萄糖),②HG组(25 mmol·L-1葡萄糖),③HG+SalB组(25 μmol·L-1 SalB预处理CFs 1 h,HG诱导),④HG+Y-27632组(10 μmol·L-1 ROCK抑制剂Y-27632预处理细胞1 h,HG诱导),⑤HG+Y-27632+SalB组(10 μmol·L-1 ROCK抑制剂Y-27632预处理细胞1 h,25 μmol·L-1 SalB预处理CFs 1 h,HG诱导)
1.2.6 免疫荧光实验将CFs接种于24孔培养板内,当细胞覆盖70%视野时,将各分组加入不同药物作用24 h,弃培养液,PBS缓冲液清洗;4%多聚甲醛固定40 min,0.5% Triton X-100处理30 min,PBS缓冲液清洗;5% BSA作用30 min;各孔加入稀释的RhoA一抗溶液(1 ∶ 100),4 ℃孵育过夜;PBS漂洗后,加入TRITC标记的荧光二抗,室温下避光静置孵育1 h;PBS漂洗,DAPI染细胞核避光5 min,吸出DAPI染液,PBS漂洗,于荧光显微镜下拍照保存。
1.2.7 Western blot各组处理因素作用CFs 24 h后,将培养基倒掉,立即放入预冷的裂解液中,在冰上进行操作,使用微量移液器吹打,冰浴中静置裂解30 min。将裂解好的CFs置于冷冻离心机离心(10 000×g、4 ℃、25 min),取上清液,用BCA法进行蛋白质浓度测定。SDS-PAGE凝胶电泳,用移液器逐个上样,上样量为20 μg。结束后将PVDF膜于封闭液中室温封闭1 h,分别加入稀释后的兔抗大鼠CollagenⅠ一抗、兔抗大鼠CollagenⅢ一抗、兔抗大鼠RhoA一抗、兔抗大鼠ROCK1一抗、兔抗大鼠α-SMA一抗,4 ℃过夜。次日TBST洗膜3次,每次10 min,加入山羊抗兔二抗稀释液(1:5000),室温孵育1 h。TBST清洗后进行ECL化学发光显影检测蛋白条带灰度值。
1.3 统计学方法实验数据分析软件为SPSS 22.0,用x±s表示。进行One-way ANOVA及LSD-t检验,并作组间对比。
2 结果 2.1 SalB对糖尿病大鼠左室心肌胶原表达的影响在显微镜下胶原组织显红色。Control组大鼠左室心肌胶原纤维呈现均匀分布状态;与Control组相比,DM组织间隙变大,红色胶原面积明显增多;与DM组相比,DM+SalB(80 mg·kg·d-1)、DM+SalB(120 mg·kg·d-1)和DM+SalB(160 mg·kg·d-1)各组胶原面积表达明显减少,组织间隙明显减小(Fig 1)。
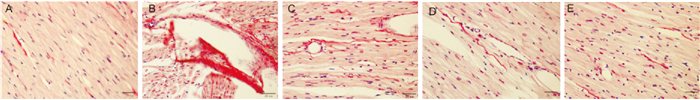
|
| Fig 1 Effect of SalB on collagen expression in left ventricular myocardium of diabetic rats (×200) A: Control group; B: DM group; C: DM+SalB(80 mg·kg·d-1)group; D: DM+SalB(120 mg·kg·d-1)group; E: DM+SalB(160 mg·kg·d-1)group |
Western(Fig 2)显示:与Control组相比,DM组α-SMA、CollagenⅠ、Collagen Ⅲ蛋白表达水平明显升高(P<0.01);与DM组相比,DM+SalB(80 mg·kg·d-1)组、DM+SalB(120 mg·kg·d-1)和DM+SalB(160 mg·kg·d-1)组α-SMA、CollagenⅠ、Collagen Ⅲ蛋白水平均降低(P<0.01),呈现一定的剂量依赖性。

|
| Fig 2 Effects of SalB on expression of α-SMA, Collagen Ⅰ and Collagen Ⅲ in left ventricular myocardium of diabetic rats (n=3) 1:Control group; 2:DM group; 3:DM+SalB(80 mg·kg·d-1)group; 4:DM+SalB(120 mg·kg·d-1)group; 5:DM+SalB(160 mg·kg·d-1)group. **P < 0.01 vs Control group; ##P < 0.01 vs DM group |
如Tab 1所示,与Control组相比,HG组(25 mmol·L-1)诱导CFs活力明显增强(P<0.01);与HG组相比,不同浓度SalB(12.5、25、50 μmol·L-1)干预,对CFs活力均出现抑制作用(P<0.05),25 μmol·L-1 SalB给药组已具有极显著性差异(P<0.01),后续实验选取SalB的给药浓度为25 μmol·L-1。MG组细胞无明显变化(P>0.05),提示渗透压对CFs活力无影响。
| Group | Concentration/μmol·L-1 | OD/490nm | Cell viability Rate/% |
| Control | 0.245±0.019 | 100.00 | |
| MG | 0.251±0.025 | 100.38 | |
| HG | 0.498±0.015** | 192.18 | |
| HG+SalB | 12.5 | 0.476±0.029# | 190.15 |
| 25 | 0.373±0.010## | 121.05 | |
| 50 | 0.321±0.008## | 114.66 | |
| **P<0.01 vs Control group;#P<0.05,##P<0.01 vs HG group | |||
免疫荧光结果实验显示(Fig 3),蓝色荧光代表细胞核,红色荧光代表RhoA,与Control组相比,HG组细胞RhoA红色荧光强度明显增强;与HG组相比,HG+SalB组以及HG+Y-27632组RhoA荧光强度减弱;HG+Y-27632+SalB组RhoA荧光强度减弱更加明显。
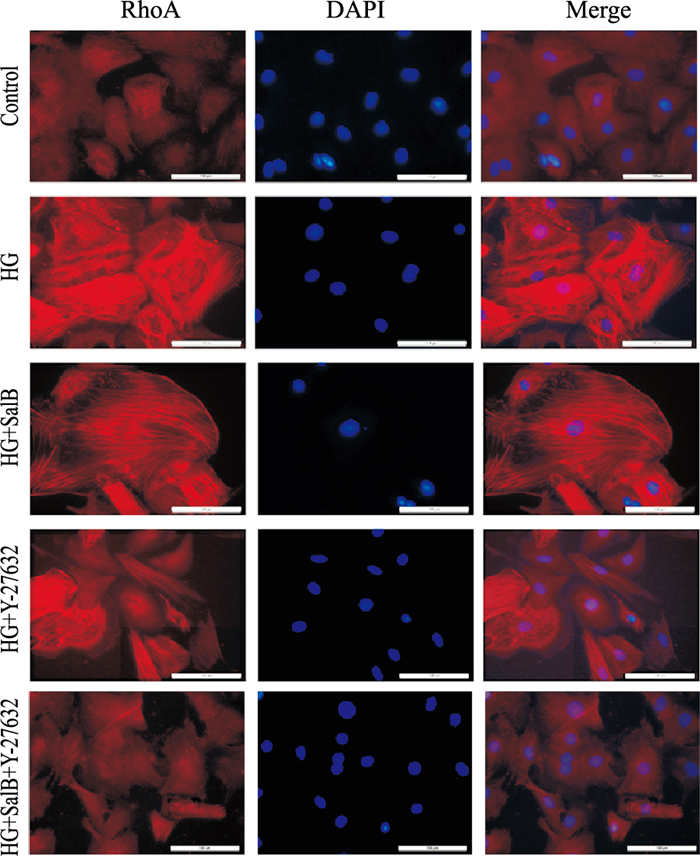
|
| Fig 3 Effect of SalB on expression of RhoA in CFs induced by high glucose (×400) |
Western(Fig 4)显示:与Control组相比,HG组α-SMA、RhoA、ROCK1、CollagenⅠ、Collagen Ⅲ蛋白表达水平明显升高(P<0.01);与HG组相比,HG+SalB组与HG+Y-27632组上述蛋白水平降低(P<0.01);HG+Y-27632+SalB组水平降低更加显著。
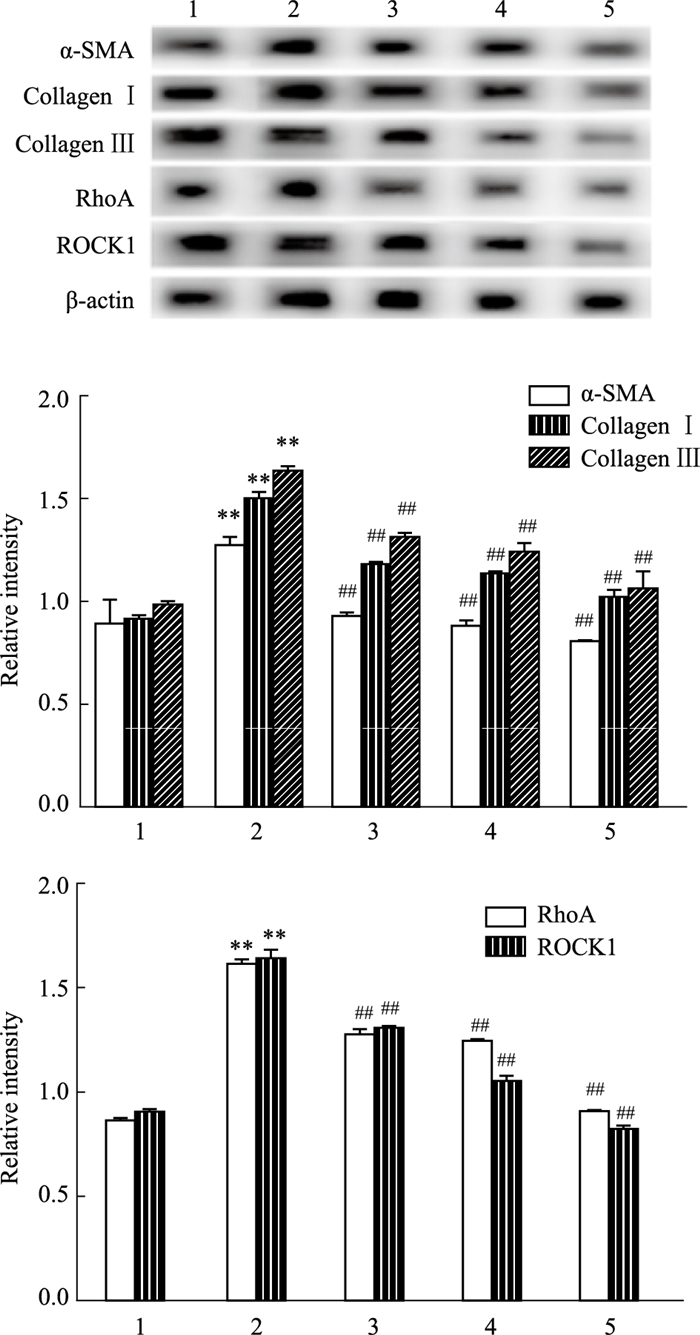
|
| Fig 4 Effects of SalB on expression of α-SMA, RhoA, ROCK1, Collagen Ⅰ, Collagen Ⅲ in CFs induced by high glucose (n=3) 1:Control group 2:HG group 3:HG+SalB group 4:HG+Y-27632 group 5:HG+Y-27632 +SalB group. **P < 0.01 vs Control group; ##P < 0.01 vs HG group |
长期糖尿病会导致心血管并发症的发生,包括心肌纤维化[5]。心肌纤维化的主要特征是CFs活力增强和细胞外基质过度沉积[6]。CFs是心肌内的主要细胞,约占60%~70%;在心肌细胞外基质中,存在多种类型的胶原蛋白,其中分布最多的主要是胶原蛋白Ⅰ(CollagenⅠ)和胶原蛋白Ⅲ(Collagen Ⅲ)。当机体处于正常的生理状态时,心肌中的胶原蛋白始终处于动态平衡,确保维持心肌组织的正常功能,不断合成与降解保证结构和功能的完整性,任一胶原蛋白发生改变,都有可能引起心肌功能的紊乱。本研究中,糖尿病大鼠心肌和高糖诱导CFs的CollagenⅠ和Collagen Ⅲ的表达出现同步上调,进而促进心肌纤维化的形成,和已知文献[7]保持一致。实验中应用不同剂量的SalB干预后,糖尿病大鼠左室心肌胶原表达减少,α-SMA、CollagenⅠ、Collagen Ⅲ蛋白表达降低,提示SalB能够抑制糖尿病大鼠心肌纤维化。
RhoA/ROCK1途径是一条参与细胞增殖等多种生物行为的信号通路,与肌动蛋白纤维形成有着关键的作用,是一个重要的分子机制[8]。研究发现,抑制肌成纤维细胞产生的靶点中,ROCK1有调节作用,阻断RhoA/ROCK1通路,可以减轻组织纤维化[9]。糖尿病心肌RhoA活性与肌动蛋白聚合有着密切关联,其活性的增强会引发ROCK靶点磷酸化增加,从而致使纤维化因子表达水平增高,引起器官纤维化的发生与发展。
我们前期实验中,25 mmol·L-1葡萄糖诱导CFs 24 h已出现明显增殖效果[10],故本实验使用此方法模拟高糖状态。在本实验中,高糖诱导CFs 24 h后,CollagenⅠ和Collagen Ⅲ蛋白表达水平显著上升;RhoA、ROCK1以及α-SMA蛋白表达水平也均出现上升趋势;给予ROCK1抑制剂Y-27632及SalB单独进行预处理后,上述各蛋白表达降低;给予Y-27632及SalB双重因素处理后,二者产生了累加效应,各蛋白显著降低,提示在糖尿病心肌纤维化的进程中,高糖可以通过激活RhoA/ROCK1信号通路,胶原蛋白表达增加,进而促进心肌纤维化的形成,而SalB对糖尿病心肌纤维化具有一定的保护作用,但其具体机制还需进一步研究。
综上所述,在细胞水平及在体水平,SalB对改善糖尿病心肌纤维化具有一定的作用;其机制可能与抑制RhoA/ROCK1信号通路有关。
| [1] |
Zeng Q C, Yong G. Cardiac fibroblas-derived extracellular matrix produced in vitro stimulates growth and metabolism of cultured ventricular cells[J]. Int Heart J, 2013, 54(1): 40-4. doi:10.1536/ihj.54.40 |
| [2] |
Jerry C. NASH (nonalcoholic steatohepatitis), diabetes, and macrovascular disease: multiple chronic conditions and a potential treatment at the metabolic root[J]. Exp Opinion Investigatil Drugs, 2020, 29(2): 191-196. doi:10.1080/13543784.2020.1715940 |
| [3] |
张旭, 朱元美, 唐保露, 等. 丹酚酸B对糖尿病大鼠肾纤维化的改善作用及其机制[J]. 中国药理学通报, 2019, 1: 51-5. Zhang X, Zhu Y M, Tang B L, et al. Effects of salvianolic acid B on renal fibrosis in diabetic rats[J]. Chin pharmacol bull, 2019, 1: 51-5. |
| [4] |
Shi J, Xiao P, Liu X, et al. Notch3 Modulates Cardiac Fibroblast Proliferation, Apoptosis, and Fibroblast to Myofibroblast Transition via Negative Regulation of the RhoA/ROCK/Hif1α Axis[J]. Front Physiol, 2020, 30(11): 669. |
| [5] |
Eschalier R, Rossignol P, Kearney-Schwartz A, et al. Features of cardiac remodeling, associated with blood pressure and fibrosis biomarkers, are frequent in subjects with abdominal obesity[J]. Hypertension, 2014, 63: 740-6. doi:10.1161/HYPERTENSIONAHA.113.02419 |
| [6] |
Bugyei-Twum A., Advani A., Advani S.L., et al. High glucose induces Smad activation via the transcriptional coregulator p300 and contributes to cardiac fibrosis and hypertrophy, Cardiovasc[J]. Diabetol, 2014, 13: 89. |
| [7] |
Guo S, Meng X W, Yang X S, et al. Curcumin administration suppresses collagen synthesis in the hearts of rats with experimentaldiabetes[J]. Acta Pharmacol Sin, 2018, 39(2): 195-204. doi:10.1038/aps.2017.92 |
| [8] |
Zhou H, Li Y J, Wang M, et al. Involvement of RhoA/ROCK in myocardial fibrosis in a rat model of type 2 diabetes[J]. Acta Pharmacol Sin, 2011, 32(8): 999-1008. doi:10.1038/aps.2011.54 |
| [9] |
Sakai K, Jawaid S, Sasaki T, et al. Transforming growth factor-β-independent role of connective tissue growth factor in the development of liver fibrosis[J]. Am J Pathol, 2014, 184(10): 2611-7. |
| [10] |
王娜, 隋海娟, 符丽娟. 丹酚酸B对高糖诱导心肌成纤维细胞增殖及转分化的作用研究[J]. 中国药理学通报, 2020, 36(3): 414-9. Wang N, Sui H J, Fu L J. Effects of salvianolic acid B on proliferation and transdifferentiation of myocardial fibroblasts induced by hyperglycemia[J]. Chin Pharmacol Bull, 2020, 36(3): 414-9. doi:10.3969/j.issn.1001-1978.2020.03.022 |

