


2. 蚌埠医学院 第一附属医院麻醉科,安徽 蚌埠 233030;
3. 蚌埠医学院 心脑血管疾病基础与临床重点实验室,安徽 蚌埠 233030
 ,
HU Miao1,
LIU Gang2,
DUAN Fang-fang1,
TONG Xu-hui1,
HUANG Jie1,
JIN Wen-jing1,
DONG Shu-ying1,3
,
HU Miao1,
LIU Gang2,
DUAN Fang-fang1,
TONG Xu-hui1,
HUANG Jie1,
JIN Wen-jing1,
DONG Shu-ying1,3

2. Dept of Anesthesia, First Affiliated Hospital, Bengbu Medical College, Bengbu Anhui 233030, China;
3. Key Laboratory of Cardiovascular and Cerebrovascular Diseases, Bengbu Medical College, Bengbu Anhui 233030, China
脑卒中是严重危害人类健康的疾病,其中缺血性脑卒中占比达80%以上。目前临床上主要采用溶栓和血管内介入疗法以恢复血管再通[1],然而血液恢复灌注时又会造成脑缺血/再灌注(ischemia/reperfusion,I/R)损伤。
铁死亡是一种铁依赖的脂质过氧化物的过量累积导致的细胞死亡。大量临床数据表明,脑缺血患者脑组织中的铁水平明显升高。另有研究报道,香芹酚通过增加谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)的表达,抑制沙鼠脑I/R损伤中的铁死亡,进而提高沙鼠脑I/R损伤中海马神经元的存活率[2],但铁死亡在脑I/R损伤中具体的作用机制,仍有待进一步的研究。
核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)是胞内的重要转录因子,能够协调胞内各种抗氧化基因在应激状态下的激活,可通过影响脂质过氧化的生成进而调控铁死亡。有研究表明,Nrf2可以通过调节其下游基因的转录进而提高肿瘤细胞对铁死亡的抵抗能力[3]。胱氨酸/谷氨酸逆向转运蛋白溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)是编码谷胱甘肽合成相关蛋白的基因之一,作为Nrf2的下游,具有抵抗脂质过氧化的能力。有研究表明,SLC7A11表达被抑制后,可导致GPX4活性和抵抗脂质过氧化的能力降低,最终发生铁死亡[4]。然而,Nrf2是否参与了脑I/R损伤中铁死亡的发生仍不清楚。
右美托咪定(dexmedetomidine, DEX)是一种临床上广泛使用的麻醉辅助用药,具有镇静、抗焦虑和镇痛作用[5]。研究表明,DEX对多种组织器官的I/R损伤均具有保护作用[6],例如心脏、肾脏和脑等。有文献报道,在SK-N-SH细胞中,DEX的抗氧化作用与其抑制铁超载有关[7]。大量研究表明,细胞内铁离子的超载是诱导细胞铁死亡的主要机制[8]。然而,DEX在脑I/R损伤中的保护作用,是否与其对铁死亡的抑制有关,却尚未见报道。因此本研究采用HT22细胞H/R损伤模型,探讨DEX抗HT22细胞H/R损伤的作用及其机制,为DEX在临床治疗脑I/R损伤提供理论依据。
1 材料与方法 1.1 细胞HT22细胞购买于中科院上海细胞库。
1.2 主要试剂盐酸右美托咪定注射液(货号H20110076)购自江苏恩华药业有限公司;DMEM干粉(货号2164119)购自美国Gibco公司;ML385(货号HY-100523)购自美国MCE公司,丙二醛试剂盒(货号A003-1)、还原型谷胱甘肽试剂盒(货号A006-2-1)购自南京建成生物工程研究所,胰蛋白酶(货号EZ2811A172)购自中国上海Beyotime公司;Nrf2抗体(货号ab137550)、GPX4抗体(货号ab125066)、SLC7A11抗体(货号ab37185)、TFR1抗体(货号ab8403)购自英国Abcam公司;GAPDH抗体(货号10494-1-AP)购自中国Proteintech公司;FerroOrange荧光探针(货号SH951)购自日本DOJINDO公司,C11 BODIPY 581/591(货号2115343)购自美国Sigma公司。
1.3 主要仪器酶标仪购自美国BioiTek公司,高速冷冻离心机购自德国艾本德公司,凝胶成像仪购自美国BIO-RAD公司,二氧化碳培养箱购自上海ESCO公司,缺氧培养箱购自美国赛默飞公司。
1.4 H/R损伤模型建立当HT22细胞占据培养皿65%左右时,用PBS清洗细胞3次,用无血清无糖培养基替换完全培养基至细胞培养皿中,置于缺氧培养箱(94% N2,5% CO2,1% O2),缺氧12 h,复糖复氧24 h。
1.5 实验分组HT22细胞分为:, 对照组(Control)、H/R组、DEX低浓度组(H/R+DEX2.5, μmol·L-1)组、DEX中浓度组(H/R+DEX5,5 μmol·L-1)组、DEX高浓度组(H/R+DEX10, 10 μmol·L-1)组,探讨DEX对HT22细胞H/R损伤的保护作用的最适浓度;再将HT22细胞分为4组,即Control、H/R组、H/R+DEX5组和H/R+DEX5+ML385组,进一步探究DEX对HT22细胞H/R保护作用的机制。DEX在缺氧时加入;ML385于复氧时立即加入,终浓度为2 μmol·L-1。
1.6 细胞存活率检测HT22细胞接种于96孔板中,分组给药并处理后,每孔加入20 μL MTT试剂,继续孵育4 h。孵育完成后,于孔中加入DMSO,37 ℃烘箱中孵育0.5 h。孵育完成后检测各孔在490 nm波长处的吸光度值,并计算细胞存活率。
1.7 细胞中Fe2+的检测消化并收集细胞,将HT22细胞接种于共聚焦小皿中,待细胞长至适宜密度时,根据分组,给药处理。处理后弃去培养液,加入FerroOrange工作液,37 ℃孵育20 min。活细胞工作站下观察细胞,并进行图像采集。
1.8 细胞内Lipid ROS检测取对数生长期的细胞,接种于6孔板中培养,按照实验分组完成相应的处理,加入C11 BODIPY 581/591染液,在培养箱中孵育0.5 h。弃去各孔中的培养液,消化并收集细胞,随后用250 μL PBS重悬,最后将重悬液通过流式细胞仪检测,并数据收集。
1.9 MDA、GSH含量检测不同实验组的细胞,给药处理后,消化并收集细胞,超声破碎后按照MDA,GSH说明书中的操作于532 nm、405 nm处检测各实验组细胞中MDA、GSH的含量。
1.10 Western blot检测蛋白收集并裂解细胞,随后进行定量、上样、转膜、封闭,孵育一抗过夜(Nrf2、TFR1、SLC7A11、GPX4抗体稀释比例均为1∶1 500,GAPDH抗体稀释比例为1∶3 000)。次日孵育二抗,随后用凝胶成像仪对蛋白条进行成像并用Bio Imaging System对图像进行灰度扫描分析。
1.11 统计学分析实验数据使用SPSS 20.0软件进行统计分析,计量资料以x±s表示,各组计量资料比较采用单因素方差分析。
2 结果 2.1 DEX对H/R损伤HT22细胞存活率的影响结果显示,经H/R处理后HT22细胞的存活率明显降低(P<0.01);H/R+DEX2.5、H/R+DEX5、H/R+DEX10组HT22细胞存活率相较于H/R组均有不同程度的升高(P<0.05),且H/R+DEX5组与H/R+DEX10组HT22细胞存活率升高较为明显(P<0.01)。同时H/R+DEX5,H/R+DEX10两组细胞存活率无明显差异,所以后续均采用5 μmol·L-1的DEX开展实验。B图显示,在使用DEX的基础上使用Nrf2抑制剂ML385(2 μmol·L-1)[9]后,HT22细胞存活率较H/R+DEX5组降低(P<0.01)。
2.2 DEX对H/R损伤HT22细胞中Nrf2蛋白表达的影响结果显示,相较于Control组,H/R损伤后的Nrf2蛋白表达水平明显降低(P<0.01);相较于H/R组,DEX处理后中Nrf2蛋白表达明显增加(P<0.05);相较于H/R+DEX组,在DEX基础上使用ML385后,Nrf2蛋白表达又明显降低(P<0.01)。
2.3 DEX对H/R损伤HT22细胞中Fe2+、Lipid ROS、MDA及GSH的影响采用FerroOrange作为荧光探针,对细胞内Fe2+进行荧光成像。结果显示,与Control组相比较,H/R组Fe2+荧光强度增强,表明细胞中的Fe2+含量增加;与H/R组相比,H/R+DEX5组Fe2+荧光强度减弱,细胞内Fe2+含量减少;与H/R+DEX5组相比,H/R+DEX5+ML385组Fe2+荧光强度增强,胞内Fe2+含量增加。用流式细胞仪分析各实验组细胞中Lipid ROS含量以及对胞内MDA和GSH的含量测定,结果表明:相较于Control组,H/R组HT22细胞内Lipid ROS及MDA的含量明显升高(均P<0.01)、GSH的含量则明显降低(P<0.01);使用DEX后,与H/R组相比,胞内Lipid ROS及MDA含量明显降低(均P<0.01),GSH的含量则明显增加(P<0.01);而在使用DEX的基础上使用Nrf2抑制剂后,胞内Lipid ROS水平及MDA含量明显升高(均P<0.05),GSH的含量则明显降低(P<0.01)。
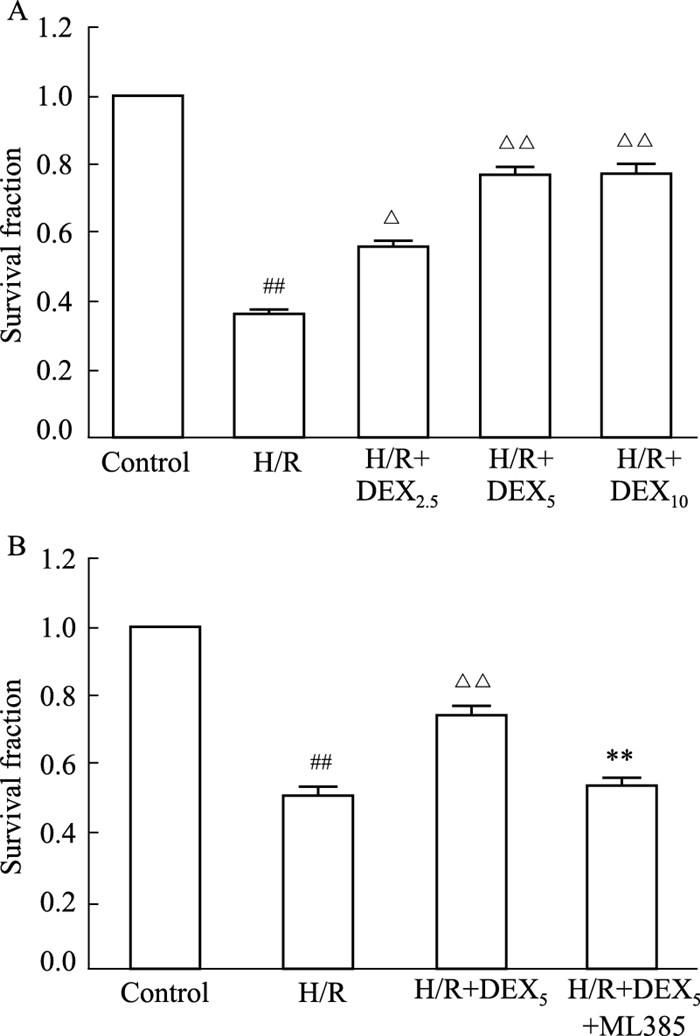
|
| Fig 1 Effect of DEX and ML385 on survival rates of HT22 cells with H/R injury (x±s, n=3) A: Different concentrations of DEX increased the survival fraction of HT22 cells with H/R injury; B: ML385 attenuated the protective effect of DEX with H/R injury on HT22 cells (x±s, n=3). ##P < 0.01 vs Control; △P < 0.05, △△P < 0.01 vs H/R; **P < 0.01 vs H/R+DEX5+ML385. |
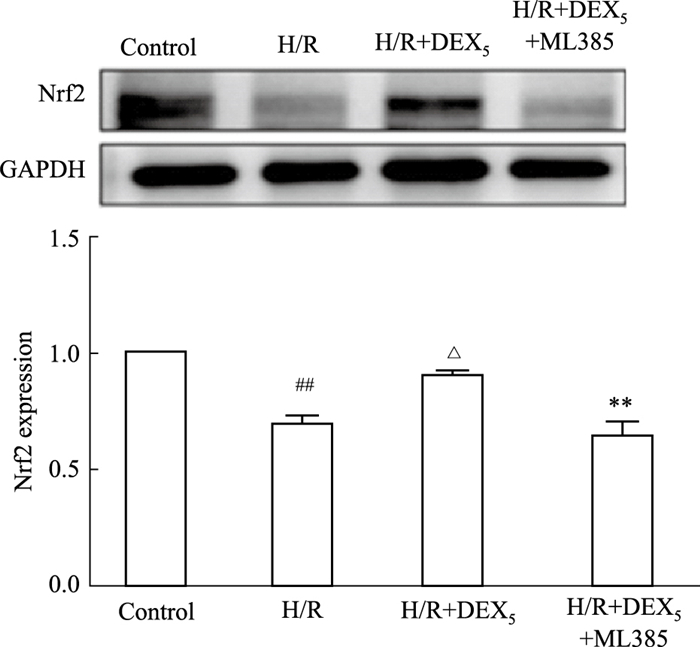
|
| Fig 2 Effect of DEX on expression of Nrf2 protein on HT22 cells with H/R injury (x±s, n=3) ##P < 0.01 vs Control; △P < 0.05 vs H/R; **P < 0.01 vs H/R+DEX5+ML385 |
采用蛋白质印迹法检测HT22细胞中铁死亡相关蛋白:GPX4、SLC7A11以及TFR1蛋白的表达变化。结果如图所示,HT22细胞经H/R处理后,细胞中GPX4、SLC7A11蛋白表达明显降低(均P<0.05),TFR1蛋白表达则明显升高(P<0.01);在给予DEX后发现,GPX4、SLC7A11蛋白的表达明显增加(均P<0.05),而TFR1蛋白的表达明显降低(P<0.01);在DEX的基础上使用Nrf2抑制剂后,HT22细胞中GPX4、SLC7A11蛋白表达明显降低(均P<0.01),TFR1蛋白表达则明显升高(P<0.01)。
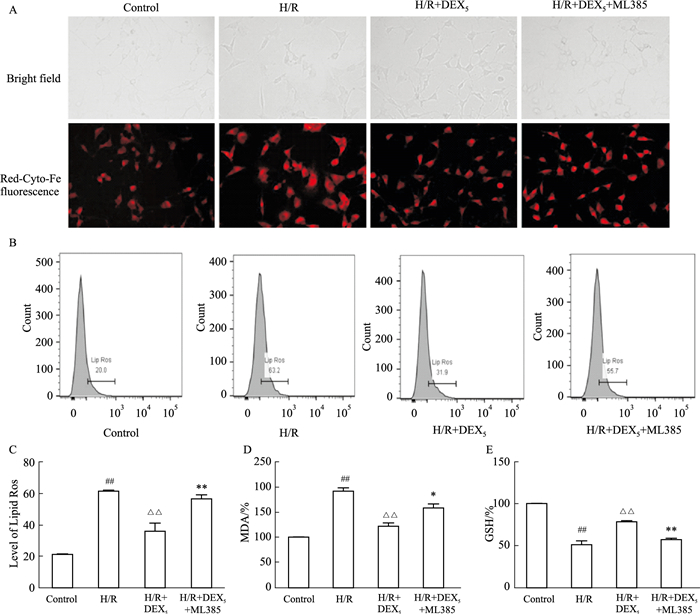
|
| Fig 3 Effect of DEX on Fe2+, lipid ROS, MDA and GSH on HT22 cells with H/R injury (x±s, n=3) A: The fluorescence image of Fe2+ in different groups; B, C: The levels of Lipid ROS in HT22 cells with different treatment; D: MDA levels on HT22 cells with different treatment. E: GSH levels on HT22 cells with different treatment. ##P < 0.01 vs Control; △△P < 0.01 vs H/R; *P < 0.05, **P < 0.01 vs H/R+DEX5+ML385 |
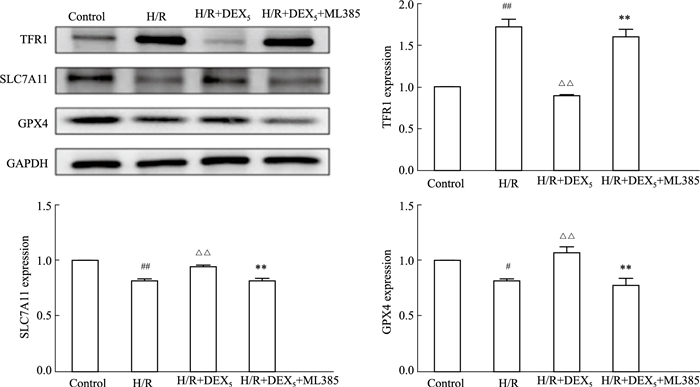
|
| Fig 4 Effect of DEX on expression of ferroptosis related proteins on HT22 cells with H/R injury (x±s, n=3) #P < 0.05, ##P < 0.01 vs Control; △△P < 0.01 vs H/R; **P < 0.01 vs H/R+DEX5+ML385 |
近年来,脑卒中在中老年群体中的发病率逐年增加,给患者及其家属带来了严重的负担。DEX作为临床常用的麻醉辅助剂,具有良好的镇静、抗焦虑等作用。有研究发现,DEX可通过AKT信号通路减轻大鼠心肌I/R损伤[10],Yin等[11]研究发现,DEX和Netrin-1联合使用可以通过调节ERK5/MEF2A信号通路抑制内质网应激减轻脑I/R损伤。目前关于DEX抗脑I/R损伤的研究愈发深入,但其可能的保护机制尚需进一步探明。为了探究DEX对HT22细胞H/R损伤后的保护作用,本实验采用MTT法检测不同浓度的DEX对HT22细胞H/R后的生存情况。结果显示:低、中、高浓度的DEX均能增加HT22细胞在H/R后的存活率,说明DEX能够减轻HT22细胞H/R损伤。与单独使用DEX相比较,在DEX基础上使用Nrf2抑制剂ML385后,细胞存活率明显降低,这表明Nrf2可能参与了DEX对HT22细胞H/R损伤的保护作用。
铁死亡涉及到胞内铁稳态的失衡和脂质过氧化的累积,是诱导脑I/R损伤的机制之一。在神经系统中,铁稳态可维持胞内脂质、蛋白质、碳水化合物和DNA的氧化和修饰[2]。然而,铁离子在应激条件下会在细胞内过度累积,过多的Fe2+通过芬顿(Fenton)反应引起膜脂质过氧化,导致Lipid ROS过度累积,线粒体结构皱缩,功能损伤,最终造成细胞死亡[12]。流行病学研究已经确定了铁蓄积会加重脑卒中患者的神经损伤[13]。转铁蛋白受体1(transferrin receptor 1,TFR1)是胞内铁代谢的重要蛋白,脑I/R损伤时,TFR1的表达增强,进而增加其对铁的摄取,最终导致胞内的铁离子过载[14]。我们的研究发现DEX可以明显抑制HT22细胞H/R后TFR1的表达,同时,FerroOrange荧光探针的结果也表明使用DEX后可以明显降低胞内Fe2+的水平。上述结果表明,DEX可能通过抑制TFR1的表达,进而降低由H/R引起的胞内铁离子的过量蓄积。
正常细胞中,膜脂质过氧化反应的产物被胞内的抗氧化体系所清除,其中以SLC7A11/GPX4为核心的抗脂质过氧化体系可以将脂质过氧化物的过氧键转变为羟基,失去其过氧化物的活性[15]。神经细胞H/R损伤后,伴随着抗脂质过氧化体系的破坏,SLC7A11、GPX4蛋白的表达降低,以及胞内抗氧化物GSH含量的大幅减少。因此铁蓄积和抗脂质过氧化体系的损伤导致了大量Lipid ROS的产生以及生物膜脂质过氧化产物MDA的累积。而DEX具有优秀的抗氧化能力,可以通过清除细胞内过多的氧自由基减轻氧化损伤[16]。在HT22细胞H/R损伤中,使用DEX后明显提高SLC7A11和GPX4的蛋白表达以及胞内GSH的水平,DEX对于HT22细胞抗氧化体系的保护显然增强了其对脂质过氧化物的分解能力:Lipid ROS和MDA的水平相较于H/R损伤均明显下降。
Nrf2是具有神经保护作用的关键转录因子,负责维持细胞氧化还原的动态平衡。研究表明,人参皂苷Rg1可以通过激活Nrf2减轻心肌细胞H/R损伤[17]。此外,在脑I/R损伤中的研究表明,激活Nrf2可以通过抑制神经炎症和氧化应激减轻神经损伤[18]。我们的研究发现,DEX可以明显提高H/R损伤下HT22细胞中Nrf2的表达,为了进一步探究Nrf2在DEX抗HT22细胞H/R损伤中的作用,我们使用ML385抑制Nrf2的表达,实验结果表明,Nrf2被抑制后DEX对胞内亚铁离子的运输能力明显降低,同时,胞内的各种抵抗脂质过氧化的能力及脂质过氧化产物均明显下降,这表明Nrf2的抑制降低了DEX对细胞H/R损伤引起的铁死亡的抵抗能力。
铁在氧气运输,能量代谢和DNA合成中均发挥着重要的作用,然而过量的铁对于细胞内氧化还原稳态是有害的。同样,铁离子依赖的胞内脂质氧化稳态的失衡是导致神经细胞H/R损伤的重要原因。我们的研究表明DEX可以通过Nrf2抑制TFR1的表达,调控受损状态下神经细胞铁离子的运输,进而维持胞内铁离子水平的稳态。同时,铁离子作为芬顿反应的重要参与者,当其在胞内过度蓄积的情况得以缓解时,芬顿反应也会受到抑制。此外,DEX经由Nrf2增强了神经细胞以SLC7A11/GPX4为核心的抗脂质过氧化的能力,最终使得脂质过氧化产物Lipid ROS以及MDA水平的降低。本研究以铁死亡为切入点,探究了DEX在抗HT22细胞H/R损伤中的作用及机制,为临床上合理使用DEX提供了新的理论依据。
| [1] |
Sun H, Liu Y, Gong P, et al. Intravenous thrombolysis for ischemic stroke with hyperdense middle cerebral artery sign: A meta-analysis[J]. Acta Neurol Scand, 2020, 141(3): 193-201. doi:10.1111/ane.13177 |
| [2] |
Guan X, Li X, Yang X, et al. The neuroprotective effects of carvacrol on ischemia/reperfusion-induced hippocampal neuronal impairment by ferroptosis mitigation[J]. Life Sci, 2019, 235: 116795. doi:10.1016/j.lfs.2019.116795 |
| [3] |
Song X, Long D. Nrf2 and ferroptosis: A new research direction for neurodegenerative diseases[J]. Front Neurosci, 2020, 14: 267. doi:10.3389/fnins.2020.00267 |
| [4] |
Kim D H, Kim W D, Kim S K, et al. TGF-β1-mediated repression of SLC7A11 drives vulnerability to GPX4 inhibition in hepatocellular carcinoma cells[J]. Cell Death Dis, 2020, 11(5): 406. doi:10.1038/s41419-020-2618-6 |
| [5] |
门运政. 基于铁死亡探讨右美托咪定抗小鼠脑缺血/再灌注损伤的作用及机制[D]. 安徽蚌埠: 蚌埠医学院, 2021. Men Y Z. Protective effects and mechanisms of dexmedetomidine against cerebral ischemia/reperfusion injury in mice based on ferroptosis[D]. Bengbu: Bengbu Med Coll, 2021. |
| [6] |
王鹏程, 王震, 代彦文, 等. 右美托咪定通过调控SIGIRR/NF-κB信号对脂多糖诱导的大鼠急性肺损伤的影响[J]. 中国药理学通报, 2021, 37(8): 1076-80. Wang P C, Wang Z, Dai Y W, et al. Effects of dexmedetomidine on acute lung injury induced by lipopolysaccharide by regulating SIGIRR/NF-κB signaling[J]. Chin Pharmacol Bull, 2021, 37(8): 1076-80. |
| [7] |
Qiu L, Ge L, Hu Q. Dexmedetomidine protects SK-N-SH nerve cells from oxidative injury by maintaining iron homeostasis[J]. Biol Pharm Bull, 2020, 43(3): 424-31. doi:10.1248/bpb.b19-00711 |
| [8] |
Su Y, Zhao B, Zhou L, et al. Ferroptosis, a novel pharmacological mechanism of anti-cancer drugs[J]. Cancer Lett, 2020, 483: 127-36. doi:10.1016/j.canlet.2020.02.015 |
| [9] |
Boucquey M, De Plaen E, Locker M, et al. Noxp20 and Noxp70, two new markers of early neuronal differentiation, detected in teratocarcinoma-derived neuroectodermic precursor cells[J]. J Neurochem, 2006, 99(2): 657-69. doi:10.1111/j.1471-4159.2006.04093.x |
| [10] |
Shao Z, Shen Q, Kong M, et al. Involvement of GPR30 in protection effect of dexmedetomidine against myocardial ischemia/reperfusion injury in rat via AKT pathway[J]. Acta Biochim Pol, 2021, 68(1): 119-26. |
| [11] |
Yin J W, Li J, Ren Y M, et al. Dexmedetomidine and Netrin-1 combination therapy inhibits endoplasmic reticulum stress by regulating the ERK5/MEF2A pathway to attenuate cerebral ischemia injury[J]. Front Neurosci, 2021, 15: 641345. doi:10.3389/fnins.2021.641345 |
| [12] |
He Y J, Liu X Y, Xing L, et al. Fenton reaction-independent ferroptosis therapy via glutathione and iron redox couple sequentially triggered lipid peroxide generator[J]. Biomaterials, 2020, 241: 119911. doi:10.1016/j.biomaterials.2020.119911 |
| [13] |
Van der Loo L E, Aquarius R, Teernstra O, et al. Iron chelators for acute stroke[J]. Cochrane Database Syst Rev, 2020, 11(11): CD009280. |
| [14] |
Tang L J, Zhou Y J, Xiong X M, et al. Ubiquitin-specific protease 7 promotes ferroptosis via activation of the p53/TfR1 pathway in the rat hearts after ischemia/reperfusion[J]. Free Radic Biol Med, 2021, 162: 339-52. doi:10.1016/j.freeradbiomed.2020.10.307 |
| [15] |
Guan X, Li Z, Zhu S, et al. Galangin attenuated cerebral ischemia-reperfusion injury by inhibition of ferroptosis through activating the SLC7A11/GPX4 axis in gerbils[J]. Life Sci, 2021, 264: 118660. doi:10.1016/j.lfs.2020.118660 |
| [16] |
Chen Y, Feng X, Hu X, et al. Dexmedetomidine ameliorates acute stress-induced kidney injury by attenuating oxidative stress and apoptosis through inhibition of the ROS/JNK signaling pathway[J]. Oxid Med Cell Longev, 2018, 2018: 4035310. |
| [17] |
Li Q, Xiang Y, Chen Y, et al. Ginsenoside Rg1 protects cardiomyocytes against hypoxia/reoxygenation injury via activation of Nrf2/HO-1 signaling and inhibition of JNK[J]. Cell Physiol Biochem, 2017, 44(1): 21-37. doi:10.1159/000484578 |
| [18] |
Liu D, Wang H, Zhang Y, et al. Protective effects of chlorogenic acid on cerebral ischemia/reperfusion injury rats by regulating oxidative stress-related Nrf2 pathway[J]. Drug Des Devel Ther, 2020, 14: 51-60. doi:10.2147/DDDT.S228751 |