

2. 安徽省中医药科学院中药药效与安全性评价研究所,安徽 合肥 230012
2. Institute for Pharmacodynamics and Safety Evaluation of Chinese Medicine, Anhui Academy of Chinese Medicine, Hefei 230012, China
支气管哮喘是呼吸系统常见疾病,近年来发病率逐年上升,日渐成为影响人民生活质量的主要因素之一,也是发展中国家卫生行业的一项沉重负担。哮喘以可逆的气道阻塞、支气管气道高反应性为特征,以气道的慢性炎症为主要致病因素。反复发作的气道炎症与机体免疫失衡共同导致了气道重塑和气道高反应性(airway hyperresponsiveness, AHR)的发生。目前,临床上哮喘的治疗方法以松弛气道平滑肌和抗气道慢性炎症为主,一线药物包括β2肾上腺素受体激动药和糖皮质激素类药。β2肾上腺素受体属于G蛋白偶联受体(G-protein coupled receptors, GPCRs),其激动后介导了气道平滑肌的舒张。而气道平滑肌上的其他GPCRs,如胆碱受体、组胺受体、白三烯受体、白介素受体、趋化因子受体及前列腺素受体等,均与气道平滑肌的收缩及气道的慢性炎症密切相关,甚至介导了肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、白细胞介素(interleukin, IL)-4、IL-13等炎症因子的释放及气道慢性炎症反应。因此近年来靶向这些G蛋白偶联受体(G-protein coupled receptors, GPCRs)的药物也层出不穷,如白三烯受体拮抗剂、抗IL-4Rα抗体等。这类药物能够通过细胞内第二信使cAMP影响其下游的PKA、Ca2+通道、PKC的激活及ERK、JNK、MAPK、JAK的磷酸化等,介导了包括支气管松弛、抑制气道炎症等多种细胞内代谢、免疫、炎症反应,促进了哮喘的病理生理过程发生[1-3]。
中药川芎具有祛风止痛、活血行气之功效,为“血中之气药”。川芎嗪作为川芎的主要药效成分,对血管平滑肌有解痉作用,并能够提高血小板中的cAMP含量,可降低血小板表面活性,抑制血栓烷A2(thromboxane A2, TXA2)的活性和生物合成,抑制血小板聚集,并且能使已聚集的血小板解聚[4]。祖国传统医学将哮喘归于肺气虚证,认为其兼有气虚、血瘀的特点,而气虚血瘀则可使血液中的白细胞、单核细胞等黏附于血管内皮,促进炎症的发生发展。已有研究表明,多种具有活血化瘀作用的中药及方剂对哮喘有较好的疗效[5-6]。近年来也有研究发现,川芎嗪能够影响白介素及其受体的功能,有效抑制哮喘中的气道炎症,对p38MAPK通路的活性具有明显的抑制作用,有可能成为一种潜在的哮喘治疗药物[7-9]。我们前期的研究表明,川芎嗪能够明显改善哮喘大鼠的血流变特征,抑制大鼠的血小板聚集,并减少大鼠气道的炎症细胞浸润,抑制AHR的发生并降低血清IgE含量,对催化cAMP水解反应的磷酸二酯酶(phosphodiesterase, PDE)也有明显的抑制作用[10-12]。
为进一步研究川芎嗪对哮喘的防治作用及其对GPCR信号活性的影响,阐明其作用机制,该研究以幼龄大鼠复制哮喘模型,研究川芎嗪对哮喘模型大鼠的AHR及气道炎症细胞浸润、胶原增生、黏液分泌的影响,并从GPCR信号通路的活性方面进一步研究其作用机制,为阐明川芎嗪对哮喘的防治作用及可能的作用机制提供实验依据。
1 材料与方法 1.1 实验动物3~4周龄Sprague-Dawley大鼠(80~100) g,SPF级,♂,动物合格证号: Scxk(沪)2008-0016,购自上海西普尔-必凯实验动物有限公司,在安徽中医药大学动物中心饲养。环境温度(22±2)℃,湿度50%~80%,光照实行每12 h明暗交替,自由摄食饮水。实验设计已经安徽中医药大学伦理委员会论证(动物伦理号:AHUCM-rats-008)。
1.2 药物与试剂卵白蛋白(ovalbumin,OVA,V级,Sigma公司,A5253);乙酰甲胆碱(methacholine,Mch,Sigma公司,批号79H1505);磷酸川芎嗪片(鼎复康药业股份有限公司,批号160511);硫酸沙丁胺醇片(天津力生制药股份有限公司,批号160522),IL-4、IL-5、IL-13、TNF-α大鼠ELISA试剂盒(武汉基因美科技有限公司,JYM0647Ra & GR2016-05、JYM0490Ra & GR2016-05、JYM0477Ra & GR2016-05、JYM0635Ra & GR2016-05);环磷酸腺苷(cAMP)大鼠ELISA试剂盒(上海源叶生物科技有限公司,20161108)。TRIzol(Invitrogen公司,135303);氯仿、无水乙醇、异丙醇(上海苏懿化学试剂有限公司,20151020);DEPC(Sigma公司,20150802554);QuantiFast SyBr Green PCR kit(Qiagen,151033144);逆转录试剂盒(RevertAidTM first Strand cDNA Synthesis Kit)(Thermo公司,00330969);引物由Invitrogen公司合成。RIPA细胞裂解液(Beyotime,P0013B);预染蛋白Marker(Thermo,00495577);ECL超敏发光试剂盒(Thermo,QF220648);Western一抗二抗去除液(Beyotime,P0025);cAMP反应元件结合(cAMP response element, CREB)(兔抗大鼠,Bioworld,CJ36131);PKA(兔抗大鼠,北京博奥森,AD17852061);Gαs(兔抗大鼠,NewEast Bio,21007);GRK2(兔抗大鼠,Bioss,bs-1209R);β-Actin(小鼠抗大鼠,Zsbio,17AV0303);通用二抗试剂盒(北京中杉,K136830B)。
1.3 主要仪器小动物肺功能仪(南京美易公司,V5.0);雾化吸入器(上海新天缘医疗设备有限公司,980型);显微镜(Olympus BX51,Germany);冷冻离心机(黑马仪器公司,TGL-18R)。切片机(德国Leica RM2135);自动脱水机(亚光ZT-12M、亚光YB-7B,湖北孝感)。酶标仪(雷杜公司,RT-6000);荧光定量PCR仪(Thermo PIKOREAL 96);微量离心机(海门市其林贝尔仪器制造有限公司,LX300);洗板机(雷杜公司,RT-3100);Millipore PVDF膜;EPS300型电泳仪(Tanon);VE-180型电泳槽(Tanon);VE-186型转膜仪(Tanon);医学影像分析系统(江苏省捷达科技发展有限公司,JD801)。
1.4 方法 1.4.1 哮喘大鼠模型复制哮喘大鼠模型采用十点致敏法,以含0.2%OVA (GradeⅤ)的Al(OH)3凝胶十点致敏,并以含1%OVA的生理盐水溶液雾化被动吸入攻击复制。具体方法如下:d 0,对各组大鼠进行十点致敏,每点皮下注射0.05 mL含0.2%OVA的Al(OH)3凝胶,另再腹腔注射0.5 mL,每鼠总共1 mL[13]。从d 14开始,每天用含1%OVA的生理盐水溶液给大鼠雾化吸入30 min进行攻击,连续7 d,复制哮喘大鼠模型。
1.4.2 动物分组及给药各组大鼠适应性饲养1周,随机分为对照组、哮喘模型组、川芎嗪组(根据前期实验结果[11],结合临床成人用量,选择最佳剂量40 mg·kg-1·d-1,每片含川芎嗪50 mg,取8粒药加入100 mL 5%葡萄糖溶液中充分溶解,配成4g·L-1的药液,每天按10 mL·kg-1给药)、沙丁胺醇组(1 mg·kg-1·d-1,每片含沙丁胺醇2 mg,取5粒药加入100 mL 5%葡萄糖溶液中充分溶解,配成0.1 g·L-1的药液,每天按10 mL·kg-1给药),每组15只。哮喘模型组及各给药组动物采用十点致敏法复制哮喘模型,其中川芎嗪组和沙丁胺醇组大鼠于每次攻击前0.5 h灌胃给药,每天1次,持续7 d。
1.4.3 大鼠AHR测定哮喘大鼠在末次抗原攻击后24 h,以20%乌拉坦5 mL·kg-1腹腔注射实施麻醉,行气管插管,置于小动物肺功能仪的密闭的体描箱内,记录各组大鼠的初始肺阻力(resistance of lung, RL) 和肺顺应性(dynamic compliance, Cdyn),之后以超声雾化器将质量浓度分别为0.5、1.0、2.0、4.0和8.0 g·L-1的Mch雾化依次注入大鼠气道,每一浓度Mch吸入20 s,记录5 min内的RL和Cdyn的变化。
1.4.4 哮喘大鼠的肺组织形态学变化观察以10%甲醛固定大鼠肺组织,行常规石蜡包埋,HE、Masson、PAS染色观察哮喘大鼠肺组织及气道周围炎症细胞浸润、黏液分泌及纤维增生。
1.4.5 大鼠血清中炎症因子含量测定末次抗原攻击后24 h,麻醉大鼠,股动脉取血,离心取血清,依照ELISA检测试剂盒说明书检测血清中炎症因子含量。检测的炎症因子, 包括IL-4、IL-5、IL-13、TNF-α。
1.4.6 大鼠肺组织及血浆中cAMP含量的测定末次抗原攻击后24 h,麻醉大鼠,股动脉取血,抗凝后离心取血浆,ELISA法检测血浆cAMP含量。取大鼠肺组织匀浆,离心取上清,ELISA法检测肺组织cAMP含量。
1.4.7 大鼠肺组织中PKA蛋白的表达量测定取肺组织蜡块切片,常规免疫组化染色法观察哮喘大鼠肺组织PKA表达情况。PKA一抗选用兔抗大鼠(1 ∶200),二抗选用即用型二抗。
1.4.8 q-PCR法检测大鼠肺组织CREB的mRNA表达量TRIzol法提取肺组织RNA,定量检测RNA浓度,合成cDNA,进行qRT-PCR。以二步法荧光定量PCR检测大鼠肺组织中CREB的基因表达量,反应条件为95 ℃进行1 min,95 ℃变性20 s、60 ℃退火30 s,72 ℃延伸20 s,循环进行40次。ΔΔCt法分析Ct值,以β-actin作为内参参照基因进行计算,以2-ΔΔCt表示基因表达量。所用引物序列见Tab 1。
| Gene | Forward primer (5′-3′) | Reverse primer (5′-3′) |
| CREB | GACAACCAGCAGAGTGGAG | GCATGGATACCTGGGCTAAT |
| β-actin | CCCATCTATGAGGGTTACGC | TTTAATGTCACGCACGATTTC |
取100 mg肺组织,常规方法提取肺组织总蛋白。按照1 ∶4比例在蛋白样品中加入5×SDS-PAGE蛋白上样缓冲液,沸水中加热10 min,充分变性蛋白。冷却至室温,上样到SDS-PAGE胶加样孔内,电泳(80 V 30 min,120 V 1 h)、转膜、封闭后,加入一抗、二抗孵育。一抗参考说明书,CREB抗体按照1 ∶500比例、GRK2抗体按照1 ∶200比例、Gas抗体按照1 ∶200比例,分别用一抗稀释液进行稀释(抗体属性均为兔抗);二抗参考说明书,按照1 ∶10 000比例用二抗稀释液稀释。蛋白检测按照说明书要求,用ECL发光试剂盒检测。
1.4.10 统计学分析采用IBM SPSS 13.0统计软件进行多因素方差分析,计量资料用x±s表示。每个点上多个分组之间的比较用多变量方差分析。对各数据做Shapiro-Wilk检验,符合正态分布。做单因素方差分析,方差齐的组间比较用LSD法,方差不齐的组间比较用Games-Howell(A)法。
2 结果 2.1 川芎嗪对哮喘大鼠AHR的影响根据小动物肺功能仪分析所得数据,分别绘制大鼠肺阻力变化和肺顺应性变化趋势图。如Fig 1A所示,模型组大鼠肺阻力较对照组明显升高,随Mch刺激浓度的增加,模型组大鼠肺阻力上升趋势增加,4.0 g·L-1和8.0 g·L-1的Mch浓度刺激时肺阻力增加较对照组差异具有统计学意义(P < 0.01),肺阻力上升趋势大于其余各组,说明哮喘大鼠的AHR较其余各组明显;与模型组相比,川芎嗪和沙丁胺醇组大鼠在各个浓度Mch刺激时的肺阻力明显降低,4.0 g·L-1和8.0 g·L-1的MCh浓度刺激时较模型组大鼠差异有统计学意义(P < 0.05)(Fig 1A)。如图 1B所示,模型组大鼠的肺顺应性较对照组明显降低,在2.0 g·L-1、4.0 g·L-1和8.0 g·L-1的Mch浓度刺激时肺顺应性的降低较对照组差异具有统计学意义(P < 0.05),且Mch刺激浓度增加时降低趋势增加,高于其余各组;与模型组相比,川芎嗪和沙丁胺醇组大鼠在各Mch浓度刺激时肺顺应性明显升高,其中沙丁胺醇组在2.0 g·L-1、4.0 g·L-1和8.0 g·L-1的MCh浓度刺激下与模型组大鼠相比差异有统计学意义(P < 0.05),川芎嗪组也能够增加哮喘大鼠的肺顺应性,但是与模型组相比差异没有统计学意义(P>0.05)(Fig 1B)。
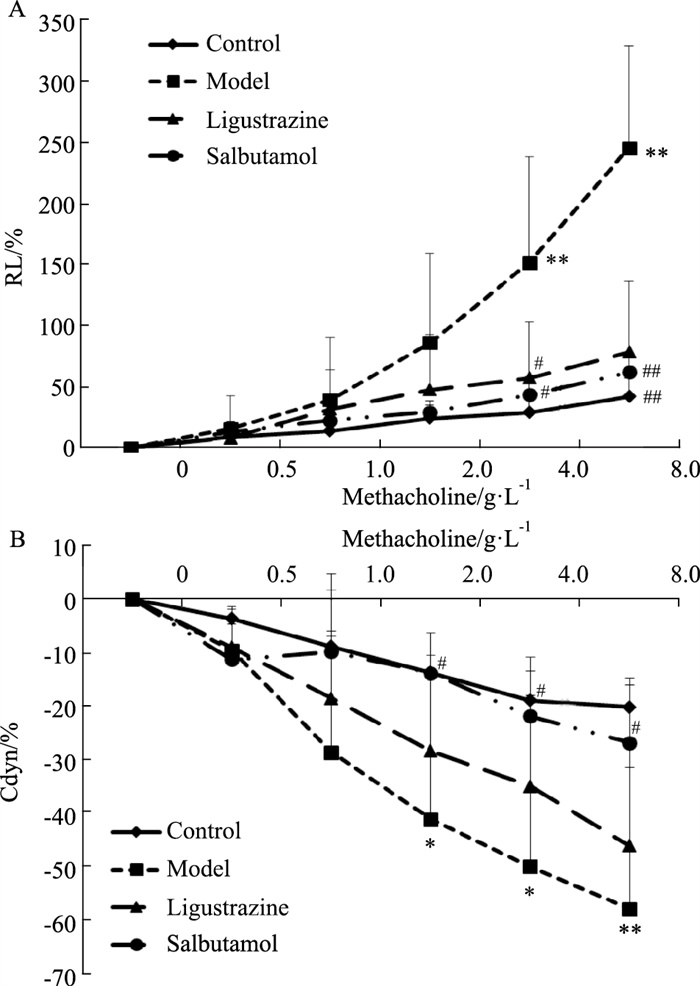
|
| Fig 1 Effect of ligustrazine on RL (A) and Cdyn (B) of asthmatic rats (x±s, n=8) **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs asthma model. |
HE染色观察肺组织及气道周围病理变化,Fig 2可见,对照组气道壁及肺泡结构正常,气道黏膜上皮结构完整,未见明显炎症细胞浸润,哮喘大鼠肺间质及气道周围可见炎症细胞大量浸润,支气管管壁明显增厚、管腔变窄,气道壁及肌层较对照组明显增厚。川芎嗪组、沙丁胺醇组大鼠肺间质及气道周围炎症细胞浸润明显减少,气道壁及肌层较模型组明显变薄,且二者作用相当(Fig 2)。
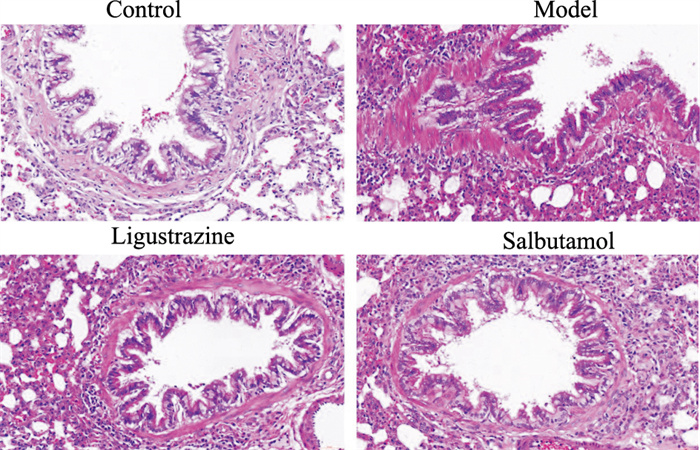
|
| Fig 2 Effect of ligustrazine on lung tissues of asthmatic rats (HE×200) |
气道炎症会导致杯状细胞增生及黏液分泌增加,从而加重气流受限,诱发AHR。PAS糖原染色可观察大鼠气道杯状细胞黏液分泌的变化,黏液染色为紫红色。由Fig 3可见,对照组大鼠气道黏液分泌不明显,杯状细胞基本无增生,哮喘大鼠气道内可见杯状细胞明显增生,黏液分泌也较对照组明显增加。川芎嗪组、沙丁胺醇组大鼠气道黏液分泌和杯状细胞增生情况较模型组明显改善,且川芎嗪作用优于沙丁胺醇(Fig 3)。
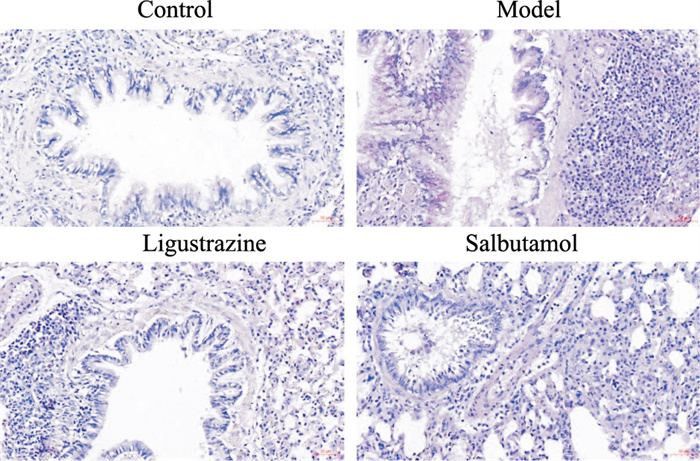
|
| Fig 3 Effect of ligustrazine on goblet cell hyperplasia and mucus secretion of asthmatic rats (PAS staining, ×200) |
气道慢性炎症会导致肺间质及气道周围纤维增生,从而降低肺弹性,增加肺阻力,降低肺顺应性。Masson染色可观察大鼠肺间质与气道周围纤维增生的情况,纤维组织染色为蓝色。由Fig 4可见,对照组大鼠肺间质及气道周围未见明显纤维增生情况,哮喘大鼠肺间质及气道周围可见大量纤维增生,和对照组相比纤维增生明显。川芎嗪组、沙丁胺醇组大鼠肺组织及气道周围纤维增生较模型组明显减少,川芎嗪作用稍弱于沙丁胺醇(Fig 4)。
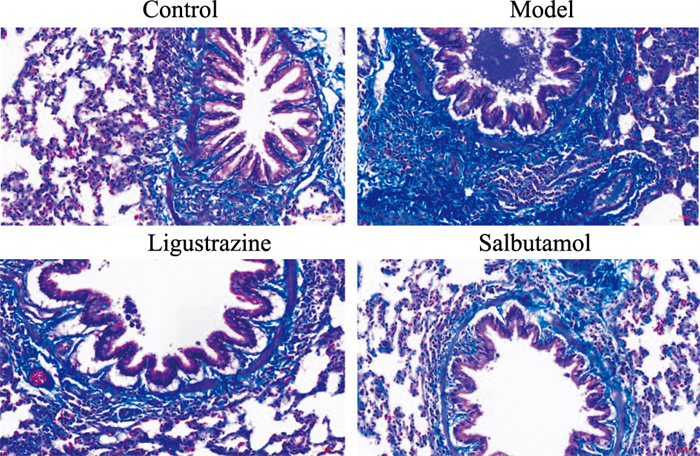
|
| Fig 4 Effect of ligustrazine on fibroplasia of asthmatic rats (Masson ×200) |
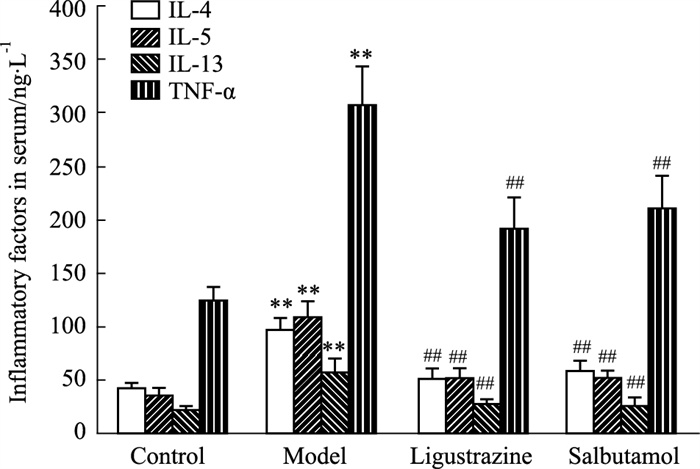
呼吸道慢性炎症是哮喘的本质,大量Th2型炎症因子的分泌是介导气道慢性炎症反应和机体的免疫失衡的关键因素,也是AHR和气道重塑的主要诱因,其中最重要的是以IL-4、IL-5、IL-13和TNF-α为代表的炎症因子。本研究发现,哮喘大鼠的血清中TNF-α、IL-4、IL-5及IL-13水平与对照组相比明显升高(P < 0.01);川芎嗪组和沙丁胺醇组大鼠血清及肺组织中IL-4、IL-5、IL-13及TNF-α水平较模型组明显降低(P < 0.01),且川芎嗪与沙丁胺醇作用相当,提示川芎嗪能够抑制支气管哮喘中相关炎症因子的过度分泌,从而抑制气道的慢性炎症,对机体免疫失衡也可能有改善作用(Fig 5)。
|
| Fig 5 Effect of ligustrazine on IL-4, IL-5, IL-13 and TNF-α levels in serum of asthmatic rats (x±s, n=6) **P < 0.01 vs control; ##P < 0.01 vs asthma model. |
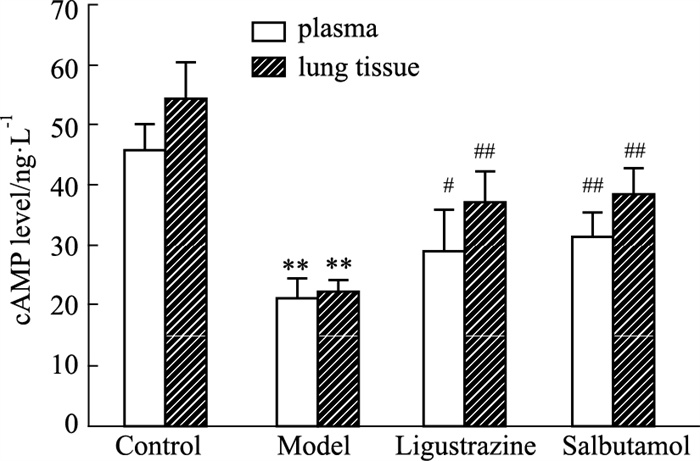
cAMP是GPCR下游的关键信号,介导了细胞炎症、免疫等多种生理、生化反应,血浆cAMP水平的降低也是临床上哮喘的主要特征。如Fig 6所示,哮喘模型组大鼠血浆和肺组织匀浆中cAMP含量与对照组相比明显降低(P < 0.01),川芎嗪组和沙丁胺醇组大鼠血浆和肺组织中cAMP含量与模型组相比均有明显升高(P < 0.05),提示川芎嗪对cAMP信号的活性有一定的影响(Fig 6)。
|
| Fig 6 Effect of ligustrazine on cAMP level in plasma and lung tissues of asthmatic rats (x±s, n=6) **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs asthma model. |
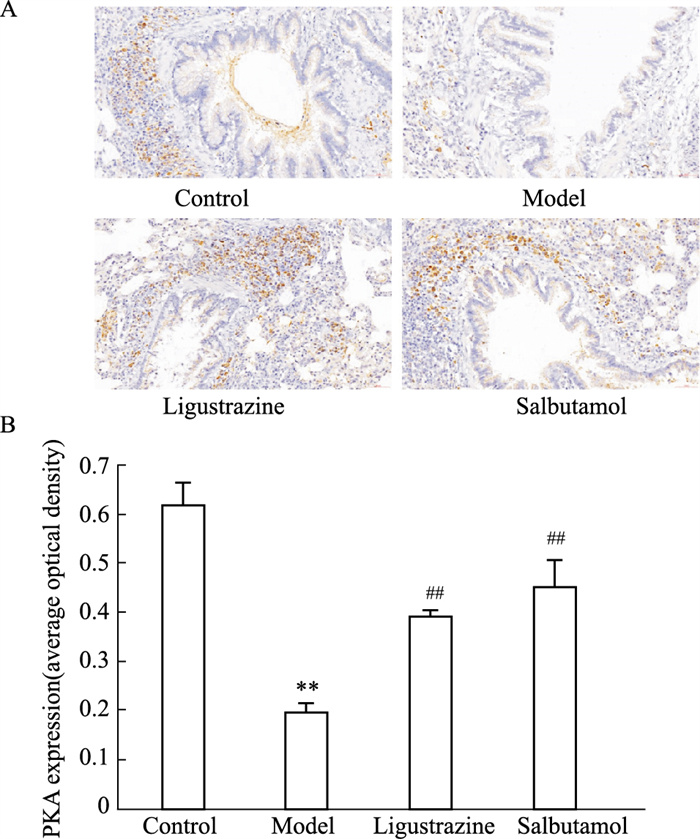
PKA是cAMP的下游的关键效应蛋白,细胞内cAMP通过活化PKA激活下游信号级联反应,引发GPCR信号通路介导的生物效应。本研究通过免疫组化染色发现,哮喘大鼠的肺组织中PKA蛋白表达量与对照组相比明显减少,川芎嗪和沙丁胺醇干预能使大鼠肺组织中PKA蛋白表达量明显升高(P < 0.01),提升川芎嗪能够增加cAMP信号通路的活性(Fig 7A、B)。
|
| Fig 7 Effect of Ligustrazine on PKA expression of asthmatic rats (IHC staining) (A) and analysis of average optical density(B) (x±s, n=6) **P < 0.01 vs control; ##P < 0.01 vs asthma model. |
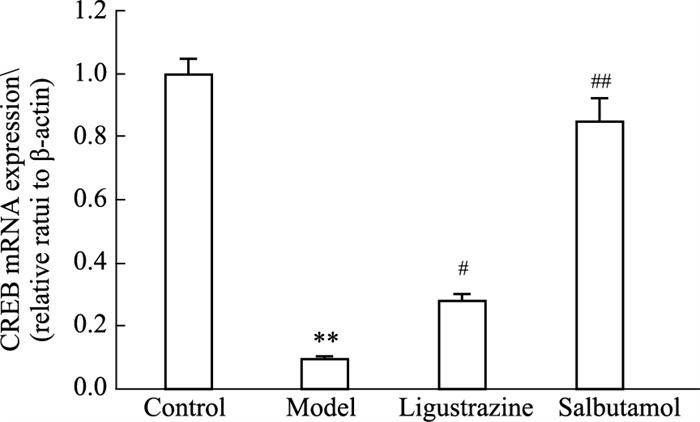
CREB是PKA下游的信号蛋白,能够被PKA介导活化引起气道平滑肌细胞的松弛。哮喘时cAMP水平的下降引起PKA活化减少,CREB表达下降,气道收缩。CREB是cAMP信号激活并引发效应的重要标志性蛋白。川芎嗪能够增加血浆及肺组织中的cAMP水平,并上调肺组织PKA表达,而PKA活化后会增强CREB的转录活性,因此,川芎嗪可能通过上调cAMP信号活性使CREB表达增加。哮喘模型组大鼠肺组织中CREB表达与对照组相比明显降低(P < 0.01);川芎嗪和沙丁胺醇组大鼠肺组织CREB mRNA表达较模型组明显升高,差异具有显著性(P < 0.05)(Fig 8)。
|
| Fig 8 Effect of ligustrazine on CREB mRNA expression of asthmatic rats (x±s, n=6) **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs asthma model. |
模型组大鼠肺组织中CREB和Gαs表达水平降低而GRK2表达升高,较对照组差异明显(P < 0.01);川芎嗪组和沙丁胺醇组大鼠的肺组织中CREB和Gαs表达水平升高而GRK2表达降低,与模型组相比差异有统计学意义(P < 0.01),且二者相当(Fig 9)。
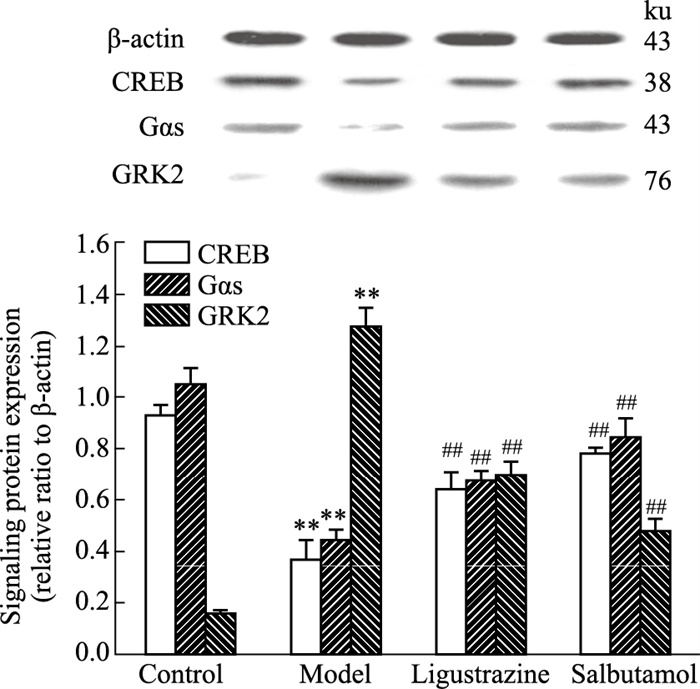
|
| Fig 9 Effect of ligustrazine on CREB, Gαs and GRK2 expression of asthmatic rats (x±s, n=6) **P < 0.01 vs Control; #P < 0.05, ##P < 0.01 vs Asthma model. |
哮喘的病理过程涉及机体的炎症、免疫等多个环节,是机体对外界细菌、病毒、抗原等多种致病因素过度抵抗引发的综合结果,在致病因素的刺激下,机体释放一系列的刺激分子和细胞因子,促进气道炎症发生,引起粘液分泌、气道平滑肌痉挛等哮喘症状[14],因此哮喘是以免疫系统功能紊乱为基础,以气道炎症及气流受限、AHR为表现形式的复杂免疫炎症性疾病。GPCR是具有7次跨膜结构的蛋白质,其信号活性受到G蛋白的状态、功能及GPCR激酶(GRK)和β-arrestin的调节[15],其中GRK2在肺动脉及肺动脉平滑肌中表达,抑制GRK2可为肺血管收缩性疾病提供一种替代治疗策略,其介导的信号通路更有望成为潜在的阻止或治疗气道平滑肌对β2肾上腺素受体激动剂敏感性降低的治疗手段[16-17]。cAMP是GPCR信号激活后关键的细胞内信号分子,其介导的生理功能与G蛋白状态密切相关。cAMP激活PKA,继而促进CREB转录,引起膜上的Gq蛋白活化,激活蛋白激酶C(protein kinase C,PKC),引起肌球蛋白轻链激酶(myosin light chain kinase, MLCK)激活,最后促进气道平滑肌(airway smooth muscle, ASM)松弛[18]。
本实验结果显示,川芎嗪能够有效改善哮喘模型大鼠的AHR,减轻气道阻力并增加肺顺应性,在高浓度的乙酰甲胆碱刺激下,可以明显降低肺阻力;肺组织HE染色结果显示川芎嗪能够抑制哮喘大鼠肺组织及气道周围的炎症细胞浸润,PAS染色结果显示川芎嗪能够减少气道杯状细胞增生和黏液分泌,Masson染色结果也显示川芎嗪能够降低哮喘大鼠肺组织及气道周围纤维增生,以上结果提示川芎嗪对幼龄哮喘模型大鼠的气道炎症和AHR有改善作用。对外周血中相关炎症因子的检测结果显示,川芎嗪能够降低哮喘大鼠血清中炎症因子含量,显著降低TNF-α和IL-4、IL-5、IL-13水平,提示川芎嗪能够抑制Th2型细胞因子和炎症因子分泌,可能对哮喘大鼠的免疫失衡有改善作用。在进一步对GPCR信号通路活性的研究中发现,川芎嗪能够明显抑制GRK2蛋白表达并增加Gαs蛋白表达,增加血浆中cAMP含量,上调cAMP的效应蛋白PKA和CREB的表达,提示川芎嗪对GPCR信号通路活性具有有一定的调节作用,能够减弱GRK对GPCR信号的抑制作用并减少受体脱敏,增加Gαs蛋白活性从而产生更多的cAMP,从而激活细胞内PKA/CREB信号,这也可能是川芎嗪防治哮喘的关键机制。由于GPCR信号涉及多种信号分子,共同参与了机体的炎症反应和免疫平衡的调节,在哮喘的发生发展过程中G蛋白发生了哪些具体变化,G蛋白的平衡如何影响了机体的免疫平衡,而川芎嗪对于其他的G蛋白亚型又是否有影响,这些问题还有待进一步研究。
| [1] |
Sharma P, Penn R B. Can GPCRs be targeted to control inflammation in asthma?[J]. Adv Exp Med Biol, 2021, 1304: 1-20. |
| [2] |
Wendell S G, Fan H, Zhang C. G Protein-coupled receptors in asthma therapy: Pharmacology and drug action[J]. Pharmacol Rev, 2020, 72(1): 1-49. doi:10.1124/pr.118.016899 |
| [3] |
廖礼彬, 吴娜, 姚雪萍. 多巴胺及其受体在哮喘发病机制中的研究进展[J]. 中国药理学通报, 2022, 38(1): 5-8. Liao L B, Wu N, Yao X P. Research progress of dopamine and dopamine receptor in pathogenesis of asthma[J]. Chin Pharmacol Bull, 2022, 38(1): 5-8. |
| [4] |
汪宁. 活血化瘀药[M]//徐宏喜主编. 中药药理学. 第3版. 上海: 上海科学技术出版社, 2019: 204-5. Wang N. Drug for invigorating blood circulation and eliminating stasis[M]// Edited by Xu H X. Pharmacology of Chinese materia medica. The third edition. Shanghai science and technology press, 2019: 204-5. |
| [5] |
陈婵, 郭淑贞, 王伟, 等. 气虚血瘀证(心肌缺血)大鼠模型单核细胞炎性因子表达的相关性探讨[J]. 中医药学报, 2010, 38(4): 16-9. Chen C, Guo S Z, Wang W, et al. Study on mononuclear cells associated with the expression of inflammatory factors in rats with qi deficiency and blood stasis syndrome(myocardial ischemia)[J]. Acta Chin Med Pharmacol, 2010, 38(4): 16-9. doi:10.3969/j.issn.1002-2392.2010.04.007 |
| [6] |
彭波, 李泽庚, 孙志广. 支气管哮喘肺气虚证的研究进展[J]. 临床肺科杂志, 2008, 13(9): 1186-7. Peng B, Li Z G, Sun Z G. Research progress of lung qi deficiency syndrome in bronchial asthma[J]. J Clin Pulm Med, 2008, 13(9): 1186-7. doi:10.3969/j.issn.1009-6663.2008.09.044 |
| [7] |
Liu X M, Wang Y B, Wu Q, et al. Effects of ligustrazine on airway inflammation in a mouse model of neutrophilic asthma[J]. Chin J Integr Med, 2018, 24(5): 353-8. doi:10.1007/s11655-017-2830-0 |
| [8] |
Wei Y, Liu J, Zhang H, et al. Ligustrazine attenuates inflammation and the associated chemokines and receptors in ovalbumine-induced mouse asthma model[J]. Environ Toxicol Pharmacol, 2016, 46: 55-61. doi:10.1016/j.etap.2016.07.005 |
| [9] |
Alves M F, da Fonseca D V, de Melo SAL, et al. New therapeutic targets and drugs for the treatment of asthma[J]. Mini Rev Med Chem, 2018, 18(8): 684-96. doi:10.2174/1389557517666170927145011 |
| [10] |
Wang Y, Zhu H, Tong J, et al. Ligustrazine improves blood circulation by suppressing platelet activation in a rat model of allergic asthma[J]. Environ Toxicol Pharmacol, 2016, 45: 334-9. doi:10.1016/j.etap.2016.06.016 |
| [11] |
王雅娟, 朱慧志, 孔献春, 等. 川芎嗪改善哮喘大鼠气道高反应性的作用观察[J]. 中成药, 2014, 36(4): 834-7. Wang Y J, Zhu H Z, Kong X C, et al. Effect of ligustrazine on airway hyperresponsiveness in asthmatic rats[J]. Chin Tradit Pat Med, 2014, 36(4): 834-7. doi:10.3969/j.issn.1001-1528.2014.04.036 |
| [12] |
Wang Y J, Zhu H Z, Tong J B, et al. Ligustrazine inhibits lung phosphodiesterase activity in a rat model of allergic asthma[J]. Comput Math Methods Med, 2022, 2022: 1452116. |
| [13] |
陈艳, 李子刚, 汤慧芳, 等. 咯利普兰对大鼠哮喘模型肺组织磷酸二酯酶及IL-4的影响[J]. 中国药理学通报, 2006, 22(4): 447-51. Chen Y, Li Z G, Tang H F, et al. The effects of rolipram on PDE activity and IL-4 level in the lung tissue of ovalbum in sensitized and repeatedly challenged rats[J]. Chin Pharmacol Bull, 2006, 22(4): 447-51. doi:10.3321/j.issn:1001-1978.2006.04.015 |
| [14] |
Kaiko G E, Horvat J C, Beagley K W, et al. Immunological decision-making: How does the immune system decide to mount a helper T-cell response?[J]. Immunology, 2008, 123(3): 326-38. doi:10.1111/j.1365-2567.2007.02719.x |
| [15] |
Zalewska M, Siara M, Sajewicz W G. protein-coupled receptors: Abnormalities in signal transmission, disease states and pharmacotherapy[J]. Acta Pol Pharm, 2014, 71(2): 229-43. |
| [16] |
Xu R, Gopireddy R R, Wu Y, et al. Hyperinsulinemia promotes heterologous desensitization of β2 adrenergic receptor in airway smooth muscle in obesity[J]. FASEB J, 2020, 34(3): 3996-4008. doi:10.1096/fj.201800688RR |
| [17] |
Barreto Ortiz S, Hori D, Nomura Y, et al. Opsin 3 and 4 mediate light-induced pulmonary vasorelaxation that is potentiated by G protein-coupled receptor kinase 2 inhibition[J]. Am J Physiol Lung Cell Mol Physiol, 2018, 314(1): L93-106. doi:10.1152/ajplung.00091.2017 |
| [18] |
Haak A J, Ducharme M T, Diaz Espinosa A M, et al. Targeting GPCR signaling for idiopathic pulmonary fibrosis therapies[J]. Trends Pharmacol Sci, 2020, 41(3): 172-82. doi:10.1016/j.tips.2019.12.008 |

