


2. 中南大学湘雅护理学院,湖南 长沙 410000;
3. 长沙民政职业技术学院医学院,湖南 长沙 410000
2. Xiangya Nursing School, Central South University, Changsha 410000, China;
3. School of Medicine, Changsha Social Work College, Changsha 410000, China
肺纤维化(pulmonary fibrosis,PF)是一种慢性、进展性、致死性的肺间质疾病,以肺泡间质内炎性细胞浸润、成纤维细胞大量增殖和细胞外基质蛋白过度沉积为特征,最终导致肺组织结构破坏[1],是一系列慢性肺部疾病的共同结局。近些年来,PF的发病率和死亡率在世界各地均呈上升趋势,有数据显示,PF确诊后的生存中位数2.9年,5年生存率 < 50%,对人类健康带来严重危害[2]。目前,除肺移植之外尚缺乏有效的治疗手段。因此,以肺纤维化发病机制中的关键环节为切入点,研发靶向治疗药物对于改善肺纤维化预后具有十分重要的价值。
水蛭素是从吸血水蛭唾液腺中提取的一种活性成分,为单链环肽化合物,由65个氨基酸残基组成,是天然的凝血酶抑制剂,能与凝血酶以1 ∶1特异性结合[3],具有抗凝、抗炎、抗肿瘤、抗风湿等生物学作用[4]。有研究发现,水蛭素通过抑制大鼠肾间质NF-κB的活化延缓单侧输尿管结扎诱导的大鼠肾间质纤维化的进展[5],减少NF-κB的激活来保护大鼠背根神经节神经元免受高糖诱导的损伤[6]。虽有研究报道水蛭素通过减少TGF-β1的表达减轻大鼠肺纤维化,然而,水蛭素抗纤维化的机制仍未完全阐明。本研究通过气管内注射博莱霉素构建肺纤维化大鼠模型,通过检测肺组织炎症因子和纤维化相关蛋白表达,旨在揭示p38MAPK/NF-κB信号通路在水蛭素抗肺纤维化中的作用,为其临床应用于肺纤维化的治疗提供新的视角。
1 材料与方法 1.1 实验动物SPF级SD大鼠60只,♂,6周龄,体质量(200~220) g,购于湖南省长沙市天勤生物技术有限公司,动物合格证号:SCXK(湘)2019-0014。饲养于中南大学动物学部,环境温度(23±2)℃,湿度60%±10%,12 h ∶12 h昼夜比周期循环,不限制食物和水的摄入,构建动物模型前先进行1周的适应性饲养。实验过程中无动物死亡,未观察到不良反应,本实验方案已通过湖南医药学院动物伦理委员会审查批准。
1.2 主要试剂及仪器注射用博莱霉素A5购自天津太和制药有限公司(批号:180901),水蛭素购自广西科康科技集团有限公司(批号:20190901),醋酸泼尼松片购自安阳市华安药业有限公司(批号:181111),ELISA检测试剂盒购自上海酶联生物科技有限公司,TRIzol试剂购自艾科瑞生物(货号:AG21102,编号:A3A0028),逆转录试剂盒购自赛默飞公司(货号:K16622,批号:01036205),由上海生工生物工程公司合成qRT-PCR所需引物,SYBR Green Real Time PCR Master Mix购自于Promega公司(货号:A6001,批号:0000467613),p-p38 MAPK抗体(货号:4511T,批号:13)、p38MAPK抗体(货号:8690T,批号:9),NF-κB p-p65抗体(货号:333T)、NF-κB p65抗体(货号:8242T)购自CST公司,p-IκB抗体(货号:abs130622)、IκB抗体(货号:abs122175)购自Absin公司,GAPDH抗体(货号:#37985,批号:4023)SAB公司,Ⅰ型胶原蛋白(type Ⅰ collagen, COLⅠ)抗体(货号:14695AP,批号:00096972)购自武汉三鹰生物技术有限公司,α平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)抗体(货号:ab5649,批号:GR3263275-6)购自Abcam。Syngene Gnome XQR印迹扫描仪(英国Syngene公司),PCR仪(美国Thermo公司),荧光定量PCR仪(美国Bio-Rad公司),Varioskan LUX多功能微孔板读数仪(美国Thermo公司)。
1.3 实验动物与分组进行1周的适应性饲养后,使用随机数字表随机抽取10只大鼠作为对照组,余50只大鼠随机分为模型组、水蛭素低、中、高浓度组和醋酸泼尼松组,每组10只。
1.4 动物模型建立与处理腹腔注射3 mL·kg-1浓度为100 g·L-1水合氯醛对大鼠进行麻醉,麻醉后的大鼠呈仰卧位固定于鼠板上,颈部脱毛,75%乙醇消毒颈部皮肤,纵行切开颈部皮肤,钝性分离暴露气管,用1 mL注射器向气管内一次性准确注入溶解了博莱霉素A5(5 mg·kg-1)的生理盐水0.2 mL,对照组注入生理盐水0.2 mL;注射完毕立即将大鼠垂直竖立,左右旋转鼠板约1 min,使药物在肺部分布均匀,缝合切口,观察待麻醉苏醒后正常喂养。大鼠肺纤维化的模型构建参照文献[7]。d 2起,水蛭素各干预组的浓度根据课题组前期预实验结果和文献[8]设定,分别给予水蛭素(25、50、100 AT-U·mL-1,1 mL·kg-1)溶解于生理盐水后皮下注射,泼尼松组给予5 mg·kg-1溶解于生理盐水中的醋酸泼尼松溶液2 mL灌胃,对照组给予2 mL生理盐水灌胃,给药次数均为1次·d-1。所有大鼠在d 28处死,取右肺组织放入液氮中冻存,供羟脯氨酸(hydroxyproline,HYP)、炎症因子含量和相关蛋白表达的检测。4%多聚甲醛经主支气管向左肺注入,肺泡展开后再放入4%多聚甲醛中固定,24 h后进行石蜡包埋,用于后续肺组织病理学检查。
1.5 肺组织病理学检查取固定后的大鼠左肺组织脱水透明、浸蜡包埋、切片进行HE染色和Masson染色,显微镜下观察肺组织病理变化,通过Image-ProPlus 6.0图像分析软件评价肺泡炎症和肺纤维化程度,评分标准参照文献[7]。
1.6 肺组织HYP含量测定称取100 mg大鼠肺组织,充分匀浆后,4 000 r·min-1离心10 min,取上清液,严格按照试剂盒提供的检测方法对HYP含量进行测定,根据试剂盒提供的公式进行计算,以上实验重复3次。
1.7 qRT-PCR检测COL-Ⅰ、α-SMA mRNA水平称取50 mg大鼠肺组织与无酶钢柱一同放入研磨管中,加入1 mL TRIzol充分研磨,取上层备用,加入异丙醇沉淀,乙醇洗除杂质,加入30 μL DEPC水轻柔混匀,用紫外分光光度计对每个样本总RNA的浓度、纯度进行测定,各样本A260/280比值在1.8~2.0之间,符合实验要求。取RNA 2 μL,按照逆转录试剂盒提供的步骤合成cDNA。取10 μL cDNA进行PCR反应,以GAPDH为内参,计算相对表达量。以上实验重复3次。各引物序列见Tab 1。
| Gene | Sequences(5′-3′) | |
| Col Ⅰ | Forward | 5′-GCGTGGCTATTCCTTCGTGACTAC-3′ |
| Reverse | 5′-CATCAGGCAGTTCGTAGCTCTTCTC-3′ | |
| α-SMA | Forward | 5′-GCGTGGCTATTCCTTCGTGACTAC-3′ |
| Reverse | 5′-CATCAGGCAGTTCGTAGCTCTTCTC-3′ | |
| GAPDH | Forward | 5′-GACATGCCGCCTGGAGAAAC-3′ |
| Reverse | 5′-AGCCCAGGATGCCCTTTAGT-3′ |
称取100 mg大鼠肺组织加入到含蛋白酶、磷酸酶抑制剂的RIPA裂解液中,充分研磨,冰盒上裂解30 min充分裂解组织,离心取上清备用,使用BCA蛋白定量试剂盒测定蛋白浓度,加入等体积5%巯基乙醇的2×loading buffer,放入金属蛋白浴100 ℃,15 min,使蛋白变性。制备10% SDS-PAGE,取30 μg蛋白上样,进行电泳并转膜,5%脱脂牛奶或BSA封闭两小时后分别加入稀释的山羊抗兔p38 MAPK、p-p38 MAPK、NF-κB p65、NF-κB p-p65、p-IκB、ⅠκB抗体(1 ∶1 000),4 ℃孵育过夜;TBST洗膜3次,加入稀释后的二抗(1 ∶5 000),室温孵育1 h;最后用化学发光法进行显色和曝光,使用ImageJ软件分析得出目的蛋白灰度值(A),目的蛋白表达水平=目的蛋白/内参GAPDH。以上实验重复3次。
1.9 ELISA实验检测肺组织中炎症因子IL-6、TNF-α浓度ELISA试剂盒使用前常温下平衡20 min,标准品孔各加入不同浓度的标准品50 μL,样本孔先加待测肺组织匀浆液后加样本稀释液。各孔再加入HRP标记的检测抗体,37 ℃恒温箱温育60 min。洗板,加入底物A、B液,37 ℃避光孵育15 min。加入终止液,15 min内在450 nm波长处测定各孔的OD值,通过计算标准曲线计算IL-6、TNF-α浓度。以上实验重复3次。
1.10 统计学分析采用GraphPad Prism 5.0进行统计学分析。实验结果计量资料以x±s表示,组间比较采用单因素方差分析。
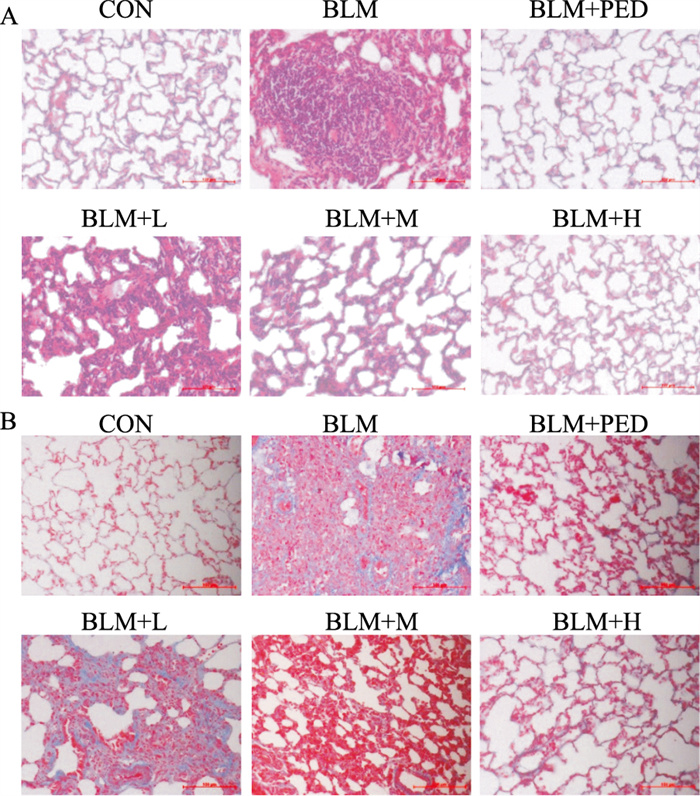
2 结果 2.1 肺组织病理学改变实验过程中所有大鼠均无死亡,未发现出血现象。HE染色结果和Masson染色显示,对照组大鼠肺组织未发现肺泡炎性渗出及纤维化病变,肺泡结构清晰;模型组大鼠肺间质内有较多的片状实变区,肺泡壁明显增宽,肺泡结构紊乱,成纤维细胞大量增生,可见大量蓝色胶原积聚在肺间质内,形成广泛纤维化病灶(Fig 1A,1B)。定量分析显示模型组大鼠肺泡炎症及纤维化得分均高于对照组(P < 0.05),与模型组相比,水蛭素各浓度干预组和泼尼松组肺泡炎症及纤维化得分明显降低(P < 0.05),并以中、高浓度组和泼尼松组改善尤为明显,见Tab 2。
|
| Fig 1 Effect of hirudin on histopathological changes in BLM induced PF rats (×200) A: HE staining of lung tissues in rats; B: Masson staining of lung tissues in rats. The scale bar=100 μm.CON: Control group; BLM: BLM group; BLM+L: BLM+Hirudin low concentration group; BLM+M: BLM+Hirudin middle concentration group; BLM+H: BLM+Hirudin high concentration group; BLM+PED: BLM+Prednisone |
| Group | Alveolitis (Scores) | Pulmonary fibrosis(Scores) | HYP /μg·g-1 |
| CON | 0.00±0.00 | 0.00±0.00 | 196.6±51.02 |
| BLM | 1.64±0.16** | 2.79±0.12** | 668.0±49.96** |
| BLM+L | 1.46±0.15**# | 2.37±0.17**## | 479.8±66.12**# |
| BLM+M | 0.86±0.12**## | 1.62±0.11**## | 332.8±50.75## |
| BLM+H | 0.55±0.11**## | 1.22±0.13**## | 280.9±65.65## |
| BLM+PED | 0.51±0.11**## | 1.19±0.11**## | 231.1±46.68## |
| **P < 0.01 vs control groups; #P < 0.05,##P < 0.01 vs BLM groups | |||
与对照组相比,模型组肺组织HYP的含量明显增多,差异有统计学意义(P < 0.05);与模型组相比,水蛭素干预组和泼尼松组肺组织HYP含量均减少,且呈浓度依赖效应,并以中、高浓度水蛭素组和泼尼松组最为明显,差异有统计学意义(P < 0.05),见Tab 2。
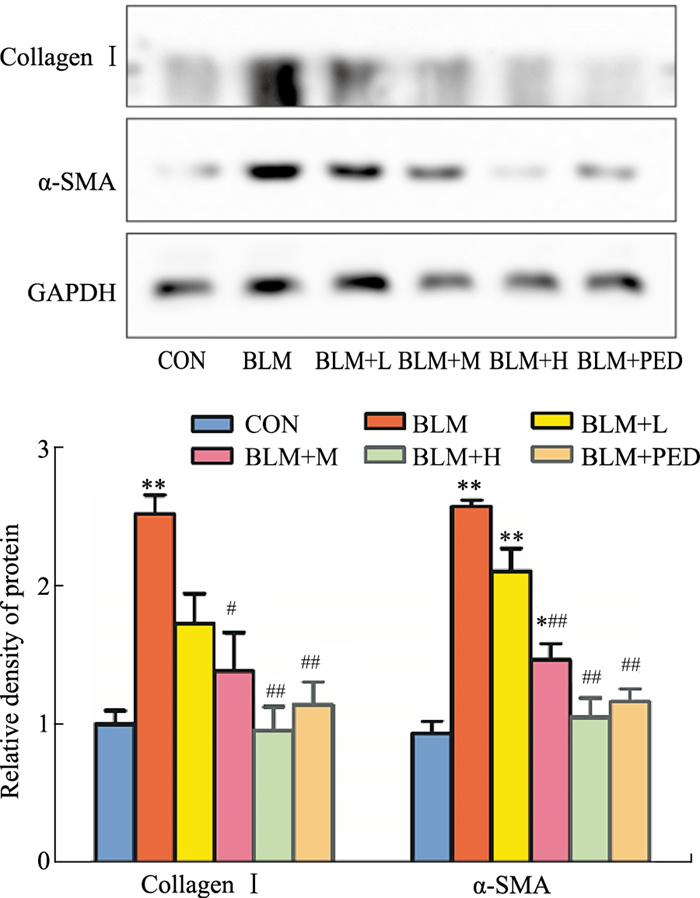
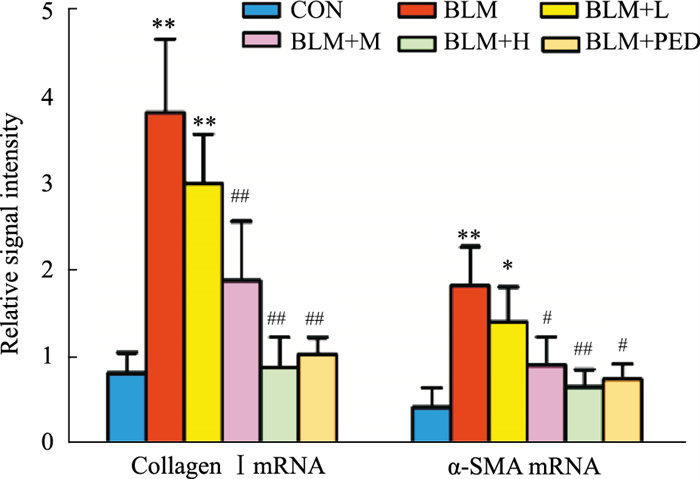
2.3 肺组织COL-Ⅰ、α-SMA mRNA与蛋白的表达水平与对照组相比,模型组大鼠肺组织COL-Ⅰ、α-SMA mRNA与蛋白的表达水平明显升高(P < 0.05);与模型组相比,水蛭素干预组与泼尼松组大鼠肺组织COL-Ⅰ、α-SMA mRNA与蛋白表达水平明显减轻(P < 0.05),以中、高浓度组更为明显(Fig 2、3)。
|
| Fig 2 Expression of collagen Ⅰ, α-SMA proteins detected by Western blot (x±s, n=10) *P < 0.05, **P < 0.01 vs control groups; #P < 0.05, ##P < 0.01 vs BLM groups |
|
| Fig 3 Relative signal intensity of α-SMA, collagen Ⅰ mRNA by qRT-PCR (x±s, n=10) *P < 0.05, **P < 0.01 vs control groups; #P < 0.05, ##P < 0.01 vs BLM groups |
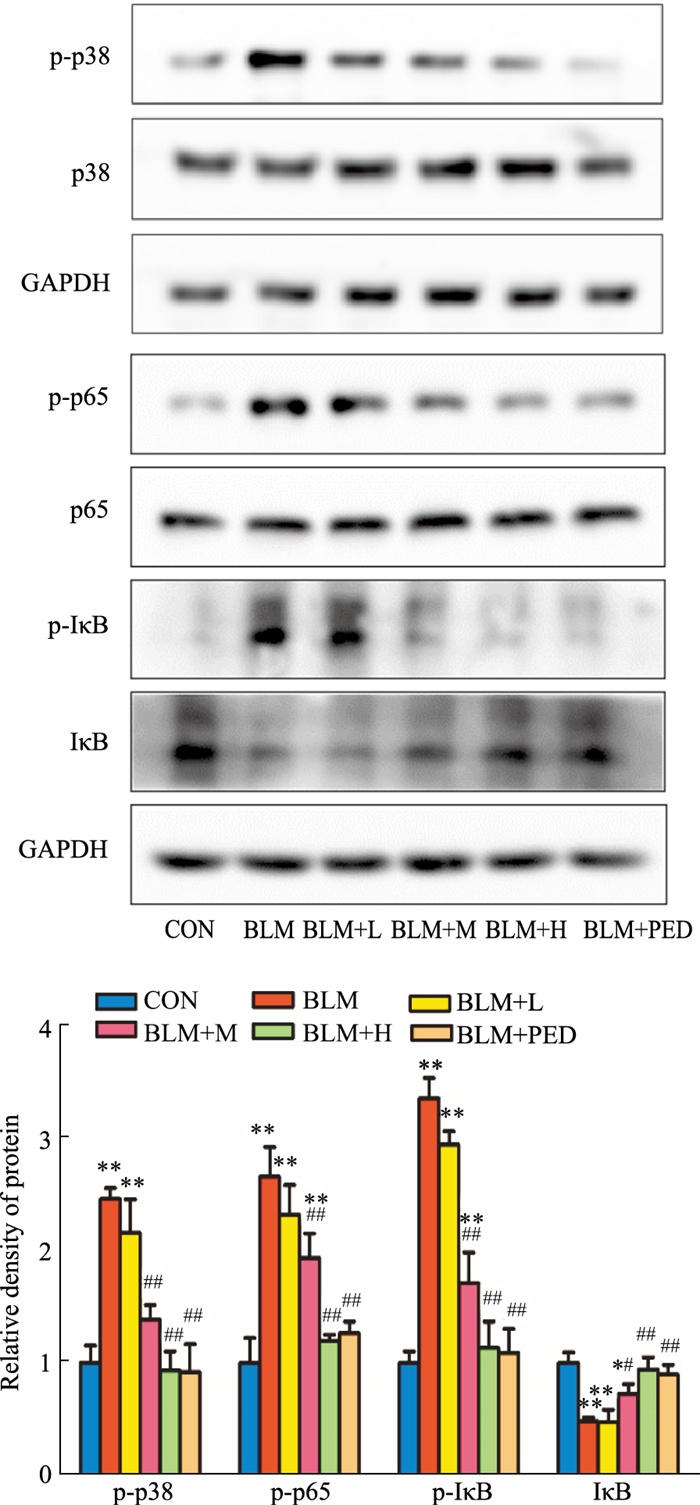
与对照组相比,模型组肺组织p-p38 MAPK表达水平明显升高(P < 0.05);与模型组相比,水蛭素干预组和泼尼松组明显降低肺纤维化大鼠肺组织p-p38 MAPK的表达(P < 0.05),且呈浓度依赖效应,尤其以中、高浓度组最为明显(Fig 4)。
|
| Fig 4 Expression of p38 MAPK/NF-κB P65 signaling pathway related proteins detected by Western blot (x±s, n=10) *P < 0.05, **P < 0.01 vs control groups; #P < 0.05, ##P < 0.01 vs BLM groups |
与对照组相比,模型组NF-κB p-p65、p-IκB表达水平明显增多(P < 0.05);与模型组相比,水蛭素干预组和泼尼松组明显降低肺纤维化大鼠肺组织NF-κB p-p65、p-IκB的表达(P < 0.05),且呈浓度依赖效应,尤其以中、高浓度组最为明显(Fig 4)。
2.5 肺组织炎症因子TNF-α、IL-6浓度与对照组相比,模型组大鼠肺组织TNF-α与IL-6的浓度明显升高(P < 0.05);与模型组相比,水蛭素干预组与泼尼松组TNF-α与IL-6的浓度明显减轻(P < 0. 05),以中、高浓度组更为明显(Fig 5)。
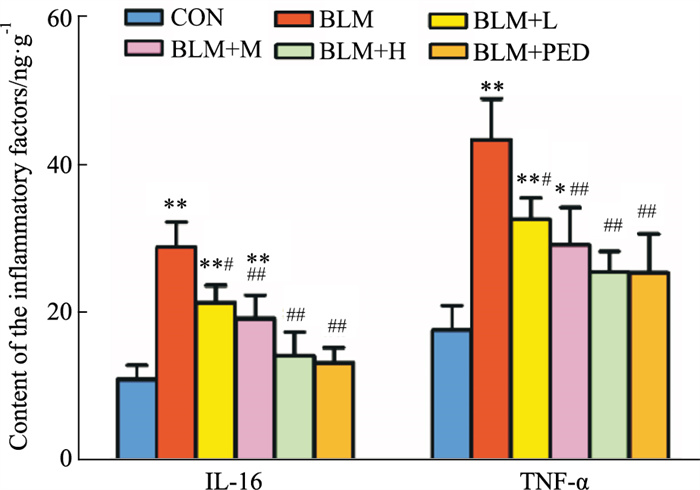
|
| Fig 5 Contents of IL-6 and TNF-α in lung tissues by ELISA (x±s, n=10) *P < 0.05, **P < 0.01 vs control groups; #P < 0.05, ##P < 0.01 vs BLM groups |
肺纤维化的发生发展过程复杂,免疫抑制剂、糖皮质激素和细胞毒类药物是目前治疗肺纤维化的主要药物,但无论是哪种治疗方法,疗效均不佳,并且由于长时间使用可出现严重的毒副作用,特发性肺纤维化指南2015版将吡非尼酮(pirfenidone,PFD)和尼达尼布(nintedanib,BIBF 1120)列为有条件的推荐[9],然而,两种药物不良反应较多且成本较高,未有可靠的证据证实两种药物能明显改善患者预后。因此,迫切需要开发不良反应少,价格相对低廉的中医药来补充现阶段西药治疗肺纤维化的不足。近年来,中医药及天然产物在治疗肺纤维化方面取得了很大的进展,如白藜芦醇、紫檀芪、黄芪甲苷等,以其多途径、多靶点、副作用少、疗效明显成为当下肺纤维化治疗的新视角。水蛭入药始载于东汉时期《神农本草经》,具有较强的破血通经、逐瘀消癥的作用[10]。水蛭素为其主要有效成分,近些年来,除了抗凝、抗血栓作用外,水蛭素一些新的生物活性作用逐渐凸显。
博莱霉素气管内注射诱导大鼠肺纤维化模型在肺组织病理学改变及肺功能等方面与人类肺纤维化最为相近,是目前应用最为广泛的动物模型[11]。本课题组肺纤维化大鼠造模方法已非常成熟,经HE染色、Masson染色可见模型组肺泡间隔增宽,肺泡结构紊乱,肺间质可见大量蓝色胶原沉积,说明建模成功;水蛭素不同浓度组干预后肺组织胶原沉积程度和范围明显减小,肺泡炎及纤维化评分明显降低,尤其以中、高浓度组最为明显,说明水蛭素能减轻肺部炎症和肺纤维化。
正常情况下,细胞外基质(extracellular matrix,ECM)的合成与分解处于动态平衡,有助于维持肺组织的正常结构与功能,COL Ⅰ、COL Ⅲ是ECM的主要组成成分,二者由肺成纤维细胞和转分化后的肌成纤维细胞合成,当肺组织受损时,肺成纤维细胞增殖并分化为肌成纤维细胞,产生过多的ECM,并在肺间质内过度蓄积,造成肺实质广泛损伤和重塑,触发肺纤维化[12]。α-SMA是肺成纤维细胞转分化为肌成纤维细胞的标志,它分泌ECM的能力比肺成纤维细胞高4~5倍。HYP为胶原中特有的氨基酸,其含量常用作评价胶原蛋白含量的重要指标。因此,检测肺组织中HYP含量,COLⅠ、α-SMA mRNA及蛋白的表达水平能准确反映出肺组织中ECM合成与分解代谢情况,评价肺纤维化的严重程度。减少HYP含量,减少COLⅠ、α-SMA mRNA及蛋白的表达是肺纤维化减轻的标志[13]。本研究结果与上述研究结果一致,水蛭素干预后HYP含量及COLⅠ、α-SMA mRNA及蛋白的表达水平明显低于模型组,表明水蛭素对肺纤维化进程中细胞外基质的过度合成具有抑制作用,能有效改善胶原蛋白的积聚,减轻肺纤维化。
肺纤维化的发生发展是一个十分复杂的病理生理过程,虽然其发生机制尚未完全研究透彻,但过度的肺部炎症反应已被证实在其发生发展中起重要作用,是肺纤维化的启动者和驱动力,大量研究证明,抑制炎症反应可以有效抑制肺纤维化[13]。组织损伤后,上皮细胞、内皮细胞释放炎症介质,引发抗纤溶性凝血级联反应,导致血栓的形成,白细胞被招募,随后被趋化因子、生长因子激活并诱导增殖。活化的白细胞进一步分泌、释放促纤维化细胞因子如TGF-β等[14]。炎症因子不仅直接导致肺泡上皮细胞损伤,还能激活炎症反应形成恶性循环,加重肺损伤,加速肺纤维化的进展[13]。NF-κB是细胞内重要的核转录因子,参与了多种细胞因子及炎症介质的转录调控,在炎症反应的网络调节中起重要作用[15-16]。阻断NF-κB激活及炎症因子介导的炎症反应是肺纤维化防治的重要手段。NF-κB通常以p50-p65二聚体形式与IκB结合成复合体,呈失活状态存在于胞质中。当细胞受到促炎因子、抗原、TNF-α、损伤DNA的化学物质和辐射等信号刺激时[16],激活IκB激酶,IκB与NF-κB解离,游离的NF-κB迅速从胞质移入胞核,在核内与目的基因如IL-6、TNF-α、IL-17中特异性序列结合,强烈诱导促炎介质的转录与释放,并且NF-κB激活后的产物如TNF-α、IL-1β等又能反向激活NF-κB,从而形成一个能放大且延续炎症反应的复杂调节环路,导致“瀑布效应”的发生[17]。阻断NF-κB激活是在上游控制炎症反应的有效方法。丝裂酶原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)级联反应信号通路是最关键的细胞内信号途径之一,主要分为ERK、JNK和p38MAPK 3个途径,参与不同的生物过程,其中p38 MAPK途径主要与炎症、细胞生长和应激反应密切相关,p38 MAPK是NF-κB的上游基因[15]。研究发现,气管内注射博莱霉素可通过激活p38 MAPK/NF-κB信号通路导致肺纤维化,抑制该信号通路能明显减轻肺纤维化[18]。本研究结果与上述研究结果一致,模型组大鼠肺组织p-p38 MAPK、NF-κB p-p65、p-IκB蛋白水平明显升高,说明模型组大鼠肺组织p38 MAPK /NF-κB信号通路被激活,水蛭素可以有效地逆转这些变化,这些结果提示水蛭素通过抑制p38 MAPK /NF-κB信号通路的激活,减少肺组织IL-6、TNF-α的含量,减轻肺组织炎症反应,减少细胞外基质沉积,从而缓解肺纤维化的进展。
综上所述,本研究结果提示,水蛭素对大鼠肺纤维化有保护作用,其机制与调控p38 MAPK /NF-κB信号通有关,该结果为水蛭素作为治疗肺纤维化的潜在药物提供了新的证据。
( 致谢: 本实验在侗医药研究湖南省重点实验室和中南大学湘雅护理学院慢性病基础研究与健康管理实验室完成,感谢各位同事和老师的指导与帮助。)
| [1] |
Sgalla G, Iovene B, Calvello M, et al. Idiopathic pulmonary fibrosis: Pathogenesis and management[J]. Respir Res, 2018, 19(1): 1-18. doi:10.1186/s12931-017-0698-3 |
| [2] |
Rodríguez-Portal J A. Efficacy and safety of nintedanib for the treatment of idiopathic pulmonary fibrosis: An update[J]. Drugs R D, 2018, 18(1): 19-25. doi:10.1007/s40268-017-0221-9 |
| [3] |
杨康, 戴璐, 任桐. 水蛭素对单侧输尿管梗阻大鼠肾间质纤维化的干预研究[J]. 中医药学报, 2018, 46(2): 36-40. Yang K, Dan L, Reng T. Intervention of hirudin on renal interstitial fibrosis in rats with unilateral ureteral obstruction[J]. Acta Chin Med Pharmacol, 2018, 46(2): 36-40. |
| [4] |
Chen J R, Xie X F, Zhang H Q, et al. Pharmacological activities and mechanisms of hirudin and its derivatives-A review[J]. Front Pharmacol, 2021, 12(4): 1-23. |
| [5] |
Yang K, Fan B, Zhao Q, et al. Hirudin ameliorates renal interstitial fibrosis via regulating TGF-β1/Smad and NF-κB signaling in UUO rat model[J]. Evid Based Complement Alternat Med, 2020, 26(4): 1-9. |
| [6] |
Liu W, Liang X C, Shi Y. Effects of hirudin on high glucose-induced oxidative stress and inflammatory pathway in rat dorsal root ganglion neurons[J]. Chin J Integr Med, 2020, 26(3): 197-204. doi:10.1007/s11655-019-2712-8 |
| [7] |
刘理静, 钱红, 王乐, 等. LncRNA GAS5通过miR-21/ADAMTS-1途径抑制大鼠肺纤维化[J]. 中国药理学通报, 2020, 36(12): 1737-43. Liu L J, Qian H, Wang L, et al. LncRNA GAS5 inhibits pulmonary fibrosis through miR-21 /ADAMTS-1 pathway in rats[J]. Chin Pharmacol Bull, 2020, 36(12): 1737-43. doi:10.3969/j.issn.1001-1978.2020.12.019 |
| [8] |
李红, 谢海彬, 刘敏, 等. 水蛭素对博莱霉素致特发性肺间质纤维化大鼠肺组织病理变化的影响[J]. 中医临床研究, 2019, 11(7): 1-6. Li H, Xie H B, Liu M, et al. Effects of hirudin on pathological changes in lung tissue of rats with idiopathic pulmonary fibrosis induced by bleomycin[J]. Chin J Chin Med, 2019, 11(7): 1-6. |
| [9] |
Wu Q, Zhou Y, Feng F C, et al. Probing into the mechanism of alkaline citrus extract promoted apoptosis in pulmonary fibroblasts of bleomycin-induced pulmonary fibrosis mice[J]. Evid Based Complement Alternat Med, 2018, 2018: 9658950. |
| [10] |
李晓文, 王泽, 林兰. 水蛭在糖尿病心血管疾病中的作用机制与应用[J]. 天津中医药, 2021, 38(7): 941-5. Li X W, Wang Z, Lin L. Mechanism and application of leech in diabetic cardiovascular disease[J]. Tianjin J Tradit Chin Med, 2021, 38(7): 941-5. |
| [11] |
Liu T, De Los Santos F G, Phan S H. The bleomycin model of pulmonary fibrosis[J]. Methods Mol Biol, 2017, 1627: 27-42. |
| [12] |
Liu H, Zhang X, Shao Y, et al. Danshensu alleviates bleomycin-induced pulmonary fibrosis by inhibiting lung fibroblast-to-myofibroblast transition via the MEK/ERK signaling pathway[J]. Bioengineered, 2021, 12(1): 3113-24. doi:10.1080/21655979.2021.1944020 |
| [13] |
Tao N, Li K, Liu J, et al. Liproxstatin-1 alleviates bleomycin-induced alveolar epithelial cells injury and mice pulmonary fibrosis via attenuating inflammation, reshaping redox equilibrium, and suppressing ROS/p53/α-SMA pathway[J]. Biochem Biophys Res Commun, 2021, 551(4): 133-9. |
| [14] |
孙晴波, 林炳静, 徐寒梅, 等. 肺纤维化的发病机制及其治疗药物研究进展[J]. 药学进展, 2018, 42(11): 868-73. Sun Q B, Lin B J, Xu H M, et al. Pathogenesis of pulmonary fibrosis and progress in drug development[J]. Prog Pharm Sci, 2018, 42(11): 868-73. |
| [15] |
Zhang H F, Wang Y L, Gao C, et al. Salvianolic acid A attenuates kidney injury and inflammation by inhibiting NF-κB and p38 MAPK signaling pathways in 5/6 nephrectomized rats[J]. Acta Pharmacol Sin, 2018, 39(12): 1855-64. doi:10.1038/s41401-018-0026-6 |
| [16] |
Kunnumakkara A B, Shabnam B, Girisa S, et al. Inflammation, NF-κB, and chronic diseases: How are they linked?[J]. Crit Rev Immunol, 2020, 40(1): 1-39. doi:10.1615/CritRevImmunol.2020033210 |
| [17] |
Yu H, Lin L, Zhang Z, et al. Targeting NF-κB pathway for the therapy of diseases: Mechanism and clinical study[J]. Signal Transduct Target Ther, 2020, 5(1): 1-23. doi:10.1038/s41392-019-0089-y |
| [18] |
刘卫东, 高歌, 刘函晔, 等. FTY-720通过TGF-β1/p38 MAPK/NF-κB信号通路对小鼠肺纤维化模型的影响[J]. 中国药理学通报, 2020, 36(2): 250-6. Liu W D, Gao G, Liu H Y, et al. Effects of FTY-720 on pulmonary fibrosis in mice via TGF-β1 / p38 MAPK / NF-κB signaling pathway[J]. Chin Pharmacol Bull, 2020, 36(2): 250-6. doi:10.3969/j.issn.1001-1978.2020.02.019 |

