

2. 暨南大学药学院,广东 广州 510632;
3. 暨南大学 广东省中药药效物质基础及创新药物研究重点实验室,广东 广州 510632;
4. 新疆医科大学中医学院,新疆 乌鲁木齐 830054;
5. 暨南大学中医学院,广东 广州 510632
 ,
LIU Jiang-han-zi1,2,3,
LUO Gan-qing1,2,3,
LI Yi-fang1,2,3,
LI Yuan-bo1,2,3,
HE Rong-rong1,2,3
,
LIU Jiang-han-zi1,2,3,
LUO Gan-qing1,2,3,
LI Yi-fang1,2,3,
LI Yuan-bo1,2,3,
HE Rong-rong1,2,3

2. College of Pharmacy, Jinan University, Guangzhou 510632, China;
3. Guangdong Key Laboratory of Research of Medicinal Substance Basis of Traditional Chinese Medicine and Innovative Drugs, Jinan University, Guangzhou 510632, China;
4. Institute of Traditional Chinese Medicine, Xinjiang Medical University, Urumqi 830054, China;
5. Institute of Traditional Chinese Medicine, Jinan University, Guangzhou 510632, China
冠心病引发的心肌缺血是导致心血管不良事件的最主要因素之一,脂质代谢异常导致的血管腔狭窄是引发心肌缺血的主要诱因。甘油三酯(triglyceride,TG)、胆固醇(cholesterol,TC)及低密度脂蛋白(low density lipoprotein,LDL)等可作为冠心病的重要诊断依据。随着医学检测技术的革新,冠心病的诊断与治疗方面已经取得了较大的进展,但每年患病率仍然居高不下,这可能与无法建立完善的临床前预测筛查机制相关。目前,寻找有效的生物靶标并将其作为预测、防治冠心病发展的生物标记物迫在眉睫。冠心病是一个漫长的疾病发展过程,不同阶段引发的心肌损伤机制各有不同。因此,研究心肌细胞在不同病理阶段的损伤特征已成为研究者们不断探索的方向。
心肌细胞损伤引发的心脏功能减退与死亡是临床不良事件发生的主要病理机制。心肌细胞损伤多由“意外”引发,目前针对心肌细胞的死亡方式主要聚焦于细胞凋亡、坏死性凋亡、细胞焦亡和自噬。但是,这些死亡方式都不足以解释其发病机制和病理进程。深入研究这些心肌死亡方式,可以发现它们存在一个共同特征——心肌细胞存在大量脂质过氧化积累。脂质过氧化有酶介导和非酶介导这两种途径,其中酶介导的磷脂过氧化与近些年来新发现的细胞死亡方式——“铁死亡”密切相关。有研究揭示了心脏损伤中确实存在铁死亡现象,而这一重要发现为冠心病的防治提供了新策略[1-2]。基于心肌细胞损伤而引发心脏功能衰退的研究一直存在较大争议,但探索步伐却从未停止,尤其随着铁死亡在心肌细胞损伤中的作用机制被发现,磷脂过氧化在心肌细胞损伤过程中被赋予举足轻重的意义。本文主要以磷脂过氧化损伤为着眼点,对心肌细胞损伤机制的近期研究进展进行综述,并提出新的观点与展望,旨在全面、深入研究磷脂过氧化损伤对心肌的调控机制,为冠心病的防治策略和诊断提供新的参考,以期延长患者寿命、提高患者生活质量。
1 磷脂过氧化与冠心病诊断 1.1 TC、TG及其氧化衍生物对冠心病诊断的局限性TC与TG是最早发现的冠心病诊断标志物,但将其作为冠心病的独立诊断依据一直存在较大争议。TG和TC的变化受多种疾病的影响,特别是肝脏相关疾病,这大大降低了临床诊断的可靠性。有研究表明,当冠心病患者进行二级预防干预后,TG和TC的检测水平与冠心病发病的相关性明显减少[3]。由此可见,TG和TC水平的变化或许无法作为冠心病的直接预测标志物。随后,研究者将目光投向了对TG和TC氧化衍生物的研究。Shrestha等[4]首次发现了在患者血液中存在11种氧化的TG,并与冠心病的发病密切相关,但具体作用机制尚不明确。此外,7α-羟化酶介导的TC氧化促进细胞膜渗透性,使胞内Ca2+浓度增加[5],这提示TC的过氧化产物能够增加冠心病的风险,参与其疾病进展。迄今为止,虽然TG与TC的氧化衍生产物对冠心病的影响已崭露头角,但仍无法确定其临床诊断价值及具体作用机制。
1.2 磷脂及其氧化衍生物对冠心病诊断的优势早在1966年就有研究发现,冠心病患者血液中的磷脂含量明显增加。近年来,有研究者证实了磷脂含量的变化是冠心病患者的一个病理特征,并认为磷脂对诊断冠心病具有重要意义。当这个观点一经提出后,越来越多的研究者将目光投向对磷脂及其代谢产物在冠心病方面的研究。有临床研究分析指出,磷脂不仅对冠心病不良事件具有较好的预测性,可用于二级预防的预测。此外,有研究在患者血液中发现了8种氧化脂质与冠心病的发病有较强的相关性,其中氧化磷脂尤为显著,且在不同程度患者中相差高达4.7倍[6]。
在冠心病疾病过程中,磷脂不仅仅来源于机体的生物膜,还可源于具有转运TG与TC功能的LDL。虽然氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)对冠心病的诊断具有一定的意义,但易于被清道夫受体识别进行代谢,且目前尚无血浆中存在ox-LDL的直接证据。大多数学者是通过ELISA的方法间接推测血浆中ox-LDL的含量,故ox-LDL这种检测方法是否能够应用于临床冠心病诊断有待证实。在LDL氧化修饰的过程中主要与其表面的磷脂层密切相关,可导致氧化磷脂、TG与TC在体内的堆积,加速泡沫细胞的形成并推动动脉粥样硬化形成(Fig 1)。综上所述,在冠心病发展过程中,氧化磷脂是生物膜损伤以及LDL代谢过程中的共有产物,在血液中相对稳定,或可将其作为一种新型临床防治及诊断冠心病的关键标志物,但具体机制仍需更多的研究证据支持这一观点的合理性。
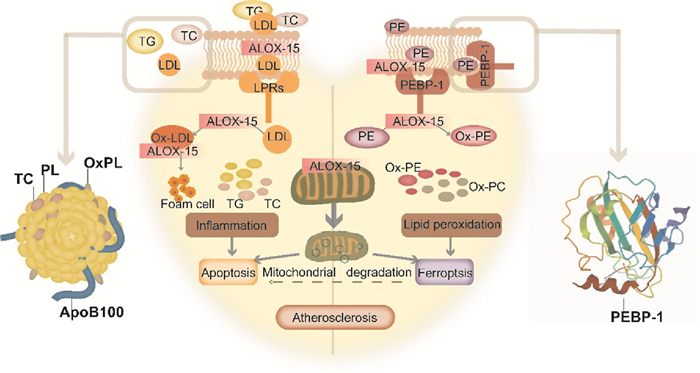
|
| Fig 1 Mechanism of ALOX15 on phospholipid peroxidation ALOX15 translocates to the plasma membrane, selectively absorbs and excretes LDL through LRPs, finally mediating LDL oxidation. Oxidative modification of LDL leads to the accumulation of oxidized phospholipids, TG and TC in vivo, accelerates foam cell formation and promotes atherosclerosis. PEBP1 translocates ALOX15 to the plasma membrane, causing the membrane-PE to produce peroxidation and induce ferroptosis. |
早期对花生四烯酸-15-脂加氧酶(arachidonic acid-15-lipoxygenase,ALOX15)的研究主要围绕冠心病的经典炎症致病学说展开,这是因为ALOX15的代谢产物可间接参与炎症反应,也可以通过调节细胞中促炎物质的表达直接加快冠心病疾病进程。目前,对ALOX15在炎症方面的作用机制已有许多综述进行总结,但是通过对炎症机制的干预不足以明确阐释冠心病的复杂病理机制,而且在临床实验中应用一些抗炎药物的疗效也不完全令人满意[7],令很多专家十分困惑。由此,研究者们逐渐将目光投向了对ALOX15其他作用机制方面的研究。
2.1 ALOX15的结构与分型脂氧合酶(lipoxygenase,LOXs)是一种不含血红素铁的酶,其主要功能是催化氧直接进入多不饱和脂肪。根据LOXs在哺乳动物中催化各种二十碳烯酸的不同位点将其分为5-LOX、8-LOX、12-LOX、15-LOX四种亚型。在脂质氧化过程中,首先由酶促途径催化产生脂质过氧化物(lipid hydroperoxides,LOOHs),随后引发非酶促途径的进一步代谢。LOXs、细胞色素P450氧化还原酶(cytochrome P450 oxidoreductase,POR)和环氧合酶(cyclooxygenases,COXs)是脂质过氧化酶促途径的关键酶。近年来,LOXs因其精确的区域选择性和多样的作用位点选择性具有较高的研究价值。12/15-脂氧合酶(12/15 lipoxygenase,12/15-LOX)是LOXs的一种亚型,也可总称为ALOX15。ALOX15酶的中心位置是非血红素铁原子,并以配位键与3个组氨酸侧链和羧基末端异亮氨酸结合,形成酶活力中心的主要组成部分。ALOX15的多肽链折叠形成了具有催化活性的C末端结构域和N末端具有β-barrel片段的结构域。ALOX15主要分为网状细胞型(ALOX15)和表皮型(ALOX15-B)。其中,ALOX15-B具有巨噬细胞区域特异性,其在巨噬细胞中的表达明显高于ALOX15,并参与调节巨噬细胞中的脂质代谢过程。目前,在冠心病发生与发展过程中,主要以对ALOX15的研究为主,而ALOX15与ALOX15-B究竟谁发挥更重要的作用仍有待深入研究。由此,本综述主要对ALOX15与冠心病发病机制进行总结。
2.2 ALOX15调控磷脂过氧化(铁死亡)对心肌的损伤随着研究的深入,ALOX15在冠心病中的作用机制也被逐渐发掘,已经不仅仅局限于诱发炎症机制方面的研究,而在磷脂过氧化方面也崭露头角。目前认为,磷脂过氧化主要由酶介导和非酶介导两大途径产生,这也是铁死亡的关键的机制。有研究发现,在大鼠心脏缺血/再灌注(ischemia/reperfusion,I/R)损伤时,Nrf2/Hmox1轴介导的线粒体铁积累和磷脂过氧化能够引发心肌细胞发生铁死亡[1]。当心肌细胞缺乏铁蛋白H(ferritin H)时,铁死亡关键调节蛋白Slc7a11表达降低,摄入过量铁离子可以通过降低谷胱甘肽含量,累积的过氧化磷脂增敏了心肌对铁死亡的易感性[2]。基于此,我们发现铁死亡对心肌损伤的研究主要聚焦于铁代谢途径方面,主要是由芬顿反应触发,而对于酶介导的磷脂过氧化方面尚未有报道。LOXs与POR被认为可以通过酶促反应参与铁死亡过程,其中LOXs被认为在铁死亡中起核心作用,尤其是ALOX15。在动物模型中发现,ALOX15在冠心病早期已经表达,且特定LOXs的代谢产物相较于冠心病晚期更为丰富,这可能与晚期的脂质过氧化更多由非酶促途径介导相关[8]。因此,有研究者认为早期ALOX15介导的磷脂过氧化作用或许可以触发后续的非酶促过程。但是,ALOX15具体是如何参与冠心病的疾病过程的具体机制仍不清楚。
从机制上来看,早期研究认为ALOX15主要氧化游离脂肪酸,产生过氧化花生四烯酸(arachidonic acid hydroperoxide,AA-OOH),进而引发炎症反应。近年来,研究者指出ALOX15的功能不仅表现在氧化游离脂肪酸,而且对膜结合的磷脂以及脂蛋白等都具有较高的特异性,其中膜磷脂可受到由ALOX15介导的磷脂过氧化攻击并介导线粒体功能紊乱。不仅如此,因ALOX15对其氧化底物的独特选择性,可直接氧化含花生四烯酸(arachidonic acid,AA)的磷脂,而无需事先通过磷脂酶A2(phospholipase A2,PLA2)释放酯化的AA。随后,有研究发现磷脂酰乙醇胺结合蛋白-1(phosphatidylethanolamine binding protein 1,PEBP1)作为ALOX15的伴侣分子可以将ALOX15铆钉到质膜后促使质膜中的磷脂酰乙醇胺(phosphatidylethanolamines,PE)产生过氧化损伤引发之后的铁死亡[9]。进一步研究证实,膜PE氧化受ALOX15/PEBP1复合物的调控,并可引发更灵敏的酶促反应促进铁死亡的发生[10](Fig 1)。与此同时,本课题组的研究证实了ALOX15可以加速钙非依赖磷脂酶A2β(calcium-independent phospholipase A2β,iPLA2β)对膜磷脂酰乙醇胺氢过氧化物(phosphatidylethanolamines hydroperoxides,PE-OOH)的代谢促使AA-OOH堆积[11]。基于此,我们发现ALOX15的早期研究主要关注的是其代谢产物在炎症反应中的作用,却忽略了ALOX15本身对磷脂氧化的作用。从冠心病的发展角度来看,炎症确实是整个疾病发展的主要基础,但是早期的生物膜磷脂的氧化损伤或许是炎症发生的更重要起始元件。因此,深入研究ALOX15在磷脂过氧化过程中的调控机制或许有助于认识冠心病发病机理。
另一方面,ALOX15可以通过氧化修饰LDL引发冠心病。在动物实验中,当机体缺失ALOX15,小鼠的心脏功能与LDL的氧化过程都得到了有效缓解;当机体过表达ALOX15,小鼠心脏功能明显受损,加速斑块形成,促进冠心病进程[12]。目前,对于ALOX15是如何介导LDL参与冠心病的作用尚不明确。有研究者认为,ALOX15介导的磷脂酰胆碱(phosphatidylcholine,PC)与PE的氧化修饰是LDL氧化引发冠心病的重要发病机制[13]。为了阐明ALOX15与LDL氧化的具体机制,有研究将ALOX15与LDL共处理后发现,ALOX15易位至胞质膜通过脂蛋白受体相关蛋白(lipoprotein receptor-related proteins,LRPs)选择性摄取和排出LDL最后介导了LDL的氧化[14](Fig 1)。此外,也有研究者认为,ALOX15先将LDL中的亚油酸盐向胆固醇转化,随后在自由基连锁反应下将LDL修饰为完全氧化状态,最后导致泡沫细胞逐渐形成并参与冠心病发展过程[15](Fig 1)。最近,有研究发现在疾病状态下,脂肪细胞中会存在铁死亡[16],而本课题组的另一项研究首次发现发生铁死亡的细胞膜PE-OOH可作为一种“吃我”信号被巨噬细胞识别吞噬[17]。由此提示我们,若脂肪细胞发生铁死亡产生大量PE-OOH引发巨噬细胞吞噬积累,或许可以促进泡沫细胞的形成,加速冠心病的进程。
此外,也有研究者提出不同的观点,认为在缺氧条件下,ALOX15与其代谢产物12-HETE和15-HETE都对细胞有一定的保护作用,分别通过TRPV1/PKC通路降低心肌I/R损伤的敏感性和Ca2+依赖途径增加了血管重塑[18]。由此可见,对于ALOX15及其代谢产物是导致心肌进一步损伤的原因,还是具有心肌保护作用,尚无确切定论。但是,铁死亡的发现对冠心病研究者而言无疑是一道明亮的曙光。
3 ALOX15抑制剂的心肌保护作用越来越多的证据表明,磷脂过氧化与冠心病的关系密切,尤其是ALOX15在冠心病发展过程的作用日益突出。因此,研究及开发ALOX15抑制剂并投入临床应用对治疗冠心病变得愈发重要。
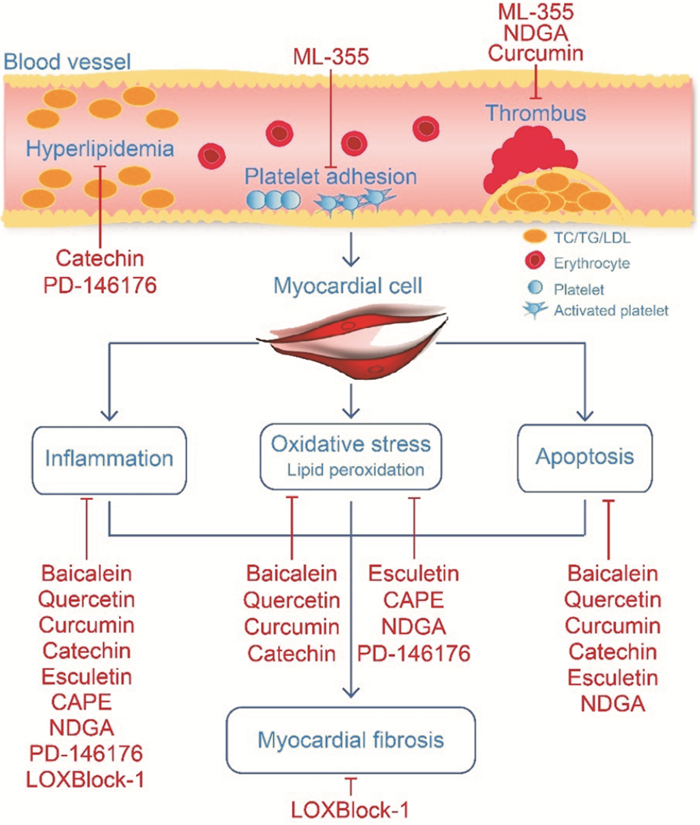
3.1 ALXO15天然产物抑制剂与心肌损伤目前,天然产物中已被报道的ALOX15抑制剂主要包括黄酮类、多酚类、香豆素类和木脂素类(Tab 1)。黄芩素是黄酮类化合物,是黄芩的主要成分之一,是一种ALOX15特异性抑制剂。黄芩素(baicalein)不仅可以通过ERK1/2、AKT、p38 MAPK、JNK1/2及NF-kB/p65等信号通路缓解心肌的I/R损伤,还可通过casepase3通路、核因子E2相关因子2(Nrf2)、血红素加氧酶1(HO-1)及IκBα信号通路缓解心肌的凋亡、炎症反应和脂质过氧化损伤[19]。不仅如此,抑制ALOX15与AA介导的线粒体去极化也是黄芩素缓解心肌I/R损伤的重要机制之一[20](Fig 2)。槲皮素(quercetin)是一种具有多种生物活性的黄酮醇类化合物,具有较强的抗氧化性,可显著降低ALOX15的酶活性,并可以抑制由ALOX15介导的LDL氧化,在延缓冠心病进展中表现出较好的作用。此外,槲皮素还可以通过AMPK介导的凋亡信号通路缓解心肌细胞缺氧损伤[21-22](Fig 2)。
| Category | Chemicals | Target LOXs | Effect | Structure | Ref. |
| Flavonoid | Baicalein | 12/15 LOX | ↓Free radicals ↑Antioxidant enzymes ↓Excessive iron |
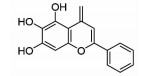 |
[19] |
| Quercetin | 5/12LOX | ↓Inflammation ↓Atherosclerosis |
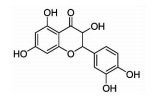 |
[21] | |
| Polyphenols | Curcumin | Non-selective LOX inhibitor |
↓Oxidative damage ↓Inflammation |
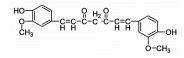 |
[23] |
| Catechin | 5-LOX 12LOX leukocyte-type |
↓LTs ↓Free radicals |
 |
[25] | |
| Coumarin | Esculetin (6,7-dihydroxycoumarin) |
5/12LOX | ↓ LTs ↓12-HETE ↓TXB2 ↓Inflammation | 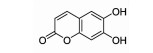 |
[27] |
| Lignin | CAPE (Caffeic acid phenethyl ester) | 5-LOX | ↓Free radicals ↓LTs |
 |
[28] |
| NDGA (Nordihydrog Cuaiaretic acid) | Non-selective LOX inhibitor |
↓LTs ↓HETEs |
 |
[18] | |
| Chemosynthesis | PD-146176 | 15-LOX | ↓Atherosclerosis | 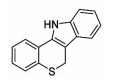 |
[29] |
| ML-355 | 12-LOX | ↓Thrombosis | 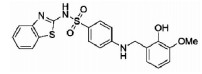 |
[21] | |
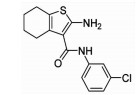
| LOXBlock-1 | 15-LOX | ↓Infarct size ↓Inflammation |
 |
[30] |
|
| Fig 2 Mechanism of ALOX15 inhibitors ALOX15 inhibitors are mainly divided into natural product inhibitors (Baicalein, Quercetin, Curcumin, Catechin, Esculetin, CAPE, and NDGA) and chemical synthesis inhibitors (PD-146176, LOXBlock-1, and ML-355). ALXO15 inhibitors can inhibit hyperlipidemia, platelet adhesion and thrombosis, thereby alleviating myocardial cell damage through oxidative stress, inflammation and apoptosis. |
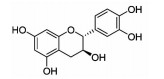
姜黄素(curcumin)是一种多酚类化合物,主要存在于姜科和天南星科的植物中,是LOXs的非选择性抑制剂,对ALOX15具有一定的抑制作用。姜黄素可以通过抑制AA与血小板磷脂的结合、减少血栓烷、减少ox-LDL来延缓动脉粥样硬化病变,进而减缓冠心病的发病进程[23]。同时,也有研究报道发现,姜黄素可以调节Nrf2-Keap1信号通路发挥抗凋亡的作用,缓解心肌细胞死亡[24](Fig 2)。儿茶素(catechin)是一种多酚类化合物,主要存在于茶叶中,又称为儿茶酸。有研究报道认为,儿茶素不仅可以通过降低血浆中TC和TG的水平来降低冠心病的风险,还可以通过抑制铁促进的反应来预防心肌膜发生磷脂过氧化损伤[25]。此外,儿茶素可以显著缓解由I/R引起的心肌细凋亡[26](Fig 1)。
七叶亭(esculetin)是一种香豆素类化合物,是12-LOX的有效抑制剂,可以通过调节JAK2/STAT3信号通路缓解I/R介导的心肌凋亡,并且对心肌有抗脂质过氧化及稳定膜结构等作用[27](Fig 1)。
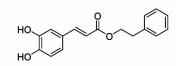
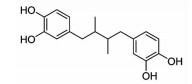
咖啡酸苯乙酯(CAPE)是一种木质素类化合物,主要存在于蜂胶中,是一种非选择性ALOX15抑制剂。CAPE可缓解心肌I/R损伤,而且对阿霉素诱导的心脏毒性也有较好的降解作用[28](Fig 2)。去甲二氢愈创木酸(NDGA)是一种木质素类化合物,广泛存在于含树脂的植物中,是非选择性的LOX抑制剂。NDGA可以通过抑制MCP-1缓解缺氧引发的血栓形成,以及Ca2+途径介导的心肌细胞凋亡[18](Fig 1)。
3.2 ALXO15化学合成抑制剂与心肌损伤基于多种结构类型的天然产物展现了良好的ALOX15抑制活性,为寻找其更为有效的抑制剂提供了潜在的先导化合物。目前,一些化学合成的ALOX15抑制剂也展现出了令人满意的优化效果。PD-146176是ALOX15的有效选择性抑制剂之一,该化合物可以抑制高胆固醇血症诱导的冠心病发病进程[29]。另外,LOXBlock-1作为一种新型的ALOX15抑制剂在心肌I/R损伤中也表现出了较好的作用[30]。ML-355作为一种选择性12-LOX抑制剂,可通过抑制血小板的聚集,减少血栓形成,进而防止心血管不良事件的发生(Fig 1)。虽然对ALOX15抑制的研发仍处于初始阶段,但随着心肌损伤病理机制的逐渐提示,其特效抑制剂在临床的应用指日可待。
4 总结与展望冠心病是一个复杂的病理过程,尽管近些年来在其发病机制领域已取得了重要进展,但磷脂过氧化这一现象在疾病发展过程中的具体作用仍需要进一步研究。本课题组一直致力于研究ALOX15在冠心病中的机制,发现冠心病的危险因素——高血脂会改变心肌中脂肪酸比例,促使不饱和脂肪酸增加,从而触发磷脂过氧化,最终引发对冠心病心肌损伤的易感性增加。但是,我们的研究只是冠心病复杂机制中的冰山一角,仍有许多机制未阐明。例如:磷脂过氧化是由心肌细胞膜引起还是LDL表面磷脂所引起;心肌细胞膜磷脂过氧化损伤与LDL的氧化是否存在先后顺序及上下游关系;以及ALOX15介导的磷脂过氧化在冠心病中是否具有一定的特异性。铁死亡的提出无疑给这些研究领域提供了方向,本课题组也一直致力于铁死亡对疾病机制与ALOX15抑制剂开发方面的研究,并寄希望于此能为认识及防治冠心病提供证据。
| [1] |
Fang X, Wang H, Han D, et al. Ferroptosis as a target for protection against cardiomyopathy[J]. Proc Natl Acad Sci USA, 2019, 116(7): 2672-80. doi:10.1073/pnas.1821022116 |
| [2] |
Fang X, Cai Z, Wang H, et al. Loss of cardiac ferritin H facilitates cardiomyopathy via Slc7a11-mediated ferroptosis[J]. Circ Res, 2020, 127(4): 486-501. doi:10.1161/CIRCRESAHA.120.316509 |
| [3] |
Preiss D, Sattar N. Lipids, lipid modifying agents and cardiovascular risk: A review of the evidence[J]. Clin Endocrinol, 2009, 70(6): 815-28. doi:10.1111/j.1365-2265.2008.03490.x |
| [4] |
Shrestha R, Hui S P, Miura Y, et al. Identification of molecular species of oxidized triglyceride in plasma and its distribution in lipoproteins[J]. Clin Chem Lab Med, 2015, 53(11): 1859-69. |
| [5] |
Kummerow F A. Interaction between sphingomyelin and oxysterols contributes to atherosclerosis and sudden death[J]. Am J Cardiovasc Dis, 2013, 3(1): 17-26. |
| [6] |
Paynter N P, Balasubramanian R, Giulianini F, et al. Metabolic predictors of incident coronary heart disease in women[J]. Circulation, 2018, 137(8): 841-53. doi:10.1161/CIRCULATIONAHA.117.029468 |
| [7] |
Hussain A, Ballantyne C M. New approaches for the prevention and treatment of cardiovascular disease: focus on lipoproteins and inflammation[J]. Annu Rev Med, 2021, 72: 431-46. doi:10.1146/annurev-med-100119-013612 |
| [8] |
Wittwer J, Hersberger M. The two faces of the 15-lipoxygenase in atherosclerosis[J]. Prostaglandins Leukot Essent Fatty Acids, 2007, 77(2): 67-77. doi:10.1016/j.plefa.2007.08.001 |
| [9] |
Wenzel S E, Tyurina Y Y, Zhao J, et al. PEBP1 wardens ferroptosis by enabling lipoxygenase generation of lipid death signals[J]. Cell, 2017, 171(3): 628-41. doi:10.1016/j.cell.2017.09.044 |
| [10] |
Anthonymuthu T S, Kenny E M, Shrivastava I, et al. Empowerment of 15-lipoxygenase catalytic competence in selective oxidation of membrane ETE-PE to ferroptotic death signals, HpETE-PE[J]. J Am Chem Soc, 2018, 140(51): 17835-9. doi:10.1021/jacs.8b09913 |
| [11] |
Sun W Y, Tyurin V A, Mikulska-Ruminska K, et al. Phospholipase iPLA2β averts ferroptosis by eliminating a redox lipid death signal[J]. Nat Chem Biol, 2021, 17(4): 465-76. doi:10.1038/s41589-020-00734-x |
| [12] |
Halade G V, Kain V, Ingle K A, et al. Interaction of 12/15-lipoxygenase with fatty acids alters the leukocyte kinetics leading to improved postmyocardial infarction healing[J]. Am J Physiol Heart Circ Physiol, 2017, 313(1): H89-h102. doi:10.1152/ajpheart.00040.2017 |
| [13] |
Kühn H, Belkner J, Suzuki H, et al. Oxidative modification of human lipoproteins by lipoxygenases of different positional specificities[J]. J Lipid Res, 1994, 35(10): 1749-59. doi:10.1016/S0022-2275(20)39770-4 |
| [14] |
Zhu H, Takahashi Y, Xu W, et al. Low density lipoprotein receptor-related protein-mediated membrane translocation of 12/15-lipoxygenase is required for oxidation of low density lipoprotein by macrophages[J]. J Biol Chem, 2003, 278(15): 13350-5. doi:10.1074/jbc.M212104200 |
| [15] |
Takahashi Y, Zhu H, Yoshimoto T. Essential roles of lipoxygenases in LDL oxidation and development of atherosclerosis[J]. Antioxid Redox Signal, 2005, 7(3-4): 425-31. doi:10.1089/ars.2005.7.425 |
| [16] |
Turchi R, Tortolici F, Guidobaldi G, et al. Frataxin deficiency induces lipid accumulation and affects thermogenesis in brown adipose tissue[J]. Cell Death Dis, 2020, 11(1): 51. doi:10.1038/s41419-020-2253-2 |
| [17] |
Luo X, Gong H B, Gao H Y, et al. Oxygenated phosphatidylethanolamine navigates phagocytosis of ferroptotic cells by interacting with TLR2[J]. Cell Death Differ, 2021, 28(6): 1971-89. doi:10.1038/s41418-020-00719-2 |
| [18] |
Ran Y, Wu H, Wei L, et al. NFATc3 pathway participates in the process that 15-LO/15-HETE protects pulmonary artery smooth muscle cells against apoptosis during hypoxia[J]. J Recept Signal Transduct Res, 2014, 34(4): 270-82. doi:10.3109/10799893.2014.917322 |
| [19] |
Sahu B D, Kumar J M, Kuncha M, et al. Baicalein alleviates doxorubicin-induced cardiotoxicity via suppression of myocardial oxidative stress and apoptosis in mice[J]. Life Sci, 2016, 144: 8-18. doi:10.1016/j.lfs.2015.11.018 |
| [20] |
Haworth R A, Potter K T, Russell D C. Role of arachidonic acid, lipoxygenase, and mitochondrial depolarization in reperfusion arrhythmias[J]. Am J Physiol Heart Circ Physiol, 2010, 299(1): H165-74. doi:10.1152/ajpheart.00906.2009 |
| [21] |
Adili R, Tourdot B E, Mast K, et al. First selective 12-LOX inhibitor, ML355, impairs thrombus formation and vessel occlusion in vivo with minimal effects on hemostasis[J]. Arterioscler Thromb Vasc Biol, 2017, 37(10): 1828-39. doi:10.1161/ATVBAHA.117.309868 |
| [22] |
卢宁, 韩吉春, 任博雪, 等. 二氢槲皮素预处理对心肌缺血/再灌注损伤抗氧化作用的影响[J]. 中国药理学通报, 2017, 33(4): 487-92. Lu N, Han J C, Ren B X, et al. Antioxidation effect of dihydroquercetin pretreatment in isolated rat hearts during myocardial ischemia reperfusion injury[J]. Chin Pharm Bull, 2017, 33(4): 487-92. doi:10.3969/j.issn.1001-1978.2017.04.009 |
| [23] |
Chompoo J, Upadhyay A, Gima S, et al. Antiatherogenic properties of acetone extract of Alpinia zerumbet seeds[J]. Molecules, 2012, 17(6): 6237-48. doi:10.3390/molecules17066237 |
| [24] |
Lin X, Bai D, Wei Z, et al. Curcumin attenuates oxidative stress in RAW264.7 cells by increasing the activity of antioxidant enzymes and activating the Nrf2-Keap1 pathway[J]. PLoS One, 2019, 14(5): e0216711. doi:10.1371/journal.pone.0216711 |
| [25] |
Koo S I, Noh S K. Green tea as inhibitor of the intestinal absorption of lipids: potential mechanism for its lipid-lowering effect[J]. J Nutr Biochem, 2007, 18(3): 179-83. doi:10.1016/j.jnutbio.2006.12.005 |
| [26] |
Wang W, Huang X, Shen D, et al. Polyphenol epigallocatechin-3-gallate inhibits hypoxia/reoxygenation-induced H9C2 cell apoptosis[J]. Minerva Med, 2018, 109(2): 95-102. |
| [27] |
Ibrar M, Khan M A, Abdullah, et al. Evaluation of Paeonia emodi for its cardioprotective potentials: An investigative study towards possible mechanism[J]. J Ethnopharmacol, 2019, 231: 57-65. doi:10.1016/j.jep.2018.10.041 |
| [28] |
Tolba M F, Omar H A, Azab S S, et al. Caffeic acid phenethyl ester: A review of its antioxidant activity, protective effects against ischemia-reperfusion injury and drug adverse reactions[J]. Crit Rev Food Sci Nutr, 2016, 56(13): 2183-90. doi:10.1080/10408398.2013.821967 |
| [29] |
Sendobry S M, Cornicelli J A, Welch K, et al. Attenuation of diet-induced atherosclerosis in rabbits with a highly selective 15-lipoxygenase inhibitor lacking significant antioxidant properties[J]. Br J Pharmacol, 1997, 120(7): 1199-206. doi:10.1038/sj.bjp.0701007 |
| [30] |
Kar F, Hacioglu C, Senturk H, et al. Curcumin and LOXblock-1 ameliorate ischemia-reperfusion induced inflammation and acute kidney injury by suppressing the semaphorin-plexin pathway[J]. Life Sci, 2020, 256: 118016. doi:10.1016/j.lfs.2020.118016 |