


2. 广西医科大学医学科学实验中心细胞与免疫实验室,广西 南宁 530021;
3. 广西中医药研究院,广西 南宁 530022
 ,
LUO Zhuo1,
LI Li3,
MO Xiao-xiang1,
SHEN Xiao-ju1,
MO Xiao-cheng1,
TAN Wei-dan1,
HE Jing-chuan1,
DENG Zhi-hua1,
YANG Jie1
,
LUO Zhuo1,
LI Li3,
MO Xiao-xiang1,
SHEN Xiao-ju1,
MO Xiao-cheng1,
TAN Wei-dan1,
HE Jing-chuan1,
DENG Zhi-hua1,
YANG Jie1

2. Guangxi Medical University, Cell and immunity Laboratory of Medical Science Experiment Center, Nanning 530021, China;
3. Guangxi Institute of Traditional Chinese Medicine & Pharmaceutical Science, Nanning 530022, China
小细胞肺癌作为恶性程度最高的肺部肿瘤,临床上分为局限期和广泛期,多数患者就诊时已是广泛期,难以进行手术治疗、只能放化疗[1]。顺铂作为临床主要用药(cisplatin,DDP),与依托泊苷的联合治疗是SCLC一线治疗的首选方案。但是,绝大多数患者易快速耐药而复发[2]。目前针对非小细胞肺癌的特异性靶向药对SCLC的治疗反应欠佳,治疗进展极为缓慢,因此,亟需发现新的SCLC治疗靶点和药物[3]。
两面针(Zanthoxylum nitidum)是我国常用抗肿瘤壮药,又名入地金牛、双面刺、双背针、山椒、下山虎等,为芸香科花椒属植物两面针的干燥根,主产于广西、福建、湖南、广东、云南等地。据2020年版《中国药典》记载其具有“行气止痛,活血散瘀,通络祛风等功效”,归肝、胃经[4]。氯化两面针碱是从两面针的干燥根茎中提取的一种苯骈菲啶类生物碱,其化学结构如Fig 1所示[5]。研究表明氯化两面针碱对乳腺癌、肝癌及鼻咽癌等多种恶性肿瘤具有抗肿瘤活性[6],但目前对小细胞肺癌的研究甚少。因此,本研究以小细胞肺癌细胞H1688和H446为研究对象,将顺铂作为阳性对照药,采用MTT法、流式细胞术检测氯化两面针碱对SCLC细胞活力和凋亡的影响; 通过倒置显微镜和HE染色观察氯化两面针碱处理后细胞的形态学变化; 通过蛋白免疫印迹法(Western blot)进一步探究氯化两面针碱处理SCLC细胞后相关蛋白的表达变化,从而阐明氯化两面针碱诱导SCLC发生凋亡的分子机制。
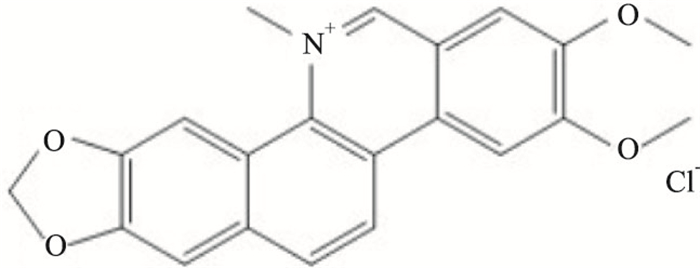
|
| Fig 1 Chemical structure of nitidine chloride |
SCLC细胞株NCI-H1688、NCI-H446、NCI-H209来源于中国科学院细胞库(中国上海),NCI-H196来源于美国细胞培养收藏中心(American Type Culture Collection,ATCC),在37℃、5%CO2的培养箱中培养; 培养基为RPMI1640,含有10%胎牛血清和1%青-链霉素双抗。
1.2 药物与试剂氯化两面针碱,纯度HPLC ≥ 98%,北京索莱宝公司,用二甲基亚砜(DMSO)配成1 g·L-1的贮存液; 顺铂,齐鲁制药,用生理盐水配成1 g·L-1的贮存液; 四甲基偶氮唑盐(MTT),北京索莱宝公司; 胰酶粉末,北京索莱宝公司; 青-链霉素双抗,北京索莱宝公司; AnnexinV-PE/ 7-AAD凋亡试剂盒,联科生物; 伊红,北京索莱宝公司; 苏木精,北京中杉新桥生物技术公司; PAGE凝胶快速制备试剂盒,5×Loading buffer,双色预染蛋白Marker(10 ku~250 ku),上海雅酶生物医药科技有限公司; caspase-3、cleaved-caspase-3、p-Akt美国CST公司; Bax、Bcl-2、PARP(武汉Proteintech公司); p-PI3K北京博奥森公司。
1.3 主要仪器CO2培养箱,美国Thermo公司公司(3110);细胞培养超净工作台,苏州净化设备有限公司(YJ-1360);荧光倒置相差显微镜,日本NIKON公司(TS100-F); 多功能酶标仪,美国伯腾公司(SynergyH1);FACS Calibur流式细胞仪,美国BD公司; 双色红外成像系统(扫膜仪),美国Licor公司(ODYSSEY); 低温高速离心机,德国Eppendorf公司(5810R)。
1.4 方法 1.4.1 MTT法检测氯化两面针碱对SCLC细胞活性的影响将H1688、H446、H196及H209细胞培养于25T细胞培养瓶,待细胞处于对数生长期时,用PBS洗2遍细胞,然后用0.25%胰酶进行消化,并进行细胞计数,分别制成单细胞悬液,将H1688、H446、H196及H209细胞分别以每孔3 000、5 000、3 000、3 000、20 000个/孔的细胞浓度接种于96孔板中,每孔细胞悬液100 μL,每个分组设置5个复孔,每组实验重复3次。待24 h细胞贴壁后分别以0、0.5、1、2、4、8、16 μmol·L-1的氯化两面针碱作用48 h以及0、2.5、5、10、20、40、80 μmol·L-1的顺铂作为阳性对照药物组作用48 h后,每孔加入20 μL 0.5 mg·L-1的MTT,放入培养箱中孵育4 h后,小心吸去培养液,每孔加入150 μL DMSO,放置于摇床快速震荡10 min后,在490 nm波长处用酶联免疫检测仪测吸光度值(OD)。计算细胞存活率:细胞存活率/%=(实验组OD值-空白孔OD值)/(对照组OD值-空白孔OD值)×100%。取平均值绘制药物剂量效应曲线,通过SPSS计算药物的半数抑制浓度(IC50)。本实验中阴性对照组(Control)为0.1% DMSO。
1.4.2 倒置显微镜及HE染色法观察给药前后H1688和H446细胞细胞核及细胞质的形态变化将H1688和H446细胞用PBS清洗2遍,胰酶消化,计数,以1×105个·mL-1细胞接种到24孔板中,每孔细胞悬液500 μL,放入培养箱培养24 h。待24 h细胞贴壁后,给予对应浓度氯化两面针碱或顺铂孵育,实验分组情况同方法“2.4”部分表 1。药物处理48 h后,于倒置显微镜下观察药物处理后的细胞形态学变化并拍照; 弃去培养基,用PBS洗涤2次,用4%多聚甲醛固定20 min,PBS洗涤2次,每次1 min。苏木精染色5 min,自来水洗涤。伊红染色5 min,自来水洗涤,与倒置显微镜下观察药物处理后细胞核及细胞质的形态改变并拍照。
1.4.3 流式细胞术检测氯化两面针碱对H1688和H446细胞凋亡的影响按AnnexinV-PE/ 7-AAD cell apoptosis试剂盒说明书操作,主要步骤为:取对数生长期的H1688和H446细胞,调整细胞密度,以2×105个/孔接种于6孔板中,待细胞完全贴壁后采用氯化两面针碱低浓度组、氯化两面针碱高浓度组、顺铂组及DMSO对照组分别处理细胞,实验分组情况同方法“2.4”部分Tab 1。继续培养48 h后,用不含EDTA的0.25%胰酶消化,用离心管收集各组细胞,800 r·min-1离心5 min,弃去上清,用预冷PBS重悬离心洗涤,800 r·min-1离心5min,弃去上清,留细胞沉淀,加入400 μL 1×Binding buffer工作液,吹打混匀后转移细胞混悬液至流式管,每管加入5 μL AnnexinV-PE和5 μL 7-AAD混匀后,室温避光孵育15 min,在流式细胞仪上进行检测分析。
| Group | Control | Nitidine chloride/μmol·L-1 | Cisplatin/μmol·L-1 | |
| IC20 | IC60 | |||
| H1688 | 0 | 0.75 | 1.5 | 15 |
| H446 | 0 | 0.5 | 1 | 15 |
取对数生长期的H1688和H446细胞,分别以每孔3 000、5 000个/孔接种于96孔板,待细胞贴壁24 h后,吸走培养液上清后,依次向每孔加入含有药物RPMI1640完全培养基溶液100 μL,实验分组和加药浓度如Tab 1和Tab 2,每个浓度设置5个复孔,每组实验重复3次。继续培养48 h后,往每孔加入20 μL 0.5 mg·L-1的MTT,放入培养箱中孵育4 h后,小心吸去培养液,应尽量避免吸到紫色结晶沉淀,每孔加入150 μL DMSO,放置于摇床快速震荡10 min后,在490 nm波长处用酶联免疫检测仪测吸光度值(OD)。计算细胞存活率:细胞存活率/%=(实验组OD值-空白孔OD值)/(对照组OD值-空白孔OD值)×100%。
| Compound | 0 | Nitidine chloride | Cisplatin/15 μmol·L-1 | |
| IC20 | IC60 | |||
| Z-VAD-FMK/μmol·L-1 | 10 | 10 | 10 | 10 |
细胞处理及给药方法同方法“2.3部分”,实验分组情况同方法“2.4”部分Tab 1。细胞用药物处理48 h后,收集旧培养基,用PBS洗涤2次,胰酶消化,收集细胞,800 r·min-1,离心5 min。根据细胞数加入适量的1×RIPA buffer裂解(含磷酸酶抑制剂和蛋白酶抑制剂),冰上裂解30 min后,用细胞刮收集蛋白,12 000×g离心30 min后吸取上清,用BCA法检测蛋白浓度后,按比例加入5×Loading buffer,100 ℃水浴孵育5 min使蛋白变性。根据待检测蛋白的分子量大小,制备12.5%的聚丙烯酰胺凝胶,取30 μg蛋白进行聚丙烯酰胺凝胶电泳,电泳完成后转膜。在5%脱脂奶粉中常温封闭1 h,加入一抗溶液在4 ℃下孵育过夜,d 2回收一抗,用PBST缓冲液洗涤3次后,加入抗兔或鼠IgG二抗溶液,在室温下孵育1 h,PBST缓冲液洗涤3次。将PVDF膜置于Odyssey红外荧光成像系统中,按照仪器说明进行扫描,结果以ImageJ软件进行测量分析。
1.4.6 统计学处理采用SPSS 17.0统计软件进行统计分析,数据以x±s表示,多组间均数比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 氯化两面针碱可呈浓度依赖性地抑制人SCLC细胞株H1688、H446、H196、H209的活力结果如Fig 2所示,随着氯化两面针碱浓度(0、0.5、1、2、4、8、16 μmol·L-1)的升高,H1688、H446、H196和H209的细胞活力逐渐降低,表明氯化两面针碱可呈浓度依赖性地抑制SCLC细胞活力。如Tab 3所示,氯化两面针碱或顺铂作用于H1688细胞48 h的IC50分别为(1.52±0.08)、(16.93±1.51) μmol·L-1,H446细胞分别为(1.99±0.21)、(16.72±1.70) μmol·L-1,H196细胞分别为(4.65±0.57)、(16.22±1.73) μmol·L-1以及H209细胞分别为(3.26±0.09)、(35.02±1.85) μmol·L-1。以上结果表明,相比顺铂(16.2~35.0 μmol·L-1)氯化两面针碱以更小的剂量(1.5~4.6 μmol·L-1)抑制SCLC细胞活力。其中氯化两面针碱对H1688和H446细胞的体外抑制效果更好,因此,我们选择H1688和H446细胞进行相关机制研究。用SPSS软件计算得到氯化两面针碱处理H1688细胞48 h的IC20和IC60分别为0.5和1 μmol·L-1,对H446细胞48 h的IC20和IC60分别为0.75和1.5 μmol·L-1。因此我们选择0.5和1 μmol·L-1作为H688细胞后续实验的条件,选择0.75和1.5 μmol·L-1作为H446细胞后续实验的条件,阳性对照药物顺铂组我们统一选择15 μmol·L-1作为两株细胞后续实验的条件进行研究。
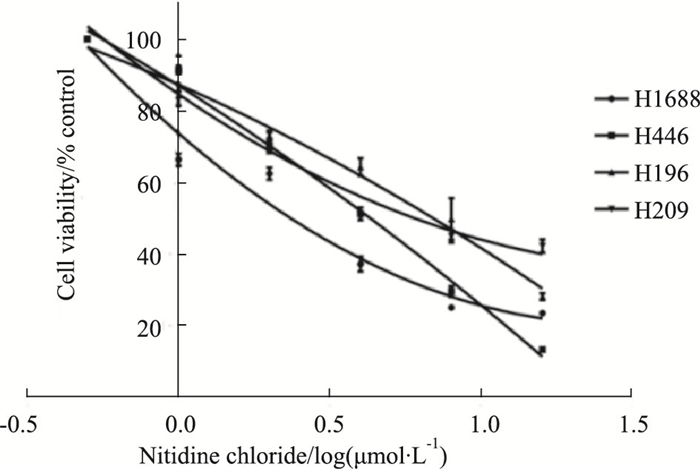
|
| Fig 2 Effect of nitidine chloride on activity of human SCLC cell lines H1688, H446, H196, H209(x±s, n=3) |
| IC50 | Nitidine chloride/μmol·L-1 | Cisplatin/μmol·L-1 |
| H1688 | 1.52±0.08 | 16.93±1.51 |
| H446 | 1.99±0.21 | 15.72±1.70 |
| H196 | 4.65±0.57 | 16.22±1.73 |
| H209 | 3.26±0.09 | 35.02±1.85 |
结果如Fig 3所示,0.1%DMSO处理的阴性对照组(Control)H1688细胞呈菱形,H446细胞呈卵圆形、三角形,细胞大小均匀一致,细胞膜完整,分裂状态正常。与阴性对照组(Control)相比,用15 μmol·L-1 DDP处理的H1688和H446细胞出现细胞皱缩,部分细胞呈长梭形,胞膜上有小泡状形成,呈现出凋亡形态特征。与阳性对照药物顺铂组(DDP 15 μmol·L-1)相似,随着氯化两面针碱浓度的增加,凋亡细胞增多。以上结果表明,氯化两面针碱可呈剂量依赖性地诱导SCLC细胞出现凋亡形态特征。
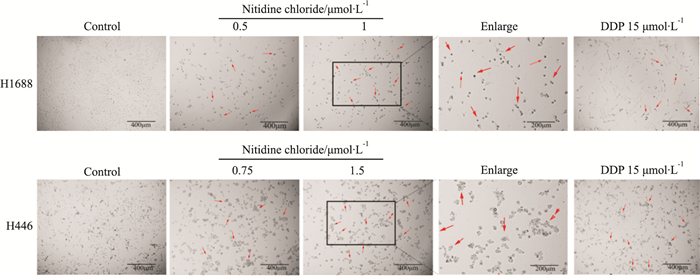
|
| Fig 3 Density and morphological changes of cells in each group observed by inverted fluorescence microscope |
结果如Fig 4所示,0.1%DMSO处理的阴性对照组(Control)细胞胞质呈红紫色,胞核呈深紫色,细胞形态完整,胞质较丰富且无明显变化; 与阴性对照组(Control)相比,用15 μmol·L-1 DDP处理的H1688和H446细胞胞质密度下降,细胞质减少,部分细胞出现皱缩,细胞核边集。与阳性对照药物顺铂组(DDP 15 μmol·L-1)相似,随着氯化两面针碱浓度的增加,H1688细胞和H446细胞出现胞浆流失,细胞核固缩、边集化现象。以上结果表明,氯化两面针碱可能诱导SCLC细胞发生凋亡。
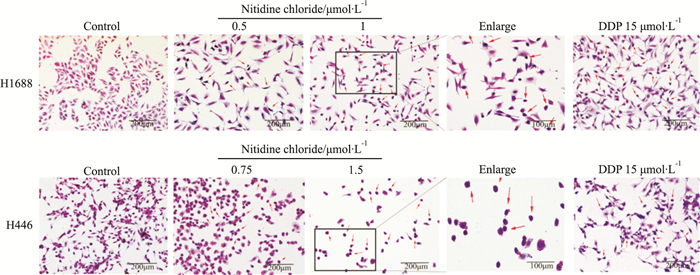
|
| Fig 4 The morphological changes of cells observed by HE staining in each group after treatment with nitidine chloride |
结果如Fig 5所示,与0.1%DMSO处理的阴性对照组(Control)比较,用阳性对照药物顺铂处理H1688和H446细胞后,细胞凋亡率升高。与阳性对照药物顺铂组(DDP 15 μmol·L-1)相似,随着氯化两面针碱浓度的增加,氯化两面针碱处理的H1688和H446细胞凋亡率显著升高。以上结果表明,氯化两面针碱可呈剂量依赖性地诱导SCLC细胞发生凋亡。
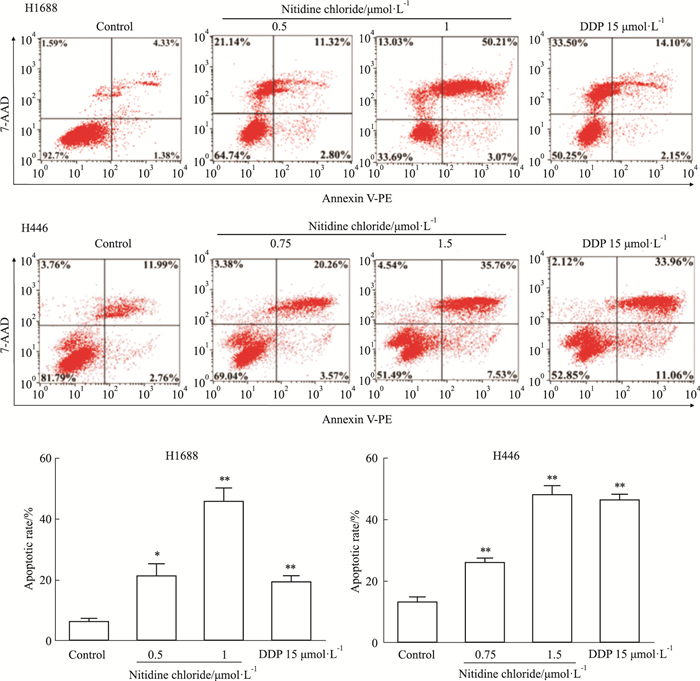
|
| Fig 5 The apoptotic rate of H1688 and H446 cells increased by nitidine chloride in a dose-dependent manner(x±s, n=3) *P < 0.05, **P < 0.01 vs Control |
结果如Fig 6所示,与0.1%DMSO处理的阴性对照组(Control)比较,用阳性对照药物顺铂处理H1688和H446细胞后,H1688和H446细胞cleaved-caspase-3和cleaved PARP蛋白表达均明显升高。与阳性对照药物顺铂组(DDP 15 μmol·L-1)相似,氯化两面针碱1 μmol·L-1处理的H1688细胞cleaved caspase-3蛋白表达明显升高,氯化两面针碱0.5、1 μmol·L-1处理的H1688细胞cleaved PARP蛋白表达明显升高; 氯化两面针碱0.75、1.5 μmol·L-1处理的H446细胞cleaved-caspase-3和cleaved PARP蛋白表达明显升高。以上结果表明,氯化两面针碱可激活H1688和H446细胞caspase-3和PARP蛋白表达。
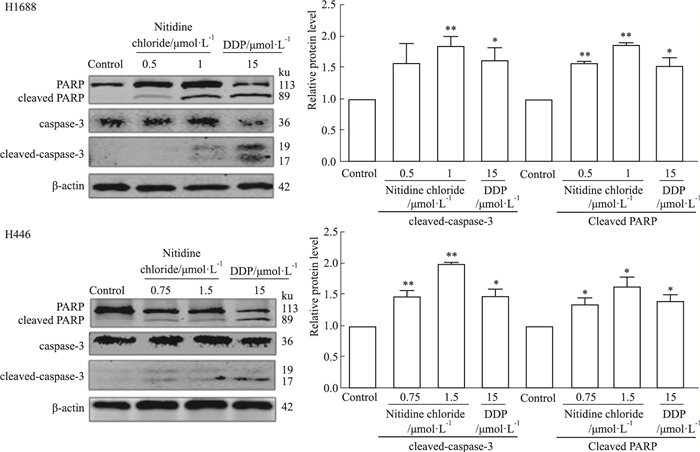
|
| Fig 6 Caspase-3 and PARP protein expression in H1688 and H446 cells activated by nitidine chloride in a dose-dependent manner(x±s, n=3) *P < 0.05, **P < 0.01 vs Control |
Bcl-2家族作为caspase-3的上游调节信号,可作为凋亡信号的开关诱导细胞发生凋亡。其中,Bax/Bcl-2比值通常可作为细胞抗凋亡能力的评判指标[7]。结果如Fig 7所示,与0.1%DMSO处理的阴性对照组(Control)对照组比较,用15 μmol·L-1 DDP处理H1688和H446细胞后,两株细胞的Bax/Bcl-2蛋白表达比值明显升高。与阳性对照药物顺铂组(DDP 15 μmol·L-1)相似,随着氯化两面针碱浓度的增加,H1688和H446细胞Bax/Bcl-2蛋白表达比值明显升高。以上结果表明,氯化两面针碱可升高H1688和H446细胞Bax表达、降低Bcl-2蛋白表达。
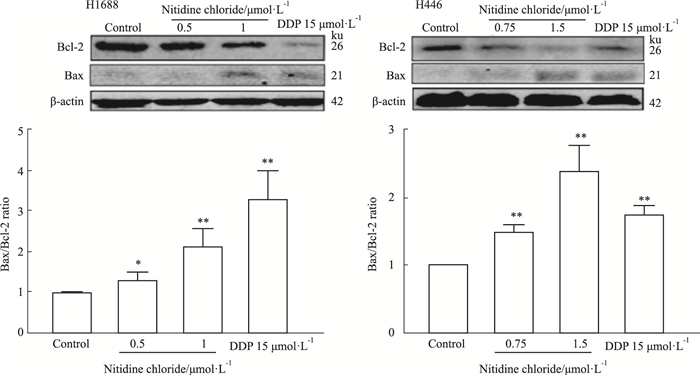
|
| Fig 7 Ratio of Bax/Bcl-2 protein expression in H1688 and H446 cells increased by nitidine chloride in a dose-dependent manner (x±s, n=3) *P < 0.05, **P < 0.01 vs Control |
凋亡抑制剂Z-VAD-FMK能以不可逆的形式与活化的半胱氨酸蛋白酶caspases结合,从而阻断细胞凋亡。结果如Fig 8所示,与单用氯化两面针碱或顺铂组(DDP 15 μmol·L-1)比较,当凋亡抑制剂Z-VAD-FMK分别与氯化两面针碱或顺铂联用时,可部分拮抗氯化两面针碱或顺铂对H1688和H446细胞凋亡的诱导作用。以上结果表明,氯化两面针碱对H1688和H446细胞凋亡的抑制作用可被凋亡抑制剂Z-VAD-FMK部分拮抗; 结合“3.4”部分的结果,我们推测氯化两面针碱可诱导人SCLC细胞发生caspases酶依赖的细胞凋亡。
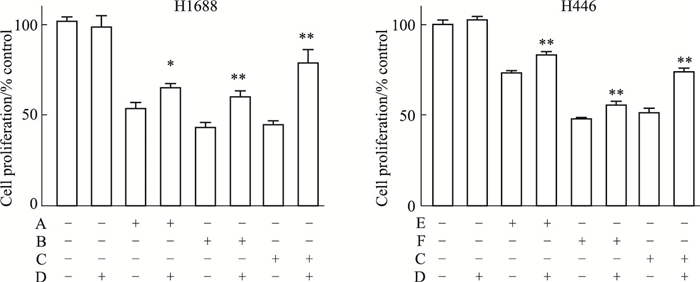
|
| Fig 8 Effect of apoptosis inhibitor Z-VAD-FMK on apoptosis of H1688 and H446 cells induced by nitidine chloride or cisplatin(x±s, n=3) A: Nitidine chloride 0.5 μmol·L-1; B: Nitidine chloride 1 μmol·L-1; C: DDP 15 μmol·L-1; D: Z-VAD-FMK 10 μmol·L-1; E: Nitidine chloride 0.75 μmol·L-1; F: Nitidine chloride 1.5 μmol·L-1. *P < 0.05, **P < 0.01 vs the Single drug group |
Akt作为PI3K/Akt信号通路中的主要功能靶点激酶,可作为Bcl-2蛋白的上游信号分子,并通过磷酸化Bcl-2进而激活其下游的caspase-3[8]。如Fig 9所示,与0.1%DMSO处理的阴性对照组(Control)比较,用DDP 15 μmol·L-1处理后H1688和H446细胞p-PI3K和p-Akt水平降低。与阳性对照药物顺铂组(DDP 15 μmol·L-1)相似,随着氯化两面针碱浓度的增加,H1688和H446细胞p-PI3K和p-Akt水平显著降低。以上结果表明,氯化两面针碱可呈剂量依赖性地抑制H1688和H446细胞p-PI3K和p-Akt蛋白表达。
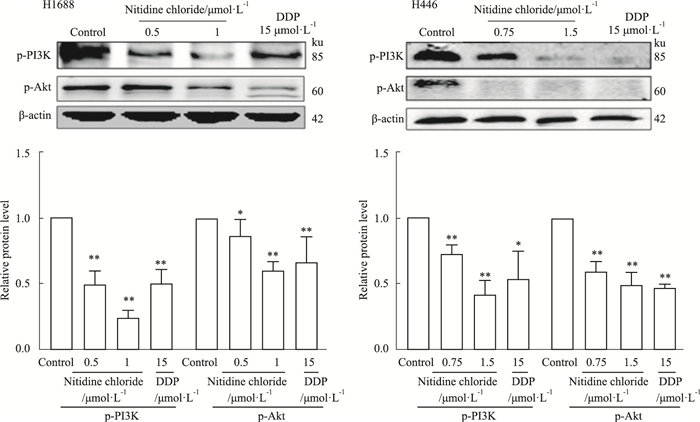
|
| Fig 9 Expression of p-PI3K and p-Akt protein in H1688 and H446 cells inhibited by nitidine chloride in a dose-dependent manner(x±s, n=3) *P < 0.05, **P < 0.01 vs Control |
SCLC因其具有早期转移倾向、快速分裂、免疫逃逸、躲避凋亡等特点,导致临床极差的预后[9]。顺铂作为SCLC的一线化疗药,由于顺铂毒性大、不良反应较多,限制了其临床应用和疗效[10]。因此,寻找高效低毒的抗肿瘤药物是肿瘤药理学领域研究的热点和难点。本研究中通过将顺铂作为阳性对照药与氯化两面针碱进行比较研究发现,氯化两面针碱能以更小的剂量(5 μmol·L-1)诱导SCLC细胞发生凋亡,提示其可作为一种更高效的具有抗SCLC潜力的药物。
包括民族药在内的中草药是我国传统医药和创新药物研发的宝贵资源,许多中药及其有效成分具有良好的抗肿瘤活性。氯化两面针碱作为一种中药单体已被证明具有较强的抗非小细胞肺癌活性,其作用机制主要是通过下调Hippo通路相关蛋白MOB-1、LATS-1、YAP的表达从而产生抗NSCLC作用[11]。而氯化两面针碱能否通过诱导凋亡来发挥抗SCLC作用,目前仍不清楚。本文旨在研究氯化两面针碱作用于小细胞肺癌的机制。
我们通过HE染色和流式细胞术发现,与顺铂相似,氯化两面针碱可诱导SCLC细胞发生凋亡的形态学改变,细胞数量明显减少并升高凋亡率。caspase-3作为细胞凋亡的执行者,其被激活后,在大量自由基和氧化剂存在的情况下会激活聚腺苷二磷酸核糖聚合酶-1(Poly ADP-ribose polymerase 1,PARP-1),引起ATP的过度消耗,诱导细胞发生凋亡[12]。Bcl-2家族作为凋亡信号通路的开关,可激活caspase-3,诱导细胞发生凋亡。本研究中我们通过Western blot实验发现, 氯化两面针碱可升高Bax并抑制Bcl-2,使cleaved-caspase-3及PARP的表达增加,提示氯化两面针碱对H1688和H446细胞的促凋亡作用可能与调控Bcl-2家族蛋白表达,激活caspase-3及PARP有关。
PI3K/Akt通路与肿瘤发生发展密切相关,目前针对这一信号通路已有临床研究正在开展,如目前正在开展临床Ⅰ期实验的PI3K抑制剂BKM120,与顺铂和依托泊苷联用可延缓耐药的发生; 正在开展临床Ⅱ期实验的Akt抑制剂MK-2206,可应用于小细胞肺癌、非小细胞肺癌和胸腺等恶性肿瘤[13]。近年来研究表明,具有抗肿瘤活性的中药活性成分或单体可通过调控PI3K/Akt通路诱导肿瘤细胞凋亡。有研究发现,蓝萼甲素可通过抑制PI3K和Akt的磷酸化来诱导三阴性乳腺癌细胞发生凋亡来发挥抗肿瘤作用[14]。本实验中,我们发现氯化两面针碱可抑制PI3K和Akt的磷酸化,因此, 我们推测氯化两面针碱诱导SCLC发生的凋亡可能与抑制PI3K和Akt的磷酸化,升高Bax的表达,抑制Bcl-2进而激活caspase-3及PARP有关。
值得注意的是,抗凋亡抑制剂Z-VAD-FMK并不能完全拮抗氯化两面针碱或顺铂诱导的细胞死亡。研究表明,顺铂除了可诱导肿瘤细胞发生凋亡外,还能诱导肿瘤细胞发生铁死亡[15]、焦亡[16]、程序性坏死[17]等死亡方式来发挥抗癌作用。中药包括中药活性单体具有多靶点、多环节、多途径的抗癌特性,可诱导细胞发生凋亡、坏死、焦亡、铁死亡、胀亡等多种死亡方式来发挥抗癌作用[18]。近年来,铁死亡、焦亡、坏死、自噬性死亡等多种非凋亡性死亡的发现为阐明肿瘤发生发展机制和抗癌药物的研究提供了新思路和新的治疗靶点。目前, 关于氯化两面针碱引起细胞发生除凋亡外的其他死亡方式鲜有报道。因此,我们推测氯化两面针碱除了诱导凋亡,还可能通过诱导细胞发生其他死亡来发挥抗SCLC作用。
综上所述,氯化两面针碱可诱导SCLC细胞发生凋亡,其机制可能与抑制PI3K和Akt的磷酸化,升高Bax、抑制Bcl-2的表达进而激活caspase-3及PARP有关。我们还将进一步研究氯化两面针碱是否还通过诱导其他死亡方式发挥抗肿瘤作用及其具体机制,从而为广西特色抗肿瘤民族药的开发和利用提供新的依据和思路。
| [1] |
Rudin C M, Poirier J T. Small-cell lung cancer in 2016: Shining light on novel targets and therapies[J]. Nat Rev Clin Oncol, 2017, 14(2): 75-6. doi:10.1038/nrclinonc.2016.203 |
| [2] |
Kryczka J, Kryczka J, Czarnecka-Chrebelska K, et al. Molecular mechanisms of chemoresistance induced by cisplatin in NSCLC cancer therapy[J]. Int J Mol Sci, 2021, 22(16): 8885. doi:10.3390/ijms22168885 |
| [3] |
Oronsky B, Reid T R, Oronsky A, et al. What's New in SCLC? A Review[J]. Neoplasia, 2017, 19(10): 842-7. doi:10.1016/j.neo.2017.07.007 |
| [4] |
吴孟华, 马志国, 张英, 等. 两面针的本草考证[J]. 中国中药杂志, 2021, 46(20): 5436-42. Wu M H, Ma Z G, Zhang Y, et al. Herbalogical study on Liangmianzhen (Zanthoxyli Radix)[J]. Chin J Chin Mater Med, 2021, 46(20): 5436-42. |
| [5] |
秦舒琴, 李海云, 宋静茹, 等. 氯化两面针碱的提取分离、全合成及药理活性的研究进展[J]. 广西植物, 2018, 38(9): 1248-60. Qin S Q, Li H Y, Song J R, et al. Research progress on extraction, separation, total synthesis and pharmacological activity of nitidine chloride[J]. Guihaia, 2018, 38(9): 1248-60. |
| [6] |
Cui Y, Wu L, Cao R, et al. Antitumor functions and mechanisms of nitidine chloride in human cancers[J]. Cancer, 2020, 11(5): 1250-6. doi:10.7150/jca.37890 |
| [7] |
Yochum Z, Cades J, Wang H, et al. Targeting the EMT transcription factor TWIST1 overcomes resistance to EGFR inhibitors in EGFR-mutant non-small-cell lung cancer[J]. Oncogene, 2019, 38(5): 656-70. doi:10.1038/s41388-018-0482-y |
| [8] |
钟大仓, 陈超, 李桐, 等. 胡椒碱诱导人胰腺癌PANC-1细胞凋亡的caspase-3/Bax/Bcl-2信号通路机制研究[J]. 中国现代应用药学, 2020, 37(14): 1687-91. Zhong D C, Cheng C, Li T, et al. Study on the caspase-3/Bax/Bcl-2 signal pathway mechanism of induction apoptosis effect of piperine in human pancreatic cancer PANC-1 cell[J]. Chin J Mod Appl Pharm, 2020, 37(14): 1687-91. |
| [9] |
Poirier J T, George J, Owonikoko T K, et al. New approaches to SCLC therapy: from the laboratory to the clinic[J]. Thorac Oncol, 2020, 15(4): 520-40. doi:10.1016/j.jtho.2020.01.016 |
| [10] |
徐培声, 林嘉伟, 俞美声, 等. 顺铂通过ROS介导ClC-3上调诱导鼻咽癌细胞凋亡[J]. 中国病理生理杂志, 2021, 37(6): 1091-8. Xu P S, Lin J W, Yu M S, et al. Cisplatin induces apoptosis in nasopharyngeal carcinoma cells by up-regulates of the expressions of ClC-3 via ROS mediation[J]. Chin J Chin Pathophysiol, 2021, 37(6): 1091-8. doi:10.3969/j.issn.1000-4718.2021.06.017 |
| [11] |
Zhang J, Wu L, Lian C, et al. Nitidine chloride possesses anticancer property in lung cancer cells through activating Hippo signaling pathway[J]. Cell Death Discov, 2020, 6(1): 91. doi:10.1038/s41420-020-00326-7 |
| [12] |
袁逾喆, 张忠泉, 孙庆红, 等. 白藜芦醇通过激活Caspase-3和PARP-1影响前列腺癌细胞侵袭和凋亡[J]. 实用药物与临床, 2018, 21(7): 732-6. Yuan Y Z, Zhang Z Q, Sun Q H, et al. Resveratrol affects the invasion and apoptosis of prostate cancer cells by activating caspase-3 and PARP-1[J]. Pract Pharm Clin Remed, 2018, 21(7): 732-6. |
| [13] |
Krencz I, Sztankovics D, Danko T, et al. Progression and metastasis of small cell lung carcinoma: The role of the PI3K/Akt/mTOR pathway and metabolic alterations[J]. Cancer Metastasis Rev, 2021, 40(4): 1141-57. doi:10.1007/s10555-021-10012-4 |
| [14] |
吴沁航, 鲍刚, 朱丽文, 等. 蓝萼甲素通过PI3K/Akt信号通路诱导三阴性乳腺癌MDA-MB-231细胞凋亡[J]. 中国药理学通报, 2020, 36(09): 1227-32. Wu Q H, Bao G, Zhu L W, et al. Glaucocalyxin A induces triple-negative breast cancer MDA-MB-231 cell apoptosis through PI3K/Akt signaling pathway[J]. Chin Pharmacol Bull, 2020, 36(9): 1227-32. doi:10.3969/j.issn.1001-1978.2020.09.009 |
| [15] |
Guo J, Xu B, Han Q, et al. Ferroptosis: A novel anti-tumor action for cisplatin[J]. Cancer Res Treat, 2018, 50(2): 445-60. doi:10.4143/crt.2016.572 |
| [16] |
Zhang Z, Zhang Y, Xia S, et al. Gasdermin E suppresses tumour growth by activating anti-tumour immunity[J]. Nature, 2020, 579(7799): 415-20. doi:10.1038/s41586-020-2071-9 |
| [17] |
Mao Q, Zhuang Q, Shen J, et al. MiRNA-124 regulates the sensitivity of renal cancer cells to cisplatin-induced necroptosis by targeting the CAPN4-CNOT3 axis[J]. Transl Androl Urol, 2021, 10(9): 3669-83. doi:10.21037/tau-21-777 |
| [18] |
Yu J, Zhong B, Xiao Q, et al. Induction of programmed necrosis: A novel anti-cancer strategy for natural compounds[J]. Pharmacol Ther, 2020, 214: 107593. doi:10.1016/j.pharmthera.2020.107593 |