


2. 武汉科技大学医学院,湖北 武汉 430081
 ,
LUO Fu-jiao1,
WANG Ting2,
ZHOU Zhi-yong1,
HE Yu-min1,
LIU Chao-qi1,
ZHANG Chang-cheng1,
YUAN Cheng-fu1
,
LUO Fu-jiao1,
WANG Ting2,
ZHOU Zhi-yong1,
HE Yu-min1,
LIU Chao-qi1,
ZHANG Chang-cheng1,
YUAN Cheng-fu1

2. Medical College, Wuhan University of Science and Technology, Wuhan 430081, China
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)是一种全球性流行病,它可能从独立的脂肪变性发展为非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)、肝硬化,并最终发展为肝癌。在我国,NASH是慢性重症肝病的主要诱因,也是肝移植的主要原因之一。因此,探索NASH的发生发展机制,并有针对性的建立行之有效的防治策略,具有极其重要的科学研究意义和临床应用前景。
微小核糖核酸(miRNAs)是一类由18~25个核苷酸组成的的非编码核糖核酸,在转录后水平调节基因表达[1]。去乙酰化酶1(Sirtuin1,SIRT1)是一种烟酰胺腺嘌呤二核苷酸依赖性脱乙酰酶。有研究表明SIRT1能与线粒体融合蛋白2(mitofusin-2,MFN2)相互作用,MFN2是SIRT1的底物[4]。而肝组织中MFN2表达的减少导致活性氧生成的增加和三磷酸腺苷合成的减少,从而增加氧化应激和炎症反应[2],MFN2敲除小鼠的血浆及肝脏中促炎因子的丰度明显增加[3]。
竹节参(Panacis japonici rhizoma)又名竹节人参、竹节三七,兼具人参和三七双重药效,为五加科植物竹节参(Panax japonicus.C.A.Mey.)的根状茎及肉质块根,是我国民间常用中草药[4]。有研究发现, 竹节参总皂苷(total saponins of Panax japonicas,TSPJ)可明显可明显改善由内质网应激和自噬介导的自然衰老大鼠肝脏的炎症反应[5],也可明显改善恶病质肿瘤小鼠血清中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)的水平[6]。因此,本研究将建立高脂饮食(high fat diet, HFD)小鼠模型,研究相关信号通路并探讨TSPJ在NASH发生发展过程中对小鼠肝细胞保护作用的分子机制,为临床应用竹节参防治NASH提供实验基础。
1 材料与方法 1.1 实验药物本实验所用竹节参根块采集于湖北省恩施市椿木营竹节参种植基地,由三峡大学医学院何毓敏博士团队进行分离与鉴定,并采用优化提取工艺,以竹节参干燥的粗粉为原材料进行了提取与分离,提取率达到18.4%,纯度达到83.48%,可以满足后续实验要求。
1.2 试验动物SPF级BALB/c♂小鼠45只,由湖北省宜昌市三峡大学实验动物中心提供,其动物生产许可证号SCXK(鄂)2017-0012。
1.3 试剂高脂饲料购自于华阜康公司(编号:H10060)。逆转录试剂盒、SYER GREEN均购买于诺唯赞生物科技有限公司;总RNA提取试剂盒购于大连宝生物科技有限公司;PCR引物合成于生工生物工程(上海)股份有限公司;兔单抗anti-SIRT1(millipore, #07-131)、兔单抗β-Actin(Servicebio)(GB11001)、兔单抗Mitofusion-2(NIAR164, ab124773)、兔多抗IL-1β(ab9722)、鼠单抗TNF-α(santacruz, SC-52746)购于上海优宁维生物科技有限公司;总蛋白提取裂解液、BCA工作液均购买于武汉科瑞有限公司;ECL显影液购于武汉生物科技公司。
1.4 主要仪器仪器实时定量PCR仪来自德国Applied Biosysterms公司;PowerPasBasic200电泳仪购于美国Bio-Rad公司;BioshineChemiQ4800mini化学发光凝胶成像显影设备购于上海欧翔科学仪器有限公司;IX53显微镜购于日本Olympus公司。
1.5 实验方法 1.5.1 小鼠脂高脂诱导模型的建立45只Balb/c小鼠随机分为正常组(Control组)、高脂饮食组(HFD组)、TSPJ低剂量组(15 mg·kg-1)、TSPJ高剂量组(45 mg·kg-1),正常组给予普通维持饲料,HFD组、SPJ低、高剂量组给予高脂饲料。TSPJ低、高剂量组小鼠每天灌胃给予15 mg·kg-1,45 mg·kg-1的TSPJ(溶于生理盐水),其他组每天灌胃等量的生理盐水。持续7个月后处死小鼠,进行血清收集及肝脏取材。
1.5.2 肝组织HE染色切取大小为10 mm ×3 mm的新鲜肝脏大叶组织块放入组织包埋盒中,置于中性福尔马林固定液中固定48 h,再转入75%乙醇中,8 h后再经过常规脱水处理,石蜡进行包埋,然后再将蜡块切片为厚度4 μm的组织切片,固定于防脱载玻片上,进行常规HE染色,普通显微镜下观察肝组织病理变化情况。
1.5.3 实时荧光定量PCR检测MFN2、SIRT1、TNF-α、IL-1β、miR-199的表达称取小鼠肝组织50 mg,采用试剂盒提取小鼠肝脏组织总RNA。用核酸仪测定RNA浓度,经逆转录试剂盒得cDNA;miR-199用茎环引物进行逆转录(5′-GTCGTATCCAGTGCAG GGTCCGAGGTATTCGCACTGGATACGACGAACAGGT AGTC-3′)。MFN2、SIRT1、TNF-α、IL-1β、SREBP、ChREBP以GAPDH为内参,miR-199以U6为内参,经过PCR反应扩增目的基因。RT-PCR反应体系为10 μL体系,分别为RNase-freewater 2.6 μL,SYBER GREEN 5 μL,引物0.4 μL,cDNA 2 μL。RT-PCR实验反应条件:95 ℃、5 min;95 ℃、10 s;60 ℃、30 s;95 ℃、15 s;60 ℃、1 min,95 ℃、15 s;cycles 40;溶解曲线从56 ℃到98 ℃,每0.3 ℃读取一次;PCR反应结束后读取CT值,计算2-ΔΔCt并分析目的基因在各个样本中的表达情况。
| Gene | Primer (5′-3′) |
| GAPDH | Sense: GGTTGTCTCCTGCGACTTCAA |
| Antisense: CCACCCTGTTGCTGTAGCC | |
| SIRT1 | Sense:CCAGAGTCCAAGTTTAGAAGAACCC |
| Antisense: TCCTCCAGCACATTCGGG | |
| MFN2 | Sense: TGGTCGGAGGAGTGGTGTG |
| Antisense: TGGTGGTCCAGGTCAGTCG | |
| IL-1β | Sense:TGTCCTGGTGTAATGAAAGACGGC |
| Antisense:GCTTGRGCTCTGCTTGTGAGG | |
| TNF-α | Sense: TCAACCTCCTCTCTGCCGTC |
| Antisense: GAGCAATGACTCCAAAGTAGACCT | |
| ChREBP | Sense: CCTTCAATGGGATGGTGTATACC |
| Antisense: TCTGTGACTGCCCGTGTGG | |
| SREBP | Sense: ACAGTGACTTCCCTGGCCTAT |
| Antisense: GCATGGACGGGTACATCTTCAA | |
| U6 | Sense: CTCGCTTCGGCAGCACA |
| Antisense: AACGCTTCACGAATTTGCGT | |
| miR-199 | Sense: CAGTGCAGGGTCCGAGGT |
| Antisense: CGCACGCCCAGTGTTCAG |
称取冻存肝脏组织50 mg,加入预冷的PBS洗涤组织,以RIPA ∶ PMSF ∶蛋白酶抑制剂=100 ∶ 1 ∶ 1的体积比配制裂解液。每管加入500 μL的裂解液,应用电动匀浆器进行组织匀浆,冰浴裂解15 min,再经4 ℃,12 000 r· min-1,离心10 min后取上清分装。用BCA蛋白浓度试剂盒测定所提取的蛋白浓度;加入5× loading buffer混匀后,沸水(100 ℃)煮10 min使之变性;在10% SDS-PAGE凝胶进行电泳,然后将蛋白电转印至NC膜上。用5%脱脂牛奶室温下封闭NC膜1 h,在4 ℃孵育一抗(抗体比例为1 ∶ 3 000)过夜;洗膜后再加对应来源的二抗(抗体比例为1 ∶ 4 000),在室温下孵育1 h,洗膜后用进行显影;利用ImageJ软件对所得的条带进行分析。
1.5.5 免疫荧光检测MFN2、SIRT1的定位及表达情况石蜡切片60 ℃烤片4 h以上,依次将石蜡切片放入二甲苯10 min,无水乙醇5 min,95%乙醇5 min,85%乙醇5 min,75%乙醇5 min,50%乙醇5 min,ddH2O洗5 min,微波修复,PBS冲洗3次,5% BSA 37 ℃封闭1 h,一抗4 ℃孵育于湿盒中过夜。PBS冲洗3次,每次5 min,室温下二抗避光孵育1 h,切片甩干后在滴加DAPI染液,避光孵育3~5 min。玻片用PBS洗涤3次,每次5 min。滴加适量防荧光淬灭剂,用树脂封片剂封片。
1.6 统计学处理实验数据采用用Graphpad软件进行分析,利用单因素方差分析组间数据。
2 结果 2.1 HE染色评分并观察肝组织病理变化根据Nash Clinical Research Network Scoring Systems,对NASH进行评分,评分为6分,提示NASH模型成立。Fig 1染色结果显示,正常组小鼠肝细胞排列规则而紧密,肝小叶结构清晰,肝组织结构未见病理性改变,HFD组小鼠肝组织中炎性细胞浸润明显,且伴有大量脂滴,细胞排列松散而不规则,肝细胞出现气球样变。与模型组相比较,TSPJ低剂量组和高剂量组的肝细胞排列较为紧密,脂肪空泡、肝细胞气球样变及炎性浸润情况有明显改善。
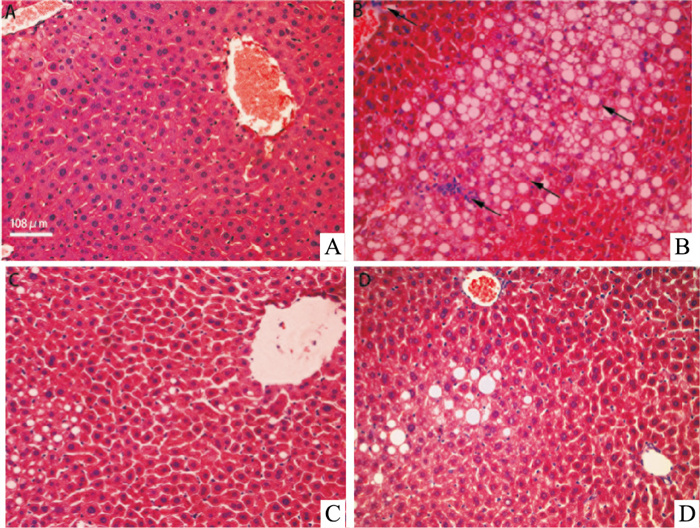
|
| Fig 1 HE staining of liver tissues in each group (200×) A: Control; B: HFD; C: TSPJ/15 mg·kg-1; D: TSPJ/45 mg·kg-1 |
如Fig 2显示,与正常组相比,HFD组中胆固醇调节元件结合蛋白(sterol-regulatory element binding proteins,SREBP)、碳水化合物反应元件结合蛋白(carbohydrate response element binding protein,ChREBP)、IL-1β及TNF-α的mRNA表达水明显升高,MFN2、SIRT1的mRNA表达明显降低,提示小鼠出现肝脏脂肪代谢异常,并出现炎症反应。当给予TSPJ干预后,ChREBP、SREBP、IL-1β及TNF-α的mRNA表达水平明显下降,SIRT1及MFN2的mRNA表达明显升高,提示TSPJ可以通过下调ChREBP、SREBP、IL-1β及TNF-α的表达来缓解NASH造成的脂肪代谢异常及炎症反应。
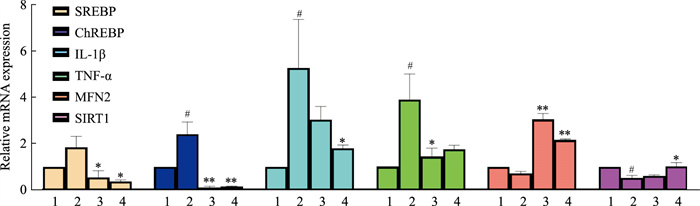
|
| Fig 2 Lipogenic genes and inflammation genes regulated by TSPJ through SIRT1/ MFN2 (x±s, n=4-8) 1:Control; 2:HFD; 3:TSPJ/15 mg·kg-1; 4:TSPJ/45 mg·kg-1.#P < 0.05 vs Control; *P < 0.05, **P < 0.01 vs HFD |
如Fig 3显示,与正常组相比,HFD组中IL-1β、TNF-α的蛋白的水平明显升高,MFN2及SIRT1的蛋白水平明显降低。当给予TSPJ干预后,IL-1β及TNF-α的蛋白表达水平明显下降,MFN2及SIRT1的蛋白水平明显升高,提示TSPJ可以通过下调TNF-α及IL-1β的表达来缓解NASH造成的炎症反应,缓解NASH的发生发展。
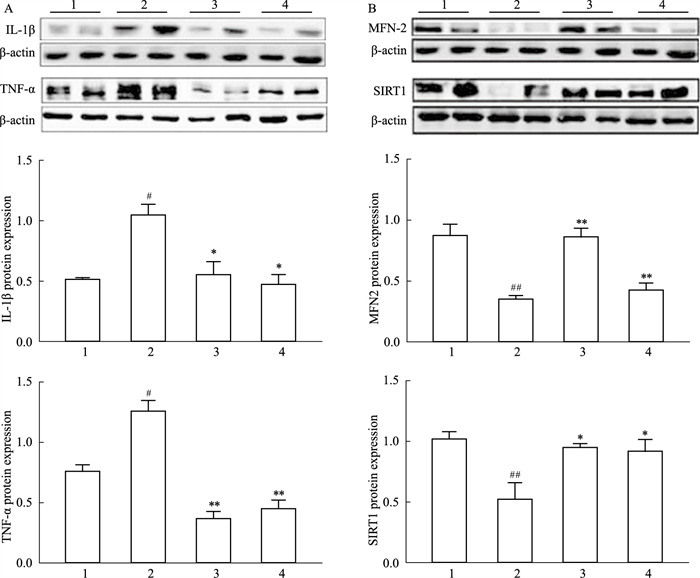
|
| Fig 3 The protein expression of inflammation genes regulated by TSPJ through SIRT1/ MFN2 pathway 1:Control; 2:HFD; 3:TSPJ/15 mg·kg-1; 4:TSPJ/45 mg·kg-1.#P < 0.05, ##P < 0.01 vs Control; *P < 0.05, **P < 0.01 vs HFD |
结果显示,对比正常组,HFD组肝组织的MFN2及SIRT1荧光强度降低。对比HFD组,TSPJ低剂量和高剂量组肝组织的MFN2及SIRT1荧光强度增加(Fig 4)。提示TSPJ可以通过上调SIRT1和MFN2的表达来缓解NASH的发生与发展。
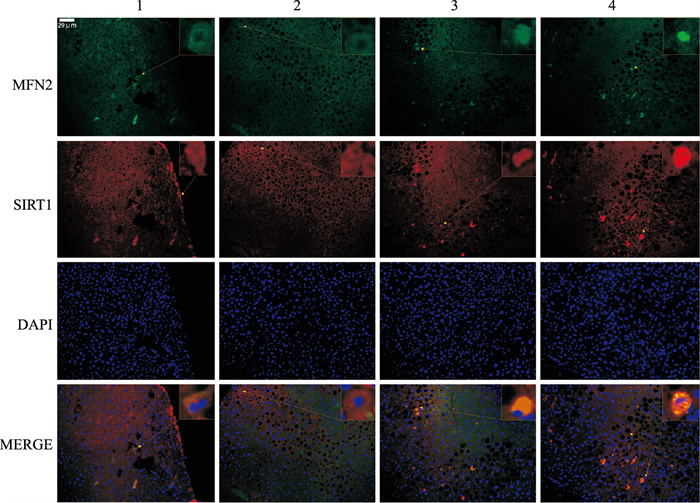
|
| Fig 4 Localization and expression of MFN2 and SIRT1 detected by immunofluorescence (200×) 1:Control; 2:HFD; 3:TSPJ/15 mg·kg-1; 4:TSPJ/45 mg·kg-1. |
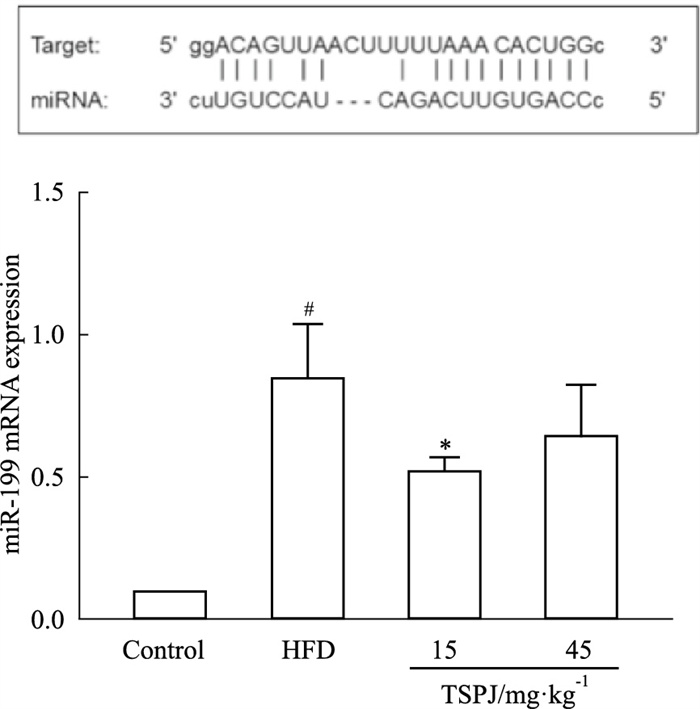
通过生物信息学验证,预测SIRT1是miR-199的靶基因之一,miR-199能够负调控SIRT1的表达。通过实时荧光定量PCR检测发现,HFD组miR-199表达明显增高,与SIRT1检测结果相比较,证实了其之间的负调控关系。同时给予TSPJ干预后,miR-199的表达明显降低(Fig 5)。
|
| Fig 5 The targeting relationship between miR-199 and SIRT1 and mRNA expression level (x±s, n=3) #P < 0.05 vs Control; *P < 0.05 vs HFD |
MFN2是一种线粒体膜蛋白,能够连接内质网膜和线粒体,具有连接内质网膜和线粒体的作用[7]。肝组织中MFN2表达的减少导致活性氧生成的增加和三磷酸腺苷合成的减少,从而增加氧化应激和破坏代谢[8]。有研究发现,肝脏MFN2敲除小鼠的血浆及肝脏中促炎因子的丰度明显增加[3]。敲除MFN2后,通过SIRT1介导的自噬和对缺血/再灌注损伤的细胞保护消失,提示MFN2是SIRT1的一个靶点[9]。SIRTI能与MFN2相互作用,MFN2是SIRT1的底物[4]。
SIRT1是一种烟酰胺腺嘌呤二核苷酸(NAD+)依赖性脱乙酰酶,在脂肪酸氧化过程中的转录网络调节中起作用[10]。研究发现SIRT1在NAFLD的发生发展中起关键作用,SIRT1通过去乙酰化调节肝脏能量代谢,SIRT1敲除小鼠肝脏脂肪变性增加,SIRT1过表达可保护高脂肪饮食诱导下的SIRT1转基因小鼠免于肝脏脂肪变性、肝脏葡萄糖耐受不良或肝脏炎症[11]。
现代药理研究表明,竹节参具有良好的抗炎活性,在小鼠NASH模型中,TSPJ能够通过干预MFN2从而调节NASH的发生与发展[12]。本研究采用BALB/c小鼠,高脂饮食诱导建立NASH模型,用药组给予TSPJ干预。结果显示,经过TSPJ干预后,MFN2及SIRT1的mRNA,蛋白及免疫荧光表达水平明显升高,IL-1β、TNF-α的mRNA及蛋白的表达明显降低,ChREBP、SREBP的mRNA表达明显降低。HE染色显示TSPJ低、高剂量组的肝细胞排列较为紧密,脂肪空泡及炎性浸润情况有明显改善。
miRNAs是一类由18~25个核苷酸组成小的非编码核糖核酸。在大多数情况下,miRNAs结合到靶基因的3′未翻译区(UTR),通过破坏miRNAs或沉默翻译来抑制蛋白合成[1]。大量研究表明,在人类和动物的NAFLD和NASH模型中都发生了肝脏miRNAs谱的改变[13],这提示miRNAs在NASH的发生发展中起着关键作用。例如,miR-122在调节脂质代谢中发挥作用[14];miR-34a表达在NASH患者的肝脏和高脂饮食诱导的NASH动物模型中高度增加[8];miR-199在NAFLD中呈现高表达[15]。有研究表明,生物信息学分析提示,miR-199靶向SIRT1基因[16]。我们的研究结果发现,TSPJ可抑制miR-199表达,促进SIRT1的表达,改善NASH的病理变化及炎症反应。
以上结果提示,miR-199/SIRT1/MFN2信号通路能影响肝细胞的炎症反应,并最终影响NASH发生发展的进程。TSPJ能过通过调节miR-199/SIRT1/MFN2信号通路改善肝细胞炎性反应,为治疗NASH提供了新思路。
| [1] |
Ambros V. The functions of animal microRNAs[J]. Nature, 2004, 431(7006): 350-5. doi:10.1038/nature02871 |
| [2] |
Xue R, Yang J, Jia L, et al. Mitofusin-2, as a protective target in the liver, controls the balance of apoptosis and autophagy in acute-on-chronic liver failure[J]. Front Pharmacol, 201, 10: 601. |
| [3] |
Sebastián D, Hernández-Alvarez M I, Segalés J, et al. Mitofusin 2 (Mfn2) links mitochondrial and endoplasmic reticulum function with insulin signaling and is essential for normal glucose homeostasis[J]. Proc Natl Acad Sci USA, 2012, 109(14): 5523-8. doi:10.1073/pnas.1108220109 |
| [4] |
国家药典委员会. 中国药典2020年版(一部)[S]. 北京: 中国医药科技出版社, 144-5. Chinese Pharmacopoeia Commission. Chinese Pharmacopoeia 2020(volume Ⅰ)[S]. Beijing: China Med Sci Tech press, 144-5. |
| [5] |
Dai Y W, Yuan D, Wan J Z, et al. Study on protective effect of total saponins of Panax japonicus on LPS-induced RAW264.7 cell inflammation through NF-kappaB pathway[J]. Chin J Chin Mater Med, 2014, 39(11): 2076-80. |
| [6] |
周志勇, 陈亚昕, 李德鸿, 等. 竹节参总皂苷通过抑制NF-κB介导的炎性反应改善小鼠肿瘤恶病质研究[J]. 中国药理学通报, 2018, 34(4): 532-6. Zhou Z Y, Chen Y X, Li D H, et al. Total saponins of Panax japonicus improve cancer cachexia in mice through inhibiting inflammatory response mediated by NF-κB[J]. Chin Pharmacol Bull, 2018, 34(4): 532-6. doi:10.3969/j.issn.1001-1978.2018.04.019 |
| [7] |
Leal N S, Schreiner B, Pinho C M, et al. Mitofusin-2 knockdown increases ER-mitochondria contact and decreases amyloid β-peptide production[J]. J Cell Mol Med, 2016, 20(9): 1686-95. doi:10.1111/jcmm.12863 |
| [8] |
Szabo G, Bala S. MicroRNAs in liver diseases[J]. Nat Rev Gastroenterol Hepatol, 2013, 10: 542-52. doi:10.1038/nrgastro.2013.87 |
| [9] |
Sooyeon L, Go K L, Kim J S. Deacetylation of mitofusin-2 by sirtuin-1:A critical event in cell survival after ischemia[J]. Mol Cell Oncol, 2015, 3(2): e1087452. |
| [10] |
Guarente L. Sirtuins as potential targets for metabolic syndrome[J]. Nature, 2006, 444(7121): 868-74. doi:10.1038/nature05486 |
| [11] |
Collin de l′Hortet A, Takeishi K, Guzman-Lepe J, et al. Generation of human fatty livers using custom-engineered induced pluripotent stem cells with modifiable SIRT1 metabolis[J]. Cell Metab, 2019, 30(2): 385-401. doi:10.1016/j.cmet.2019.06.017 |
| [12] |
李聪, 刘小慧, 熊海容, 等. 竹节参皂苷Ⅳa调节miR-17-5p/ MFN2信号通路改善非酒精性脂肪性肝炎[J]. 中国中药杂志, 2020, 45(19): 4725-31. Li C, Liu X H, Xiong H R, et al. Effect of Panax japonicas saponin Ⅳa on alleviating non-alcoholic steatohepatitis by regulating miR-17-5p/ MFN2 signaling pathway[J]. Chin J Chin Mater Med, 2020, 45(19): 4725-31. |
| [13] |
Feng Y Y, Xu X Q, Ji C B, et al. Aberrant hepatic microRNA expression in nonalcoholic fatty liver disease[J]. Cell Physiol Biochem, 2014, 34(6): 1983-97. doi:10.1159/000366394 |
| [14] |
Bandiera S, Pfeffer S, Baumert T F, et al. miR-122—a key factor and therapeutic target in liver disease[J]. J Hepatol, 2015, 62(2): 448-57. doi:10.1016/j.jhep.2014.10.004 |
| [15] |
Zhang S, Wang R, Zeng W, et al. Resource investigation of traditional medicinal plant Panax japonicus (T.Nees) C.A. Mey and its varieties in China[J]. J Ethnop-harmacol, 2015, 166: 79-85. doi:10.1016/j.jep.2015.02.051 |
| [16] |
Pittenger S T, Schaal V L, Moore D, et al. MicroRNA cluster miR199a/214 are differentially expressed in female and male rats following nicotine self-administration[J]. Sci Rep, 2018, 8(1): 17464. doi:10.1038/s41598-018-35747-z |